蛋白质连接技术1-1ok
- 格式:doc
- 大小:20.00 KB
- 文档页数:4

蛋白质对接摘要:蛋白质对接是一种基因工程技术,它的目的是将两个不同的蛋白质合成一体,形成一个新的蛋白质结构。
此外,蛋白质对接在研究蛋白质结构和功能的认识方面也发挥了重要作用。
本文将从蛋白质对接的基本原理、实验设计、后处理等方面介绍蛋白质对接,以及目前存在的技术局限和发展前景。
关键词:蛋白质对接;成;验设计;处理蛋白质对接是一种基因工程技术,它的目的是将两个不同的蛋白质的结构和功能结合起来,形成一个新的蛋白质结构。
蛋白质对接具有优越的性能特点,可以有效改变蛋白质结构和功能,较大程度地改善蛋白质性能,提高蛋白质的应用价值。
蛋白质对接在研究蛋白质结构和功能的认识方面也发挥了重要作用。
蛋白质对接是一个复杂的过程,主要包括蛋白质合成、反应条件诱导、复性分离等步骤。
其中,蛋白质合成是蛋白质对接实验的重要环节,首先根据蛋白质结构的要求,合成蛋白质的原子模型,扩增时选择正确的氨基酸序列。
然后,通过反应条件的调节和控制,可以有效地刺激蛋白质对接反应,从而实现两个蛋白质结构的结合,实现蛋白质对接。
在蛋白质对接反应之后,需要进行一系列的后处理,以确保蛋白质对接反应的有效性和稳定性。
这些处理步骤包括洗涤、离心分离、热处理、病毒性检测和蛋白质纯化等。
其中,病毒性检测是必不可少的,可以有效检测蛋白质是否具有抗病毒活性,并且可以更深入地探究蛋白质的结构和功能。
目前,蛋白质对接技术在生物医药领域中得到了广泛应用,但是它也存在一定的技术局限性。
首先,在蛋白质对接过程中,蛋白质会产生一些非特定性活性,导致蛋白质表达不准确,从而影响蛋白质的结构和功能。
此外,由于蛋白质的特殊性质,目前设计的蛋白质对接体积也较小,无法突破大规模的蛋白质对接。
尽管存在这些问题,蛋白质对接的研究仍在继续发展,未来也将有更多的新技术出现,为蛋白质对接提供更高效、更准确的实验数据,以期实现蛋白质活性改变和蛋白质性能提高,从而获得更大的科学和应用价值。
综上所述,蛋白质对接是一个重要的基因工程技术,它可以实现蛋白质结构和功能的改变,提高蛋白质应用价值。

计算机模拟蛋白质对接算法蛋白质对接是计算机模拟领域的一个重要应用,用于研究蛋白质之间的相互作用和结合机制。
蛋白质对接算法是一种数学模型,通过计算机模拟来预测蛋白质之间的结合能力和亲和力,以寻找潜在的药物靶点和药物设计。
蛋白质对接算法的核心思想是将蛋白质分子和小分子配体(潜在药物分子)看作刚性的球体,并通过模拟力学原理来预测它们之间的相互作用。
首先,需要建立一个蛋白质和配体的模型,包括原子坐标、分子力学参数等。
然后,利用物理力学模拟方法,如分子动力学模拟或蒙特卡洛模拟,对系统进行模拟运行。
在模拟过程中,蛋白质和配体分子会被赋予不同的初始构象,并通过一系列的构象搜索和能量优化算法来寻找能量最低的结合构象。
这些算法包括蛇形搜索算法、Monte Carlo模拟、遗传算法等,它们能够在巨大的搜索空间中高效地搜索最优解。
为了评估不同构象的结合能力和亲和力,蛋白质对接算法还需要引入一个评价函数。
常见的评价函数包括分子力学能量函数、统计力学势函数等,它们能够计算出蛋白质-配体结合的能量,并判断是否为稳定的结合态。
除了构象搜索和能量评价,蛋白质对接算法还需要考虑结合位点的刚性和柔性,以及溶剂效应对结合过程的影响。
柔性对接算法可以通过预先定义柔性位点,并将其纳入模拟系统中,从而考虑蛋白质和配体的柔性变化。
而溶剂模型则可以通过引入溶剂分子和溶剂效应模拟来更加准确地模拟蛋白质对接过程。
蛋白质对接算法在药物研发中具有重要的应用价值。
通过模拟分析蛋白质和配体的结合方式,可以揭示蛋白质和配体的相互作用机制,寻找潜在的药物靶点和药物候选分子。
此外,该算法还可以用于虚拟筛选,从大量的化合物库中筛选出具有潜在活性的化合物,节省了大量的实验时间和成本。
总之,蛋白质对接算法是一种重要的计算机模拟方法,能够用于预测蛋白质和配体的结合方式和亲和力。
通过构象搜索、能量评价和柔性建模等算法,该方法能够揭示蛋白质相互作用的原理和机制,为药物研发提供指导和候选分子筛选。
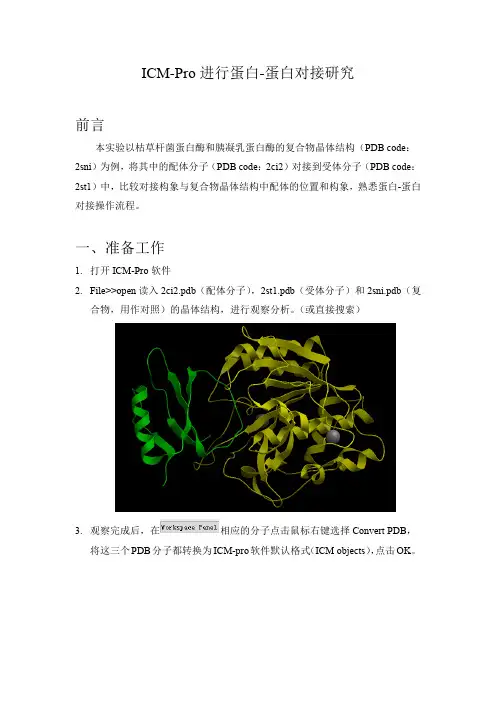
ICM-Pro进行蛋白-蛋白对接研究前言本实验以枯草杆菌蛋白酶和胰凝乳蛋白酶的复合物晶体结构(PDB code:2sni)为例,将其中的配体分子(PDB code:2ci2)对接到受体分子(PDB code:2st1)中,比较对接构象与复合物晶体结构中配体的位置和构象,熟悉蛋白-蛋白对接操作流程。
一、准备工作1.打开ICM-Pro软件2.File>>open读入2ci2.pdb(配体分子),2st1.pdb(受体分子)和2sni.pdb(复合物,用作对照)的晶体结构,进行观察分析。
(或直接搜索)3.观察完成后,在相应的分子点击鼠标右键选择Convert PDB,将这三个PDB分子都转换为ICM-pro软件默认格式(ICM objects),点击OK。
4.单击菜单栏Docking>>Protein-protein>>Legacy Protocol>>Set Project,输入Project的名称(eg. DOCK1),给此次对接工作命名。
二、蛋白-蛋白中受体设置1.菜单栏Docking>>Protein-protein>>Legacy Protocol>>Receptor setup,输入Project名称DOCK1,指定受体分子a_2st1.m(如果想包含所有的分子如钙离子等,也可以选择a_2st1.*),点击OK。
三、蛋白-蛋白中配体设置1.菜单栏Docking>>Protein-protein>>Legacy Protocol>>Ligand setup,输入Project名称DOCK1,指定配体分子(eg. a_2ci2.i),点击OK。
四、蛋白表位选择(此步操作非必需,视具体情况选择)蛋白-蛋白可能的结合位点可通过查阅实验数据、参考复合物晶体结构信息或软件预测得到,然后在受体上选择感兴趣的点作为对接起始点,以缩小对接时结合位点的搜索范围。

蛋白分子对接蛋白分子对接是生物医学领域中的一个重要研究课题,它可以帮助人们理解蛋白质生物学的基本原理。
本文将从蛋白分子对接的概念、意义、方法、挑战以及应用等方面进行解析,为读者提供一个全面、有指导意义的了解。
一、蛋白分子对接的概念蛋白质是人体中最基本的生物分子之一,它们不仅参与构建人体细胞、器官、组织,还担负着许多生命活动的重要功能。
蛋白分子对接是指通过计算机模拟等方法,预测并优化不同蛋白质分子之间的结合方式,从而为开发新的治疗药物提供理论依据。
二、蛋白分子对接的意义在现代医学中,药物研发是一个非常重要的课题,而蛋白分子对接则是其中不可或缺的步骤。
通过结合蛋白质分子的结构信息,预测蛋白质分子之间的相互作用,可以为药物研发提供更多的目标蛋白质及其配体,从而有助于寻找更加准确、有效的药物靶点,提高药物研发的效率和成功率。
因此,蛋白分子对接对于医学研究、药物研发和临床治疗等领域都具有重要的意义。
三、蛋白分子对接的方法蛋白分子对接方法主要采用计算机模拟等方法。
这些方法可以通过分子力学、分子动力学模拟和量子化学计算等手段,对蛋白质分子结构进行预测和模拟,获得蛋白质分子之间的结合能、结合位点、键合情况等有关信息。
通过这些信息,科研人员可以更好地了解蛋白质分子的相互作用和信号传导途径,为药物研发提供理论基础。
四、蛋白分子对接的挑战由于蛋白质分子结构和功能的复杂性,蛋白分子对接仍面临着一些挑战。
其中最主要的挑战包括模拟精度不高、计算量大、计算时效性差等方面。
因此,在蛋白分子对接领域,科研人员需要不断积累经验,改进算法,提高计算精度,从而能够更好地解决目前面临的挑战。
五、蛋白分子对接的应用蛋白分子对接在生物医学和药物研发领域中具有广泛的应用价值。
例如,在疫苗研发中,研究人员可以通过蛋白分子对接技术来预测疫苗与病毒蛋白之间的结合方式,进而设计出更加有效的疫苗;在药物设计方面,蛋白分子对接也可以为研发新型药物提供有力支持。

蛋白质结构预测和分子对接技术蛋白质是构成生物体的基础分子之一,包括酶、激素、抗体等各种生物大分子都是由蛋白质组成。
蛋白质具有多个级别的结构,通常被称为一级、二级、三级和四级结构。
一级结构指的是蛋白质的氨基酸序列,即在蛋白质分子中氨基酸的排列方式。
二级结构是指蛋白质中氨基酸残基在空间中的排列方式,通常包括α-螺旋和β-折叠。
三级结构是指蛋白质空间构型的整体结构。
四级结构则指蛋白质分子与其他蛋白质小分子之间的相互作用。
在蛋白质结构预测方面,具有重要意义的方法是基于比对的方法和基于物理学原理的方法。
基于比对的方法是通过对已知结构的蛋白质序列和目标蛋白质的序列进行比对,找出最接近的已知结构,并将该结构作为目标的预测结果。
这种方法的优点是速度快,但是预测精度较低。
基于物理学原理的方法则是通过模拟蛋白质分子内部的物理过程来得出蛋白质的结构,其精度比基于比对的方法更高,但计算量也更大。
在分子对接技术方面,分子对接技术是指通过计算机模拟来研究分子之间的相互作用,常用于新药研发和分子设计中。
目前常用的分子对接技术包括基于体积网格方法、基于可调节作用位点的对接方法和基于分子动力学模拟的方法。
基于体积网格方法通过将药物分子和蛋白质分子放置在一个三维空间网格中,以模拟药物分子与蛋白质分子之间的相互作用。
这种方法的优点是计算速度快,但往往忽略了蛋白质分子的柔性,导致预测结果可能不够准确。
基于可调节作用位点的对接方法则考虑到了蛋白质的柔性,将蛋白质的某些部分设定为可调节的作用位点,使得蛋白质可以自由地移动。
这种方法的优点是准确性比基于体积网格的方法更高。
基于分子动力学模拟的方法则是将蛋白质和药物分子看作一个整体,通过模拟它们的运动、相互作用等来研究它们的相互作用。
这种方法的优点是可以考虑到分子的柔性和运动过程,因此预测结果更加准确。
但是,这种方法的计算量也更大,需要使用超级计算机等大规模计算设备。
尽管蛋白质结构预测和分子对接技术现在已经取得了不少进展,但仍然存在许多问题和挑战。


蛋白质对接
蛋白质对接,又被称为蛋白质-蛋白质相互作用(PPI),是生物
体中最常见的相互作用之一,蛋白质对接可以维持生物体的正常运行,具有重要的生物学意义。
目前,蛋白质对接的研究似乎是一把双刃剑,它可以揭示受体基因的作用机制,但可能令研究显得更加复杂。
首先,什么是蛋白质对接?蛋白质对接,指两个蛋白质之间由化学反应所形成的复合物,也就是说,两个蛋白质可以通过化学反应结合起来。
蛋白质的复合体可以改变本身的生物活性,从而为细胞提供有效的生物活性,并且可以促进细胞功能的正常运行。
其次,蛋白质交互作用对生物体有哪些作用?在细胞生物学领域,蛋白质交互作用可以影响细胞的正常生长和发育,如信号传导、基因转录和蛋白质翻译等。
蛋白质对接在细胞生物学、分子生物学、免疫学和疾病领域中都具有重要的作用,比如,含有蛋白质交互作用的分子可以用来抑制炎症,因此它们可以用于治疗一些常见的疾病,如多发性硬化症和骨关节炎等。
其次,蛋白质对接研究的技术可以总结为三个方面:一是结构基础研究,包括受体结构预测、受体拟药物设计等;二是功能验证,包括受体-配体结合稳定度检测、受体活性的确定等;三是活性验证,
包括优化药物的活性和受体拟药物的活性等。
总之,蛋白质对接是生物体中最常见的相互作用之一,其有助于细胞的正常生长发育,可以抑制炎症,从而有助于治疗多发性硬化症和关节炎等疾病,是构建药物作用机制的重要工具。
蛋白质对接研究
需要不断改进,以满足日益增长的药物研制需求,从而使药物更加有效、安全和准确。

蛋白对接分子截断-概述说明以及解释1.引言1.1 概述概述:蛋白对接是指两个或多个蛋白质分子之间的相互作用,通过特定的结合方式形成复合物。
蛋白对接在生物学研究中具有重要的意义,可以揭示蛋白质之间的相互作用、信号传导等生物学过程,对于药物设计、疾病治疗等领域也有着重要的应用价值。
分子截断技术是指利用计算机模拟手段对复杂的分子体系进行分析和研究的技术。
通过对分子的结构和相互作用进行分析,可以揭示分子的特性和功能,为药物设计、材料科学等领域提供重要的参考。
本文将重点探讨蛋白对接与分子截断技术的关联,探讨其在生物医学领域的应用,并展望未来在这一领域的发展方向。
1.2 文章结构本文共分为引言、正文和结论三个部分。
在引言中将简要介绍蛋白对接和分子截断技术的背景和意义,以及本文的目的和意义。
在正文部分,将详细探讨蛋白对接的定义和重要性,分子截断技术的原理和应用,以及蛋白对接与分子截断的关联。
最后在结论部分对本文进行总结,展望未来研究方向,并得出结论。
通过以上结构,本文将全面介绍蛋白对接和分子截断技术的相关知识,为读者提供一个全面的了解和认识。
1.3 目的:本文旨在探讨蛋白对接与分子截断技术在药物设计和生物医学领域的重要性和应用。
通过深入分析蛋白对接的定义和原理,以及分子截断技术的特点和应用,探讨二者之间的关联与互补性。
通过本文的研究,旨在为生物医学研究人员和药物设计师提供指导和启发,促进药物研发的进展和突破。
同时,也旨在引起更多科研人员对蛋白对接和分子截断技术的关注和研究,推动相关领域的发展与创新。
2.正文2.1 蛋白对接的定义和重要性蛋白对接是指两个或多个蛋白质分子相互结合形成复合物的过程。
在生物体内,许多生命活动都依赖于蛋白质之间的相互作用,因此蛋白对接在生物学研究和药物设计中具有重要意义。
蛋白对接的定义包括蛋白质的识别、结合和解除结合等过程。
在生物体内,蛋白对接能够调控信号传导、代谢和细胞生长等重要生命活动。

蛋白质-适配体相互作用预测的方法蛋白质-适配体相互作用(protein-ligand interaction)是生物学中非常重要的研究领域,对于药物研发、化学生物学以及结构生物学都起着关键的作用。
蛋白质-适配体相互作用预测是指通过计算和模拟的方法,预测蛋白质和适配体之间的结合方式和强度。
本文将介绍几种常见的蛋白质-适配体相互作用预测的方法。
1. 分子对接(molecular docking)是一种常见的蛋白质-适配体相互作用预测方法,它通过计算和模拟适配体在蛋白质的结合位点上的结合方式和能量,来预测蛋白质和适配体之间的相互作用。
分子对接方法通常包括两个步骤:刚体对接和柔性对接。
刚体对接是指在不考虑适配体和蛋白质的构象变化的情况下进行对接,在这种情况下,适配体和蛋白质的构象都是固定的。
柔性对接是指考虑适配体和蛋白质的构象变化的情况下进行对接,适配体和蛋白质的构象可以在对接过程中发生改变。
分子对接方法可以通过搜索和评分来找到最佳的适配体-蛋白质复合物。
2. 分子动力学模拟(molecular dynamics simulation)是一种基于牛顿运动定律的模拟方法,可以在原子水平上模拟蛋白质和适配体之间的相互作用。
分子动力学模拟可以模拟分子在真实环境中的自由运动和振动,并通过计算和模拟分子的力学性质来研究蛋白质和适配体之间的相互作用。
分子动力学模拟可以提供蛋白质和适配体的构象变化、结合能和结合动力学等信息,对于预测和理解蛋白质-适配体相互作用具有重要意义。
3. 特征提取和机器学习方法是一种利用已知的蛋白质-适配体相互作用数据集训练模型,并用于预测新的蛋白质-适配体相互作用的方法。
特征提取是指从蛋白质和适配体的结构和序列中提取相关的特征,如物理化学性质、结构信息和序列特征等,用于表示蛋白质和适配体的特征。
机器学习方法是指利用已知的蛋白质-适配体相互作用数据集训练模型,并用于预测新的蛋白质-适配体相互作用。

专业的分子对接过程专业的分子对接流程分子对接是一种计算技术,用于预测小分子与蛋白质或其他生物大分子之间的结合方式。
它广泛应用于药物发现、蛋白质工程等领域。
以下是专业的分子对接流程:1. 蛋白质结构准备获取靶蛋白的高分辨率晶体结构或核磁共振 (NMR) 结构。
去除蛋白质中多余的水分子和配体分子。
根据需要添加丢失的残基或侧链。
优化蛋白质结构,纠正任何错误或缺失。
2. 小分子配体准备绘制或获取小分子配体的三维结构。
优化配体结构,确保其具有合理的几何构象。
计算配体的原子电荷和极化性。
3. 对接程序选择根据对接目的和目标分子的大小,选择合适的对接程序。
程序可以基于物理力场、基于知识的评分或混合方法。
4. 对接参数设置定义配体和蛋白质的搜索空间。
设置对接精度和灵活性参数。
选择对接评分函数,用于评估配体-蛋白质相互作用的质量。
5. 对接运行使用选定的程序和参数执行对接。
生成一组配体构象,代表它们与靶蛋白的潜在结合方式。
6. 结果分析根据对接评分函数对配体构象进行排名。
分析前几个排名的构象,确定它们与蛋白质的相互作用模式。
识别关键残基和相互作用,了解小分子特异性结合的基础。
7. 验证和优化使用体外或体内实验方法验证对接预测。
根据实验结果优化配体构象和对接参数。
迭代对接和验证过程,逐步提高对接结果的准确性。
8. 应用筛选化合物库寻找潜在的药物候选物。
设计和优化靶向特定蛋白质的小分子抑制剂或激动剂。
预测蛋白质-蛋白质相互作用和信号通路。
了解生物分子之间的作用机制。
遵循这些步骤可以确保分子对接过程的准确性、可靠性和可再现性。
通过仔细的蛋白质和配体准备、适当的对接程序选择和结果的仔细分析,分子对接可以提供有价值的见解,推动药物发现和分子生物学研究。
ICM-Pro进行蛋白-蛋白对接研究前言本实验以枯草杆菌蛋白酶和胰凝乳蛋白酶的复合物晶体结构(PDB code:2sni)为例,将其中的配体分子(PDB code:2ci2)对接到受体分子(PDB code:2st1)中,比较对接构象与复合物晶体结构中配体的位置和构象,熟悉蛋白-蛋白对接操作流程。
一、准备工作1.打开ICM-Pro软件2.File>>open读入2ci2.pdb(配体分子),2st1.pdb(受体分子)和2sni.pdb(复合物,用作对照)的晶体结构,进行观察分析。
(或直接搜索)3.观察完成后,在相应的分子点击鼠标右键选择Convert PDB,将这三个PDB分子都转换为ICM-pro软件默认格式(ICM objects),点击OK。
4.单击菜单栏Docking>>Protein-protein>>Legacy Protocol>>Set Project,输入Project的名称(eg. DOCK1),给此次对接工作命名。
二、蛋白-蛋白中受体设置1.菜单栏Docking>>Protein-protein>>Legacy Protocol>>Receptor setup,输入Project名称DOCK1,指定受体分子a_2st1.m(如果想包含所有的分子如钙离子等,也可以选择a_2st1.*),点击OK。
三、蛋白-蛋白中配体设置1.菜单栏Docking>>Protein-protein>>Legacy Protocol>>Ligand setup,输入Project名称DOCK1,指定配体分子(eg. a_2ci2.i),点击OK。
四、蛋白表位选择(此步操作非必需,视具体情况选择)蛋白-蛋白可能的结合位点可通过查阅实验数据、参考复合物晶体结构信息或软件预测得到,然后在受体上选择感兴趣的点作为对接起始点,以缩小对接时结合位点的搜索范围。
蛋白质工程技术知识点总结蛋白质是生物体内功能最多样化的大分子,具有多种生物学功能,在生物医学领域有着广泛的应用。
蛋白质工程技术是指利用基因重组、蛋白质工程和蛋白质设计等技术手段,对蛋白质进行人工改造和设计,以获得具有特定功能和性质的蛋白质。
本文将围绕蛋白质工程的基本原理、技术手段和应用领域进行介绍和总结。
一、蛋白质工程的基本原理1. 基因重组技术基因重组技术是蛋白质工程的基础技术,通过将感兴趣的基因分子导入到宿主细胞中,使宿主细胞能够表达这些基因,从而产生感兴趣的蛋白质。
常用的基因重组技术包括质粒转染、病毒载体转染、基因枪转染等。
2. 蛋白质纯化技术蛋白质的产生过程中会伴随很多其他杂质,因此需要对蛋白质进行纯化。
目前常用的蛋白质纯化技术主要包括离子交换、凝胶过滤、亲和纯化、透析、超速离心等。
3. 蛋白质结构分析技术蛋白质工程需要对蛋白质的结构进行分析,以确定蛋白质的二、三维结构,常用的技术包括X射线晶体学、核磁共振、质谱、表面等离子共振等。
4. 蛋白质工程设计和改造技术蛋白质工程的设计和改造技术是指对蛋白质的氨基酸序列进行修改、融合、重组等,以获得更理想的蛋白质性质和功能。
常用的技术手段包括点突变、插入、删除、重组、融合以及改变翻译后修饰等。
二、蛋白质工程的技术手段1. 蛋白质工程中的点突变技术点突变技术是通过对蛋白质基因进行特定的DNA序列改变,使蛋白质的氨基酸序列发生改变,从而改变蛋白质的性质和功能。
常用的点突变技术包括重叠PCR、引物设计、缺失突变和插入突变等。
2. 蛋白质工程中的插入和删除技术插入和删除技术是指在蛋白质的氨基酸序列中直接插入或删除特定的氨基酸残基,从而改变蛋白质的结构和功能。
常用的技术手段包括基因克隆、引物设计、限制性内切酶切割等。
3. 蛋白质工程中的重组和融合技术重组和融合技术是指将两种或多种不同的蛋白质基因进行重组组合,从而产生具有新功能和性质的蛋白质。
常用的重组和融合技术包括PCR扩增、质粒构建、引物设计等。
蛋白对接金属离子蛋白质是生物体中一类重要的有机分子,也是构成细胞的基本结构单元。
金属离子是生物体中必需的微量元素,它们在生物体内发挥着重要的生理功能。
蛋白质能与金属离子发生特异性的相互作用,形成蛋白质金属配合物,从而参与到生物体的各种生理过程中。
本文将探讨蛋白质与金属离子之间的对接过程及其在生物体中的重要意义。
蛋白质与金属离子的相互作用是一种高度特异性的配位键合作用。
蛋白质通过其特定的结构域与金属离子结合,形成蛋白质金属配合物。
这种结合方式可以通过静电相互作用、金属离子与蛋白质中的氨基酸侧链之间的配位键合等方式实现。
蛋白质金属配合物的形成使得金属离子在生物体内得到了稳定地储存和运输,同时也赋予了金属离子特定的生理功能。
蛋白质与金属离子的对接过程是一个高度精确的过程。
蛋白质通过其特定的结构域识别并结合特定的金属离子。
这种识别过程往往依赖于蛋白质中的特定氨基酸残基,如半胱氨酸、组氨酸、赖氨酸等。
这些氨基酸残基能够与金属离子形成稳定的配位键合。
在蛋白质中,这些特定的氨基酸残基往往组成了一个或多个配体结构域,通过与金属离子的配位键合来形成蛋白质金属配合物。
蛋白质与金属离子的对接过程对于生物体具有重要的生理意义。
首先,金属离子在生物体内参与多种酶的催化活性。
例如,锌离子可以与胰岛素结合,参与葡萄糖的代谢过程。
铁离子则是血红蛋白和肌红蛋白中的重要组成部分,参与氧气的运输过程。
其次,金属离子还参与细胞信号传导过程。
例如,钙离子在神经元内起着重要的信号传递作用。
此外,金属离子还参与细胞的抗氧化防御过程。
例如,锌离子能够与超氧化物歧化酶结合,参与清除细胞内的自由基。
蛋白质对金属离子的选择性结合是由其特定的结构域和氨基酸残基所决定的。
不同的蛋白质结构域和氨基酸残基对不同的金属离子具有不同的亲和力。
这种选择性结合为生物体中的金属离子提供了高效的储存和利用方式。
例如,铁离子在生物体内往往以铁蛋白的形式存在,从而避免了其与其他物质发生非特异性的反应。
蛋白质互作的主要方法及原理1. 蛋白质互作的基础知识1.1 什么是蛋白质互作大家知道,蛋白质是我们身体里的“小工人”,负责各种各样的任务。
蛋白质互作就是这些“小工人”之间的合作。
简单说,就是一种蛋白质和另一种蛋白质“牵手”,一起完成工作。
这种合作关系在生物体内至关重要,像是你跟朋友一起完成一个大项目,单打独斗可不行。
1.2 蛋白质互作的意义这“牵手”不仅是为了完成某个任务,还能调节各种生理过程。
比如,细胞里的信号传递、免疫反应,甚至某些疾病的发生,都是通过这些蛋白质之间的互动来实现的。
就好比一个团队里,有的人负责计划,有的人负责执行,大家一起才能达成目标。
2. 主要的蛋白质互作方法2.1 酵母双杂交技术这是一种用来研究蛋白质互作的经典方法。
想象一下,你在实验室里建了一个小小的“蛋白质社交圈”,看看哪些蛋白质愿意“握手”。
这种方法就像是在“社交聚会”中找朋友,看看谁和谁有缘分。
具体来说,它是通过在酵母细胞中引入两个不同的蛋白质,并观察它们是否能结合在一起,从而确定它们是否存在互作。
2.2 免疫共沉淀另一种方法是免疫共沉淀,听起来有点复杂,但其实就是通过抗体来“抓住”我们感兴趣的蛋白质。
这个过程就像是在海里捞鱼,我们用一个“网”(抗体)去捞那些我们想知道的蛋白质,再看它们有没有带其他“伙伴”(互作蛋白质)一起上来。
这样,就能确定这些蛋白质之间是否有互动了。
2.3 表面等离子共振(SPR)表面等离子共振是一种高科技的方法,能够实时监测蛋白质互作。
可以把它想象成一种“高科技监控”,能够在蛋白质互作的过程中实时“录像”,记录下每一个细节。
这种技术非常精确,可以让我们看到蛋白质之间的微小变化,就像是细致入微地观察一个人的每一个动作和表情。
3. 蛋白质互作的应用3.1 药物开发通过了解蛋白质互作,我们可以在药物开发上大显身手。
比如,某些疾病的发生是由于蛋白质互作的异常,我们可以设计药物去干预这些异常的互作,从而治疗疾病。
蛋白质连接技术蛋白质连接技术人工抗原的合成是化学免疫的重要问题,化学免疫研究的对象,除上面提及的药物、毒物、激素外,还有多糖类、神经递质、肽类、核酸及生物体内其它小分子活性物质,总起来说,它们大多都是无免疫原性的半抗原,在对其进行免疫学及其它相关研究时,一方面要通过化学合成的手段,即蛋白质连接技术,经与载体蛋白交联合成制备人工抗原,继而用其免疫动物制备相应的抗体或单克隆抗体,作为研究用的探针;另一方面还必须将此探针用各种标记物进行标记,如本文论及的酶标记,以便用作研究工具;在分子生物学研究中,包括核酸或基因探针的研究及应用,多种类型探针的标记也都将涉及蛋白质连接技术。
半抗原分子量一般较小,其结构及化学功能团的性质多种多样,数量各不相同,在与酶蛋白或载体蛋白进行交联时,必须考虑交联双方的性质、交联剂、交联方法和载体.2.混合酸酐法制备G6PDH(葡糖—6—磷酸脱氢酶)标记利多卡因(Lidocaine.Li)结合物[29](1)Li—混合酸酐的制备首先将Li经化学修饰(琥珀酸酐法,略),在其分子中引入羟基(一COOH),制成Li—COOH(Li一琥珀酸半酯);然后,将此Li—COOHl0mg(0.0285mm0l)溶于375ul的DMF中,用电磁搅拌混溶。
在一10℃条件下,边搅动边滴入21ul的三乙胺,再缓慢滴入14ul的卡必醇氯甲酸酯,于一10。
C 继续搅拌反应1.5小时,此全部过程应保持无水,即获得Li—混合酸酐(Li—MA)。
(2)酶——底物溶液的制备在冰浴中,将G6FDH(L.m)lmg用50mmol/LpH8.1Tris—HCl溶解,同时加入G6P—Na(葡糖—6一磷·酸钠盐)10mg及NADH 3mg(底物一辅酶系统,用于保护酶活性),使其溶解,随后缓慢加入300ul卡必醇,用2m0l/LNaOH调pH至9.0。
(3)G6PDH—Li的交联将酶—底物溶液置于冰浴中,在搅拌条件下,每隔10~15分钟向此酶液中缓慢加入一定量(25ul,50ul,100ul……)的Li—MA溶液,反应10~15分钟后,分别取出反应液5u1测定酶活性及Li半抗原的抗体对标记酶活性的抑制率.直至加入Li—MA的量所引起酶活性的下降程度最低,而抗体对酶活性的抑制率又最高时,此标记过程即完成(表2—8)表2—8 G6PDH—Lidocaine交联反应中酶活性变化及抗体抑制率3.碳化二亚胺法(EDC)制备人工抗原最近几年,在对无免疫原性小分子物质的化学免疫研究中,采用碳化二亚胺作为交联剂制备合成人工抗原的工作愈来愈多,因为用这种试剂进行交联最为方便,除交联的一方作为载体的蛋白质,具有多个氨基或羧基外,不少小分于化合物也具有此反应基团,或通过化学修饰引入羧基。
蛋白质工程原理与技术蛋白质工程与原理技术1、什么是蛋白质工程?P1答:蛋白质工程(Protein engineering )是通过对蛋白质结构与功能关系的了解,借助于生物信息学的知识和手段,利用基因定点诱变和基因重组等技术特异性地改造蛋白质的结构基因,产生具有新的特性的蛋白质的技术。
2、什么是基因定点诱变?答:就是在DNA水平上,通过对蛋白质结构基因中某个或某些氨基酸编码顺序加以改变,从而改变蛋白质结构的技术。
该技术不仅可用于改造天然蛋自质,而且可以用于确定蛋白质中每一个氨基酸在结构和功能上的作用,以收集有关氨基酸线形顺序与其空间构象和生物学活性之间的对应关系,为人工改造蛋白质提供理论依据。
3、什么是表达载体?P27答:表达载体:就是在克隆载体基本骨架的基础上增加表达元件(转录和翻译所必需的DNA序列,如启动子、终止子等),使外源DNA片段能够在宿主细胞中表达蛋白质。
包括原核细胞表达载体和哺乳动物细胞表达载体两类。
4、什么是克隆载体?P27答:克隆载体:在载体上插入合适大小的外源DNA片段,并引入到宿主细胞中进行大量繁殖,使外源DNA片段得到大量扩增。
5、基因克隆的基本程序?P29答:(1)获得目的基因;(2)与克隆载体连接,形成新的重组DNA分子;(3)用重组DNA分子转化受体细胞,并能在受体细胞中复制和遗传;(4)对转化子筛选和鉴定;(5)对获得外源基因的细胞或生物体通过培养,获得所需的遗传性状或表达出所需要的产物。
6、真核基因在大肠杆菌中的表达方式?(条件)P34答:基本条件:①大肠杆菌没有剪切内含子的功能,所以,真核细胞的目的基因必须来自于cDNA;②真核基因mRNA缺乏结合细菌核糖体的SD序列,因此cDNA的起始密码子(ATG)上游部分(5‘端非编码区)是无用的,必须除去。
对于一些分泌性蛋白,还应除去信号肽部分;③表达载体应是含有大肠杆菌RNA聚合酶所能识别的启动子和SD序列的大肠杆菌表达载体; ④载体上只能用大肠杆菌启动子,将外源基因克隆在启动子下游,以便大肠杆菌RNA聚合酶识别启动子,并带动真核基因在大肠杆菌细胞中转录。
蛋白质连接技术主编洪孝庄孙曼霁编著者洪孝庄孙曼霁龚雄麒仲伯华沈倍奋陈泮藻李春海卢秀桂何云汉中国医药科技出版社.前言随着生物医学研究的迅速发展,在其相应的研究领域中也出现许多新颖的应用技术,蛋白质连接技术即是其一。
蛋白质连接技术的出现最早是在本世纪20年代,在化学免疫研究中,首次合成人工抗原时已开始使用。
此后,在免疫学研究中,特别是在免疫标记技术中广为应用并迅速发展。
从40、50年代的免疫荧光技术,60年代的放射免疫技术,到70年代的酶免疫技术,及在此前后出现的发光免疫技术、胶体金免疫技术和稀土元素免疫标记技术等都大大丰富和发展了蛋白质连接技术。
更为突出的是在1975年单克隆抗体的研制成功,以及化学家们新合成的多种异型双功能交联剂的出现,更将蛋白质连接技术的应用推向新天地。
近些年来,在国内外非常活跃的研究领域——导向药物、免疫毒素相载体释放药物的研究中,亦广泛采用此类蛋白质连接技术。
如将某种药物(例如抗肿瘤药物)或毒素与载体分子(如单克隆抗体或受体)进行交联组成导向药物,人们誉之为“生物导弹”。
应用这种技术,将抗肿瘤药物(如多诺霉素、丝裂霉素、氨甲蝶吟等)或毒素(如白喉毒素、蓖麻毒素、红豆毒素等)作为弹头药物与肿瘤单克隆抗体作导向载体所制成的导向药物,对相应肿瘤细胞的杀伤力大大超过一般抗肿瘤药物。
毒素大多都是蛋白质,所以,上述蛋白质连接技术则可选用于导向药物的制备。
更为可喜的是,近些年来,在分子生物学研究中,特别是在核酸探针的研究与应用中,蛋白质连接技术也大显身手,有人称其为分子生物学的支撑技术。
随着这一技术的应用及其在相关研究领域的不断开拓,蛋白质交联方法也不断改进和渐趋完善,使其在生物医学领域中得到广泛的应用和重视。
目前,蛋白质连接技术不仅广泛应用于人工抗原的合成,而且在小分子物质(如毒物、药物、激素等)和生物大分子的标记免疫分析(放射免疫分析RIA、酶免疫分析EIA、荧光免疫分析FIA、发光免疫分析CIA、时间分辨免疫分析TrFIA)、标记受体分析(放射受体分析RRA、酶受体分析ERA)及竞争蛋白结合分析等配体结合分析方法中,普遍用作标记配体的制备方法。
此外,在基因探针标记、肿瘤标志和诊断研;究中也广为采用。
蛋白质连接技术是一种具有理论研究和实际应用价值的新技术,近几年来快速发展和更趋成熟。
但是,在实际应用中,它所涉及的问题较多,无论从理论上或在实践中都还存在一些需要进一步阐明和有待解决的问题。
现在,涉及这一技术的国内外文献及著述不少见,也是大家非常数悉的。
然而,至今未见到对此类技术较为全面系统的论述。
为满足有关科技研究工作的需要,我们几位作者,根据多年科研实践之所得,并参阅有关文献,从介绍化学反应的主要类型出发,以生物医学研究中的实际应用为目的编写本书,愿为同行提供有用的研究工具。
由于本书涉及内容较广,作者水平有限,经验不足,书中难免有谬误之处,敬请读者批评指正。
洪孝庄军事医学科学院毒物药物研究所1992年5月第一章蛋白质交联方法及其应用仲伯华龚雄麒(军事医学科学院毒物药物研究所)蛋白质交联系指将小分子物质(如药物、半抗原等)或大分子物质(如酶、蛋白毒素等)以共价键的方式连接于蛋白质分子,以制备人工抗原、酶标抗体、载体释放药物、抗体导向药物和免疫毒素等。
随着放射免疫分析法、酶标免疫技术、载体药物学和导向物学的发展,蛋白质交联技术的方法和手段也不断改进和完善,并且在生物学和医学领域得到愈来愈广泛的应用。
蛋白质交联方法首先发展于人工抗原的制备研究。
自70年前Landsteiner第一次合成人工抗原以来,人们将许多没有抗原性的小分子物质(半抗原)如化学药物、神经递质和激素等与蛋白质或多糖等载体大分子共价结台;使其具备抗原性,以诱发动物产生特异性抗体,用于放射免疫分析等。
为了使放射免疫分析达到灵敏度高、特异性强的要求,前人对半抗原和蛋白质连接的方法进行了大量的研究,建立了重氮化法、戊二醛法、混合酸酐法、二异氰酸酯法及卤代硝基苯法等交联技术近10多年来发展起来的酶标免疫检测技术,要求制备保持酶的生物活性和抗体的免疫结合活性的酶—抗体偶合物。
常用的交联方法如戊二醛法、碳二亚胺法和混合酸酐法不可避免地要产生酶或抗体的自身交联产物或多聚物,致使交联效率降低、结合物活性减弱。
为了克服这一不足,人们发展了异型双功能交联试剂,如N—羟基琥珀酰亚胺—3—(2吡啶基二硫)—丙酸酯,以实现控制交联,提高交联反应的选择性和交联产物的均一性。
将药物与大分子载体连接,制备药物一载体结合物,以改善和控制药物在体内的转运和代谢,实现缓释给药和定向给药,提高生物利用度和治疗指数。
这是现代药物研究领域一个崭新的分支。
载体药物必须能够在体内定量、定位释放原型药物,因此要求设计pH 敏感或特定酶敏感的偶联键。
导向药物的发展对蛋白质交联方法提出了更高的要求。
早在1906年,Ehrlich就提出了靶向给药的设想。
随着生物医学的发展,这一设想不断得到具体的实现。
单克隆抗体作为导向载体的出现,更使导向药物的研究成为当代药物研究中最活跃和最引人注目的领域之一,而其中研究得最广泛的是肿瘤治疗的抗体导向研究。
其载体主要有针对肿瘤细胞表面相关抗原的抗体及其片断,肿瘤细胞表面受体的模拟配基。
这些载体与药物或毒素分子连接而成的偶合物,能够选择性地杀伤肿瘤细胞,被誉为“生物导弹”。
为了最大限度地保持导向载体和药物弹头的生物活性,同时实现最大的药物载运量,人们不断创新交联剂,改进交联方法,发展了一批新的各具特性的异型双功能交联剂,提高了导向药物的有效性和实用性。
随着新的交联试剂和交联方法的出现,使得放射免疫、酶标免疫和导向药物的研究不断深入;.而后者的发展又反过来促进蛋白交联技术趋于成熟。
目前的交联方法可以,将任一个半抗原或细胞毒分子以一定方式与载体交联,获得所需的偶合物。
下面分别介绍蛋白质交联中常用的试剂、方法及其应用。
一、交联方法一般说来,蛋白分子中可以用于交联的活性基团有游离氨基(如赖氨酸的c—氨基或末端氨基)、游离羧基(如天冬氨酸残基,谷氨酸残基及末端羧基)、苯基(苯丙氨酸、色氨酸或酪氨酸)、酚基(酪氨酸)、巯基(半胱氨酸)、羟基(丝氨酸或苏氨酸)、咪唑基(组氨酸)、吲哚基(色氨酸)或胍基(精氨酸)等。
为了避免蛋白质变性及其生物活性的损失,药物或半抗原等与蛋白的交联应采用具有中等反应活性的试剂,在温和的条件(如接近中性的pH、室温、水溶液中)进行。
(一)重氮化法含芳香胺的化合物,可以与亚硝酸反应形成重氮盐,然后直接连接于蛋白质分子中酪氨酸残基上酚羟基的邻位,即得以偶氮键相联的结合物。
这种重氮盐也能与组氨酸残基上的咪唑环或色氨酸残基的吲哚环反应:本方法副反应较多,故一般限于人工抗原的制备。
(二)戊二醛法同型双功能交联剂戊二醛的两个醛基可以分别与两个相同或不同分子上的伯氨基形成Schiff氏碱,将两分子以五碳链的桥连接起来。
戊二醛连接反应是最温和的交联反应之一,可在4~40℃温度范围,pH6.0~8。
0的缓冲水溶液中进行,但是缓冲组份中不得含有氨基化合物。
以硼氢化钠或氰基硼氢化还原Schiff 氏碱可以形成稳定的单键;根据对偶联键的不同要求,还原步骤也可省略。
但是,本交联方法易形成相同蛋白间的连接;产物的均一性较差。
因此,多用于酶标抗体的制备。
(三)过碘酸盐氧化法[1]糖类或含糖基化合物分子中的邻二醇结构可被过碘酸钠氧化为醛基,然后与蛋白分子中的氨基形成Schiff氏碱:与戊二醛的交联反应相似,过碘酸钠氧化法比较温和,可在常温和中性pH的条件下进行。
这是一个两步反应,第一步生成醛基衍生物后,过量的过碘酸盐必须除去或消耗后,方可进行与蛋白交联的第二步反应。
(四)混合酸酐法半抗原或药物及其衍生物分子中的羧基可以在三级胺存在下与氯甲酸异丁酯反应,生成活泼中间体混合酸酐,然后与蛋白载体上的伯氨基反应,形成酰胺交联键:本反应过程简单,毋需制备和分离中间产物。
(五)碳二亚胺法碳二亚胺是一类很强的脱水剂,能使羧基和氨基脱水形成酰胺键。
在反应时,一种分子中的羧基先与碳二亚胺反应生成一个加成中间产物,再与另一分子上的氨基反应形成酰胺键,实现两者的交联:除戊二醛外,碳二亚胺是常见的另一类交联剂,最早用于药物化学和有机化学领域;脂溶性的二环己基碳二亚胺至今仍被广泛用于多肽合成领域,但其反应必须在有机溶剂中进行,不适用于蛋白质交联。
水溶性的1—乙基—3—(3—二甲基氨基丙基)—碳二亚胺(EDC)等的出现,使这一缩合反应成功地用于蛋白质交联中。
本交联反应条件温和即使在冷却(0)条件下,也能于中性pH中进行。
但是,由于碳二亚胺的缩合反应没有选择性;易形成蛋白分子间的自身聚合,产生非均一性产物;先将含羧基的药物或半抗原分子与EDC反应,活化羧基后,再加入蛋白反应物,可以减少蛋白分子交联。
.(六)活泼酯法[2]含有羧基的半抗原或药物在二环己基碳二亚胺(DCC)的作用下,与N—羟基琥珀酰亚胺反应,生成活泼酯衍生物,后者与载体蛋白上的氨基反应,形成以酰胺键连接的偶合物:本法是对碳二亚胺法的改进:由于避免了碳二亚胺对蛋白的直接作用,从而避免了蛋白分子间的交联。
活泼酯法在导向药物的研究中得到广泛的应用。
(七)多元酸酐法[3]半抗原或药物分子中的羟基或氨基与琥珀酸酐、顺—乌头酸酐等在无水吡啶催化下反应,形成单酯或单酰胺衍生物,引入游离羧基,然后以活泼酯法或碳二亚胺法与蛋白交联:多元酸酐法可以十分方便地将小分子中的羟基或氨基转变为合游离羟基的衍生物,具有较广的应用范围。
但是,与羟基形成的酯健在血浆中不稳定;而与氨基形成的酰胺键又往往不能充分降解;释放游离药物,影响导向药物的效价。
有趣的是,药物通过顾—乌头酸与蛋白形成的偶合物,在中性pH介质(如血浆中)稳定,而在酸性pH介质中充分解离,释放活性药物。
由此产生的溶酶体内降解性复合物,经细胞内化后,进入溶酶体内,在酸性条件下解离。