Ch.2 烷 烃
- 格式:doc
- 大小:316.00 KB
- 文档页数:34


第二章烷烃Chapter TwoAlkanes1.掌握碳正四面体的概念、sp 3杂化和σ键;2.掌握烷烃的命名法、常见烷基的名称;3.掌握烷烃的化学性质(稳定性、取代反应、各种氢的相对活性);4.掌握烷烃光卤代反应历程;5.掌握过渡态理论;6.掌握烷烃的构象及锯架式、楔形式和纽曼式的写法;7.掌握烷烃的物理性质;8.掌握同系列、同分异构、构造异构、反应机理等概念;9.掌握游离基的稳定性次序,计算ΔH ;10.掌握反应进程-位能曲线意义;11.了解烷烃的制备及其来源与应用。
学习要求“烃(hydrocarbon)”及其分类烃开链烃碳环烃饱和烃不饱和烃烷烃烯烃炔烃二烯烃脂环烃芳香烃饱和脂环烃不饱和脂环烃单环芳烃多环芳烃非苯芳烃CH 3CH 3CH 2CH 2CH CH CH 2CHCHCH 2烃类的用途§2-1 烷烃的同系列及同分异构现象系列差:相邻的同系物在组成上的差(例如烷烃的系列差为CH 2)同系列(homologous series):具有一个通式,结构、化学性质相似、物理性质随碳原子的增加而有规律的变化。
同系列是有机化合物中的普遍现象。
通式:烷烃C n H 2n+2。
如甲烷CH 4, 乙烷C 2H 6, 丙烷C 3H 8…同系物(homologs): CH 4, C 2H 6, C 3H 8, C 4H 10, 等互称为同系物烷烃的同系列烷烃的同分异构现象同分异构现象:分子式相同,而结构不同同分异构体(isomer):分子式相同,结构不同的化合物互称同分异构体烷烃的同分异构体主要是构造异构体(constructional isomerism),即碳干异构。
CH 3CH 2CH 2CH 3CH 3CH CH 3CH 3正丁烷b.p=-0.5℃异丁烷b.p=-10.2℃同分异构体结构不同,性质也不同(物、化)同分异构体的书写—缩短碳链法最长碳链减一碳取代……剔除相同者1 CH3—2 CH—1 C H—减二碳取代减三碳取代……C C C C C(1)C C C CCHC C C CCH(2)(3)C C C CCH(4)C C CCH3H3C C C CCH3CH3(4)(5)(6)C C CCH3CH3C C C CH2CH3(7)1=4=5=7, 2=3=4, 6. 共三种伯(1o)、仲(2o)、叔(3o)、季(4o)碳原子伯(1o)、仲(2o)、叔(3o)氢原子C H3C H2C HC H3CC H3C H3C H3§2-2 烷烃的命名认识烷基CH3甲基(methyl, Me)CH3CH2乙基(ethyl,Et)CH3CH2CH2正丙基(n-propyl, n-Pr)CH3CHCH3异丙基(iso-propyl, i-Pr)CH2CH CH2 CH3正丁基(n-butyl,n-Bu)CH3CH CH2CH3异丁基(iso-butyl,i-Bu)CH2CHCH3CH3仲(另)丁基(sec-butyl, s-Bu)CH3CCH3CH3叔丁基(tert-butyl, t-Bu)烷烃的命名普通命名法—简单烷烃的命名方法CH3CH2CH2CH2CH3正戊烷CH3CH CH2CH3CH3异戊烷CCH3CH3CH3H3C新戊烷CH3CH CH2CH3C CH3CH3CH3异辛烷衍生物命名法—以甲烷的衍生物命名CH2二苯甲烷CH三苯甲烷CH CH2CH3CH3H3C二甲基乙基甲烷CH2CCCH3CH3CH3H3CCH3CH3二叔丁基甲烷系统命名法—IUPAC命名法1947年国际纯粹与应用化学联合会IUPAC (I nternational U nionof P ure and A pplied C hemistry)在日内瓦命名法的基础上加以修订形成了IUPAC命名法。

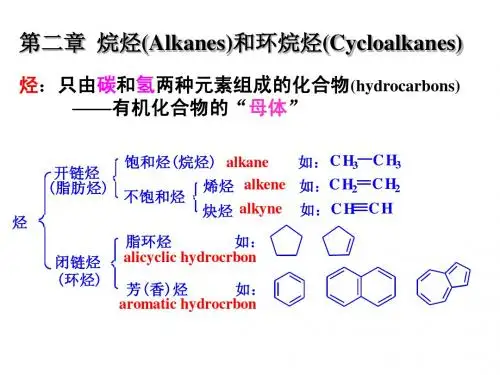




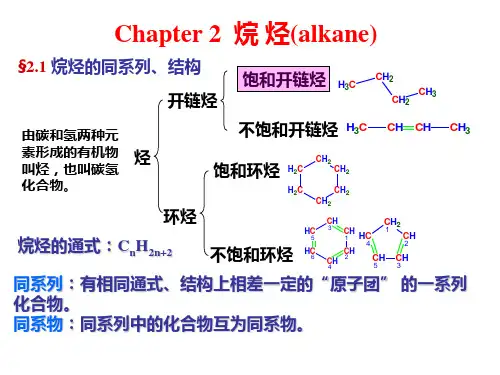
第二章 烷 烃烃的定义——烃的分类: 先据C 架,后据C 、H 的比例来分。
烷烃的存在:烷烃分子的组成特点和结构特点:第一节烷烃的同系列及同分异构现象一、烷烃同系列1. 通式用来表示结构相似因而化学性质也相似的一系列化合物的组成的式子叫做通式。
2. 同系列3. 同系物4. 系差二、烷烃的同分异构现象在烷烃同系列中,除了CH4外,其它任何一个同系物均可看成是前面一个成员的某个H被一个CH3取代得到的产物。
从丙烷导出丁烷时,由于丙烷有两种类型的H,因而可导出两种结构不同的丁烷:同分异构体——同分异构现象——注意: 同分异构现象可以存在于同一个同系列中,也可以存在于不同的同系列中。
●烷烃的同分异构主要是C 干异构。
●观察P.17表2—2可看出,烷烃随C 原子数n 的增加,异构体的数目急剧增大。
●要确定异构体的数目,没有一个普遍适用的计算公式。
●对于C原子数不多的烷烃,其异构体数目的确定可按下述步骤导出。
下面以C7 H16 为例说明之。
Step 1.写出最长的C链C—C—C—C—C—C ……①Step 2.写出少一个C的直链, 余下一个C作为支链依次连到各个主链的各个C上。
②③与③同与②同Step 3.写出少两个C的直链,余下的两个C作为支链。
⑴作为一个支链与③相同④与③相同⑵作为二个支链⑤⑥⑦⑧与⑥同Step 4. 写出少三个C 的直链, 余下的三个C 作为支链。
⑴ 作为一个支链与③同 与⑥同⑵ 作为两个支链与⑧同 与⑥同⑶ 作为三个支链 —C 、—C 、—C⑨根据C 原子的4价,加上所有H 原子,便得到完整的构造式,熟练的话,可直接写出构造简式。
二、 C原子和H原子的类型伯C原子(一级C原子)用1︒表示伯H原子仲C原子(二级C原子)用2︒表示仲H原子叔C原子(三级C原子)用3︒表示叔H原子季C原子(四级C原子)用4︒表示无季H原子不同类型的H 原子,反应活性是有别的。
第二节烷烃的命名法烷烃的命名法是一切有机物命名法的基础,烷烃的命名法有三种,本节只介绍最常用的二种。
一、普通命名法规则如下1.无支链烷烃称为某烷,超过四个C的烷烃,为了区别异构体,须加“正”字。
CH4甲烷CH3—CH2—CH2—CH3正丁烷CH3—(CH2)10—CH3正十二烷2. 凡具有这种结构,称为异某烷。
3. 含C5 ~ C6的、链端第二位有2个CH3的烷烃称为“新”某烷。
衡量汽油品质的异辛烷是误名:二、烷基和它的普通名烷基—烷烃去掉若干个H或基团,剩下的残基称为烷基。
去掉一个H或基团产生的烷基是一价基,用C n H2n+1 表示其组成。
从三个C开始的一价烷基,必须冠以正、异、仲(另)、新、叔(特)等词头。
三、系统命名法●日内瓦命名法●I U P A C命名法(国际通用的命名法)● C C S 命名法(即中国化学会命名法)烷烃的CCS命名规则●无支链的烷烃名称不加“正”字,称为某烷。
●有支链的烷烃,命名按下列步骤进行:1. 选主链作母体,称作某烷① C链最长②支链最多③支链具有“最低系列”编号2. 给主链C 编号,以确定支链的位次①取支链具有“最低系列”编号的那个编码方向②当二个不同支链的位次相当时,最小位次应给予在命名时较先列出的支链正确命名:2,2,6,6,7 -五甲基辛烷(位次之和为23)误名:2,3,3,7,7 -五甲基辛烷(位次之和为22)3. 写出全名①支链的名称按“次序规则”依次列出②注明支链的位次③相同支链要合并④最后写出母体的名称例12,3,5 -三甲基- 4 -丙基庚烷不应3,5,6 -三甲基- 4 -丙基庚烷因为编号不对烷基的CCS命名:●无支链者称为某基。
●有支链者,要给烷基主链编号,带有自由价的C永远编 1号。
如:亚烷基(二价基):—CH2—叫亚甲基CH叫甲叉2—CH2CH2—叫1,2—亚乙基—CH2CH2CH2—叫1,3—亚丙基烷基(三价基):例2根据前述命名规则的1.③,应选 为主链。
正确名称为:2,5 - 二甲基– 4 - (2 - 甲基丙基)庚烷或:2,5 - 二甲基– 4 –2ˊ- 甲基丙基庚烷因此,上面的化合物也可命名为:2,5 –二甲基– 4 –异丁基庚烷第三节烷烃的构型●SP3杂化轨道的成分●SP3杂化轨道的图形●4个SP3杂化轨道在空间的分布正四面体构型●CH4 C — H 键的形成σ1S-SP3●CH4分子的构型●立体结构式的一种——楔形式(伞形式)●其它烷烃分子中σ键的形成σ健的特性:○可单独存在○牢固○可极化性小○可“自由”旋转四、分子构型是指原子在空间一定的排列使分子所具有的立体形象。
直链烷烃的含义——是指没有支链的烷烃。
正烷烃——无支链的烷烃。
n-第四节烷烃的构象构象——是指由于分子中单键的旋转而产生的各种立体形象。
一、乙烷的构象3.各构象的能量关系 见教材P.29常温下,在乙烷的无数种构象中,哪一种是优势构象?二、 正丁烷的构象2. 各构象的能量关系一般说来,●交叉式的能量总是 重叠式●二个最大基团处于对位交叉时的构象是能量最低的●二个最大基团处于全重叠时的构象是能量最高的正丁烷各种构象的内能高低见教材P.30图2—11练习题 1 将下列各化合物改写成楔形式、纽曼式,并写出其优势构象的纽曼式。
解:练习题 2 将下列化合物改写成锯架式、纽曼式,并写出其优势构象的纽曼式。
解:略现在回过头来思考教材P.26“在结晶状态时,烷烃的C链排列整齐,且成锯齿状”这句话,为什么C链会成锯齿状?第五节烷烃的物理性质一、物态从烷烃的沸点和熔点可以看出,在室温(20︒C),常压101千帕(1大气压)下:C1- C4 gC5- C16 lC17以上 s二、沸点正烷烃 b.p随分子量的增加而有规律地升高。
对于异构体正烷烃b.p最高。
支链越多,b.p越低。
三、熔点烷烃m.p的变化不象b.p的变化那么有规律。
正烷烃 m.p也随分子量的增加而升高(但前三个成员不遵循这一规律)。
●由奇数C→偶数C,m.p升高的幅度较大;●由偶数C→奇数C,m.p升高的幅度较大。
对于异构体一般来说,正烷烃的m.p比有支链的高,支链多但对称性高的反而比正烷烃的高。
四、比重n 烷烃的比重随C原子的增加而缓慢地增加,最后趋于最大值0.78。
五、溶解性遵循“相似相溶”的经验规律。
在非极性溶剂中易溶。
在水或极性有机溶剂(如乙醇)中不溶或稍溶。
第六节烷烃的化学性质烷烃分子中的单键均是比较牢固的 键盘,因此,烷烃,尤其是正烷烃,具有很高的化学稳定性,与大多数试剂都不起反应,或反应速度极慢。
烷烃与下列试剂都不反应:强酸(浓H2SO4、沸HNO3)强碱(熔融状态的NaOH)强氧化剂(K2CrO7、KMnO4)强还原剂(Zn-HCl、Na-C2H5OH、Na)烷烃化学惰性的应用:作反应中的溶剂;作药物制剂中的软膏基质。
在特殊条件下,烷烃也能发生一些反应,如氧化、卤代、硝化。
由于烷烃中C、H的电负性(2.5、2.1)差别很小,C-H键的极性很小,因此,烷烃发生的反应一般为游离基型反应,不易发生离子型反应。
一、氧化1.燃烧空气或氧气充足时,能完全燃烧(完全氧化、彻底氧化),最终产物是 CO2 和 H2O 。
气混合后,形气体烷烃或成为极细雾状的液体烷烃与空气或O2成爆炸性混合物,在火焰或火花或高温出现时,会立即发生猛烈爆炸。
内燃机利用这一原理来产生机械能。
空气或氧气不足时,烷烃不能完全燃烧,除了生成CO2 和 H2O外,同时还会产生CO、游离C、醛等空气污染物。
在内燃机中,烷烃很难完全燃烧,这些产物与CO2 和 H2O及未燃烧的燃油一起排放出来造成环境污染。
烷烃的燃烧肯定是游离基型反应,所以需要较高的温度才能燃烧。
2.控制氧化在催化剂、高压下,将烷烃与O2(空气)控制在发火点(蒸气着火的温度)以下,可使烷烃发生部分氧化(与彻底氧化相对而言),可生成醇、醛(酮)、羧酸等产物。
例如CH 4的整个氧化过程可表示如下:CH4CH 3OH HCHO [ O ][ O ][ O ][ O ]CO 2 + H 2O其它烷烃分子的这种氧化过程很复杂,氧化位置可以是C 链的中部,也可以是C 链末端,还可以是几个位置同时发生反应,因此氧化产物是混合物。
若控制反应条件,可使其中某种产物为主,工业上常用这种方法制取化工原料。
例如 :产物是混合物,尚有醇、醛、酮等,其中C 12 ~ C 18的高级脂肪酸可用于制肥皂。
二、 裂化烷烃的裂化主要是指由长C 链的烷烃分解为较短C 链的烷烃、烯烃和H 2的过程。
烷烃的裂化是石油加工中的重要反应,主要用于提高汽油、柴油的产量和质量。
从反应的本质看,裂化反应主要是C—C键和C—H键的断裂,虽然C—C键比C—H键易断裂,但是在C—C键断裂的同时,C—H键也不可避免地发生断裂。
裂化是一个复杂的化学过程,产物是多种产物的混合物,分子越大,产物就越复杂,不过反应仍有一般的规律:●长链烷烃的C链断裂的趋势是在C链的一端,短碎片成为烷烃,长碎片成为烯烃。
●同级烷烃,有支链的更易裂化。
裂解——在更高温度下(>700︒C)的深度裂化称为裂解。
在石油加工中,裂解的主要目的是获得低级烯烃等化工原料。
液化石油气——是石油的催化裂化过程中分离出的C3、C4的烷烃和烯烃:三、卤代反应反应时卤素的活性次序:F2> Cl2> Br2> I2F代是一个难以控制破坏性反应,即使在黑暗中,-80︒C时也能发生激烈反应:I代反应较难,而且可逆:氯代与溴代比较适中,容易进行,又不至于太激烈,但小分子量的烷烃在强日光下与Cl2反应,也发生爆炸:通常所说的卤代是指在漫射光或高温或有催化剂的条件下的氯代或溴代。
以CH4为例,其氯代反应如下所示:有机反应式的连写:不同类型H的相对活性:3︒ H的相对活性 = 36 / 1 = 361︒ H的相对活性 = 64 / 9 = 7.1 相对活性比为 3︒ H : 1︒ H = 36 : 7.1≈ 5 : 1 由下面的反应:可得出活性比2︒ H : 1︒ H = 4 : 1氯代时,活性比为3︒ H : 2︒ H : 1︒ H = 5 : 4 : 1溴代时,活性比为3︒ H : 2︒ H : 1︒ H = 1600 : 82 : 1上述活性比在太高的温度下适用,与烷烃的结构无关。
在高温下,各类H 的活性无差异。
第七节 卤代反应历程 (掌握)第八节 过渡态理论反应历程又称反应机制或反应机理,是“反应所经历的过程”或“从反应物转变成产物的详细步骤。
”通常所写的反应式都不表示反应历程,即使是一个很简单的反应,其反应历程也是由多个“基元反应”构成的。
基元反应——反应物种在碰撞中一步转变成产物的反应。
其反应历程为:X2对CH4的相对反应活性不讨论。
对不同类型H在卤代反应中相对活性的解释——1.从C-H 键能的相对大小来解释2.从烷基游离基 R·的相对稳定性来解释3︒ R·>2︒ R·>1︒ R·>CH3·关于R·的结构:3.从X·+ H-R → X-H + ·R 这个步骤过渡态能量的高低来解释因为这一步是卤代反应中的决速步骤。