§10.1 分解电压
- 格式:ppt
- 大小:132.50 KB
- 文档页数:6





分解电压的测定摘要:分解电压是探索电极过程机理和实际电解过程中电位控制的重要依据。
用线性扫描伏安法测得氢氧化钠的电解质溶液中插入铂电极进行的电解,即电池反应的结果是使水分解。
热力学分析表明实测分解电压与理论分解电压相差较大的主要原因是阳极上的去极化作用。
关键词:分解电压;氢氧化钠;线性扫描伏安法前言:物质的分解电压是指进行长时间电解并析出电解产物所需的外加最小电压。
分解电压不仅为探索电极过程机理提供依据,在生产中还可以利用对分解电压或反电动势的测定来控制电解过程。
因此,分解电压研究具有非常重要的理论及实际意义。
本实验在1mol/dm-3NaOH 水溶液中插入两个铂电极,连接分解电压测量装置,逐渐增加电压进行电解,记录相应的电流值。
从实验数据可见,当电压增加到某一数值时,电流突然直线上升,电极上有气泡逸出。
为使电解不断进行而必须外加的最小电压值,称为电解质在该条件下的分解电压,用E分解表示。
作I-V曲线,可求得E 分解。
以期为工艺实验和实际生产提供基础数据和理论依据。
一、实验目的及要求1.了解分解电压的概念,掌握测量分解电压的实验方法;2.了解分解电压与电极材料的关系。
二、实验基本原理当直流电通过电解质溶液时,在溶液内部,阳离子向阴极移动,阴离子向阳极移动,并在电极上进行放电,阳离子在阴极上得到电子发生还原反应;阴离子在阳极上失去电子发生氧化反应。
在H2SO4电解质溶液中,插入铂电极通电进行电解,有如下电极反应:阴极2H2O+2e→H2(g,101325Pa)+2OH-阳极2OH-→1/2O2(g,101325Pa)+2e电池反应为:2H2O→H2(g,101325Pa)+1/2O2(g,101325Pa)即电池反应的结果是使水分解。
本实验在1mol-1dm-3NaOH 水溶液中插入两个铂电极,连接分解电压测量装置,逐渐增加电压进行电解,记录相应的电流值。
从实验数据可见,当电压增加到某一数值时,电流突然直线上升,电极上有气泡逸出。


第十章 电解与极化作用本章要求:1.了解分解电压的意义,要使电解池不断工作必须克服哪几种阻力?2.了解什么是极化现象,什么是超电势?极化作业有哪几种?如何降低极化作用?3.了解电解的一般过程及应用,特别是有关电解分离提纯方面的应用。
4.了解金属腐蚀的类型以防止金属腐蚀的常用方法。
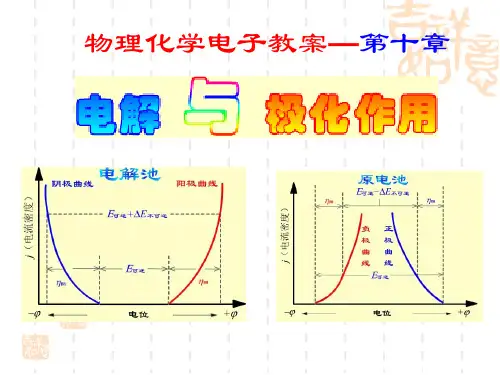
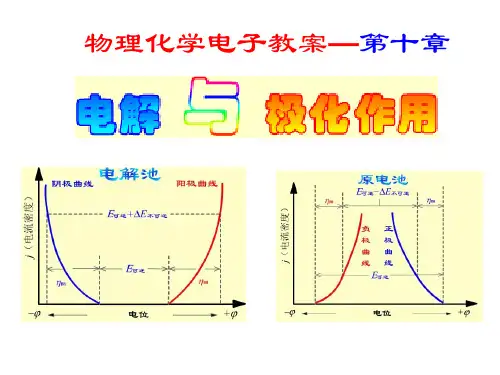
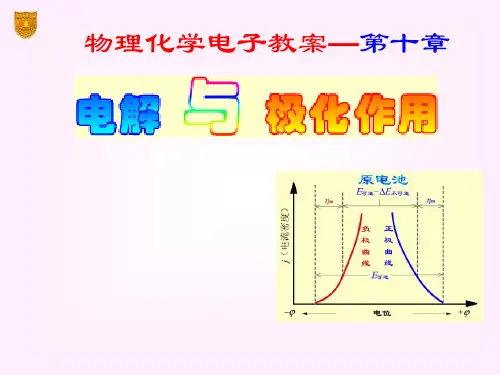
电解池:使电能转变成化学能的装置当一个电池与外接电源反向对接时,只要外加电压大于该电池的电动势E ,电池中的反应逆向发生,原电池就要变成电解池,要使电解池继续正常工作,外加电压要比电池电动势E 大很多,这些额外的电能一部分用来克服电阻,一部分用来克服电极的极化作用极化作用:当电流通过电极时,电极电势偏离其平衡的现象,且该过程是步可逆过程。
§10.1 分解电压在电池上外加一个直流电源,并逐渐增加电压,使电池中的物质在电极上发生化学反应,称为电解。
如电解HCl 水溶液阴极: ).(()p g aH e H H 222→+-++阳极:).(p g Cl e Cl 222→--- 总反应: )()()(p P aq Cl H HCl 222+−−→−电解 分解装置P118图10.1,并绘制电流─电压曲线。
由P118图10. 电流─电压曲线可看出:① 当开始加外电压时,还没有)()(g g Cl H 22和生成,P=0 电路中几乎没有电流通过。
② 当稍增大外电压,电极表面有少量)()(g g Cl H 22和产生,其压力虽小,却构成了一个原电池,产生了与外加电压方向相反的反电动b E 由于压力很小,低于大气压力,产生气体不能离开电极自由逸出,而是扩散到溶液中消失,此时此时就需要通入极微小的电流使电极产物得到补充,相当于图1─2段。
③ 继续增大外电压,电极时上)()(g g Cl H 22和继续产生,当22cL H P P 和等于外界大气压力时,电极上开始有气泡逸出,此时反电动势b E 达到了最大值MAX b E 而不在继续增加,若此时继续增大外电压,则电流急曾,如图曲线2─3段直线部分。

第十章电解与极化作用一、本章主要内容§10.1 分解电压§10.2 极化作用§10.3 电解时电极上的反应§10.4 金属的电化学腐蚀与防腐§10.5 化学电源二、本章重点与难点1、分解电压的概念。
2、极化作用。
3、电解时电极上的反应。
4、金属的电化学腐蚀与防腐。
5、化学电源。
三、教学目的1、掌握电化动力学的一般原理;2、掌握电化学的基本理论和技能,为后续专业课的学习奠定坚实的理论基础。
四、教学要求1、了解分解电压的意义。
2、了解产生极化的原因,了解氢超电势在电解中的作用。
3、能计算一些简单的电解分离问题。
4、了解金属腐蚀的原因和各种防腐的方法。
5、了解化学电源的类型及应用。
五、授课时数8学时用Nernst 方程式处理电化学体系时,都有一个前提,即该体系需处于热力学平衡态。
所以用Nernst方程研究的问题具有很大的局限性。
一切实际的电化学过程都是不可逆过程。
对不可逆电极过程进行的研究,无论是在理论上或实际应用中,都有非常重要的意义。
因为要使电化学反应以一定的速度进行,无论是原电池的放电或是电解过程,在体系中总是有显著的电流通过。
因此,这些过程总是在远离平衡的状态下进行的。
研究不可逆电极反应及其规律对电化学工业有着十分重要的意义。
因为它直接涉及工艺流程、能量消耗、原料消耗等因素。
本章我们将讨论电解过程中在电极上进行的不可逆反应,从中得出不可逆电极过程的一些规律,将它们应用于电镀、电化学腐蚀、化学电源等方面。
§10.1 分解电压一、理论分解电压使某电解质溶液能连续不断发生电解反应时所必须外加的最小电压称为理论分解电压。
理论分解电压在数值上等于该电解池作为可逆电池时的可逆电动势:E (理论分解电压)=E (可逆)二、分解电压的测定若外加一电压在一个电池上,逐渐增加电压,使电池中的化学反应发生逆转,这就是电解。
当直流电通过电解质溶液时,正离子向阴极迁移,负离子向阳极迁移,并分别在电极上起还原和氧化反应,从而获得还原产物和氧化产物。
利用“分解电压”解题的方法引言在研究电学时,分解电压是一个重要的概念。
它可以帮助我们更好地理解电路中电压的变化与分布。
本文将介绍利用“分解电压”解题的方法,希望能帮助读者更好地掌握电路分析技巧。
什么是“分解电压”在电路中,当电路中存在多个元件时,电压会在这些元件之间进行分布。
这种电压的分布可以通过“分解电压”来计算和分析。
分解电压指的是将总电压分解为每个元件所承受的电压。
解题方法1. 确定电路连接方式:首先要了解电路中元件的连接方式,例如是串联连接还是并联连接。
这对于后续计算分解电压非常重要。
2. 应用基本电路定律:根据所学到的基本电路定律,例如欧姆定律和基尔霍夫定律,可以找到计算分解电压所需的方程式。
3. 进行电压分解计算:根据电路中元件的连接方式和所得到的方程式,可以进行电压分解计算。
一般情况下,对于串联电路,每个元件所承受的电压之和等于总电压;而对于并联电路,每个元件所承受的电压相等。
4. 检查计算结果:计算完分解电压后,应该对计算结果进行检查,确保所得到的电压符合实际电路的情况。
实例分析下面通过一个简单的电路实例来说明利用“分解电压”解题的方法。
假设有一个串联电路,其总电压为10V,电阻R1为4Ω,电阻R2为6Ω。
我们要计算R1和R2分别承受的电压。
根据串联电路的性质,我们知道总电压等于每个元件所承受的电压之和。
因此,我们可以设置如下方程:10V = VR1 + VR2同时,根据欧姆定律,可以得到以下两个方程:VR1 = I * R1VR2 = I * R2结合以上方程,我们可以解得电流I为1A。
代入方程`10V =VR1 + VR2`,可以求得VR1为4V,VR2为6V。
因此,R1承受的电压为4V,R2承受的电压为6V。
结论通过利用“分解电压”解题的方法,我们可以更好地理解和计算电路中元件承受的电压。
这种方法对于解决复杂电路问题非常有用。
希望本文所介绍的方法能帮助读者在电路分析中取得好的成果。
实际分解电压
电压分解是一种对在网络中的电压和流量进行测量的技术。
它是一种量度和调节的重要方法,用于在多个网络节点间划分电压幅值。
它有助于更好地了解网络中的电力控制、管理和调整。
电压分解是一种针对每个网络节点的智能分解电压的技术。
它可以对网络中的电压进行定期监测,并将电压以最佳方式平均分配到各个节点中以保持网络的稳定性。
通过这种分布有效的方式,有助于降低断路器、变压器和装置的使用成本,以及保护其他部件免受高压电流的伤害,提高电力质量。
电压分解的实施原理是通过监测和控制电压,使得在系统中所有节点的电压都达到一个特定的电压水平,并特别关注了某些特定节点或子网络的电压水平,以保证网络的正常运行。
它可以在瞬时条件发生变化时进行调整,以维持系统电压范围内的稳定性。
电压分解有助于实现系统电压的范围内稳定,有效地减少线路负载,以及提高系统的可用性.它可以有效节省系统的功耗,有助于实现节能减排。
电压分解系统可以被用在大型电力系统中,以桥接这些大型系统之间的电压差异,确保系统的安全运行。
电压分解的实现的一个重要任务是实施一个可靠的测量系统,以精确监控每个网络节点的电压水平,从而准确分析电压降低和提高的原因,并可以根据情况及时调整电压幅值。
电压分解的好处不仅仅体现在它可以更好地监控和控制电压和流量,还体现在更高级的功能上,如节能和故障检测以及电网的优化。
这些功能对电力行业和电力客户来说都是非常有效的。
总之,电压分解是在电力网络中实施、监控及控制电压水平的一种重要技术,具有十分重要的作用,可以有效改善电力系统的效率,同时也可以提高网络的可靠性和可靠性。
分解电压的测定The measurement of decomposition voltage一、实验目的及要求1.了解分解电压的概念,掌握测量分解电压的实验方法;2.了解分解电压与电极材料的关系。
二、实验基本原理当直流电通过电解质溶液时,在溶液内部,阳离子向阴极移动,阴离子向阳极移动,并在电极上进行放电,阳离子在阴极上得到电子发生还原反应;阴离子在阳极上失去电子发生氧化反应。
在H2SO4电解质溶液中,插入铂电极通电进行电解,有如下电极反应:阴极2H2O+2e→H2(g,101325Pa)+2O H-阳极2O H-→1/2O2(g,101325Pa)+2e电池反应为:2H2O→H2(g,101325Pa)+1/2O2(g,101325Pa) 即电池反应的结果是使水分解。
本实验分别在0.5 mol-1dm-3H2SO4与1mol-1dm-3NaOH 水溶液中插入两个铂电极,连接分解电压测量装置,逐渐增加电压进行电解,记录相应的电流值。
从实验数据可见,当电压增加到某一数值时,电流突然直线上升,电极上有气泡逸出。
为使电解不断进行而必须外加的最小电压值,称为电解质在该条件下的分解电压,用E分解表示。
作I-V曲线,可求得E分解。
三、仪器试剂毫安表、电压表各一个,接线板一付(含滑线电阻器一个)。
直流稳压电源一台或甲电池一对;0.5 mol-1dm-3H2SO4与1mol-1dm-3NaOH溶液。
四.实验步骤1.电极清洗干净后,将两支铂电极分别插入已装电解质溶液的“H”型电解池直至浸没。
2.按照要求正确连接线路后,应使滑线电阻的滑动点放在输出的最低处。
3.缓慢移动电阻器,使电压以0.2V间隔增加,并记下相应的电流值。
到1V时,以0.1V间隔增加电压。
到电压为2.6V可终止实验。
记录实验数据时,应在电压表、电流表均稳定时读取数据。
五.注意事项1.正确连接线路,防止短路;2.电源输出不宜太高,一般小于5V。
六.数据处理1.根据实验数据作I-V曲线,从曲线上找出电流直线上升段,将此直线作延长线与电压轴的交点即为所求分解电压。