10.1分解电压
- 格式:ppt
- 大小:110.00 KB
- 文档页数:16


《物理化学A》教案Physical chemistry教案说明:1.本教案内容参照傅献彩主编《物理化学》(高教第五版,2005)确定。
2.本教案适用于应化和化工本科各专业。
3.根据本学科发展的前沿和专业方向,介绍本学科的最新成就和发展动态。
4.除绪论外,每一部分结束后进行归纳总结,并安排2学时习题课。
5.本课程授课采用板书与多媒体课件相结合的方式进行。
第0章绪论(1学时)教学目的与要求:了解物理化学课程的内容、任务、研究方法、特点和学习方法。
本章主要内容:0.1 物理化学的建立与发展0.2 物理化学课程的内容与任务0.3 理化学课程的研究方法0.4 理化学课程的特点和学习方法本章重点:1. 物理化学课程的内容与任务2. 理化学课程的研究方法3. 理化学课程的特点和学习方法本章难点:1. 物理化学课程的内容与任务2. 理化学课程的研究方法第1章气体(7学时)教学目的与要求:1. 了解气体分子动理论、及其有关计算;2. 掌握对比状态和对比状态定律。
本章主要内容:1.1气体分子动理论1.2 实际气体1.3 压缩因子图本章重点:1. 气体分子动理论的基本公式。
2. 实际气体的行为。
3. 对比状态和对比状态定律。
本章难点:1.对比状态和对比状态定律;2. 压缩因子图的应用。
第2章热力学第一定律(12学时)教学目的与要求:1. 理解并掌握状态与状态函数、热力学平衡态、热力学能、热与功、热容、焓、可逆过程等热力学基本概念。
2. 熟练掌握热力学第一定律的叙述及数学表达式;体积功和过程热的计算;热力学第一定律对理想气体及相变过程的应用。
3. 熟练掌握标准摩尔生成焓、标准摩尔燃烧焓,Hess定律。
4. 了解用基希霍夫定律处理问题的方法。
本章主要内容:2.1 热力学总论及热力学基本概念2.2 热力学第一定律2.3 等容过程热、等压过程热与焓2.4 可逆过程和最大功2.5 热容2.6 热力学第一定律对理想气体及相变过程的应用2.7 热力学第一定律对实际气体的应用2.8 热化学2.9 绝热反应本章重点:1.理解状态函数、可逆过程、焓、标准摩尔生成焓和标准摩尔燃烧焓五个基本概念;2.热力学第一定律对理想气体及相变过程的应用。





分解电压的测定摘要:分解电压是探索电极过程机理和实际电解过程中电位控制的重要依据。
用线性扫描伏安法测得氢氧化钠的电解质溶液中插入铂电极进行的电解,即电池反应的结果是使水分解。
热力学分析表明实测分解电压与理论分解电压相差较大的主要原因是阳极上的去极化作用。
关键词:分解电压;氢氧化钠;线性扫描伏安法前言:物质的分解电压是指进行长时间电解并析出电解产物所需的外加最小电压。
分解电压不仅为探索电极过程机理提供依据,在生产中还可以利用对分解电压或反电动势的测定来控制电解过程。
因此,分解电压研究具有非常重要的理论及实际意义。
本实验在1mol/dm-3NaOH 水溶液中插入两个铂电极,连接分解电压测量装置,逐渐增加电压进行电解,记录相应的电流值。
从实验数据可见,当电压增加到某一数值时,电流突然直线上升,电极上有气泡逸出。
为使电解不断进行而必须外加的最小电压值,称为电解质在该条件下的分解电压,用E分解表示。
作I-V曲线,可求得E 分解。
以期为工艺实验和实际生产提供基础数据和理论依据。
一、实验目的及要求1.了解分解电压的概念,掌握测量分解电压的实验方法;2.了解分解电压与电极材料的关系。
二、实验基本原理当直流电通过电解质溶液时,在溶液内部,阳离子向阴极移动,阴离子向阳极移动,并在电极上进行放电,阳离子在阴极上得到电子发生还原反应;阴离子在阳极上失去电子发生氧化反应。
在H2SO4电解质溶液中,插入铂电极通电进行电解,有如下电极反应:阴极2H2O+2e→H2(g,101325Pa)+2OH-阳极2OH-→1/2O2(g,101325Pa)+2e电池反应为:2H2O→H2(g,101325Pa)+1/2O2(g,101325Pa)即电池反应的结果是使水分解。
本实验在1mol-1dm-3NaOH 水溶液中插入两个铂电极,连接分解电压测量装置,逐渐增加电压进行电解,记录相应的电流值。
从实验数据可见,当电压增加到某一数值时,电流突然直线上升,电极上有气泡逸出。

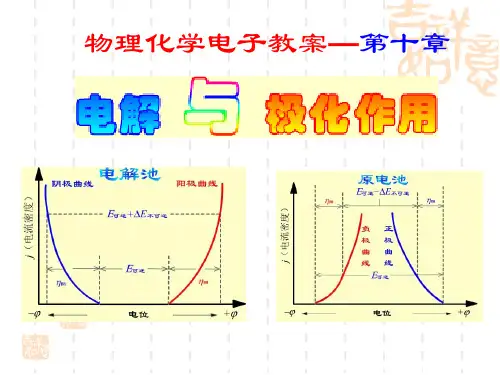
第十章 电解与极化作用本章要求:1.了解分解电压的意义,要使电解池不断工作必须克服哪几种阻力?2.了解什么是极化现象,什么是超电势?极化作业有哪几种?如何降低极化作用?3.了解电解的一般过程及应用,特别是有关电解分离提纯方面的应用。
4.了解金属腐蚀的类型以防止金属腐蚀的常用方法。
电解池:使电能转变成化学能的装置当一个电池与外接电源反向对接时,只要外加电压大于该电池的电动势E ,电池中的反应逆向发生,原电池就要变成电解池,要使电解池继续正常工作,外加电压要比电池电动势E 大很多,这些额外的电能一部分用来克服电阻,一部分用来克服电极的极化作用极化作用:当电流通过电极时,电极电势偏离其平衡的现象,且该过程是步可逆过程。
§10.1 分解电压在电池上外加一个直流电源,并逐渐增加电压,使电池中的物质在电极上发生化学反应,称为电解。
如电解HCl 水溶液阴极: ).(()p g aH e H H 222→+-++阳极:).(p g Cl e Cl 222→--- 总反应: )()()(p P aq Cl H HCl 222+−−→−电解 分解装置P118图10.1,并绘制电流─电压曲线。
由P118图10. 电流─电压曲线可看出:① 当开始加外电压时,还没有)()(g g Cl H 22和生成,P=0 电路中几乎没有电流通过。
② 当稍增大外电压,电极表面有少量)()(g g Cl H 22和产生,其压力虽小,却构成了一个原电池,产生了与外加电压方向相反的反电动b E 由于压力很小,低于大气压力,产生气体不能离开电极自由逸出,而是扩散到溶液中消失,此时此时就需要通入极微小的电流使电极产物得到补充,相当于图1─2段。
③ 继续增大外电压,电极时上)()(g g Cl H 22和继续产生,当22cL H P P 和等于外界大气压力时,电极上开始有气泡逸出,此时反电动势b E 达到了最大值MAX b E 而不在继续增加,若此时继续增大外电压,则电流急曾,如图曲线2─3段直线部分。
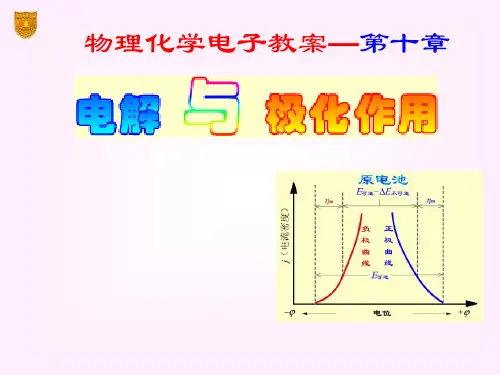
第十章电解与极化作用一、本章主要内容§10.1 分解电压§10.2 极化作用§10.3 电解时电极上的反应§10.4 金属的电化学腐蚀与防腐§10.5 化学电源二、本章重点与难点1、分解电压的概念。
2、极化作用。
3、电解时电极上的反应。
4、金属的电化学腐蚀与防腐。
5、化学电源。
三、教学目的1、掌握电化动力学的一般原理;2、掌握电化学的基本理论和技能,为后续专业课的学习奠定坚实的理论基础。
四、教学要求1、了解分解电压的意义。
2、了解产生极化的原因,了解氢超电势在电解中的作用。
3、能计算一些简单的电解分离问题。
4、了解金属腐蚀的原因和各种防腐的方法。
5、了解化学电源的类型及应用。
五、授课时数8学时用Nernst 方程式处理电化学体系时,都有一个前提,即该体系需处于热力学平衡态。
所以用Nernst方程研究的问题具有很大的局限性。
一切实际的电化学过程都是不可逆过程。
对不可逆电极过程进行的研究,无论是在理论上或实际应用中,都有非常重要的意义。
因为要使电化学反应以一定的速度进行,无论是原电池的放电或是电解过程,在体系中总是有显著的电流通过。
因此,这些过程总是在远离平衡的状态下进行的。
研究不可逆电极反应及其规律对电化学工业有着十分重要的意义。
因为它直接涉及工艺流程、能量消耗、原料消耗等因素。
本章我们将讨论电解过程中在电极上进行的不可逆反应,从中得出不可逆电极过程的一些规律,将它们应用于电镀、电化学腐蚀、化学电源等方面。
§10.1 分解电压一、理论分解电压使某电解质溶液能连续不断发生电解反应时所必须外加的最小电压称为理论分解电压。
理论分解电压在数值上等于该电解池作为可逆电池时的可逆电动势:E (理论分解电压)=E (可逆)二、分解电压的测定若外加一电压在一个电池上,逐渐增加电压,使电池中的化学反应发生逆转,这就是电解。
当直流电通过电解质溶液时,正离子向阴极迁移,负离子向阳极迁移,并分别在电极上起还原和氧化反应,从而获得还原产物和氧化产物。
分解电压的测定摘要:分解电压是探索电极过程机理和实际电解过程中电位控制的重要依据。
用线性扫描伏安法测得氢氧化钠的电解质溶液中插入铂电极进行的电解,即电池反应的结果是使水分解。
热力学分析表明实测分解电压与理论分解电压相差较大的主要原因是阳极上的去极化作用。
关键词:分解电压;氢氧化钠;线性扫描伏安法前言:物质的分解电压是指进行长时间电解并析出电解产物所需的外加最小电压。
分解电压不仅为探索电极过程机理提供依据,在生产中还可以利用对分解电压或反电动势的测定来控制电解过程。
因此,分解电压研究具有非常重要的理论及实际意义。
本实验在1mol/dm-3NaOH 水溶液中插入两个铂电极,连接分解电压测量装置,逐渐增加电压进行电解,记录相应的电流值。
从实验数据可见,当电压增加到某一数值时,电流突然直线上升,电极上有气泡逸出。
为使电解不断进行而必须外加的最小电压值,称为电解质在该条件下的分解电压,用E分解表示。
作I-V曲线,可求得E 分解。
以期为工艺实验和实际生产提供基础数据和理论依据。
一、实验目的及要求1.了解分解电压的概念,掌握测量分解电压的实验方法;2.了解分解电压与电极材料的关系。
二、实验基本原理当直流电通过电解质溶液时,在溶液内部,阳离子向阴极移动,阴离子向阳极移动,并在电极上进行放电,阳离子在阴极上得到电子发生还原反应;阴离子在阳极上失去电子发生氧化反应。
在H2SO4电解质溶液中,插入铂电极通电进行电解,有如下电极反应:阴极2H2O+2e→H2(g,101325Pa)+2OH-阳极2OH-→1/2O2(g,101325Pa)+2e电池反应为:2H2O→H2(g,101325Pa)+1/2O2(g,101325Pa)即电池反应的结果是使水分解。
本实验在1mol-1dm-3NaOH 水溶液中插入两个铂电极,连接分解电压测量装置,逐渐增加电压进行电解,记录相应的电流值。
从实验数据可见,当电压增加到某一数值时,电流突然直线上升,电极上有气泡逸出。
xxx学校《化学综合设计实验》题目报告人院(系)专业指导教师二○一六年六月摘要:本实验利用电化学工作站采用线性扫描伏安法(L S V)测定1mol-1dm-3H2SO4、1.0mol/LNaOH溶液溶液分解电压。
往不同溶液,插入两个银电极,一个参比电极,连接分解电压测量装置,逐渐增加电压进行电解,记录相应的电流值。
从实验数据可见,当电压增加到某一数值时,电流突然直线上升,电极上有气泡逸出。
作I-V曲线,测得硫酸的分解电压E分解=0.516V、氢氧化钠E分解=1.103V、第二次硫酸E分解=0.0.514V。
与理论分解电压相差较大,其原因是阳极上发生极化作用。
关键词:线性扫描;伏安法;硫酸;氢氧化钠;分解电压引言物质的分解电压是指进行长时间电解析出电解产物所需的外加最小电压。
分解电压可以探索电极过程机理,以及在生产中还可以测定分解电压或反电动势来控制电解。
两极产生的氢气和氧气被银电极吸附后,实际上就构成了氢电极和氧电极。
这两个电极产生一个跟外加电压方向相反的电动势(叫反电动势)。
因此要使电解顺利进行,外加电压必须大于反电动势,这就是分解电压产生的原因。
电解时由于两个电极都存在超电势,使阳极的电极电势增大,阴极的电极电势减小,因此实际的反电动势要大于理论反电动势,使电解质的分解电压增大,电解时耗的电量增加。
因此,分解电压研究具有非常重要的理论及实际意义。
当直流电通过电解质溶液时,在溶液内部,阳离子向阴极移动,阴离子向阳极移动,并在电极上进行放电,阳离子在阴极上得到电子发生还原反应;阴离子在阳极上失去电子发生氧化反应。
在H2SO4电解质溶液中,插入铂电极通电进行电解,如下电极反应:阴极 2H2O+2e→H2(g,101325Pa)+2OH-阳极 2OH-→1/2O2(g,101325Pa)+2e电池反应:2H2O→H2(g,101325Pa)+1/2O2(g,101325Pa)即电池反应的结果是水分解1实验内容1.1实验药品及仪器1.1.1药品:1.0mol/L H2SO4溶液、0.5mol/L KCl溶液、Al2O3、1.0mol/L NaOH溶液;1.1.2仪器:电子天平、电化学工作站、三口烧瓶、银电极两支、甘汞电极一支、 100ml容量瓶;1.2实验步骤1.2.1工作电极的预处理实验前,检查电极是否完好,参比电极内的饱和溶液应以淹没电极为度,不足时要补加,银电极上撒上少量的抛光粉(Al2O3)进行打磨,用少量的蒸馏水冲洗电极表面除去附着的大团抛光粉。