分解电压的测定与分析
- 格式:docx
- 大小:340.84 KB
- 文档页数:5

概述•电解分析法是将被测溶液置于电解装置中进行电解中进行电解,,使被测离子在电极上以金属或其它形式析出或其它形式析出,,由电解所增加的重量求算出其含量的方法算出其含量的方法。
这种方法实质上是重量分析法量分析法,,因而又称为电重量分析法因而又称为电重量分析法。
•将电解方法用于物质的分离将电解方法用于物质的分离,,则为电解分离法分离法。
•库仑分析法是在电解分析法的基础上发展起来的一种分析方法上发展起来的一种分析方法。
它不是通过称量电解析出物的重量是通过称量电解析出物的重量,,而是通过测量被测物质在是通过测量被测物质在100100100%%电流效率下电解所消耗的电量来进行定量分析的方法分析的方法。
按实验所控制的参数按实验所控制的参数((E 或i )不同不同,,本章的方法可分为控制电位法和控制电流法。
控制电位法是控制电极电位在某一恒定值定值,,使电位有一定差值的几种离子能够分别进行测定分别进行测定,,因而选择性较高因而选择性较高,,但分析时间较长时间较长;;控制电流法是控制通过电解池的电流,一般为一般为22~5A ,电解速度较快电解速度较快,,分析时间较短间较短,,但选择性较差但选择性较差,,需要有适当的指示电解完全或电流效率示电解完全或电流效率100100100%%的方法的方法。
当直流电通过某种电解质溶液时,电极与溶液界面发生化学变化电极与溶液界面发生化学变化,,引起溶液中物质分解引起溶液中物质分解,,这种现象称为电解。
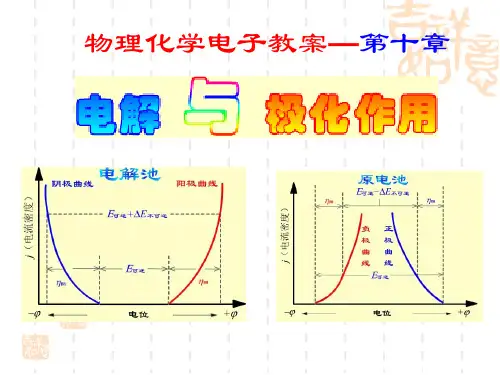
一、电解分析的基本原理(一)、)、基本原理基本原理(1)电解装置与电解过程两类电池两类电池::原电池:正极正极((阴极阴极))、负极负极((阳极阳极));电解电池:正极正极((阳极阳极))、负极负极((阴极阴极));电解过程电解硫酸铜溶液电解硫酸铜溶液, , , 当逐渐增加电压当逐渐增加电压当逐渐增加电压,,达到一定值后一定值后,,电解池内与电源“-”极相连的阴极上开始有上开始有Cu Cu Cu生成生成生成,,同时在与电源“+”极相连的阳极上有气体放出极上有气体放出,,电解池中发生了如下反应电解池中发生了如下反应::阴极反应阴极反应::Cu 2++ 2e =Cu 阳极反应阳极反应::2H 2O =O 2+ 4H ++4e 电池反应电池反应::2Cu 2++ 2H 2O = 2Cu + O 2+ 4H +二、分解电压和析出电位在铂电极上电解硫酸铜溶液在铂电极上电解硫酸铜溶液。





电解氯酸钠的理论分解电压与实际槽电压于海王梅白杰(大连保税区高佳化工国际工贸有限公司大连 116100)摘要:本文应用热力学理论和相关数据对电解氯酸钠的理论分解电压进行了计算,详细讨论了决定理论分解电压的因素,通过实验装置描述了标准条件下以二氧化铅为阳极、不锈钢为阴极电解氯酸钠的分解电压,讨论了槽电压的构成及降低槽电压的措施,此外简要说明了电解氯酸钠的槽电压与电流效率的关系。
关键词:可逆分解电压极化过电势电解槽的槽电压是电解运行过程中一个极为重要的参数,它受诸多因素的影响,直接或间接反映电解运行的难易程度、电极反应的速度以及电能的利用率,对槽电压的构成和相关决定因素的深入了解分析,在电解槽的设计、电极材料的选择、使用过程中工艺参数的确定以及生产成本的控制等方面都有着非常重要的指导意义。
本文运用热力学和动力学的研究方法,分析了电解氯酸钠的理论分解电压与实际槽电压,并详细讨论了与之有关的影响因素。
1.理论分解电压1.1标准理论分解电压理论分解电压是电极反应不存在极化时电极两端的外加电压,其值与电极产物构成的原电池的反电动势相差无限小,此时电解槽中通过的电流亦趋于无限小,过程的反抗力趋于零,系统处于热力学上的平衡态,通过对原电池的电动势的计算可以得出电解时的理论分解电压。
在恒温、恒压、可逆条件下,根据吉布斯—亥姆霍兹(Gibbs—Helmholts)公式,电池反应的电动势E与反应热Δr H,熵变Δr S、温度T 的关系为:nF S T nF H E ∆∆+-=计算标准条件时下列反应的吉布反应热Δr H ,熵变Δr S 和吉布斯自由能Δr G 。
ClO 4– + H 2 ClO 3– + H 2O (1)Δr H=ΔH f (ClO 3–)+ΔH f (H 2O)-ΔH f (ClO 4–)-ΔG f H(H 2)=-99.2+(-285.83)-(-129.3+0)=-255.73KJ/molΔr S=ΔS f (ClO 3–)+ΔS f (H 2O)-ΔS f (ClO 4–)-ΔS f H(H 2)=162+69.6-(182+130.59)=-80.69 J/molΔr G=Δr H-Δr S=-255.73―(―80.69×10-3)×298.15=-231.67 KJ/mol热力学研究表明Δr G<0的过程在一定条件下能自发进行,即上述反应的逆向是不能自发进行的,必须由外界输入额外的功(电解),过程才能进行。


分解电压的测定摘要:分解电压是探索电极过程机理和实际电解过程中电位控制的重要依据。
用线性扫描伏安法测得氢氧化钠的电解质溶液中插入铂电极进行的电解,即电池反应的结果是使水分解。
热力学分析表明实测分解电压与理论分解电压相差较大的主要原因是阳极上的去极化作用。
关键词:分解电压;氢氧化钠;线性扫描伏安法前言:物质的分解电压是指进行长时间电解并析出电解产物所需的外加最小电压。
分解电压不仅为探索电极过程机理提供依据,在生产中还可以利用对分解电压或反电动势的测定来控制电解过程。
因此,分解电压研究具有非常重要的理论及实际意义。
本实验在1mol/dm-3NaOH 水溶液中插入两个铂电极,连接分解电压测量装置,逐渐增加电压进行电解,记录相应的电流值。
从实验数据可见,当电压增加到某一数值时,电流突然直线上升,电极上有气泡逸出。
为使电解不断进行而必须外加的最小电压值,称为电解质在该条件下的分解电压,用E分解表示。
作I-V曲线,可求得E 分解。
以期为工艺实验和实际生产提供基础数据和理论依据。
一、实验目的及要求1.了解分解电压的概念,掌握测量分解电压的实验方法;2.了解分解电压与电极材料的关系。
二、实验基本原理当直流电通过电解质溶液时,在溶液内部,阳离子向阴极移动,阴离子向阳极移动,并在电极上进行放电,阳离子在阴极上得到电子发生还原反应;阴离子在阳极上失去电子发生氧化反应。
在H2SO4电解质溶液中,插入铂电极通电进行电解,有如下电极反应:阴极2H2O+2e→H2(g,101325Pa)+2OH-阳极2OH-→1/2O2(g,101325Pa)+2e电池反应为:2H2O→H2(g,101325Pa)+1/2O2(g,101325Pa)即电池反应的结果是使水分解。
本实验在1mol-1dm-3NaOH 水溶液中插入两个铂电极,连接分解电压测量装置,逐渐增加电压进行电解,记录相应的电流值。
从实验数据可见,当电压增加到某一数值时,电流突然直线上升,电极上有气泡逸出。

材料科学与冶金工程学院《冶金原理实验指导书》晋克勤编写适用冶金专业贵州大学二OO 七年八月本实验是冶金专业实验中的重要组成部分,对冶金方面起着较为重要的基础作用,不仅使学生了解和掌握实验,原理,更重要的是使学生能够在一个实践的基础,也为以后参加实际工作带来许多益处。
1、实验一:碳酸钙的分解 12、实验二:硫酸铜溶液分解电压的测定 63、实验三:金属氢氧化物pH值的测定8实验一:碳酸钙的分解实验学时:2实验类型:验证实验要求:必修一、实验原理及实验目的碳酸钙的分解反应是冶金中重要反应之一:CaCO3===== CaO+CO2根据相律,此体系的自由度为期1所以平衡时的Pco2,仅是温度的函数Pco2==P﹙T﹚本实验的目的就是测定在不同温度下的分解压Pco2,从而绘出分解曲线图,并计算化学沸腾温度。
由于实验中用的试料是高分散度CaCO3在分析实验结果8670时必须考虑到分散度对分解压的影响。
在一般条件下,分解压与温度的关系可按下式确定:LgPco2﹙CaCO3﹚= -8670/T+7.5(Pco2为atm)二、实验方法加热预先抽真空的反应器,在指定温度下将碳酸钙加入反应器,再次抽真空,在指定不同温度下分别恒温,二氧化碳的压力用与反应器相联接的压力计量出并换算而得,该法即为静态法。
只适用于平稀压力比较大的体系,不适用于平稳压力比较小的体系(例测定低温下金属蒸气就不适用这种方法)。
三、实验装置:(如图)1. 毫伏高温表;2.热电偶;3.管式电炉;4.瓷管反应器;5.瓷盘;6.橡皮塞;7.三通阀;8.两通阀;9开式水银压力计;10.保险瓶;11.手动调压计;12碳酸钙四、实验步骤1、准备实验前,打开阀门7和8,使反应器、压力计都与保险相通;2、检查每一个接头及塞子是否接牢,塞紧,阀门是否漏气(若漏气用真空脂处理),然后用热蜡将各接口处密封,直至保证不漏气为止;3、接真空泵到保险瓶上,开始抽气并尽可能将系统抽成真空;4、停止抽气前,先用阀门7使反应器只与压力计接通,再把阀门8扭向保险瓶与大气相通的方向,关上真空泵;5、然后对炉子升温,加热反应器,在700℃时,若水银柱降不超过20mmHg,证明系统漏气甚微,可以进行实验;6、再次将阀7与反应器,压力计,阀8相通,然后再将阀6据向保险瓶与反应器相通;7、打开橡皮塞6,仔细地将盛有碳酸钙的瓷盘推入到插热电偶的部分,然后塞紧橡皮塞6,重复做一遍步骤3、4,不过在用阀7使反应器只与压力计接通的同时记录下压力计的读数;8、然后在700℃恒温,(用调整围变压器的方法),直到水柱停止下降,读出压力计上的压差,作好记录,尔后再按第一组分别再在800℃,900℃恒温,记录下压差;第二组分别再在750℃,900℃恒温,记录下压差。
xxx学校《化学综合设计实验》题目报告人院(系)专业指导教师二○一六年六月摘要:本实验利用电化学工作站采用线性扫描伏安法(L S V)测定1mol-1dm-3H2SO4、1.0mol/LNaOH溶液溶液分解电压。
往不同溶液,插入两个银电极,一个参比电极,连接分解电压测量装置,逐渐增加电压进行电解,记录相应的电流值。
从实验数据可见,当电压增加到某一数值时,电流突然直线上升,电极上有气泡逸出。
作I-V曲线,测得硫酸的分解电压E分解=0.516V、氢氧化钠E分解=1.103V、第二次硫酸E分解=0.0.514V。
与理论分解电压相差较大,其原因是阳极上发生极化作用。
关键词:线性扫描;伏安法;硫酸;氢氧化钠;分解电压引言物质的分解电压是指进行长时间电解析出电解产物所需的外加最小电压。
分解电压可以探索电极过程机理,以及在生产中还可以测定分解电压或反电动势来控制电解。
两极产生的氢气和氧气被银电极吸附后,实际上就构成了氢电极和氧电极。
这两个电极产生一个跟外加电压方向相反的电动势(叫反电动势)。
因此要使电解顺利进行,外加电压必须大于反电动势,这就是分解电压产生的原因。
电解时由于两个电极都存在超电势,使阳极的电极电势增大,阴极的电极电势减小,因此实际的反电动势要大于理论反电动势,使电解质的分解电压增大,电解时耗的电量增加。
因此,分解电压研究具有非常重要的理论及实际意义。
当直流电通过电解质溶液时,在溶液内部,阳离子向阴极移动,阴离子向阳极移动,并在电极上进行放电,阳离子在阴极上得到电子发生还原反应;阴离子在阳极上失去电子发生氧化反应。
在H2SO4电解质溶液中,插入铂电极通电进行电解,如下电极反应:阴极 2H2O+2e→H2(g,101325Pa)+2OH-阳极 2OH-→1/2O2(g,101325Pa)+2e电池反应:2H2O→H2(g,101325Pa)+1/2O2(g,101325Pa)即电池反应的结果是水分解1实验内容1.1实验药品及仪器1.1.1药品:1.0mol/L H2SO4溶液、0.5mol/L KCl溶液、Al2O3、1.0mol/L NaOH溶液;1.1.2仪器:电子天平、电化学工作站、三口烧瓶、银电极两支、甘汞电极一支、 100ml容量瓶;1.2实验步骤1.2.1工作电极的预处理实验前,检查电极是否完好,参比电极内的饱和溶液应以淹没电极为度,不足时要补加,银电极上撒上少量的抛光粉(Al2O3)进行打磨,用少量的蒸馏水冲洗电极表面除去附着的大团抛光粉。
li2sio3的分解电压Li2SiO3是一种重要的材料,具有许多应用领域。
本文将重点讨论Li2SiO3的分解电压,以及与其相关的实验方法和应用。
Li2SiO3是一种典型的离子晶体,由锂离子(Li+)和硅酸根离子(SiO32-)组成。
在高温下,Li2SiO3可以分解为Li2O和SiO2。
而Li2SiO3的分解电压是指在一定条件下,将Li2SiO3分解为Li2O 和SiO2所需要的电压。
分解电压是评价材料热稳定性和电化学性能的重要参数。
为了确定Li2SiO3的分解电压,可以采用电化学方法进行实验。
首先,需要制备Li2SiO3样品。
一种常用的方法是通过固相反应,将适量的Li2CO3和SiO2在高温下反应,生成Li2SiO3。
然后,将制备好的Li2SiO3样品进行粉碎和筛分,以获得均匀的粒径分布。
接下来,可以采用电化学分解方法来测定Li2SiO3的分解电压。
首先,将Li2SiO3样品制备成电极,并将其与适量的电解质(如LiCl、LiNO3等)浸泡在一定温度下的电解池中。
然后,通过施加不同的电压,使电解池中的电流达到一定数值,记录此时的电压值。
重复多次实验,可以得到不同温度下Li2SiO3的分解电压。
实验结果显示,Li2SiO3的分解电压随着温度的升高而降低。
这是因为在高温下,Li2SiO3的热解反应速率增加,需要的电压值相对较低。
此外,实验还发现,Li2SiO3的分解电压与电解质的种类和浓度有关。
一般来说,使用浓度较高的电解质可以降低Li2SiO3的分解电压。
Li2SiO3的分解电压与其在锂离子电池中的应用密切相关。
锂离子电池是一种常见的高能量密度电池,广泛应用于移动通信、电动汽车等领域。
而Li2SiO3作为一种锂源材料,可以在锂离子电池的正极中发挥重要作用。
通过控制Li2SiO3的分解电压,可以调节锂离子电池的工作电压和充放电性能,提高电池的循环寿命和安全性能。
除了在锂离子电池中的应用,Li2SiO3还具有其他重要的应用领域。
xxx学校
《化学综合设计实验》
题目
报告人
院(系)
专业
指导教师
二○一六年六月
摘要:本实验利用电化学工作站采用线性扫描伏安法(L S V)测定
1mol-1dm-3H
2SO
4
、1.0mol/LNaOH溶液溶液分解电压。
往不同溶液,插入两个银电
极,一个参比电极,连接分解电压测量装置,逐渐增加电压进行电解,记录相应的电流值。
从实验数据可见,当电压增加到某一数值时,电流突然直线上升,电极上有气泡逸出。
作I-V曲线,测得硫酸的分解电压E
分解
=0.516V、氢氧化钠
E
分解=1.103V、第二次硫酸E
分解
=0.0.514V。
与理论分解电压相差较大,其原因是
阳极上发生极化作用。
关键词:线性扫描;伏安法;硫酸;氢氧化钠;分解电压
引言
物质的分解电压是指进行长时间电解析出电解产物所需的外加最小电压。
分解电压可以探索电极过程机理,以及在生产中还可以测定分解电压或反电动势来控制电解。
两极产生的氢气和氧气被银电极吸附后,实际上就构成了氢电极和氧电极。
这两个电极产生一个跟外加电压方向相反的电动势(叫反电动势)。
因此要使电解顺利进行,外加电压必须大于反电动势,这就是分解电压产生的原因。
电解时由于两个电极都存在超电势,使阳极的电极电势增大,阴极的电极电势减小,因此实际的反电动势要大于理论反电动势,使电解质的分解电压增大,电解时耗的电量增加。
因此,分解电压研究具有非常重要的理论及实际意义。
当直流电通过电解质溶液时,在溶液内部,阳离子向阴极移动,阴离子向阳极移动,并在电极上进行放电,阳离子在阴极上得到电子发生还原反应;阴离子在阳极上失去电子发生氧化反应。
在H2SO4电解质溶液中,插入铂电极通电进行电解,如下电极反应:
阴极 2H
2O+2e→H
2
(g,101325Pa)+2OH-
阳极 2OH-→1/2O
2
(g,101325Pa)+2e
电池反应:2H
2O→H
2
(g,101325Pa)+1/2O
2
(g,101325Pa)
即电池反应的结果是水分解
1实验内容
1.1实验药品及仪器
1.1.1药品:1.0mol/L H
2SO
4
溶液、0.5mol/L KCl溶液、Al
2
O
3
、
1.0mol/L NaOH溶液;
1.1.2仪器:电子天平、电化学工作站、三口烧瓶、银电极两支、甘汞电极一支、 100ml容量瓶;
1.2实验步骤
1.2.1工作电极的预处理
实验前,检查电极是否完好,参比电极内的饱和溶液应以淹没电极为度,不
足时要补加,银电极上撒上少量的抛光粉(Al
2O
3
)进行打磨,用少量的蒸馏水冲洗
电极表面除去附着的大团抛光粉。
打磨2次,清洗抛光粉,擦干。
1.2.2分解电压的测定
将100mL1.0mol/L H
2SO
4
溶液倒入三口烧瓶中,分别将银电极和甘汞电极插
入硫酸溶液中,甘汞电极插在中间接入白色夹头,红色和绿色夹头分别接入两支银电极。
打开电化学软件,点击“T”,选择“Linear Sweep Voltammetry”,在对话框中设置扫描参数如表1,点击“OK”再点击运行开始扫描测试。
多次重复扫描,直到找到最佳的电压扫描范围。
表1硫酸、氢氧化钠分解电压参数
2.结果分析
由以上表中参数,用线性扫描伏安法测定硫酸、氢氧化钠、氯化钠溶液的分解电压,分解电压如下图1~图3。
分析:曲线的前部分基本处于同一条直线,未发生电解。
其灵敏度较低,作切线
和横坐标相交于一点得到 1.0mol/LH 2SO 4溶液电压增加到0.514 V 时,电流
突然直线上 升,其分解电压为0.514V 。
图2 1.0mol/L H 2SO 4溶液分解电压I-V 曲线
图1 1.0mol/L H 2SO 4溶液分解电压I-V 曲线
3.总结
实验采用的线性扫描伏安法(LSV)测定 1.0mol/LH 2SO 4溶液、1.0mol/LNaOH 分解电压,其实就是电解水的过程。
图1和图2是1.0mol/LH 2SO 4溶液的分解电压曲线图,所测得的分解电压大致相同,其原因是两次的电压扫描范围不同,造成的。
采取了三电极体系,可以减少IR 电位的降低。
4.创新
实际上电解时,电极的平衡状态已破坏,成为不可逆电极,实际电解所需的电压比理论电压要大。
分解电压超过原电池之可逆电动势的部分称为超电势。
超电势包含三部分:一是电极和电解质溶液产生的电阻消耗的一部分电压(IR ),称为电阻超电势;二是由浓差极化引起的浓差超电势E 浓差;三是电化学极化引起的活化超电势η。
因此,分解电压为:
E 分解=E 理论+IR+E 浓差+η
分析:曲线的前部分基本处于同一条直线,未发生电解。
其灵敏度较低,作切 线和横坐标相交于一点可得到,当 1.0mol/LNaOH 溶液电压增加到1.103V 时,电流突然直线上升,其分解电压为 1.103V 。
1.0mol/ LNaOH 理论电压 为2.172V ,产生的误差可能是电极极化等原因造成的。
图3 1.0mol/L NaOH 溶液分解电压I-V 曲线。