∆T
若比热容取定值或平均值,有: ∆ h = c p ∆ T
∆h = c p
T2 T1
∆T
3. 理想气体熵变化量的计算:
δ q du + pdv cv dT p ds = = = + dv T T T T cv dT p v cv dT dv = + dv = + Rg T T v T v
同理:
δ q dh − vdp c p dT v ds = = = − dp T T T T c p dT p v c p dT dp = − dp = − Rg T T p T p
Rg ,eq = ∑ wi Rg ,i
i
作业:P103-104
3-10 3-15
思考题: P102
10
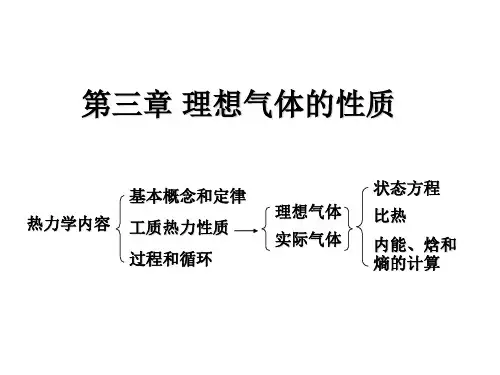
五. 理想气体的基本热力过程 热力过程被关注的对象:
1) 参数 ( p, T, v, u, h, s ) 变化 2) 能量转换关系, q , w, wt 。
思路:
1) 抽象分类:
p
v T
s
n
基本过程 2) 简化为可逆过程 (不可逆再修正)
R = 8.314 J/(mol ⋅ K)
R 是一个与气体的种类
无关,与气体的状态也 无关的常数,称为通用 (摩尔)气体常数。
R = M ⋅ Rg
例题3.1: 已知体积为0.03m3的钢瓶内装有氧气,初 始压力p1=7×105Pa,温度t1=20℃。因泄漏,后 压力降至p2=4.9×105Pa ,温度未变。问漏去多少 氧气? 解:取钢瓶的容积为系统(控制容积),泄漏过 程看成是一个缓慢的过程。初终态均已知。假定 瓶内氧气为理想气体。根据状态方程:
V
0 m
= 22 . 414 m