中和反应的反应热及其测定
- 格式:doc
- 大小:173.50 KB
- 文档页数:5

高中化学中和反应反应热的测定编稿老师佘平平一校黄楠二校林卉审核王慧姝【考点精讲】1. 中和热的定义:在稀溶液中,强酸和强碱发生中和反应生成1mol水所放出的热量。
2. 中和热的测定(1)实验用品大烧杯(500 mL)、小烧杯(100 mL)、温度计、2个量筒(50 mL)、泡沫塑料或纸条、泡沫塑料板或硬纸板(中心有两个小孔)、环形玻璃搅拌棒。
0.50 mol·L-1盐酸、0.55 mol·L-1NaOH溶液。
(2)实验原理通过测定酸碱中和反应前后溶液温度的变化来计算中和热的大小。
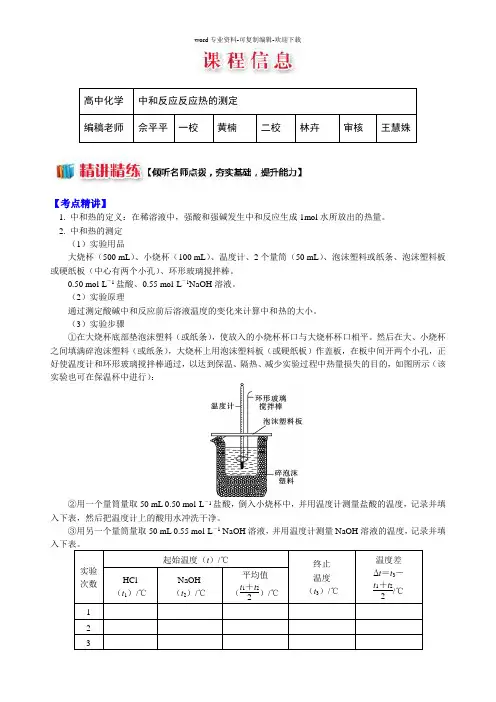
(3)实验步骤①在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。
然后在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过,以达到保温、隔热、减少实验过程中热量损失的目的,如图所示(该实验也可在保温杯中进行):②用一个量筒量取50 mL 0.50 mol·L-1盐酸,倒入小烧杯中,并用温度计测量盐酸的温度,记录并填入下表,然后把温度计上的酸用水冲洗干净。
③用另一个量筒量取50 mL 0.55 mol·L-1 NaOH溶液,并用温度计测量NaOH溶液的温度,记录并填实验次数起始温度(t)/℃终止温度(t3)/℃温度差Δt=t3-t1+t22/℃HCl(t1)/℃NaOH(t2)/℃平均值(t1+t22)/℃1 2 3④把温度计和环形玻璃搅拌棒放入小烧杯的盐酸中,并把量筒中的NaOH 溶液一次倒入小烧杯(注意不要洒在外面),用环形玻璃搅拌棒轻轻搅动溶液,并准确读出混合溶液的最高温度,作为终止温度,记录并填入表格。
⑤重复实验三次,取测量所得数据的平均值作为计算的依据。
⑥根据实验数据计算中和热。
【典例精析】例题1 某学生进行中和热测定,取用50 mL 0.50 mol·L -1的HCl 和50 mL 0.55 mol·L -1 的NaOH 溶液(密度都是1 g·cm -3)。

中和反应反应热的测定实验注意事项一、引言中和反应是化学中常见的一种反应类型,它是指酸和碱在适当的条件下发生反应,生成盐和水的化学变化过程。
在中和反应中,反应热是一个重要的物理量,它可以用来评估反应的放热或吸热性质。
本文将介绍如何进行中和反应反应热的测定实验以及实验中需要注意的事项。
二、实验目的本实验的主要目的是通过实验测定中和反应的反应热,从而了解该反应的放热或吸热性质,并掌握实验方法和注意事项。
三、实验原理中和反应的反应热可以通过测定反应前后溶液的温度变化来间接计算。
实验中,需要将一定量的酸和碱溶液混合,使其发生中和反应,测量反应前后溶液的温度变化,并利用热容量公式计算反应热。
四、实验仪器和试剂1. 实验仪器:烧杯、温度计、计时器等。
2. 实验试剂:酸和碱溶液。
五、实验步骤1. 准备实验仪器和试剂,并按照实验要求配制好酸和碱溶液。
2. 使用烧杯分别量取一定量的酸和碱溶液,并记录其初始温度。
3. 将酸和碱溶液缓慢倒入同一个烧杯中,搅拌均匀。
4. 开始计时,并记录混合溶液的温度变化。
5. 当混合溶液的温度变化趋于平缓时,停止计时,并记录最终温度。
六、实验注意事项1. 实验操作要规范,注意安全。
在进行实验时,应佩戴实验室必备的防护用具,如实验手套、护目镜等。
2. 实验仪器和试剂要干净,避免杂质的干扰。
在使用烧杯等实验仪器前,应先进行清洗和干燥。
3. 酸和碱溶液的配制要准确,浓度要一致。
使用天平等仪器进行称量时,应注意准确读数,避免误差。
4. 在混合溶液时,要轻轻搅拌,避免剧烈搅拌产生的热量对实验结果的影响。
5. 记录温度变化时,要准确读数。
温度计应插入溶液中央,避免接触容器壁面,以免产生误差。
6. 在混合溶液温度变化趋于平缓时,应立即停止计时,并记录最终温度。
过长的实验时间可能导致温度变化不明显,影响结果的准确性。
7. 实验结束后,应将实验仪器和试剂清洗干净,放置在指定位置。
七、实验数据处理与结果分析根据实验记录的初始温度、最终温度和实验所使用的试剂浓度,可以计算出中和反应的反应热。

(人教版选修4)第一章《化学与能量》教学设计第一节《化学反应与能量变化》(第二课时:中和反应的反应热及其测定)A.稀H2SO4与稀Ba(OH)2溶液反应生成1molH2OB.稀盐酸与氨水反应生成1molH2OC.稀盐酸与稀Ba(OH)2溶液反应生成1molH2OD.稀NaOH与95%浓硫酸反应生成1molH2O【答案】 C【板书】1中农和热:在稀溶液中,酸跟碱发生中和反应而生成 1 mol H2O 时的反应热叫中和热。
【讨论】2.注意事项:【回答】①稀溶液:是指存在大量水的溶液。
②量的标准:必须是生成 1 mol 水。
【讲解】(3)对于强酸和强碱的稀溶液反应,中和热基本上是相等的,表示为H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1。
【讨论】已知在稀溶液里盐酸与氢氧化钠溶液发生中和反应生成 1 mol 水时,放出的热量为57.3 kJ。
【思考】:(1)弱碱与弱酸反应;(2)浓硫酸与稀氢氧化钠溶液反应;(3)稀硫酸与氢氧化钡溶液反应放出的热量是否也都是57.3 kJ?【回答】(1)因为弱酸、弱碱在电离过程中需要吸热,所以弱酸、弱碱发生中和反应生成 1 mol H2O 放出的热量要小于 57.3 kJ;(2)因为浓硫酸与稀 NaOH 溶液的反应过程中还包括浓硫酸的稀释,稀释时要放出大量的热,所以浓硫酸与稀NaOH 溶液发生中和反应生成 1 mol H2O 放出的热量要大于 57.3 kJ;(3)稀硫酸与稀氢氧化钡溶液发生中和反应,不仅生成H2O,而且生成 BaSO4 沉淀,生成 BaSO4 沉淀时会放出热量,所以此反应生成 1 mol 水时放出热量要大于 57.3 kJ。
【思考】2.已知H+(aq)+OH-(aq)===H2O(l)ΔH=-57.3 kJ·mol-1,回答下列问题:(1)用含20 g NaOH的稀溶液跟足量稀盐酸反应放出____________kJ的热量。

[基础过关]一、中和反应反应热1.已知H ++OH -===H 2O 生成1 mol H 2O 放出热量57.3 kJ ,下列反应中能放出57.3 kJ 热量的是( )A .1 mol 稀H 2SO 4与足量NaOH 溶液反应B .稀盐酸与氨水反应生成1 mol H 2OC .稀盐酸与稀Ba(OH)2溶液反应生成1 mol 水D .稀NaOH 与95%浓硫酸反应生成1 mol 水 答案 C解析 A 放出热量应为2 mol ×57.3 kJ·mol -1;B 放出热量应略小于57.3 kJ ,因弱酸、弱碱在水中电离要吸收一部分热量,故多数强酸与弱碱、弱酸与强碱的中和反应热数值小于57.3 kJ ;酸与碱的浓度不能太大,否则中和热数值会偏大,故D 错。
2.含有11.2 g KOH 的稀溶液与1 L 0.1 mol·L -1的H 2SO 4溶液反应,放出11.46 kJ 的热量,表示该反应的中和热的热化学方程式为( )A .KOH(aq)+12H 2SO 4(aq)===12K 2SO 4(aq)+H 2O(l) ΔH =-11.46 kJ·mol -1B .2KOH(aq)+H 2SO 4(aq)===K 2SO 4(aq)+2H 2O(l) ΔH =-11.46 kJ·mol -1C .2KOH(aq)+H 2SO 4(aq)===K 2SO 4(aq)+2H 2O(l) ΔH =-114.6 kJ·mol -1D .KOH(aq)+12H 2SO 4(aq)===12K 2SO 4(aq)+H 2O(l) ΔH =-57.3 kJ·mol -1答案 D解析 中和热是以生成1 mol H 2O(l)所放出的热量来定义的,故书写中和热的热化学方程式时,应以生成1 mol H 2O(l)为标准来配平其余物质的化学计量数,故答案为D 。



中和反应反应热的测定实验原理
中和反应是指一种化学反应,其中酸和碱反应生成盐和水。
中和反应通常是放热的,这是因为酸和碱结合后会释放出能量。
测定中和反应的反应热可以使用热量计来完成。
热量计是一个装置,用于测量化学反应释放或吸收的热量。
实验原理如下:
1. 首先,在热量计中准确测量一定量的酸和碱的体积,通常使用定容烧瓶或分别称量一定质量的酸和碱。
2. 然后,将酸和碱混合在热量计中,并迅速加上热量计的盖子,以避免热量的散失。
3. 当酸和碱反应时,会释放出热量。
这些释放的热量将升高热量计中的水的温度。
4. 在反应结束后,测量水的温度变化。
从温度变化可以推断出反应释放的热量。
5. 通过测量酸和碱的质量或体积,并结合热量计中水的特定热容量,可以计算出单位质量或单位体积的酸碱反应的反应热。
这种测定中和反应反应热的实验原理适用于室温下的中和反应。
通过测量反应热,可以了解酸和碱之间的相对强度和反应的放热程度,以及控制化学反应中热量变化的关键参数。

课时1.2 反应热的测定——中和反应的反应热及其测定【学习目标】1、正确认识中和热的概念2、掌握中和热的测定实验方法,会分析测定反应热时误差产生的原因,并能采取适当措施减小实验误差【主干知识梳理】一、中和热概念及其数值1、概念:在稀溶液中,酸与碱发生中和反应生成1 mol H2O(l)时释放的热量称为中和热2、表示方法:H+(aq)+OH-(aq)===H2O(l)ΔH=-57.3 kJ·mol-1【微点拨】中和反应的实质是H+和OH-结合生成水,因而理解中和热时要注意以下几点:①条件:稀溶液,因浓酸溶液或浓碱溶液稀释时会放出热量②反应物:酸与碱(在中学化学中,只讨论强酸和强碱反应的中和热)③生成物及其物质的量:必须是形成1mol的H2O(l)④表述:用文字叙述中和热时,不带“-”;用ΔH表示时,带上“-”如:强酸与强碱反应的中和热为57.3 kJ·mol-1或ΔH=-57.3 kJ·mol-1⑤强酸、强碱发生中和反应时,中和热为一定值,与酸、碱的用量无关,与其中一种过量也无关,但酸和碱放出的热量与其用量有关⑥浓的强酸和强碱在发生中和反应的同时还要发生溶解,溶解要放出热量,故放出热量大于57.3kJ⑦弱酸和弱碱在发生中和反应的同时还要发生电离,电离要吸收热量,故放出热量小于57.3kJ⑧中和反应的实质是H+和OH-化合反应生成H2O。
若反应过程中有其它物质生成(生成不溶物质或难电离的物质等),这部分热量不包含在中和热内【对点训练1】1、下列说法正确的是()A.中和热一定是强酸跟强碱反应放出的热量B.1 mol酸与1 mol碱完全反应放出的热量是中和热C.在稀溶液中,酸与碱发生中和反应生成1 mol H2O(l)时的反应热叫做中和热D.测定中和热时可用稀硫酸和稀Ba(OH)2溶液2、下列关于中和热的说法中正确的是()A.10 L 0.1 mol·L-1 NaOH溶液与10 L 0.1 mol·L-1盐酸反应时的反应热是中和热B.1 mol HCl气体通入1 L 0.01 mol·L-1 NaOH溶液中反应时的反应热是中和热C.1 mol CH3COOH与2 mol NaOH溶液反应时的反应热是中和热D.只要强酸与强碱在稀溶液中反应生成1 mol水时的反应热就是中和热3、下列有关H+(aq)+OH-(aq)===H2O(l)ΔH=-57.3 kJ·mol-1的说法正确的是()A.代表所有的酸碱中和反应B.反应物一定是强酸与强碱C.强酸与强碱的中和反应的热化学方程式都可以这样表示D .表示稀的强酸溶液与稀的强碱溶液反应生成可溶性盐和1 mol 液态水时放出57.3 kJ 热量4、已知稀盐酸和氢氧化钠稀溶液反应的中和热ΔH =-57.3 kJ·mol -1,则下列物质间发生反应时放出的热量与57.3 kJ 最接近的是( )A .含1 mol 氢氧化钙的稀溶液与足量稀硫酸反应B .含1 mol 硫酸的稀溶液与足量稀氢氧化钠溶液反应C .含1 mol 醋酸的稀溶液与足量稀氢氧化钾溶液反应D .含1 mol 氢氧化钡的稀溶液与含1 mol 氯化氢的稀盐酸反应5、强酸与强碱的稀溶液发生中和反应的热效应:H +(aq)+OH -(aq)=H 2O(l);ΔH =-57.3 kJ/mol ,向1 L 0.5 mol/L 的NaOH 溶液中加入稀醋酸、浓H 2SO 4、稀HNO 3,则恰好完全反应时的热效应ΔH 1、ΔH 2、ΔH 3的关系正确的是( )A .ΔH 1>ΔH 2>ΔH 3B .ΔH 1<ΔH 3<ΔH 2C .ΔH 2>ΔH 1>ΔH 3D .ΔH 1>ΔH 3>ΔH 2二、中和反应反应热的测定 1、实验装置2、实验测量数据 (1)反应物温度的测量①用量筒量取50 mL 0.50 mol·L-1盐酸,打开杯盖,倒入量热计的内筒,盖上杯盖,插入温度计,测量并记录盐酸的温度(数据填入下表)。


中和反应反应热的测定及化学答题规范技巧1.反应原理H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1通过测定一定量的酸、碱溶液在反应前后温度的变化,计算反应放出的热量,由此得中和热。
2.实验装置3.实验用品大烧杯(500 mL)、小烧杯(100 mL)、环形玻璃搅拌棒、量筒(50 mL)两个、温度计、泡沫塑料或纸条、泡沫塑料板或硬纸板(中心有两个小孔)、盐酸(0.50 mol·L −1)、氢氧化钠溶液(0. 55 mol·L −1)4.实验步骤5.实验说明(1)中和热的测定实验中,NaOH溶液的浓度稍大于盐酸的浓度是确保HCl 反应完全。
若采用的酸、碱浓度相等,可采用碱体积稍过量的方法达到这个目的。
(2)中和热的计算公式ΔH= kJ/mol(3)实验中若用弱酸(或弱碱)代替强酸(或强碱),因弱酸(或弱碱)电离出H +(或OH −)需要吸收热量,故测定的中和热的数值偏小;若用浓硫酸与强碱反应测定中和热,因浓硫酸稀释要放热,故测定的中和热的数值偏大。
(4)要提高反应热测定的准确性,应注意“快”(实验操作要快,尽量减少热量散失)、“准”(准确测量液体温度和液体体积)、“稀”(浓度不宜过大,避免稀释放热,也要避免浓度过小)。
(5)要使用同一支温度计,温度计的水银球要完全浸入溶液中,读出变化过程中的最高温度。
(6)环形玻璃搅拌棒不能用铁丝代替,若用铁丝代替,会因铁丝与酸反应放出热量,且铁丝传热快而使测试结果不准确。
(7)对于定量实验,需重复实验步骤,取3次实验数据的平均值,但相差太大的数据应舍弃。
6.误差分析(1)分析的依据看实验中有哪些因素能造成( t终−t始)出现误差。
若(t终−t始)偏大,则|ΔH|偏大;若(t终−t始)偏小,则|ΔH|偏小。
(2)误差分析实例50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液反应的误差分析:反应热答题规范指导(1)用“焓变(Δ H)”表示反应热时,ΔH>0表示吸热,ΔH<0表示放热,因而,ΔH后所跟数值需要带“+”、“-”符号。
第一节 化学反应与能量的变化 第2课时 中和反应的反应热及其测定[学习目标]1.正确认识中和热的概念。
2.通过中和热的测定,初步学会测定化学反应反应热的实验方法,会分析测定反应热时误差产生的原因,并能采取适当措施减小实验误差。
[基础知识梳理]1.中和反应的反应热在稀溶液中,强酸与强碱发生中和反应生成 时的反应热。
表示为H +(aq)+ OH -(aq)===H 2O(l) ΔH =-57.3 kJ·mol -1。
2.实验原理通过一定量的酸碱溶液在反应前后温度的变化,计算反应放出的热量,由此求得中和热。
3.实验仪器装置(1)将下列实验装置中各仪器(或物品)的名称填在方框中。
(2)实验过程中,还需要的其他仪器有 。
4.测量步骤(1)初始温度(t 1)的测量 用一 量取50 mL 0.50 mol·L-1盐酸,倒入 中并测量其 ;用另一 量取50 mL 0.55 mol·L -1 NaOH 溶液并测量其 ,取两温度平均值为t 1。
(2)终止温度(t 2)的测量把套有盖板的温度计和环形玻璃搅拌棒放入小烧杯的 中,并把量筒中的 倒入小烧杯中,盖好盖板。
用环形玻璃搅拌棒轻轻搅动溶液,并准确读取混合溶液的 ,记录终止温度为t 2。
(3)重复实验操作三次,记录每次的实验数据,取其平均值作为计算依据。
5.数据处理ΔH =cm Δt ×10-3n H 2O kJ·mol -1 [其中c =4.18 J/(g·℃)][互动探究提高][思考探究]甲同学用50 mL 0.50 mol·L-1的盐酸与50 mL 0.55 mol·L-1的KOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量计算中和反应的反应热。
结论:H+(aq)+OH-(aq)===H2O(l)ΔH=-57.3 kJ·mol-1。
问题思考:(1)实验装置中在大、小烧杯之间填满碎泡沫塑料的目的是什么?(2)装置中的环形玻璃搅拌棒能否用金属(不与酸、碱反应)质环形搅拌棒代替?为什么?(3)实验中为何使用0.55 mol·L-1KOH溶液与0.50 mol·L-1盐酸反应,而不是选用0.50 mol·L-1 KOH溶液?(4)能否用浓硫酸代替盐酸?对结果会产生什么影响?(5)能否用醋酸代替盐酸或用氨水代替KOH溶液?对结果会产生什么影响?(6)乙同学将甲同学实验装置进行了改进,如图所示:①简易量热计②简易量热计[归纳总结]1.中和反应反应热测定原理的理解(1)中和反应的对象为酸、碱的稀溶液。
中和反应反应热的测定实验.doc实验目的:通过实验测定中和反应的反应热,并掌握测定方法。
实验原理:中和反应是指酸和碱反应后生成盐和水的化学反应。
中和反应通常是放热反应,反应热量可以用来测量反应的热力学性质。
在实验中,通过测定反应前后溶液的温度变化来计算反应热。
实验仪器:常压容量瓶、酸钠、氢氧化钠、稀盐酸、热量计、温度计等。
实验方法:1. 取两个常压容量瓶,一个装入30mL浓氢氧化钠溶液,另一个装入30mL的稀盐酸溶液。
2. 将热量计放置在容量瓶下方的支架上,然后将两个容量瓶倒置,使其顶端分别浸入热量计中的两个槽内。
3. 稳定后,将氢氧化钠溶液迅速倒入稀盐酸溶液中,开始反应。
4. 观察反应过程,记录反应前后的溶液温度。
5. 清洗实验仪器,重复以上步骤进行第二次实验。
实验数据及处理:反应前温度(℃)反应后温度(℃)稀盐酸 21.5 45.0氢氧化钠 21.5 45.0反应热计算:在实验中,反应热可以用以下公式计算:Q = m·C·ΔT其中,Q为反应放出的热量,m为反应混合物的质量,C为混合物的比热容,ΔT为反应前后溶液温度差。
计算中可将酸钠溶液和氢氧化钠溶液质量视为相等,且C值可取水的比热容为4.18J/g·℃。
则可得出以下数据:实验1中,反应前后温度差ΔT = 23.5℃,m = 60g,Q = 60×4.18×23.5 = 5926.4J = 5.93kJ。
实验平均反应热:(5.93 + 6.27) / 2 = 6.10kJ。
实验结论:通过实验,成功测定出中和反应的平均反应热为6.10kJ,证明中和反应属于放热反应。
掌握了测定反应热的方法,同时提高了实验操作技能。
第2课时 中和反应的反应热及测定关键词语1.1个数值:强酸、强碱在稀溶液中发生中和反应生成1 mol 水,放出57.3 kJ 的热量。
2.1个公式:中和热的计算公式:ΔH =-cm Δt ×10-3n (H 2O )kJ·mol -1(其中c =4.18 J/(g·℃)。
3.热化学方程式书写“三步骤”: (1)写出配平的化学方程式;(2)注明物质的聚集状态;(3)注明反应热的正、负号、数值和单位。
教材新知知识点一热化学方程式[自学教材·填要点]1.热化学方程式和化学方程式的差异H 2(g)+I 2(g)=====200℃101 kPa2HI(g)ΔH =-14.9 kJ/mol 与化学方程式H 2+I 2△2HI 相比较而言其特点为:(1)指明了反应的温度和压强,若在25℃、101 kPa 时进行的反应,可不注明。
(2)注明了各物质的状态:s(固体)、l(液体)或g(气体)。
(3)在方程式的右边注明了ΔH 的数值、正负号及单位。
2.热化学方程式的概念能表示参加反应物质的量和反应热关系的化学方程式。
3.热化学方程式的意义热化学方程式不仅表示化学反应中的物质变化,也表明了化学反应中的能量变化。
[师生互动·解疑难]书写热化学方程式的注意事项(1)注意ΔH 的符号:ΔH 只能写在热化学方程式的右边,且中间留空格。
若为放热反应,ΔH 为“-”;若为吸热反应,ΔH 为“+”。
ΔH 的单位一般为“kJ/mol”(或“kJ/mol”)。
(2)注意物质的聚集状态:反应物和产物的聚集状态不同,反应热ΔH 也不同。
因此,书写热化学方程式必须注明物质的聚集状态。
气体用“g”,液体用“l”,固体用“s”,溶液用“aq”。
热化学方程式中不用标“↑”和“↓”。
(3)注意化学计量数:①化学计量数只表示物质的量,因此可以为分数或小数。
②由于ΔH 与反应物的物质的量有关,所以热化学方程式中化学式前面的化学计量数必须与ΔH 相对应。
第一章 化学反应与能量训练2 中和反应的反应热及其测定[基础过关]一、中和反应反应热1. 已知H ++OH -===H 2O 生成1 mol H 2O 放出热量57.3 kJ ,下列反应中能放出57.3 kJ 热量的是 ( ) A .1 mol 稀H 2SO 4与足量NaOH 溶液反应 B .稀盐酸与氨水反应生成1 mol H 2OC .稀盐酸与稀Ba(OH)2溶液反应生成1 mol 水D .稀NaOH 与95%浓硫酸反应生成1 mol 水2. 含有11.2 g KOH 的稀溶液与1 L 0.1 mol·L-1的H 2SO 4溶液反应,放出11.46 kJ 的热量,表示该反应的中和热的热化学方程式为 ( )A .KOH(aq)+12H 2SO 4(aq)===12K 2SO 4(aq)+H 2O(l) ΔH =-11.46 kJ·mol -1B .2KOH(aq)+H 2SO 4(aq)===K 2SO 4(aq)+2H 2O(l) ΔH =-11.46 kJ·mol -1C .2KOH(aq)+H 2SO 4(aq)===K 2SO 4(aq)+2H 2O(l) ΔH =-114.6 kJ·mol -1 D .KOH(aq)+12H 2SO 4(aq)===12K 2SO 4(aq)+H 2O(l) ΔH =-57.3 kJ·mol -1二、中和反应反应热的测定3. 实验室进行中和热的测定实验时除需要大烧杯(500 mL)、小烧杯(100 mL)外,所用的其他仪器和试剂均正确的一组是 ( ) A .0.50 mol·L -1盐酸,0.50 mol·L -1 NaOH 溶液,100 mL 量筒1个B .0.50 mol·L -1盐酸,0.55 mol·L -1 NaOH 溶液,100 mL 量筒2个C .0.50 mol·L -1盐酸,0.55 mol·L -1 NaOH 溶液,50 mL 量筒1个 D .0.50 mol·L-1盐酸,0.55 mol·L -1 NaOH 溶液,50 mL 量筒2个4. 用50 mL 0.50 mol·L-1盐酸和50 mL 0.55 mol·L -1 NaOH 溶液反应,实验中测得起始温度为20.1 ℃,终止温度为23.4 ℃,反应后溶液的比热容为4.18 J·g -1·℃-1,盐酸和NaOH 溶液的密度都近似认为是1 g·cm -3,则中和反应生成1 mol 水时放热 ( ) A .55.2 kJ B .391 kJ C .336 kJ D .1.38 kJ5. 将V 1 mL 1.00 mol·L -1 HCl 溶液和V2 mL 未知浓度的NaOH 溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V 1+V 2=50 mL)。
下列叙述正确的是()A.做该实验时环境温度为22 ℃B.该实验表明化学能可以转化为热能C.NaOH溶液的浓度约为1.00 mol·L-1D.该实验表明有水生成的反应都是放热反应三、反应热与物质能量的关系6.已知25 ℃、101 kPa下,石墨、金刚石燃烧的热化学方程式分别为①C(石墨,s)+O2(g)===CO2(g) ΔH=-393.51 kJ·mol-1②C(金刚石,s)+O2(g)===CO2(g) ΔH=-395.41 kJ·mol-1据此判断,下列说法正确的是()A.由石墨制备金刚石是吸热反应;石墨的能量比金刚石的低B.由石墨制备金刚石是吸热反应;石墨的能量比金刚石的高C.由石墨制备金刚石是放热反应;石墨的能量比金刚石的低D.由石墨制备金刚石是放热反应;石墨的能量比金刚石的高7.下列依据热化学方程式得出的结论正确的是() A.已知2SO2(g)+O2(g)2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量B.已知C(石墨,s)===C(金刚石,s)ΔH>0,则金刚石比石墨稳定C.已知H+(aq)+OH-(aq)===H2O(l)ΔH=-57.3 kJ·mol-1,则任何酸碱中和反应的热效应均为57.3 kJD.已知2C(s)+2O2(g)===2CO2(g)ΔH1,2C(s)+O2(g)===2CO(g)ΔH2,则ΔH1<ΔH28.已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2均为正值):H2(g)+Cl2(g)===2HCl(g)ΔH=-Q1H2(g)+Br2(g)===2HBr(g)ΔH=-Q2有关上述反应的叙述正确的是()A.Q1<Q2B.生成物总能量均高于反应物总能量C.生成1 mol HCl气体时放出Q1热量D.1 mol HBr(g)具有的能量大于1 mol HBr(l)具有的能量[能力提升]9.某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1 NaOH溶液(1) 若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体________g。
(2) 从下图中选择称量NaOH固体所需要的仪器(填字母):__________。
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如下图所示。
(1)写出该反应的热化学方程式(中和热为57.3 kJ·mol-1):___________________________________________。
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:②近似认为0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·g-1·℃-1。
则中和热ΔH=_______(取小数点后一位)。
③上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是(填字母)_______。
a.实验装置保温、隔热效果差b.量取NaOH溶液的体积时仰视读数c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度10.下表中的数据是断裂1 mol物质中的化学键所消耗的能量(kJ):根据上述数据回答(1)~(4)题。
(1) 下列物质本身具有的能量最低的是()A.H2B.Cl2C.Br2D.I2(2) 下列氢化物本身具有的能量最低的是()A.HCl B.HBr C.HI D.HF(3) X2+H2===2HX(X代表Cl、Br、I)的反应是________反应(填“吸热”或“放热”)。
(4) 相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出的热量最多的是______________________________________________________。
11. 写出下列反应的热化学方程式。
(1) 16 g CH4(g)与适量O2(g)反应生成CO2(g)和H2O(l),放出890.3 kJ热量____________________________________________________________。
(2) 1L 1 mol·L-1KOH溶液中和 1 L 1 mol·L-1HNO3溶液,放出57.3 kJ热量__________________________________________________________。
(3) 若适量的N2和O2完全反应,每生成23 g NO2需要吸收16.95 kJ热量_________________________________________________________。
(4) 已知拆开1 mol H—H键,1 mol N—H键,1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2(g)与H2(g)反应生成NH3(g)的热化学方程式为_______________________________________________________。
12.红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。
反应过程和能量关系如下图所示(图中的ΔH表示生成1 mol产物的数据)。
根据上图回答下列问题:(1)P和Cl2反应生成PCl3的热化学方程式是_______________________________。
(2)PCl5分解成PCl3和Cl2的热化学方程式是_____________________________。
(3)P和Cl2分两步反应生成1 mol PCl5的ΔH3=______,P和Cl2一步反应生成1 mol PCl5的ΔH4___________ΔH3(填“大于”、“小于”或“等于”)。
[拓展探究]13.0.3 mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态的三氧化二硼和液态水,放出649.5 kJ热量,其热化学方程式为_______________________________________。
已知H2O(l)===H2O(g)ΔH=+44 kJ·mol-1。
则11.2 L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是__________kJ。
第一章化学反应与能量训练2中和反应的反应热及其测定答案1.C2.D3.D 4.A 5.B 6.A 7.D8.D9.Ⅰ.(1) 5.0(2) abeⅡ.(1) H2SO4(aq)+2NaOH(aq)===Na2SO4(aq)+2H2O(l)ΔH=-114.6 kJ·mol-1(2) ①4.0②-53.5 kJ·mol-1 ③acd10.(1) A(2) D (3) 放热(4) Cl211.(1) CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1(2) KOH(aq)+HNO3(aq)===KNO3(aq)+H2O(l) ΔH=-57.3 kJ·mol-1(3) N2(g)+2O2(g)===2NO2(g) ΔH=+67.8 kJ·mol-1(4) N2(g)+3H2(g) ===2NH3(g) ΔH=-92 kJ·mol-112.(1) 32Cl2(g)+P(s)===PCl3(g) ΔH=-306 kJ·mol-1(2) PCl5(g)===PCl3(g)+Cl2(g) ΔH=+93 kJ·mol-1(3) -399 kJ·mol-1等于13.B2H6(g)+3O2(g)===B2O3(s)+3H2O(l) ΔH=-2 165 kJ·mol-1 1 016.5。