中和反应的反应热及其测定专题讲解
- 格式:docx
- 大小:966.48 KB
- 文档页数:12



高中化学中和反应反应热的测定编稿老师佘平平一校黄楠二校林卉审核王慧姝【考点精讲】1. 中和热的定义:在稀溶液中,强酸和强碱发生中和反应生成1mol水所放出的热量。
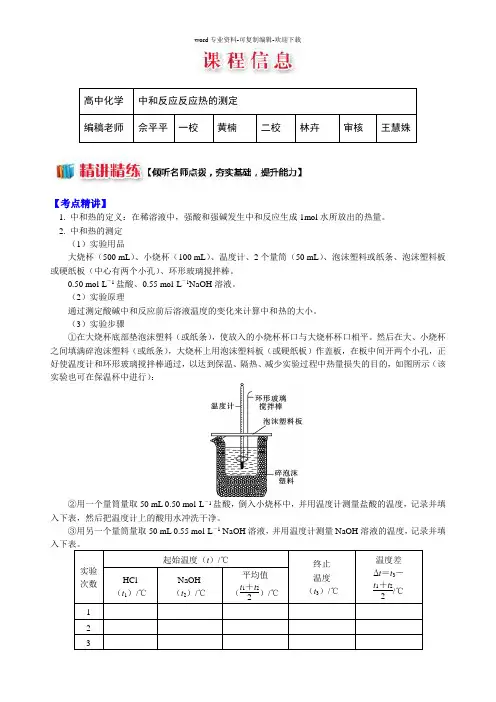
2. 中和热的测定(1)实验用品大烧杯(500 mL)、小烧杯(100 mL)、温度计、2个量筒(50 mL)、泡沫塑料或纸条、泡沫塑料板或硬纸板(中心有两个小孔)、环形玻璃搅拌棒。
0.50 mol·L-1盐酸、0.55 mol·L-1NaOH溶液。
(2)实验原理通过测定酸碱中和反应前后溶液温度的变化来计算中和热的大小。
(3)实验步骤①在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。
然后在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过,以达到保温、隔热、减少实验过程中热量损失的目的,如图所示(该实验也可在保温杯中进行):②用一个量筒量取50 mL 0.50 mol·L-1盐酸,倒入小烧杯中,并用温度计测量盐酸的温度,记录并填入下表,然后把温度计上的酸用水冲洗干净。
③用另一个量筒量取50 mL 0.55 mol·L-1 NaOH溶液,并用温度计测量NaOH溶液的温度,记录并填实验次数起始温度(t)/℃终止温度(t3)/℃温度差Δt=t3-t1+t22/℃HCl(t1)/℃NaOH(t2)/℃平均值(t1+t22)/℃1 2 3④把温度计和环形玻璃搅拌棒放入小烧杯的盐酸中,并把量筒中的NaOH 溶液一次倒入小烧杯(注意不要洒在外面),用环形玻璃搅拌棒轻轻搅动溶液,并准确读出混合溶液的最高温度,作为终止温度,记录并填入表格。
⑤重复实验三次,取测量所得数据的平均值作为计算的依据。
⑥根据实验数据计算中和热。
【典例精析】例题1 某学生进行中和热测定,取用50 mL 0.50 mol·L -1的HCl 和50 mL 0.55 mol·L -1 的NaOH 溶液(密度都是1 g·cm -3)。

课时1.2 反应热的测定——中和反应的反应热及其测定【学习目标】1、正确认识中和热的概念2、掌握中和热的测定实验方法,会分析测定反应热时误差产生的原因,并能采取适当措施减小实验误差【主干知识梳理】一、中和热概念及其数值1、概念:在稀溶液中,酸与碱发生中和反应生成1 mol H2O(l)时释放的热量称为中和热2、表示方法:H+(aq)+OH-(aq)===H2O(l)ΔH=-57.3 kJ·mol-1【微点拨】中和反应的实质是H+和OH-结合生成水,因而理解中和热时要注意以下几点:①条件:稀溶液,因浓酸溶液或浓碱溶液稀释时会放出热量②反应物:酸与碱(在中学化学中,只讨论强酸和强碱反应的中和热)③生成物及其物质的量:必须是形成1mol的H2O(l)④表述:用文字叙述中和热时,不带“-”;用ΔH表示时,带上“-”如:强酸与强碱反应的中和热为57.3 kJ·mol-1或ΔH=-57.3 kJ·mol-1⑤强酸、强碱发生中和反应时,中和热为一定值,与酸、碱的用量无关,与其中一种过量也无关,但酸和碱放出的热量与其用量有关⑥浓的强酸和强碱在发生中和反应的同时还要发生溶解,溶解要放出热量,故放出热量大于57.3kJ⑦弱酸和弱碱在发生中和反应的同时还要发生电离,电离要吸收热量,故放出热量小于57.3kJ⑧中和反应的实质是H+和OH-化合反应生成H2O。
若反应过程中有其它物质生成(生成不溶物质或难电离的物质等),这部分热量不包含在中和热内【对点训练1】1、下列说法正确的是()A.中和热一定是强酸跟强碱反应放出的热量B.1 mol酸与1 mol碱完全反应放出的热量是中和热C.在稀溶液中,酸与碱发生中和反应生成1 mol H2O(l)时的反应热叫做中和热D.测定中和热时可用稀硫酸和稀Ba(OH)2溶液2、下列关于中和热的说法中正确的是()A.10 L 0.1 mol·L-1 NaOH溶液与10 L 0.1 mol·L-1盐酸反应时的反应热是中和热B.1 mol HCl气体通入1 L 0.01 mol·L-1 NaOH溶液中反应时的反应热是中和热C.1 mol CH3COOH与2 mol NaOH溶液反应时的反应热是中和热D.只要强酸与强碱在稀溶液中反应生成1 mol水时的反应热就是中和热3、下列有关H+(aq)+OH-(aq)===H2O(l)ΔH=-57.3 kJ·mol-1的说法正确的是()A.代表所有的酸碱中和反应B.反应物一定是强酸与强碱C.强酸与强碱的中和反应的热化学方程式都可以这样表示D .表示稀的强酸溶液与稀的强碱溶液反应生成可溶性盐和1 mol 液态水时放出57.3 kJ 热量4、已知稀盐酸和氢氧化钠稀溶液反应的中和热ΔH =-57.3 kJ·mol -1,则下列物质间发生反应时放出的热量与57.3 kJ 最接近的是( )A .含1 mol 氢氧化钙的稀溶液与足量稀硫酸反应B .含1 mol 硫酸的稀溶液与足量稀氢氧化钠溶液反应C .含1 mol 醋酸的稀溶液与足量稀氢氧化钾溶液反应D .含1 mol 氢氧化钡的稀溶液与含1 mol 氯化氢的稀盐酸反应5、强酸与强碱的稀溶液发生中和反应的热效应:H +(aq)+OH -(aq)=H 2O(l);ΔH =-57.3 kJ/mol ,向1 L 0.5 mol/L 的NaOH 溶液中加入稀醋酸、浓H 2SO 4、稀HNO 3,则恰好完全反应时的热效应ΔH 1、ΔH 2、ΔH 3的关系正确的是( )A .ΔH 1>ΔH 2>ΔH 3B .ΔH 1<ΔH 3<ΔH 2C .ΔH 2>ΔH 1>ΔH 3D .ΔH 1>ΔH 3>ΔH 2二、中和反应反应热的测定 1、实验装置2、实验测量数据 (1)反应物温度的测量①用量筒量取50 mL 0.50 mol·L-1盐酸,打开杯盖,倒入量热计的内筒,盖上杯盖,插入温度计,测量并记录盐酸的温度(数据填入下表)。


【教材实验热点】13 中和反应反应热的测定专题13 中和反应反应热的测定【教材实验梳理】1.反应原理H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1通过测定一定量的酸、碱溶液在反应前后温度的变化,计算反应放出的热量,由此得中和热。
2.实验装置3.实验用品大烧杯(500 mL)、小烧杯(100 mL)、环形玻璃搅拌棒、量筒(50 mL)两个、温度计、泡沫塑料或纸条、泡沫塑料板或硬纸板(中心有两个小孔)、盐酸(0.50 mol·L−1)、氢氧化钠溶液(0. 55 mol·L−1)4.实验步骤5.实验说明(1)中和热的测定实验中,NaOH溶液的浓度稍大于盐酸的浓度是确保HCl反应完全。
若采用的酸、碱浓度相等,可采用碱体积稍过量的方法达到这个目的。
(2)中和热的计算公式ΔH=()()酸终碱始水+⋅⋅--m m c t tnkJ/mol(3)实验中若用弱酸(或弱碱)代替强酸(或强碱),因弱酸(或弱碱)电离出H+(或OH−)需要吸收热量,故测定的中和热的数值偏小;若用浓硫酸与强碱反应测定中和热,因浓硫酸稀释要放热,故测定的中和热的数值偏大。
(4)要提高反应热测定的准确性,应注意“快”(实验操作要快,尽量减少热量散失)、“准”(准确测量液体温度和液体体积)、“稀”(浓度不宜过大,避免稀释放热,也要避免浓度过小)。
(5)要使用同一支温度计,温度计的水银球要完全浸入溶液中,读出变化过程中的最高温度。
(6)环形玻璃搅拌棒不能用铁丝代替,若用铁丝代替,会因铁丝与酸反应放出热量,且铁丝传热快而使测试结果不准确。
(7)对于定量实验,需重复实验步骤,取3次实验数据的平均值,但相差太大的数据应舍弃。
6.误差分析(1)分析的依据看实验中有哪些因素能造成(t终−t始)出现误差。
若(t终−t始)偏大,则|ΔH|偏大;若(t 终−t始)偏小,则|ΔH|偏小。
(2)误差分析实例50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液反应的误差分析:【答题技巧】反应热答题规范指导(1)用“焓变(ΔH)”表示反应热时,ΔH>0表示吸热,ΔH<0表示放热,因而,ΔH后所跟数值需要带“+”、“-”符号。


中和反应反应热的测定实验实验原理:稀溶液中,酸跟碱发生中和反应而生成1molH 2O ,这时的反应能量变化叫做中和热。
实验中通过测定酸碱中和反应过程中所放出的热量来计算中和热。
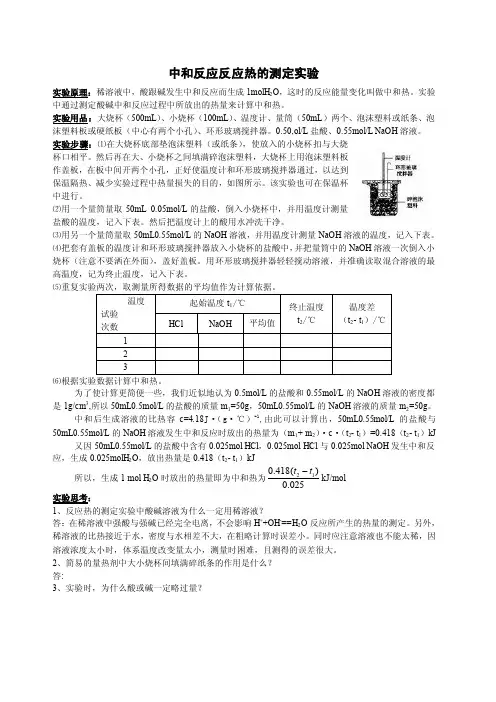
实验用品:大烧杯(500mL )、小烧杯(100mL )、温度计、量筒(50mL )两个、泡沫塑料或纸条、泡沫塑料板或硬纸板(中心有两个小孔)、环形玻璃搅拌器。
0.50,ol/L 盐酸、0.55mol/L NaOH 溶液。
实验步骤:⑴在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯扣与大烧杯口相平。
然后再在大、小烧杯之间填满碎泡沫塑料,大烧杯上用泡沫塑料板作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌器通过,以达到保温隔热、减少实验过程中热量损失的目的,如图所示。
该实验也可在保温杯中进行。
⑵用一个量筒量取50mL 0.05mol/L 的盐酸,倒入小烧杯中,并用温度计测量盐酸的温度,记入下表。
然后把温度计上的酸用水冲洗干净。
⑶用另一个量筒量取50mL0.55mol/L 的NaOH 溶液,并用温度计测量NaOH 溶液的温度,记入下表。
⑷把套有盖板的温度计和环形玻璃搅拌器放入小烧杯的盐酸中,并把量筒中的NaOH 溶液一次倒入小烧杯(注意不要洒在外面),盖好盖板。
用环形玻璃搅拌器轻轻搅动溶液,并准确读取混合溶液的最高温度,记为终止温度,记入下表。
⑸重复实验两次,取测量所得数据的平均值作为计算依据。
为了使计算更简便一些,我们近似地认为0.5mol/L 的盐酸和0.55mol/L 的NaOH 溶液的密度都是1g/cm 3,所以50mL0.5mol/L 的盐酸的质量m 1=50g ,50mL0.55mol/L 的NaOH 溶液的质量m 2=50g 。
中和后生成溶液的比热容c=4.18J ·(g ·℃)-1,由此可以计算出,50mL0.55mol/L 的盐酸与50mL0.55mol/L 的NaOH 溶液发生中和反应时放出的热量为(m 1+ m 2)·c ·(t 2- t 1)=0.418(t 2- t 1)kJ 又因50mL0.55mol/L 的盐酸中含有0.025mol HCl ,0.025mol HCl 与0.025mol NaOH 发生中和反应,生成0.025molH 2O ,放出热量是0.418(t 2- t 1)kJ所以,生成1 mol H 2O 时放出的热量即为中和热为025.0)(418.012t t kJ/mol实验思考:1、反应热的测定实验中酸碱溶液为什么一定用稀溶液?答:在稀溶液中强酸与强碱已经完全电离,不会影响H ++OH -==H 2O 反应所产生的热量的测定。

酸碱中和反应的反应热实验及教学总结
本文旨在介绍酸碱中和反应的反应热实验及教学总结。
通过实验,我们可以深入了解酸碱中和反应的基本原理和反应热的测量方法,从而提高化学实验教学的效果。
一、实验原理及方法
1.实验原理
酸碱中和反应是指酸性和碱性物质按一定比例混合后,发生化学反应,产生水和盐的过程。
此种反应可释放热量,称为中和反应热。
若将一定质量的酸和碱按化学计量比完全中和,则所释放热量称为单次中和反应热。
2.实验方法
(1)实验器材:理化实验室常用器材如量筒、热计、反应瓶、电子天平等。
(2)实验药品:类似于氢氧化钠、盐酸等酸碱试剂。
(3)实验步骤:
①在天平上称量一定量的酸和碱,分别注入盛有定量水的量筒中。
②将酸、碱溶液缓慢加入反应瓶中并记下反应前后的体积,计算出反应时反应液的体积。
③将热计与反应瓶紧密接触,通过温度上升计算出反应热。
④进行数据分析并作出实验报告。
二、实验结果分析
经过实验测量,理论值与实验值基本相等,说明实验准确可靠。
需注意的是,实验过程中需要严格控制一些细节,避免误差的发生。
三、教学总结
本次实验的实施使我们更深入地了解了酸碱中和反应的基本原理和反应热的测量方法。
我们认为,在化学实验教学过程中,实验的设计和实施应当更加注重实用性,具有针对性和实际意义。
此外,更需要加强教师指导,确保学生安全和实验效果,从而提高化学实验教学质量和水平。
第2课时中和反应的反应热及其测定一、中和热及其测定1.判断下列关于中和热的说法是否正确(对的打“√”,错的打“×”)(1)H2SO4与Ba(OH)2溶液反应放出的热量是5.12 kJ,那么该反应的中和热为5.12 kJ·mol-1()(2)表示中和热的热化学方程式:H+(l)+OH-(l)===H2O(l)ΔH=-57.3 kJ·mol-1()(3)在稀溶液中,强酸与强碱反应的中和热为ΔH=-57.3 kJ·mol-1,若将含有0.5 mol H2SO4的浓硫酸和含有1 mol NaOH的溶液混合,放出的热量大于57.3 kJ()(4)中和热的数值57.3 kJ·mol-1表示所有酸碱反应生成1 mol H2O的反应热()(1)中和热的概念是酸和碱在稀溶液中发生中和反应生成1 mol H2O(l)时的反应热。
(2)浓的强酸和强碱在发生中和反应的同时还要发生溶解,溶解要放出热量;若是浓的弱酸和弱碱在发生中和反应的同时还要发生电离,电离要吸收热量,故放出的热量均不完全是中和热。
(3)强酸和强碱在稀溶液中发生中和反应时,1 mol H+和1 mol OH-反应生成 1 mol H2O(l),放出57.3 kJ的热量,表示为H+(aq)+OH-(aq)===H2O(l)ΔH=-57.3 kJ·mol-1。
2.中和热的测定(1)实验装置将下列实验装置中各仪器(或物品)的名称填在横线上。
(2)实验测量数据①初始温度(t1):测量混合前50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L -1 NaOH溶液的温度,取两温度平均值为t1。
②终止温度(t2):将酸碱溶液迅速混合,用环形玻璃搅拌棒轻轻搅动溶液,并准确读取混合溶液的最高温度,记录为终止温度t 2。
③重复实验操作三次,记录每次的实验数据,取其平均值作为计算依据。
(3)实验数据处理盐酸、氢氧化钠溶液为稀溶液,其密度近似地认为都是1 g·cm -3,反应后溶液的比热容c =4.18 J·g -1·℃-1。
该实验中盐酸和NaOH 溶液反应放出的热量是0.418(t 2-t 1) kJ ,中和热为16.72(t 2-t 1) kJ·mol -1[或ΔH=-0.418(t 2-t 10.025 kJ·mol -1]。
中和热测定实验中应注意的事项(1)防止热量散失的方法:①两个烧杯口要相平;②在两个烧杯之间填充碎泡沫塑料或碎纸片;③用玻璃棒搅拌,而不能用金属棒(丝)搅拌;④实验时动作要迅速。
(2)加过量碱液使酸完全反应,碱过量对中和热测定没有影响。
(3)数据处理时,相差较大的数据可能是偶然误差引起的,应舍去。
例1 在进行中和热的测定中,下列操作错误的是( )A.反应中用的是强酸、强碱的稀溶液B.测量溶液的温度计要一直插在溶液中C.为了使反应均匀进行,可以向酸(碱)中分次加入碱(酸)D.为了使反应更完全,可以使碱适当过量考点 中和热的实验测定题点 中和热测定实验操作和误差分析例2 某实验小组设计用50 mL 0.50 mol·L -1盐酸跟50 mL 0.55 mol·L-1氢氧化钠溶液在如图装置中进行中和反应。
试回答下列问题:(1)使盐酸与NaOH 溶液混合均匀的正确操作是 (填字母)。
A.用温度计小心搅拌B.揭开硬纸片用玻璃棒搅拌C.轻轻地振荡烧杯D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动(2)假设盐酸和氢氧化钠溶液的密度都是1 g·cm -3,又知中和反应后生成溶液的比热容c =4.18 J·g -1·℃-1。
为了计算中和热,某学生实验记录数据如下:依据该学生的实验数据计算,该实验测得的中和热ΔH=(结果保留一位小数)。
(3)实验过程中如果做出如下改变,会实测得的中和热发生怎样的变化?(填“偏大”“偏小”或“不变”)。
①本实验中用稍过量的NaOH 的原因是为保证盐酸完全被中和。
试问:盐酸在反应中若因为有放热现象,而造成少量盐酸在反应中挥发,则测得的中和热。
②在中和热测定实验中存在用水洗涤温度计上的盐酸的步骤,若无此操作步骤,则测得的中和热会。
③若用等浓度的醋酸与NaOH 溶液反应,则测得的中和热会,其原因是。
考点中和热的实验测定题点中和热测定实验的综合二、反应热的相关图像与大小比较1.能量变化关系图的识别和应用(1)根据图1(能量变化关系图)判断吸、放热反应:①A→B:ΔH>0;属于吸热反应。
②B→C:ΔH<0;属于放热反应。
(2)对比图2中a、b两条变化曲线可知,使用催化剂可以使反应物的活化能降低(填“升高”“降低”或“不变”,下同),反应过程中的焓变不变。
(3)根据图3写出N2(g)和H2(g)合成1 mol NH3(l)的热化学方程式。
2.反应热大小的比较比较ΔH时应带“+”、“-”号比较;比较吸收或放出的热量大小时,只比较数值大小。
(1)同种物质燃烧时,可燃物物质的量越大,燃烧放出的热量越多,ΔH 越小。
(2)等量的可燃物完全燃烧所放出的热量比不完全燃烧所放出的热量多,对应ΔH小。
(3)其他条件相同时,气态反应物比固态反应物放出的热量多,对应的ΔH小;生成液态产物比气态产物放出的热量多,对应的ΔH小。
例3在相同条件下,下列两个反应放出的热量分别用ΔH 1和ΔH2表示:2H2(g)+O2(g)===2H2O(g)ΔH12H2(g)+O2(g)===2H2O(l)ΔH2则()A.ΔH2>ΔH1B.ΔH1>ΔH2C.ΔH1=ΔH2D.无法确定例4反应A+B―→C(ΔH<0)分两步进行:①A+B―→X(ΔH>0),②X―→C(ΔH<0)。
下列示意图中,能正确表示总反应过程中能量变化的是()考点焓变反应热题点能量变化示意图与焓变关系例5(1)汽车发动机工作时会引发N 2和O2反应,生成NO x等污染大气,其中生成NO的能量变化如图1所示,则图1中三种分子最稳定的是,图1中对应反应的热化学方程式为。
(2)在图2的坐标系中绘制出N2(g)、O2(g)反应生成NO(g)的能量变化曲线。
考点焓变反应热题点焓变与反应热的综合考查1.在做中和热测定实验时,应使用的仪器是()①量筒②托盘天平③烧杯④容量瓶⑤冷凝管⑥温度计⑦酒精灯A.①③⑥B.②③⑤C.①②③⑥D.①②⑥⑦考点中和热的实验测定题点2.含有11.2 g KOH的稀溶液与1 L 0.1 mol·L-1的H2SO4溶液反应,放出11.46 kJ的热量,表示该反应的中和热的热化学方程式为()A.KOH(aq)+12H2SO4(aq)===12K2SO4(aq)+H2O(l) ΔH=-11.46kJ·mol-1B.2KOH(aq)+H2SO4(aq)===K2SO4(aq)+2H2O(l) ΔH=-11.46 kJ·mol-1C.2KOH(aq)+H2SO4(aq)===K2SO4(aq)+2H2O(l) ΔH=-114.6 kJ·mol-1D.KOH(aq)+12H2SO4(aq)===12K2SO4(aq)+H2O(l) ΔH=-57.3kJ·mol-1考点中和反应反应热题点表示中和热的热化学方程式3.已知H++OH-===H2O生成1 mol H2O(l)放出热量57.3 kJ,下列反应中能放出57.3 kJ热量的是()A.1 mol稀H2SO4与足量NaOH溶液反应B.稀盐酸与氨水反应生成1 mol H2OC.稀盐酸与稀Ba(OH)2溶液反应生成1 mol水D.稀NaOH与95%浓硫酸反应生成1 mol水考点中和反应反应热题点中和热与57.3 kJ·mol-14.(2017·洛阳一高高二月考)分别取40 mL 的0.50 mol·L-1盐酸与40 mL 0.55 mol·L-1氢氧化钠溶液进行中和热的测定实验。
下列说法错误的是()A.稍过量的氢氧化钠是确保盐酸完全反应B.仪器A的名称是环形玻璃搅拌棒C.在实验过程中,把温度计上的酸用水冲洗干净后再测量NaOH溶液的温度D.用硫酸和Ba(OH)2溶液代替盐酸和氢氧化钠溶液,结果也是正确的考点中和热的实验测定题点中和热测定实验操作和误差分析5.如图所示,某反应在不同条件下的反应历程分别为a、b。
(1)据图可判断出反应物的总键能(填“>”“<”或“=”,下同)生成物的总键能,则该反应的反应热ΔH0。
(2)其中b历程对应的反应采用的条件为(填字母)。
A.升高温度B.增大反应物的浓度C.增大压强D.使用催化剂考点反应热的综合题点能量变化示意图的应用6.NF3是一种温室气体,其存储能量的能力是CO2的12 000~20 000写出由N2和F2反应生成NF3的热化学方程式。
考点热化学方程式题点根据键能写热化学方程式[对点训练]题组一中和热及其测定实验1.含NaOH 20.0 g的稀溶液与足量的稀盐酸反应,放出28.7 kJ的热量,表示该反应的热化学方程式是()A.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l)ΔH=+28.7 kJ·mol-1B.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l)ΔH=-28.7 kJ·mol-1C.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l)ΔH=+57.4 kJ·mol-1D.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l)ΔH=-57.4 kJ·mol-1考点中和反应反应热题点表示中和热的热化学方程式2.强酸和强碱稀溶液的中和热可表示为H+(aq)+OH-(aq)===H2O(l)ΔH=-57.3 kJ·mol-1,已知:①HCl(aq)+NH3·H2O(aq)===NH4Cl(aq)+H2O(l)ΔH=-a kJ·mol-1②HCl(aq)+NaOH(s)===NaCl(aq)+H2O(l)ΔH=-b kJ·mol-1③HNO3(aq)+KOH(aq)===KNO3(aq)+H2O(l)ΔH=-c kJ·mol-1则a、b、c三者的大小关系为()A.a>b>cB.b>c>aC.a=b=cD.无法比较考点中和反应反应热题点中和热与57.3 kJ·mol-13.下列说法中正确的是()A.只要强酸与强碱在稀溶液中反应生成1 mol水时的反应热就是中和热B.可以用保温杯代替烧杯做有关中和热测定的实验C.在测定中和热的实验中,至少需要测定并记录3次温度D.测定中和热的实验中,若所使用的NaOH的物质的量稍大于HCl,则会导致所测得的中和热数值偏高考点中和热的实验测定题点中和热测定实验操作和误差分析4.关于中和热测定的说法错误的是()A.中和热的测定实验中需要用到的主要玻璃仪器有:两个大小相同的烧杯、两个大小相同的量筒、温度计、环形玻璃搅拌棒B.盐酸与某强碱中和放出的热量随反应物的用量改变而改变,但中和热不变C.NaOH稍过量的目的是保证盐酸完全被NaOH中和D.测定结果准确与否的关键是尽量减小热量损失及准确读取混合溶液的最高温度等考点中和热的实验测定题点中和热测定实验操作和误差分析5.某同学通过实验测出稀盐酸和稀NaOH溶液(碱稍过量)反应的中和热ΔH=-52.3 kJ·mol-1,造成这一结果的原因不可能的是()A.实验装置保温、隔热效果差B.用量筒量取盐酸时仰视读数C.分多次将NaOH溶液在倒入小烧杯中D.用测量盐酸的温度计直接测定NaOH溶液的温度考点中和热的实验测定题点中和热测定实验操作和误差分析6.已知H+(aq)+OH-(aq)===H2O(l)ΔH=-57.3 kJ·mol-1,向100 mL 1mol·L-1的NaOH溶液中加入0.5 mol·L-1的某种酸P溶液,测得加入酸的体积与反应放出的热量关系如图所示(不考虑热量损失),下列对应关系可能正确的是()考点中和反应反应热题点中和热与57.3 kJ·mol-1题组二中和热测定实验数据处理及计算7.为了测定酸碱反应的中和热,计算时至少需要的数据是()①酸溶液的浓度和体积②碱溶液的浓度和体积③比热容④反应后溶液的质量(单位:g)⑤生成水的物质的量⑥反应前后温度变化⑦操作所需的时间A.①②③⑥B.①③④⑤C.③④⑤⑥D.全部考点中和热的实验测定题点中和热测定的实验原理8.用50 mL 0.50 mol·L-1盐酸和50 mL 0.55 mol·L-1 NaOH溶液反应,实验中测得起始温度为20.1 ℃,终止温度为23.4 ℃,反应后溶液的比热容为4.18 J·g-1·℃-1,盐酸和NaOH溶液的密度都近似认为是1 g·cm -3,则中和反应生成1 mol水时放热()A.55.2 kJB.391 kJC.336 kJD.1.38 kJ考点中和热的实验测定题点中和热测定的实验原理题组三反应热的综合考查9.(2017·杭州二中期中)某化学反应的能量变化如图所示,下列有关叙述正确的是()A.该反应为放热反应B.E2kJ·mol-1可表示形成新的化学键所释放的能量 C.该反应的反应热ΔH=(E1-E2) kJ·mol-1D.加入催化剂,可同时降低E1、E2考点焓变反应热题点能量变化示意图与催化剂10.甲烷与CO2可用于合成合成气(主要成分是一氧化碳和氢气):CH4(g)+CO2(g)===2CO(g)+2H2(g),1 g CH4(g)完全反应可释放15.46 kJ的热量,下图中能表示该反应过程的能量变化的是()考点焓变反应热题点能量变化示意图与焓变关系11.(2017·安徽师大附中期中)N2和H2在催化剂表面合成氨的微观历程及能量变化的示意图如下,用、、分别表示N 2、H2、NH3,下列说法正确的是()A.使用催化剂,合成氨反应放出的热量减少B.在该过程中,N2、H2断键形成N原子和H原子C.在固体催化剂表面合成氨的过程中能量状态最低的是③D.合成氨反应中,反应物断键吸收的能量大于生成物形成新键释放的能量考点焓变反应热题点焓变、反应热与物质化学键的断裂、形成的关系12.相同条件下,下列各组热化学方程式(溶液中的反应均是在稀溶液中进行的)中,ΔH 1>ΔH 2的是( )A.2H 2(g)+O 2(g)===2H 2O(l) ΔH 1 CaCO 3(s)===CaO(s)+CO 2(g) ΔH 2B.C 2H 5OH(l)+3O 2(g)===2CO 2(g)+3H 2O(l) ΔH 1C 2H 5OH(g)+3O 2(g)===2CO 2(g)+3H 2O(l) ΔH 2C.HCl(aq)+NaOH(s)===NaCl(aq)+H 2O(l) ΔH 1HNO 3(aq)+KOH(aq)===KNO 3(aq)+H 2O(l) ΔH 2D.CO 2(g)===CO(g)+12O 2(g) ΔH 1 2CO 2(g)===2CO(g)+O 2(g) ΔH 2考点 焓变 反应热题点 反应热大小的比较[综合强化]13.含11.2 g KOH 的稀溶液与1 L 0.1 mol·L -1的H 2SO 4溶液反应放出11.46 kJ 的热量,该反应的热化学方程式为 ,则KOH 与H 2SO 4反应的中和热为 。