羰基的亲核加成
- 格式:ppt
- 大小:801.50 KB
- 文档页数:80




羰基的亲核加成及相关反应羰基化合物包括醛、酮、羧酸及衍生物和5.1 羰基的结构CO2。
CO亲电中心羰基碳的活性较大,易被亲核试剂进攻而发生亲核加成反应和亲核取代反应。
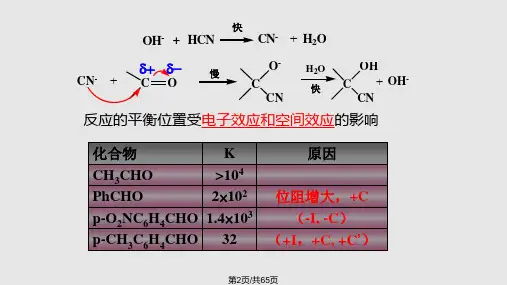
5.2 亲核加成反应的历程及影响因素 5.2.1 HCN 的加成 反应为碱催化。
v k [ CO ][ CN ]快OH - + HCN CN -+ H 2O- 慢OH 2OOHCN -+ C O C 快 C + OH -CN CN 反应的平衡位置受电子效应和空间效应的影响。
酮正向反应的趋势较小(空阻大)二、亲核加成反应的一般特点 1.反应可以被酸或碱催化 酸催化可提高羰基的亲电活性。
碱催化提高亲核试剂的亲核性。
活性:Nu -> Nu H2.多数醛酮的亲核加成为可逆反应,用于分离与提纯。
5.2.2 影响羰基亲核加成反应活性的因素 一、羰基化合物的结构1.电子效应 羰基碳的正电性越大,亲核加成速度越大,反应活性越大。
羰基碳所连的吸电基( 加成反应的活性增加,而供电基( +I , +C )则使其活性降低。
活泼顺序:H +C OH C + OHNu H + OHNu -+ H 2O-I ,-C )使其亲核50%(1) - 共轭效应(增加其稳定性) ;( 2)+C 效应(降低羰基碳的正电性) ;(3)加成产物失去共轭 能,反应活化能高; ( 4)产物的张力大幅增加。
2.立体效应、试剂的亲核性 对同一羰基化合物,试剂的亲核性越大,平衡常数越大,亲核加成越容易。
1.带负电荷的亲核试剂比起共轭酸(中性分子)的亲核性强。
OH ->H 2O, RO ->ROH 。
2.极性大的分子比极性小的分子亲核性强。
HCN>H 2O (极性与电负性 )。
3.同周期元素的负离子的亲核性与碱性大小一致; R 3C ->R 2N ->RO ->F - 4.同一主族元素的负离子的亲核性与可极化度大小一致。
I ->Br ->Cl ->F -5.2.3 亲核加成反应的立体化学 一、非手性的羰基化合物的加成前(潜)手性分子 结果得外消旋化产物-I >+C(+C) (+C, 空阻) ( +C > -I) (+C) 活性极低OH> CH 3 C HO >CH 3 C CH 3 >OOO >CH 3CH 2 C CH 2CH 3> Ph C PhR Nu C R' O -R Nu RC Nu R' OH50% dlR R'OCNuH +R R'OHCNu张力增加OH +、手性羰基化合物的亲核加成方向遵守Cram 规则,得立体选择性的非对称异构体产物。



醛酮的化学性质——羰基上的加成
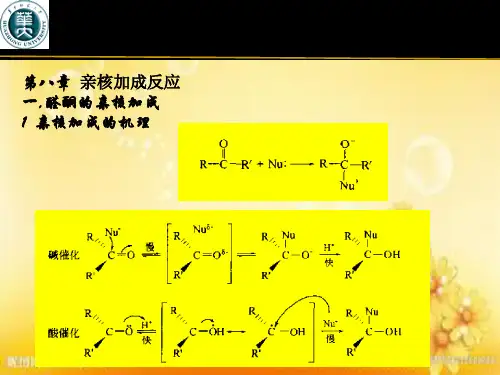
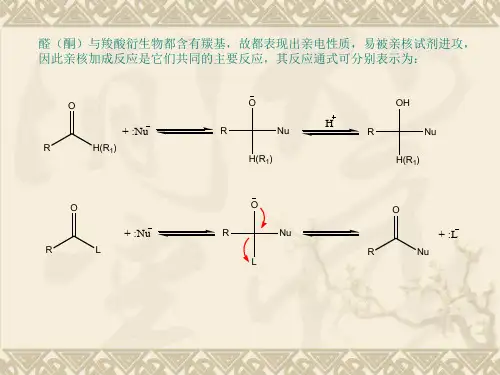
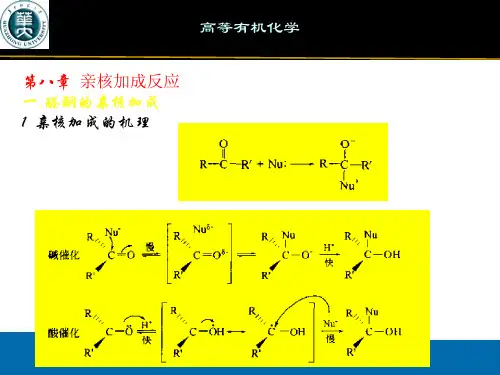
羰基双键与烯烃不同,由于π键的极化,氧原子带部分负电荷,碳原子带部分正电荷,由于氧原子可以形成稳定的氧负离子,有较大容纳负电荷的能力,所以碳氧双键中反应活性中心是带正电的碳原子,容易与带负电荷或有未共用电子对的原子或原子团(亲核试剂)相作用。
这种由亲核试剂进攻而发生的加成叫亲核加成。
1.与氰化氢加成
醛和甲基酮可与HCN加成生成α—羟腈。
2.与NaHSO3加成
醛和脂肪族甲基酮有此反应。
这一反应是典型的可逆反应,所以NaHSO3溶液是饱和的,而且需过量。
此反应常用于分离提纯醛酮。
碳原子数小于8以下的环酮也有此反应。
3.与格氏试剂反应
醛酮与格氏试剂反应是合成醇的重要方法之一。
羰基加成的立体化学
亲核加成和催化加氢还原是羰基的重要化学反应,由于羰基的平面构型,亲核试剂或者氢可以从羰基平面的上方或下方进攻羰基。
因此,除甲醛和对称酮外,其他醛、酮的加成及还原都会产生新的手性碳原子,产物是外消旋体或非对映异构体的混合物。
例如,乙醛与氢氰酸的加成,由于亲核试剂CN-可以从羰基平面的上方或下方进攻羰基碳,且机会相等,所以产物是由等量的R-羟基丙腈和S-羟基丙腈组成的外消旋体。
再例如2-丁酮的催化加氢还原,也得到外消旋体
当醛或酮的α-碳原子具有手性时,羰基平面不再是分子的对称面,亲核试剂从该平面上方或下方进攻的机会不相等,结果得到不等量的非对映体。
总结:
醛、酮是分子中含有羰基的化合物。
由于氧的电负性比碳大,所以碳氧双键是极性的不饱和键。
羰基的极化性导致醛、酮能发生亲核加成反应。
常见的亲核试剂有:氢氰酸、醇、水、Grignard试剂、氨的衍生物等。
多数情况下,羰基的亲核加成反应是可逆的。
醛酮亲核加成反应的难易主要取决于醛、酮的结构,即取决于羰基碳上连接的原子或基团的电子效应和空间效应。
醛、酮分子的α-H受羰基的影响,显得非常活泼,能发生羟醛缩合反应和卤代、卤仿反应。
醛、酮对弱氧化剂(如Tollens试剂、Fehling试剂)表现出很大差异,可用于醛酮的鉴别。
醛、酮均可被还原成醇,羰基也可被还原成亚甲基。