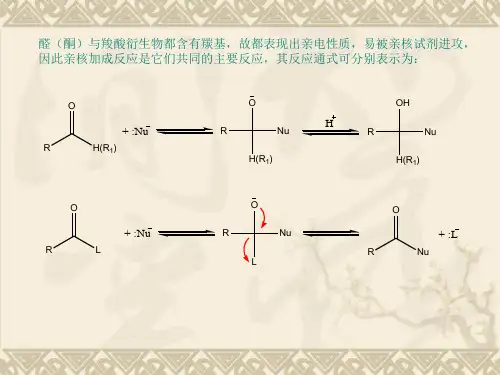
亲核加成反应
- 格式:pdf
- 大小:168.98 KB
- 文档页数:6

化学反应中的亲核加成反应机理研究化学反应是研究原子之间发生的转化和变化的科学领域。
亲核加成反应是一类常见的化学反应,其机理研究对于解释反应细节和优化化学合成具有重要意义。
本文将重点讨论亲核加成反应的机理研究,探究其在化学领域中的应用和意义。
一、亲核加成反应概述亲核加成反应是指亲核试剂通过共用电子对的方式与亲电试剂发生反应,形成新的化学键。
亲核试剂通常是具有孤对电子的化合物,如氨、醇、胺、卤素等,而亲电试剂则是带有正电荷或部分正电荷的分子,如卤代烃、酰卤等。
在亲核加成反应中,亲核试剂攻击亲电试剂的部分正电荷中心,形成一个新的共价键。
二、亲核加成反应的机理亲核加成反应的机理可以分为以下几个步骤:亲核试剂的攻击、亲电试剂的离去、质子转移和生成产物。
1. 亲核试剂的攻击亲核试剂通过其孤对电子攻击亲电试剂。
亲电试剂中的部分正电荷可以吸引亲核试剂,使其接近并进行反应。
这一步骤是亲核加成反应的关键环节。
2. 亲电试剂的离去亲核试剂攻击亲电试剂后,形成一个新的化学键。
在这个过程中,亲电试剂原来的化学键发生了断裂,从而产生一个具有正电荷的离去基团。
离去基团离开后,反应的原子间距离会有所变化。
3. 质子转移在亲核加成反应中,质子转移是常见的步骤之一。
它可以帮助调整反应物的电荷和立体结构,使反应进行得更加顺利。
质子的转移通常涉及到酸碱中心的变化。
4. 生成产物经过亲核试剂的攻击、亲电试剂的离去和质子转移等步骤后,最终会形成一个新的化学键,并生成产物。
产物的结构和性质取决于反应物的选择和反应条件的控制。
三、亲核加成反应的应用和意义亲核加成反应在化学合成中具有广泛的应用和意义。
1. 合成有机化合物亲核加成反应可以用于合成各种有机化合物,例如醇、酮、醛、酸等。
通过选择不同的反应物和反应条件,可以实现不同的合成目标,并得到具有特定结构和性质的化合物。
2. 研究反应机理亲核加成反应的机理研究有助于揭示反应发生的细节和规律,深入理解化学反应的本质。

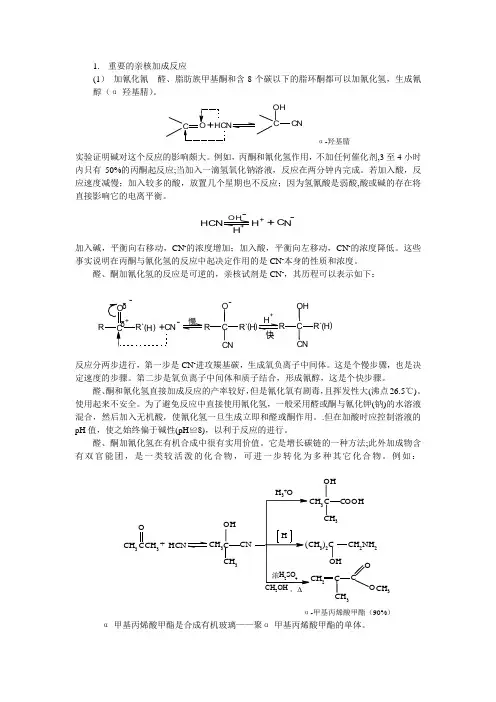
1. 重要的亲核加成反应(1) 加氰化氰 醛、脂肪族甲基酮和含8个碳以下的脂环酮都可以加氰化氢,生成氰醇(α-羟基腈)。
CO CHCNα-羟基腈实验证明碱对这个反应的影响颇大。
例如,丙酮和氰化氢作用,不加任何催化剂,3至4小时内只有50%的丙酮起反应;当加入一滴氢氧化钠溶液,反应在两分钟内完成。
若加入酸,反应速度减慢;加入较多的酸,放置几个星期也不反应;因为氢氰酸是弱酸,酸或碱的存在将直接影响它的电离平衡。
+H+--C O H HHNCN+加入碱,平衡向右移动,CN -的浓度增加;加入酸,平衡向左移动,CN -的浓度降低。
这些事实说明在丙酮与氰化氢的反应中起决定作用的是CN -本身的性质和浓度。
醛、酮加氰化氢的反应是可逆的,亲核试剂是CN -,其历程可以表示如下:反应分两步进行,第一步是CN -进攻羰基碳,生成氧负离子中间体。
这是个慢步骤,也是决定速度的步骤。
第二步是氧负离子中间体和质子结合,形成氰醇,这是个快步骤。
醛、酮和氰化氢直接加成反应的产率较好,但是氰化氧有剧毒,且挥发性大(沸点26.5℃)。
使用起来不安全。
为了避免反应中直接使用氰化氢,一般采用醛或酮与氰化钾(钠)的水溶液混合,然后加入无机酸,使氰化氢一旦生成立即和醛或酮作用。
.但在加酸时应控制溶液的pH 值,使之始终偏于碱性(pH ≌8),以利于反应的进行。
醛、酮加氰化氢在有机合成中很有实用价值。
它是增长碳链的一种方法;此外加成物含有双官能团,是一类较活泼的化合物,可进一步转化为多种其它化合物。
例如:CH 3CH 3CH 2CH 3CH 3CH3CH 333)2CCH 2NH 2CH 33CO H O H O+C H C O O HNCNCO CCHO C H +O,Δα-甲基丙烯酸甲酯(90%) α-甲基丙烯酸甲酯是合成有机玻璃——聚α-甲基丙烯酸甲酯的单体。
C R R R`δ+O H ()+--慢快C H H NCN +R`)H (-C R O CN R`)H ((2)加亚硫酸氢钠 大多数醛、脂肪族甲基酮和8个碳以下的脂环酮与亚硫酸氢钠饱和溶液(40%)加成,生成白色的α-羟基磺酸钠晶体。


亲核加成反应机理一、介绍亲核加成反应是有机化学中一种重要的反应类型。
它通过亲核试剂攻击电荷不饱和的碳原子,形成新的碳-亲核键,并伴随有官能团的转换。
本文将对亲核加成反应的机理进行全面、详细、完整且深入地探讨。
二、亲核加成反应概述亲核加成反应是一类重要的有机化学反应,其主要特点是用亲核试剂攻击双键或三键上的电子,形成新的化学键。
亲核试剂可以是阴离子、中性分子或阳离子。
在亲核加成反应中,亲核试剂通常经历亲核进攻、负离子重排和质子化等阶段。
1. 亲核进攻亲核试剂在亲核加成反应中起到亲核进攻的作用。
通常情况下,亲核试剂具有可用的自由电子对,能与电子不足的碳原子形成新的化学键。
亲核进攻的速率和选择性受到亲核试剂的性质、反应条件和底物的结构等因素的影响。
2. 负离子重排在某些亲核加成反应中,亲核试剂的亲核进攻会导致反应过渡态产生负电荷,形成负离子。
负离子重排是亲核加成反应中的一个重要步骤,可以通过改变碳原子的排列顺序来稳定负离子。
3. 质子化质子化是亲核加成反应中的最后一个阶段,通过给亲核试剂或负离子成员质子化,使反应产物获得更稳定的结构。
质子化通常发生在负离子重排之后。
三、亲核加成反应的分类亲核加成反应可根据亲核试剂和底物的不同进行分类。
下面将对几种常见的亲核加成反应进行介绍。
1. 碱性条件下的亲核加成反应在碱性条件下,亲核试剂通常是醇、酚、胺等带有孤对电子的化合物。
这类亲核试剂能够与电荷不饱和的碳原子形成新的化学键。
碱性条件下的亲核加成反应常用于合成醇、酚、胺等化合物。
2. 酸性条件下的亲核加成反应在酸性条件下,亲核试剂通常是具有孤对电子的阴离子,如卤素离子、亚硫酸根离子等。
酸性条件下的亲核加成反应可以用于合成卤代烷、磺酸酯等化合物。
3. 中性条件下的亲核加成反应在中性条件下,亲核试剂通常是中性分子,如水、醛、酮等。
中性条件下的亲核加成反应常用于合成醇、酮等化合物。
四、亲核加成反应的机理解析1. 碱性条件下的亲核加成反应机理以醇作为亲核试剂为例,碱性条件下的亲核加成反应机理如下:1.酸性条件下,氧上的醇质子化生成质子化醇。


有机化学基础知识点亲核加成反应的机理亲核加成反应是有机化学中一种重要的反应类型,常见于碳原子与亲核试剂之间的化学反应。
在亲核加成反应中,亲核试剂攻击电子不饱和化合物中的亲电中心,形成化学键。
本文将探讨亲核加成反应的机理,并介绍几种典型的亲核加成反应。
一、机理介绍亲核加成反应的机理通常分为两步:亲核试剂的攻击和中间物的转变。
1. 亲核试剂的攻击亲核试剂(Nu^-)攻击亲电中心(通常是碳原子)是亲核加成反应的第一步。
亲核试剂的正电荷亲密接触到亲电中心,形成一个新的化学键。
亲核试剂的反应活性基团(如氢、氧、卤素等)与亲电中心形成共价键。
2. 中间物的转变中间物的转变是亲核加成反应的第二步。
在中间物转变过程中,通常发生一系列的质子转移、断裂和重组步骤。
这些步骤可能涉及过渡态的形成和裂解,从而改变化合物的结构。
二、典型亲核加成反应案例以下是几种常见的亲核加成反应,以展示亲核加成反应的机理。
1. 酯的水解反应酯的水解反应是一种典型的亲核加成反应。
在碱性条件下,水分子作为亲核试剂攻击酯的羰基碳,在酸催化下进行酯的水解反应。
反应过程中,产生的中间物经过质子转移和断裂反应后,生成酸和醇。
2. 溴代烃的亲核取代反应在碱性条件下,亲核试剂(如氢氧化钠)攻击溴代烃中的溴原子,形成亲核取代产物。
此过程中,亲核试剂中的氧原子攻击溴原子,形成碳氧双键,然后其他基团进行重排,最终生成相应的取代产物。
3. 醛/酮的亲核加成反应醛和酮是常见的亲电中心,可以与亲核试剂发生亲核加成反应。
例如,醛和酮可以与氢氰酸反应形成氰醇化合物。
在这个过程中,氰离子作为亲核试剂攻击醛或酮的羰基碳,形成碳氮键,同时产生一个羟基。
4. 酸催化的醇与双键的加成反应在酸催化下,醇可以与烯烃中的双键发生亲核加成反应。
在反应过程中,醇中的氧原子攻击烯烃的亲电中心,形成一个新的碳氧键。
此外,酸催化也可促进醇与烯烃的异构化反应,产生具有不同结构的化合物。
总结:亲核加成反应是有机化学中常见的反应类型,可以用于合成新的有机分子。

有机化学中的亲核加成与消除反应亲核加成和消除反应是有机化学中两种重要的反应类型,广泛应用于有机合成、药物化学、材料科学等领域。
本文将对亲核加成和消除反应的概念、机理和应用进行介绍。
一、亲核加成反应亲核加成反应是指亲核剂(也称为亲核物质)与电子不足的亲电试剂发生反应,亲核剂的亲电性中心攻击亲电试剂上的正电子中心,形成新的化学键。
常见的亲核加成反应有醇与卤代烃的反应、醛或酮与亲核试剂的反应等。
1. 醇与卤代烃的反应醇与卤代烃的反应是亲核加成反应中的一种常见类型。
在此反应中,醇中的氧原子攻击卤代烃中的卤原子,生成醚化合物。
例如,乙醇与溴甲烷反应可得到乙基溴化物。
2. 醛或酮与亲核试剂的反应醛或酮与亲核试剂的反应也是亲核加成反应的一种重要类型。
在这类反应中,亲核试剂的亲电性中心攻击醛或酮分子中的羰基碳原子,形成新的化学键。
例如,丁酮与甲胺反应可得到丁酮胺。
二、消除反应消除反应是指一个分子中两个基团之间的共价键发生断裂,形成另外两个分子。
消除反应可以分为酸性消除和碱性消除两种类型。
1. 酸性消除酸性消除是指在酸性条件下,分子中的负电荷离子与负电荷中心形成的碳阳离子相互消除。
酸性消除是有机化学中最常用的消除反应之一。
例如,酮中的α-碳上的氢可以被酸催化的消除剂(如氢气和铂催化剂)去除,生成烯烃。
2. 碱性消除碱性消除是指在碱性条件下,负电中心与负电荷离子形成的碳阴离子相互消除,产生另外两个分子。
例如,醇中的β-羟基在碱性条件下可以消除,生成烯烃。
三、应用亲核加成和消除反应在有机合成中有着广泛的应用。
它们可以用于构建碳-碳和碳-氧化学键,实现分子结构的定向调整和功能的引入。
通过选择不同的反应条件和催化剂,可以实现对化合物结构和立体化学的精确控制。
此外,亲核加成和消除反应还常用于药物化学和材料科学领域。
在药物合成中,这些反应可以用于构建具有特定生物活性的分子骨架。
而在材料科学中,亲核加成和消除反应则被应用于构建高分子聚合物和功能性材料的合成。

有机化学中的亲核加成反应反应机制和应用亲核加成反应是有机化学中一种重要的反应类型,它在有机分子的构建和合成中具有广泛的应用。
亲核加成反应通常由一个亲核试剂和一个电荷亲和性较强的底物(通常是电子不足的烯烃或亚稳的阳离子)进行反应,最终形成一个新的化学键。
本文将介绍亲核加成反应的反应机制和一些常见的应用。
一、加成反应的机理亲核加成反应的机理可以分为两步:亲核试剂与底物的相互作用,以及生成产物。
1. 亲核试剂与底物的相互作用亲核试剂与底物发生相互作用的过程中,亲核试剂中的亲核性基团(通常是负离子或带有孤对电子的中性分子)攻击底物中的电子云不足的中心,形成较稳定的中间体。
2. 生成产物通过重新组合键,产生加成产物。
这个步骤的具体机理取决于试剂和底物的性质,可能包括质子转移、环闭合、重排等。
二、亲核加成反应的应用亲核加成反应在有机化学中有着广泛的应用,下面将介绍几个常见的应用领域。
1. 合成有机化合物亲核加成反应是有机合成中最常用的反应类型之一。
通过选择不同的亲核试剂和底物,可以合成各种结构和功能的有机化合物,如醇、醛、酮等。
例如,醇和酸酐之间的酯化反应就是一种亲核加成反应。
2. 制备药物亲核加成反应在合成药物中有着重要的应用。
许多药物的合成步骤中都包含亲核加成反应,用于构建药物分子的关键骨架和功能基团。
例如,合成乙酰水杨酸的反应中,苯酚与乙酰氯的亲核加成反应是一个关键步骤。
3. 制备橡胶和合成纤维亲核加成反应也被广泛用于生产橡胶和合成纤维。
例如,合成氨纶的过程中使用的底物与亲核试剂之间发生亲核加成反应,形成聚合物链的骨架,从而得到弹性优良的合成纤维。
4. 天然产物的合成亲核加成反应在天然产物合成领域也发挥着重要的作用。
通过亲核试剂与底物的反应,可以合成具有天然产物活性的复杂有机结构。
例如,弗里德尔-克拉夫茨反应是天然二萜类化合物合成中常用的亲核加成反应。
总结:亲核加成反应是有机化学中常见的反应类型,它通过亲核试剂与底物的相互作用,生成具有新化学键的产物。
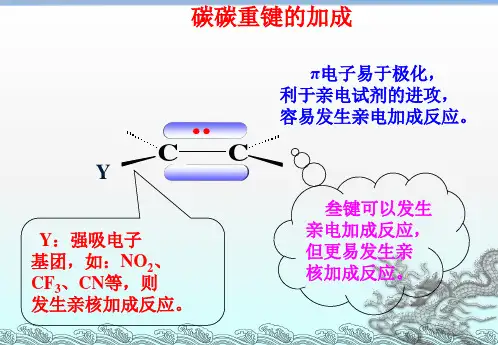
高等有机化学第七章亲核加成反应食品学院应用化学系郑福平杨绍祥第七章亲核加成反应一、碳-碳双键的亲核加成反应二、碳-碳三键的亲核加成反应三、羰基亲核加成反应四、羧酸衍生物与亲核试剂的反应五、金属氢化物与羰基的亲核加成反应六、α,β-不饱和羰基化合物的亲核加成反应七、碳-氮重键的亲核加成反应八、分子内的自催化亲核加成反应2一、碳吸电子取代基(一)氰乙基化反应(二)Micheal二、碳C CC正电荷处于p轨道属于杂化碳电负性大,难以容纳正电荷。
叁键比双键易于亲核加成的原因1. 碳原子杂化状态不同。
叁键碳sp杂化,双键碳sp2杂化。
叁键碳s轨道成分多,电子云更靠近原子核,不易给出电子,易接受电子。
2. 亲核加成活性中间体稳定性不同。
决定性作用。
12三、羰基亲核加成反应15(一)羰基的亲核加成反应历程酸除了使羰基质子化外,还能与羰基形成氢键:2注意:不论是酸还是碱催化的反应,控制反应速度的一步都是亲核试剂进攻碳原子这一步,故它们都是亲核加成。
19(二)影响羰基亲核加成反应的因素当(2)2.(3)(三)羰基加成反应中立体化学(四)羰基化合物的亲核加成反应实例1、杂原子亲核试剂的加成除NaHSO外,一般K<1。
3许多羰基化合物与含杂原子亲核试剂发生不同程度的加成。
半缩醛(酮)天然产物中有重要作用。
链状K<1,环状K>1(葡萄糖,开链式占0.003%,主要以α和β-吡喃环式存在。
)31①39醛:第一步负碳离子的生成为速控步骤,第二步为快反应,第一步不可逆。
酮:速控步骤为第二步。
C -进攻酮比进攻醛羰基碳难得多。
碱催化利于有醛的缩合,而不利于酮的缩合。
②四、羧酸衍生物与亲核试剂的反应(二)结构与活性的关系作为酰基化试剂,其活性为:RCOCl>RCOSR'>(RCO)2O>RCOOR>RCONH2 X: 具有-I效应,C-Cl键的极性大。
酯中烷氧基具有+C效应,增大了酰基与烷氧基间的电子云密度,使酰氧键难于断裂。
高等有机化学第七章亲核加成反应食品学院应用化学系郑福平杨绍祥第七章亲核加成反应一、碳-碳双键的亲核加成反应二、碳-碳三键的亲核加成反应三、羰基亲核加成反应四、羧酸衍生物与亲核试剂的反应五、金属氢化物与羰基的亲核加成反应六、α,β-不饱和羰基化合物的亲核加成反应七、碳-氮重键的亲核加成反应八、分子内的自催化亲核加成反应2一、碳吸电子取代基(一)氰乙基化反应(二)Micheal二、碳C CC正电荷处于p轨道属于杂化碳电负性大,难以容纳正电荷。
叁键比双键易于亲核加成的原因1. 碳原子杂化状态不同。
叁键碳sp杂化,双键碳sp2杂化。
叁键碳s轨道成分多,电子云更靠近原子核,不易给出电子,易接受电子。
2. 亲核加成活性中间体稳定性不同。
决定性作用。
12三、羰基亲核加成反应15(一)羰基的亲核加成反应历程酸除了使羰基质子化外,还能与羰基形成氢键:2注意:不论是酸还是碱催化的反应,控制反应速度的一步都是亲核试剂进攻碳原子这一步,故它们都是亲核加成。
19(二)影响羰基亲核加成反应的因素当(2)2.(3)(三)羰基加成反应中立体化学(四)羰基化合物的亲核加成反应实例1、杂原子亲核试剂的加成除NaHSO外,一般K<1。
3许多羰基化合物与含杂原子亲核试剂发生不同程度的加成。
半缩醛(酮)天然产物中有重要作用。
链状K<1,环状K>1(葡萄糖,开链式占0.003%,主要以α和β-吡喃环式存在。
)31(2)①39醛:第一步负碳离子的生成为速控步骤,第二步为快反应,第一步不可逆。
酮:速控步骤为第二步。
C -进攻酮比进攻醛羰基碳难得多。
碱催化利于有醛的缩合,而不利于酮的缩合。
②四、羧酸衍生物与亲核试剂的反应(二)结构与活性的关系作为酰基化试剂,其活性为:RCOCl>RCOSR'>(RCO)2O>RCOOR>RCONH2 X: 具有-I效应,C-Cl键的极性大。
酯中烷氧基具有+C效应,增大了酰基与烷氧基间的电子云密度,使酰氧键难于断裂。
亲核反应的五种反应名称亲核反应是有机化学中常见的一种反应类型,它涉及到亲电子的攻击和亲核试剂的参与。
根据亲核试剂的性质和反应机理的不同,亲核反应可以分为以下五种反应。
1. 亲核取代反应(Nucleophilic Substitution Reaction)亲核取代反应是最常见的亲核反应类型之一。
在亲核取代反应中,亲核试剂攻击一个含有亲电子的基团,将其替换掉。
常见的亲核取代反应包括SN1和SN2反应机理。
2. 亲核加成反应(Nucleophilic Addition Reaction)亲核加成反应中,亲核试剂与含有多键(通常是双键或三键)的官能团发生反应,形成一个新的化合物。
亲核试剂通常通过给予亲电子中心以亲电子形式进行反应。
3. 亲核消除反应(Nucleophilic Elimination Reaction)亲核消除反应涉及到亲核试剂与含有一对相邻碳原子之间的键的官能团发生反应。
在这种反应中,亲核试剂不仅与官能团发生反应,还通过攻击相邻的碳原子断裂化学键,从而使得官能团消失。
4. 亲核加合反应(Nucleophilic Addition-Elimination Reaction)亲核加合反应结合了亲核加成和亲核消除两种反应类型。
在亲核加合反应中,亲核试剂首先与含有多键的官能团发生加成反应,然后通过消除反应使得官能团发生重新排列。
5. 亲核环化反应(Nucleophilic Cyclization Reaction)亲核环化反应是一种特殊的亲核反应,发生在含有适当官能团的分子中。
在这种反应中,亲核试剂与官能团内的一个亲电子中心发生反应,形成一个新的环状结构。
这五种亲核反应在有机合成中起着非常重要的作用,能够构建复杂的有机分子结构,并提供了合成有机化合物的有效途径。
在实际应用中,化学家们常常根据反应条件和所需产物的特性选择适当的亲核反应类型进行研究和应用。