第9章亲核加成反应
- 格式:ppt
- 大小:890.00 KB
- 文档页数:46
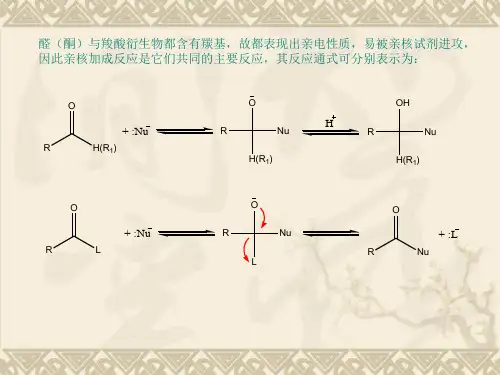
1. 重要的亲核加成反应(1) 加氰化氰 醛、脂肪族甲基酮和含8个碳以下的脂环酮都可以加氰化氢,生成氰醇(α-羟基腈)。
CO CHCNα-羟基腈实验证明碱对这个反应的影响颇大。
例如,丙酮和氰化氢作用,不加任何催化剂,3至4小时内只有50%的丙酮起反应;当加入一滴氢氧化钠溶液,反应在两分钟内完成。
若加入酸,反应速度减慢;加入较多的酸,放置几个星期也不反应;因为氢氰酸是弱酸,酸或碱的存在将直接影响它的电离平衡。
+H+--C O H HHNCN+加入碱,平衡向右移动,CN -的浓度增加;加入酸,平衡向左移动,CN -的浓度降低。
这些事实说明在丙酮与氰化氢的反应中起决定作用的是CN -本身的性质和浓度。
醛、酮加氰化氢的反应是可逆的,亲核试剂是CN -,其历程可以表示如下:反应分两步进行,第一步是CN -进攻羰基碳,生成氧负离子中间体。
这是个慢步骤,也是决定速度的步骤。
第二步是氧负离子中间体和质子结合,形成氰醇,这是个快步骤。
醛、酮和氰化氢直接加成反应的产率较好,但是氰化氧有剧毒,且挥发性大(沸点26.5℃)。
使用起来不安全。
为了避免反应中直接使用氰化氢,一般采用醛或酮与氰化钾(钠)的水溶液混合,然后加入无机酸,使氰化氢一旦生成立即和醛或酮作用。
.但在加酸时应控制溶液的pH 值,使之始终偏于碱性(pH ≌8),以利于反应的进行。
醛、酮加氰化氢在有机合成中很有实用价值。
它是增长碳链的一种方法;此外加成物含有双官能团,是一类较活泼的化合物,可进一步转化为多种其它化合物。
例如:CH 3CH 3CH 2CH 3CH 3CH3CH 333)2CCH 2NH 2CH 33CO H O H O+C H C O O HNCNCO CCHO C H +O,Δα-甲基丙烯酸甲酯(90%) α-甲基丙烯酸甲酯是合成有机玻璃——聚α-甲基丙烯酸甲酯的单体。
C R R R`δ+O H ()+--慢快C H H NCN +R`)H (-C R O CN R`)H ((2)加亚硫酸氢钠 大多数醛、脂肪族甲基酮和8个碳以下的脂环酮与亚硫酸氢钠饱和溶液(40%)加成,生成白色的α-羟基磺酸钠晶体。


亲核加成反应机理一、介绍亲核加成反应是有机化学中一种重要的反应类型。
它通过亲核试剂攻击电荷不饱和的碳原子,形成新的碳-亲核键,并伴随有官能团的转换。
本文将对亲核加成反应的机理进行全面、详细、完整且深入地探讨。
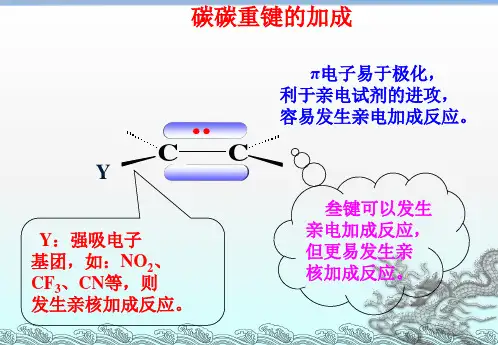
二、亲核加成反应概述亲核加成反应是一类重要的有机化学反应,其主要特点是用亲核试剂攻击双键或三键上的电子,形成新的化学键。
亲核试剂可以是阴离子、中性分子或阳离子。
在亲核加成反应中,亲核试剂通常经历亲核进攻、负离子重排和质子化等阶段。
1. 亲核进攻亲核试剂在亲核加成反应中起到亲核进攻的作用。
通常情况下,亲核试剂具有可用的自由电子对,能与电子不足的碳原子形成新的化学键。
亲核进攻的速率和选择性受到亲核试剂的性质、反应条件和底物的结构等因素的影响。
2. 负离子重排在某些亲核加成反应中,亲核试剂的亲核进攻会导致反应过渡态产生负电荷,形成负离子。
负离子重排是亲核加成反应中的一个重要步骤,可以通过改变碳原子的排列顺序来稳定负离子。
3. 质子化质子化是亲核加成反应中的最后一个阶段,通过给亲核试剂或负离子成员质子化,使反应产物获得更稳定的结构。
质子化通常发生在负离子重排之后。
三、亲核加成反应的分类亲核加成反应可根据亲核试剂和底物的不同进行分类。
下面将对几种常见的亲核加成反应进行介绍。
1. 碱性条件下的亲核加成反应在碱性条件下,亲核试剂通常是醇、酚、胺等带有孤对电子的化合物。
这类亲核试剂能够与电荷不饱和的碳原子形成新的化学键。
碱性条件下的亲核加成反应常用于合成醇、酚、胺等化合物。
2. 酸性条件下的亲核加成反应在酸性条件下,亲核试剂通常是具有孤对电子的阴离子,如卤素离子、亚硫酸根离子等。
酸性条件下的亲核加成反应可以用于合成卤代烷、磺酸酯等化合物。
3. 中性条件下的亲核加成反应在中性条件下,亲核试剂通常是中性分子,如水、醛、酮等。
中性条件下的亲核加成反应常用于合成醇、酮等化合物。
四、亲核加成反应的机理解析1. 碱性条件下的亲核加成反应机理以醇作为亲核试剂为例,碱性条件下的亲核加成反应机理如下:1.酸性条件下,氧上的醇质子化生成质子化醇。



亲核加成反应例子
1. 嘿,你知道吗,醛和酮与氢氰酸的反应就是亲核加成反应的典型例子呀!就像苹果遇到了喜爱它的人,氢氰酸这个小家伙迅速地向醛或酮跑去,结合在一起。
比如乙醛和氢氰酸反应生成乙腈醇,这多神奇呀!
2. 哇塞,还有格氏试剂和羰基化合物的反应呢!这就好比两个好朋友找到了最佳组合,互相成就。
像是甲基碘化镁和丙酮反应生成叔丁醇,多有意思啊!
3. 哎呀呀,水和羰基化合物的加成也是哦!把水想象成一个热情的拥抱者,紧紧抱住羰基化合物。
例如甲醛和水反应生成甲醇,这过程不是很奇妙吗?
4. 嘿,别忘了氢卤酸和烯烃的加成呀!这就好像一场精彩的追逐赛,氢卤酸努力地去和烯烃结合。
像丙烯和氯化氢反应生成氯丙烷,超酷的呢!
5. 哟呵,醇和羰基化合物的反应也得算上呀!好比两个合作伙伴,一拍即合。
就像乙醇和乙醛反应形成半缩醛,这多让人惊叹!
6. 哈哈,亚硫酸氢钠和醛、酮的反应也很典型呢!这就像一场特别的相遇,产生独特的结果。
比如说苯甲醛和亚硫酸氢钠反应生成苯甲醛亚硫酸氢钠加成物,是不是很特别呀!
7. 哇哦,有机金属化合物和不饱和化合物的反应也是呢!就如同两块拼图完美地契合。
像二甲基铜锂和丙烯反应生成丁烷,是不是很神奇呢!我觉得亲核加成反应真的是化学世界里超级有趣和奇妙的一部分呀!。


第九章 醛和酮 亲核加成反应第一节 结构、命名和物理性质一、醛和酮的定义醛和酮都是分子中含有羰基(碳氧双键)的化合物,因此又统称为羰基化合物。
羰基与一个烃基相连的化合物称为醛(甲醛与两个氢相连),与两个烃基相连的称为酮。
CO R'CR O HCR(H)O羰基 醛 酮二、醛和酮结构羰基是醛、酮的特征官能团。
羰基碳原子是sp 2杂化的,即碳原子以三个sp 2轨道与其它三个原子的轨道重叠形成三个σ键,碳原子上未参加杂化的p 轨道与氧原子上的p 轨道侧面重叠形成一个π键。
由于氧原子的电负性比碳原子大,故碳氧双键电子云偏向于氧原子,使氧原子带负电荷(δ-),而碳原子带正电荷(δ+),易被亲核试剂进攻发生亲核加成反应;由于羰基的吸电子作用,羰基的α-H 活性增强,表现出α-H 的酸性,进而发生羟醛缩合,卤代等反应。
此外,醛、酮还可以发生氧化、还原反应及其它一些反应。
醛、酮的结构与化学性质关系如下:CH R'H (H)R羰基的还原反应羰基的亲核加成反应醛的氧化反应H 的反应三、醛和酮的分类和命名(一)分类醛和酮根据烃基结构类型,可分为脂肪和芳香醛、酮;根据烃基的饱和程度,又分为饱和与不饱和醛、酮;根据羰基的数目,还分为一元、二元和多元醛、酮。
(二)命名 1.普通命名法结构简单的醛、酮,可采用普通命名法命名。
醛按分子中含有的碳原子数称为“某醛”,芳基作为取代基;酮则根据羰基所连的两个烃基来命名,简单的烃基放前,复杂的烃基在后,最后加“酮”字来命名。
2.系统命名法结构复杂的醛、酮主要采用系统命名法。
即选择含有羰基的最长碳链为主链,从距羰基最近的一端编号,由于醛基总是位于碳链的一端,不用标明醛基的位次,但酮的羰基位于碳链中间,位次必须标明。
将取代基的位次和名称放在母体名称前。
芳香烃基总是作为取代基。
多元醛、酮命名时,应选取含羰基尽可能多的碳链为主链,注明羰基的位置和数目。
不饱和醛、酮,应选择连有羰基和不饱和键在内的最长碳链做主链,并使羰基编号最小。

亲核加成反应影响因素以亲核加成反应影响因素为题,我们来讨论一下影响亲核加成反应速率的因素。
亲核加成反应是有机化学中一种常见的反应类型,它是指亲核试剂与电子不足的亲电试剂之间发生的反应。
亲核试剂通过给予电子形成键,而亲电试剂则通过接受电子形成键。
亲核加成反应速率的高低受到多种因素的影响。
化学反应速率与反应物浓度之间存在着关系。
亲核加成反应中,反应物的浓度越高,反应速率就越快。
这是因为反应物浓度的增加会增加反应物之间的碰撞频率,从而促进反应的进行。
温度也是影响亲核加成反应速率的重要因素之一。
一般来说,温度的升高会导致反应速率的增加。
这是因为温度的升高会增加反应物的动能,使得反应物之间的碰撞更加频繁和剧烈,从而增加反应速率。
溶剂的选择也会对亲核加成反应速率产生影响。
不同的溶剂对亲核试剂和亲电试剂的溶解度和反应物之间的相互作用有不同的影响。
有些溶剂具有良好的溶解性和稳定性,能够促进反应的进行,从而提高反应速率;而有些溶剂则可能对反应物产生不利影响,降低反应速率。
催化剂的加入也可以显著影响亲核加成反应速率。
催化剂是能够提供新的反应路径,降低反应活化能的物质。
通过催化剂的作用,亲核加成反应可以在较低的能量条件下进行,从而提高反应速率。
反应条件和反应物的结构也会对亲核加成反应速率产生影响。
例如,反应物的电子密度和反应中心的亲电性等因素都会影响反应速率。
另外,反应条件如pH值、氧气含量等也可能对反应速率产生影响。
亲核加成反应速率受到多种因素的影响,包括反应物浓度、温度、溶剂选择、催化剂的加入、反应条件和反应物的结构等。
在实际化学合成中,了解这些因素对反应速率的影响,可以帮助我们优化反应条件,提高反应效率。