植物激素突变体研究
- 格式:pdf
- 大小:403.69 KB
- 文档页数:6

赤霉素及其生理作用研究进展摘要:赤霉素(GAs)是高等植物体内调节生长的重要激素。
现就赤霉素的结构、种类,生物合成过程和生理作用研究进展进行综述。
关键词:赤霉素生物合成生理作用概述赤霉素(gibberellin,GA),是广泛存在于植物界,在被子植物、裸子植物、蕨类植物、褐藻和绿藻中被发现的植物激素。
它的发展要追溯到1926年日本热门黑泽英一对水稻恶苗病的研究。
黑泽英一发现,当水稻感染了赤霉菌后,会出现植株疯长的现象,病株往往比正常植株高50%以上,而且结实率大大降低,因而称之为“恶苗病”。
科学家将赤霉菌培养基的滤液喷施到健康水稻幼苗上,发现这些幼苗虽然没有感染赤霉菌,却出现了与"恶苗病"同样的症状。
1938年日本薮田贞治郎和住木谕介从赤霉菌培养基的滤液中分离出这种活性物质,并鉴定了它的化学结构。
命名为赤霉酸。
1956年C.A.韦斯特和B.O.菲尼分别证明在高等植物中普遍存在着一些类似赤霉酸的物质。
到1983年已分离和鉴定出60多种。
一般分为自由态及结合态两类,统称赤霉素,分别被命名为GA1,GA2等。
结构和种类赤霉素都含有赤霉素烷(gibberellance)骨架,它的化学结构比较复杂,是双萜化合物。
在高等植物中赤霉素的最近前体一般认为是贝壳杉烯。
赤霉素的基本结构是赤霉素烷,有4个环。
在赤霉素烷上,由于双键、羟基数目和位置不同,形成了各种赤霉素[2]。
自由态赤霉素是具19C或20C的一、二或三羧酸。
结合态赤霉素多为萄糖苷或葡糖基酯,易溶于水。
赤霉素的生物合成种子植物中赤霉素的生物合成途径,根据参与酶的种类和在细胞中的合成部位,大体分为三个阶段,一、二、三阶段分别在质体、内质网和胞质溶胶中进行。
1)从异戊烯焦磷酸(isopentenyl pyrophosphate)到贝壳杉烯(ent-kaurene)阶段此阶段在质体中进行,异戊烯焦磷酸是由甲瓦龙酸(mevalonic acid,MVA)转化来的,而合成甲瓦龙酸的前体物为乙酰-CoA。



2009年4月JOURNALOFBIOI。
OGYApr,2009doi:lO.3969/j.issn.1008—9632.2009.02.043植物激素受体研究进展赵丽1,黄海杰2,田维敏(1.中国热带农业科学院橡胶研究所热带作物栽培生理学重点实验室,海南儋州571737;2.中国热带农业科学院热带生物技术研究所,海南海口571101)摘要:植物激素对植物的生长发育以及在植物应对逆境方面具有重要的调节作用,植物激素受体是植物激素信号转导途径中的一个关键环节,倍受关注。
近年来,由于生物化学与分子生物学和遗传学结合,使得植物激素受体的研究取得了很大进展。
综述了5种经典植物激素受体以及油菜素内酯和茉莉酸受体在生物化学、遗传学和分子生物学三个层面上的研究成果,旨在为进一步研究植物激素作用机制提供参考资料。
关键词:植物激素;受体;突变体中图分类号:Q946.885文献标识码:A文章编号:1008—9632(2009)02—0043—05植物激素受体是植物激素信号传导途径中的一个至关重要的环节。
近年来,采用生物化学、遗传学和分子生物学相结合的研究手段,主要以拟南芥、番茄和烟草等为材料,在植物激素受体的分离鉴定和作用机理方面的研究取得了很大进展。
本文综述这方面的研究成果,旨在为迸一步研究植物激素作用机制提供参考资料。
1生长素受体研究进展虽然早就认识到生长素及其对植物生长发育的调节作用,但直到最近才证明TIRl(Transportinhibitorre-spensel)是生长素的受体。
TIRl蛋白是由TIRl基因编码的一种F.box蛋白,含有594个氨基酸残基,由N端的一个F.box模式、一段短的约40个氨基酸残基的间隔区域(spacerregion)、16个简并的LRRs(1eucine—richrepeats)和一个C端约70氨基酸残基的尾巴构成。
其中N端的75个氨基酸(包括F—box序列)是TIRl同IAA结合所必需的,推测这段序列直接控制TIRl同IAA和Aux/IAA蛋白的结合。

从19世纪中叶起,生物学研究逐渐由表及里,向理解生命现象的内在规律,探索生命过程的运行机理深入。
越来越多的化学分析,物理检测手段被运用于生物学实验中。
通过实验的严格设计和精心安排,展开对生命活动运行规律的探究。
目前,生物高考试题也较常使用标志性生物实验作为试题背景模型考查相关重要知识点,而且越来越多地要求大家自行组织科学的生物语言主观作答。
对于结果比较类的实验题型,准确寻找到题干内的变量信息,将是破解出题意图、并正确答题的重要手段。
一般而言,实验结果常见呈现形式有坐标曲线、直方图形、表格形式、文字描述等方式。
通过对上述实验结果的阅读理解,我们应该快速提取出其中的自变量(又名实验变量,既实验中由实验者所操纵的因素或条件)和因变量(又名反应变量,既实验中由于自变量而引起的变化和结果)。
确认变量之后,比较不同因变量的对应自变量,找出变化规律,结合所学知识点,归纳导致不同结果出现的根本性差异,即可准确理解试题,进而开始作答。
下面用两个典型例题,带领大家熟悉此类试题的解题过程。
例1 植物激素突变体是研究植物激素合成、代谢途径以及生理功能的重要实验材料。
某课题组为了研究生长素和赤霉素对遗传性矮生豌豆的作用效应,将适宜浓度的生长素和赤霉素,以及清水分别喷施到5个不同突变体(生长速率分别为lg1.2、lg1.4、lg1.6、lg1.8、lg2.0/毫米/7天)的矮生豌豆幼苗上,实验结果如图。
根据实验结果,你能得出哪些结论?解析 本例题中,实验结果的呈现形式为坐标曲线图。
其中,③是喷施清水正常生长的对照组,并以对照组豌豆幼苗的生长高度作为参照,标记为100%。
②与①分别对应喷施生长素和赤霉素的豌豆幼苗组。
根据我们前面介绍过的,变量是指在实验中影响实验结果的因素或条件,而实验的目的就在于捕获、解释自变量和因变量之间的前因后果。
据题分析,可以得知,本实验的自变量有两个,一是不同生长速率的突变体;二是喷施试剂的种类(赤霉素、生长素和清水)。

植物生长调控中关键基因的研究植物生长调控,是指植物在生长发育过程中,受到多种内外环境因素的影响,从而产生某些生理和形态变化的一种生命活动过程。
这个过程涉及到许多复杂的分子机制和信号转导通路,而关键基因的研究则是深入探究植物生长调控的重要途径之一。
一、关键基因是什么?在基因层面上,我们可以将关键基因定义为对于某些生命过程或特定的表型特征,其突变或缺失会对这些生命过程或表型特征产生显著影响的基因。
考虑到植物生长调控可能涉及到诸如营养吸收、细胞分裂、植物内部激素的合成、转运等方面的调节,而其中有很多基因的确是关键基因,如ABA信号通路中的ABI5、植物生长素信号通路中的ARF和IAAs等等。
二、关键基因研究手段虽然基因编辑等新技术的引入将基因研究的可行性大幅提高,但在关键基因研究方面,经典遗传学的手段仍然是十分重要的。
这主要包括突变体筛选、遗传连锁分析等。
比如,发掘某些影响植物内部激素运输的关键基因,就需要从突变体库中进行筛选。
在筛选过程中,科学家们会对突变体进行全部鉴定,寻找那些表现异常的植株,从而找到对植物生长调控有显著作用的关键基因。
三、生长调控中的关键基因举例1.在植物生长发育的不同阶段,细胞壁松弛蛋白都会发挥不同的生理功能。
而对于参与细胞壁新生的细胞壁松弛酶家族基因而言,研究发现它们突变后会影响细胞壁合成,进而影响整个细胞的生长发育。
2.SNF1-related protein kinase (SnRK1)在ABA途径中起着十分重要的作用,能够负调控ABA信号通路。
3.在植物内部激素维持的平衡中,关键基因IAA和ARF分别在生长素的合成和感应过程中发挥着重要作用。
研究发现生长素的一次合成步骤中,ARF3和ARF4是十分关键的调控节点。
综上,植物生长调控是一个非常复杂的生命过程,而关键基因研究正是在探究这个生命过程的机制。
通过遗传学手段的筛选和突变技术,作为预测调节植物生长发育有深远意义的关键基因,已经在植物科研领域中显示出了广泛的应用价值,为我们更好地理解植物生命活动的本质提供了有力依据。

南充市高中2012级第二诊断考试生物试题一、选择题(本大题共7小题,每小题6分,共42分。
在每小题给出的四个选项中,只有一个选项最符合题目要求。
)1.右图表示人体中巨噬细胞吞噬、清除衰老红细胞的过程。
相关叙述错误的是( )A.结构②为溶酶体,是由结构①以出芽的形式形成的B.吞噬泡与结构②的融合体现生物膜的流动性C.巨噬细胞识别衰老的红细胞与细胞膜表面的糖蛋白有关D.结构②中的水解酶将吞噬泡中的蛋白质、RNA、DNA等水解2.2014年,非洲地区爆发新一轮的埃博拉疫情。
其病原体为埃博拉病毒。
下列有关埃博拉病毒的叙述中不正确的是( )①为获得大量埃博拉病毒用于研究,可以用培养基在体外培养;②该病毒的遗传物质是DNA 和RNA;③该病毒结构简单,没有任何细胞器;④该病毒增殖时,遗传信息和氨基酸等原料由宿主细胞提供;⑤该病毒主要由蛋白质和核酸组成,是最小的生命系统A. 2项B.3项C.4项D.5项3.某雄性动物的基因型为AaBb。
右图是其一个精原细胞减数分裂过程中的两个不同时期细胞分裂图像。
有关该精原细胞及其分裂过程叙述正确的是( )A.图甲所示细胞处于减数第一次分裂过程中B.该精原细胞在分裂过程中发生了基因突变C.所产生的精细胞的基因型分别为ab、ab、AB、ABD.分裂过程中,基因A、a、b、b可能移向细胞同一极4.下列关于生物进化的说法,正确的是( )A.生物进化的实质是种群基因频率的改变,随机交配对种群的基因频率没有影响B.二倍体西瓜经过秋水仙素处理成为四倍体,证明了新物种的形成不一定需要隔离C.生物多样性的形成也就是新的物种不断形成的过程D.“超级细菌”的产生说明抗生素的滥用会促使细菌发生基因突变5.植物激素突变体是研究植物激素合成、代谢途径以及生理功能的重要实验材料。
某课题组为了研究生长素和赤霉素对遗传性矮生植物的作用效应,将适宜浓度的生长素和赤霉素分别喷施到 5 个不同突变体(生长速率分别为 lg1.2,lg1.4,lg1.6,lg1.8,lg2.0 毫米 /7 天)的矮生豌豆幼苗上,实验结果如图。
高考生物专题练习植物激素调节一、选择题1.通常,叶片中叶绿素含量下降可作为其衰老的检测指标。
为研究激素对叶片衰老的影响,将某植物离体叶片分组,并分别置于蒸馏水、细胞分裂素(CTK)、脱落酸(ABA)、CTK+ABA溶液中,再将各组置于光下。
一段时间内叶片中叶绿素含量变化趋势如图所示。
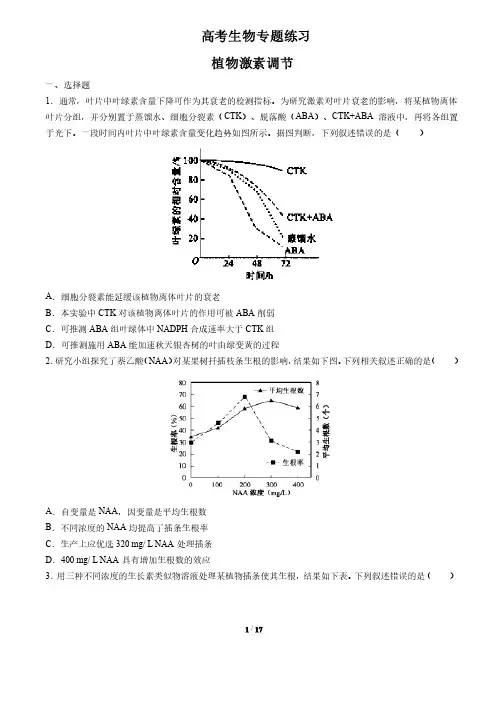
据图判断,下列叙述错误的是( )A.细胞分裂素能延缓该植物离体叶片的衰老B.本实验中CTK对该植物离体叶片的作用可被ABA削弱C.可推测ABA组叶绿体中NADPH合成速率大于CTK组D.可推测施用ABA能加速秋天银杏树的叶由绿变黄的过程2.研究小组探究了萘乙酸(NAA)对某果树扦插枝条生根的影响,结果如下图。
下列相关叙述正确的是( )A.自变量是NAA,因变量是平均生根数B.不同浓度的NAA均提高了插条生根率C.生产上应优选320 mg/ L NAA处理插条D.400 mg/ L NAA具有增加生根数的效应3.用三种不同浓度的生长素类似物溶液处理某植物插条使其生根,结果如下表。
下列叙述错误的是( )1 / 17组别组别 清水清水 浓度a 浓度b 浓度c平均生根数 1529387A .实验中用于扦插的枝条可能带有芽或幼叶B .实验结果表明促进插条生根的最适浓度是浓度bC .该生长素类似物对插条生根的作用具有两重性D .插条的长势、处理时间的长短等属于本实验的无关变量4.不同浓度的生长素影响某植物乙烯生成和成熟叶片脱落的实验结果如图所示。
下列有关叙述正确的是( )A .该实验只有脱落率是因变量B .脱落率随生长素和乙烯浓度增加而不断提高C .该实验不能证明生长素是通过乙烯而影响叶片脱落率D .图可推知生产上喷施高浓度乙烯利能降低脱落率5.下列甲、乙、丙三图分别表示有关的生物学过程,相关叙述中正确的是( )A .甲图中生长素浓度小于b 点时促进生长,大于b 点抑制生长B .甲图中,若b 点为茎背光侧的生长素浓度,则c 点不可能为茎向光侧的生长素浓度C .乙图能够正确表示不同器官对生长素的敏感度D .生产上可用一定浓度生长素类似物除去单子叶植物中的双子叶杂草,丙图中曲线1表示单子叶植物表示单子叶植物6.下列有关生物实验及其结果的叙述,正确的是( ) A .用高倍镜观察菠菜叶中的叶绿体,可见其在细胞质中是均匀分布的 B .蛋白质、氨基酸溶液中分别加入双缩脲试剂后都变紫色 C .制作生态缸可观察人工生态系统中群落的演替情况D.相同浓度的NAA(α-萘乙酸)和2,4-D促进同种插条生根的结果一定相同促进同种插条生根的结果一定相同7.下图是植物体内赤霉素(GA)和脱落酸(ABA)的形成过程,下列相关说法不正确的是( )A.GA与ABA的形成途径相似,都受到外界环境的影响B.GA与ABA在植物不同器官和组织中含量不同,但是含量都极低C.GA与ABA有一定的拮抗作用,共同对植物的生长发育起调节作用D.夏季植物体内ABA产生量增加,生长加快;冬季GA量产生增加,生长受抑制量产生增加,生长受抑制8.油菜素内酯(BL)是植物体内的甾醇类激素,科研人员以拟南芥为材料,研究其含量调节机制,做了如下实验:A组 B组处理方法 用5 μmol/L油菜素唑(Brz)处理,分解内源BL用5 μmol/L油菜素唑(Brz)处理,分解内源BL,再用O。

植物激素ABA和GA调控种子休眠和萌发的研究进展江苏农业(JiangsuJ.ofAgr.Sci.),2007,23(4):360—365植物激素ABA和GA调控种子休眠和萌发的研究进展江玲,万建民(南京农业大学作物遗传与种质创新国家重点实验室,江苏省植物基因工程技术研究中心,江苏南京210095)摘要:综述了植物激素脱落酸(Abscisicacid,ABA)和赤霉素(Gibberellinacid,GA)及其相互作用调控种子休眠和萌发过程的研究进展.大量研究结果表明,ABA和GA是种子休眠获得和解除过程中起关键作用的内源信号分子,ABA诱导种胚细胞分裂停止,启动并维持种子休眠,而GA启动和促进种子萌发,两者在调节种子休眠和萌发过程中存在相互拮抗的关系.以糊粉层组织为例,阐述了ABA和GA在调控种子萌发时仪一淀粉酶表达的信号通路.关键词:种子;休眠;萌发;ABA;GA;信号通路中图分类号:$330.2文献标识码:A文章编号:lOOO-444o(2007)04-0360-06 AdvancesinSeedDormancyandGerminationRegulatedbyPlantHor-monesABAandGAJIANGLing,WANJian—min (StateKeyLaboratoryforCropGenetics&GermplasmEnhancement,J mn~uResearchCenterofPlantGeneEngineering,NangAgriculturalUniversit y,Nanfing210095,China)Abstract:Seeddormancyandgerminationplaysakeyroleintheliving,propag ationanddistributionofaplantpop—ulation.PlanthormonesABAandGAareendogenoussignalmoleculesregul atingtheseeddormancyandgermination.ABA inducestheendofthedivisionofembryocellsandinitiatesandkeepsseeddor mancystate,whileGAgeneratesthecontraryactivity,startingandpromotingseedgermination.Aleuronewassetasaexam pletodiscussthesignalpathwayoftheactiva—tionandexpressionofamylasesregulatedbyABAandGA.Keywords:seed;dormancy;germination;ABA;GA;signalpathway种子休眠和萌发是高等植物个体发育中的重要事件,关系到种群的生存,繁衍和分布,具有重要的生态意义.而在农业生产上,种子休眠性过强,会导致田间出苗率降低,出苗参差不齐,以及带来下一季的杂革问题;休眠性过弱,田间易发生穗发芽,降低作物的品质和种子质量.因此深入研究种子休眠和收稿日期:2006-09-04基金项目:国家自然科学基金项目(30471120,30671246);江苏省青年创新人才计划项目(BK2003415);国家”973”计划子课题(2004CB117204);长江学者和创新团队发展计划项目作者简介:江玲(1968一),女,安徽歙县人,博士,教授,从事水稻遗传育种研究.通讯作者:万建民,(Te1*************;(E—mail)**************.en 穗发芽抗性的分子机理,具有重要的理论价值和实践意义.迄今利用大量影响种子休眠和萌发的相关突变体研究发现,在种子休眠获得或解除过程中起关键作用的内源信号分子即是脱落酸(Abscisicacid,ABA)和赤霉素(Gibberellinacid,GA).其中,ABA促进种子贮藏蛋白和脂肪的合成,促进种子脱水耐性和种子休眠的获得,抑制种胚萌发;而GA促进Ot一淀粉酶,核酸酶,蛋白水解酶,A TP酶等的表达,解除种子休眠,促进萌发,种子休眠或萌发取决于这两种激素的平衡.但关于这两种激素相互作用的机理及其调控种子休眠和萌发的信号通路尚不清楚.本文对植物激素ABA和GA及其相互作用调江玲等:植物激素ABA和GA调控种子休眠和萌发的研究进展控种子休眠和萌发过程的研究进展进行综述,并以糊粉层组织为例,对ABA和GA调控OL-淀粉酶表达的信号通路加以阐述.1ABA诱导种胚细胞停止分裂,启动和维持种子休眠种子发育的全过程包括种胚发育和种子成熟两个阶段.种胚发育起始于受精卵的细胞分裂,直至种胚各部分基本建成的心形胚期.在种胚发育后期,多种贮藏物质开始积累,种胚因细胞膨大而逐渐充满整个胚囊.种子成熟阶段受脱落酸信号诱导,细胞分裂停止,贮藏物质进一步积累,获得脱水耐性,种胚进入休眠状态.Wang等的研究结果表明,ABA诱导种胚细胞内依赖周期蛋白的激酶抑制物(Cyclin-dependentkinaseinhibitor,简称ICK1)的表达,使细胞周期停滞于G1期不能进入s期.Liu等报道,番茄ABA缺陷型突变体成熟种子由于缺乏ABA,使胚细胞不能受阻于G1期,直接通过s期后停滞于G2期,因此比野生型种子具有更高比例的G2期细胞(4CDNA),这些例证表明内源ABA是使胚细胞停滞于G1期所必需的信号分子. Karssen等发现拟南芥种胚在成熟过程中出现两个ABA峰,第1个峰来源于母体,第2个峰主要来源于种胚自身的合成,而第2个峰的ABA对抑制拟南芥未成熟胚的萌发极为重要.又如在油菜种子发育后期,ABA峰与未成熟胚的低萌发性有关J.FUS3和LEC基因调节种胚的生长与停滞,这些基因的突变导致种胚和胚乳细胞分裂不停止, 种胚持续生长,Raz等报道在.3和zec突变体种子发育过程中,ABA含量比野生型低3倍,这使其种子表现很高的胎萌性J.在野生型拟南芥种子中,胚性ABA累积,诱导种子进入休眠,并维持休眠状态.比较向日葵_8J,大麦J,白花烟草..的休眠和无休眠种子内源激素的差异,可知种子休眠的维持还与吸胀过程中ABA的重新合成有关.Kawaka. mi等¨发现3个无休眠性的小麦突变体,其ABA含量正常,但其种胚失去对ABA的敏感性,此外lec1突变也严重降低了ABA的敏感性.上述例证表明种胚中ABA含量及其对ABA的敏感性在诱导和维持种子休眠中起着关键作用.种子成熟阶段贮存物质的积累,晚期胚胎发生富集蛋白(Lateembryogenesisabundantprotein, LEA)基因的表达均受到ABA及转录因子的协同调控,这些基因的启动子序列中均含有发育阶段特异的,组织特异的ABA应答元件¨引.通过酵母单杂交技术鉴定了许多与这些启动子相互作用的DNA 结合因子.然而至今,仅对以下6个转录因子进行了遗传分析和功能鉴定14]:ABI3/VP1,ABI4,ABI5, LEC1,LEC2和FUS3,它们均为ABA诱导的或种子特异表达的基因产物,其中ABI3/VP1在种子脱水耐性获得,种子休眠形成等过程中起着关键的调控作用17].ABI3/VP1分别为来自拟南芥和玉米的直系同源基因,其它的直系同源基因还包括水稻OsVP1l1,小麦TaVP1l1,燕麦4,胡萝卜C.ABI3l16]和菜豆pMLFl2..等,它们均激活ABA诱导基因启动子的转录,也作为种子萌发过程基因表达转录的抑制子,VP1抑制功能域与激活域显着不同, 同时,其抑制功能的表达也需要ABA的诱导¨.2GA启动和促进种子萌发萌发过程开始于种子吸水,结束于胚轴伸长及胚根突出种皮.研究发现拟南芥GA缺陷型突变体如gal-3和gal-2的有活力种子在适宜的发芽条件下不能萌发;GA合成抑制剂如Paclobutrazol(pp333)和Uniconazole(S-3307),也抑制种子的萌发,这些实例均表明种子吸胀后胚根突出种皮需要新的GA合成,GA含量的高低决定着种子能否萌发.GA在促进种子萌发中至少起到两种信号作用:第一是软化种胚周围的组织,克服种皮机械限制;第二是促进种胚的生长.在番茄种子中,GA诱导与细胞壁松弛有关的基因如内$-甘露聚糖酶基因,木葡聚糖内转糖基酶/水解酶基因,扩展蛋白基因,13-1,3.葡聚糖酶基因和几丁质酶基因等表达,且其中的某些基因只在与胚根对应的株孔处特异表达.用拟南芥突变体,已鉴定了几种涉及GA信号通路的分子如SPY,RGL1,RGL2,它们均为含DELLA域的家族成员,在依赖GA的种子萌发中起着负调节因子的作用.如spy突变体呈现植株细长,早开花,易萌发的表型,提示SPY在GA介导的茎伸长,种子萌发中起调控作用.3ABA和GA在调控种子休眠和萌发中的互作在控制种子休眠和萌发中,ABA和GA起到相江苏农业2007年第23卷第4期反的作用.Koornneef等报道拟南芥ABA缺陷型突变体种子体眠性降低.Debeaujon等报道GA缺陷型拟南芥突变体种子休眠性增强,需用外源GA才能萌发,而去除种皮可解除这种需要,因为种皮发芽障碍和ABA引起的胚休眠需要GA来克服.ABA和GA双缺陷型突变体种子具有萌发能力,表明种胚中GA与ABA在调节这一过程中存在相互拮抗的关系.在拟南芥中,一个类似扩展蛋白的基因AtEPR1,在萌发种子珠孔末端的胚乳中表达,且其表达只受GA调控,不受ABA的调控¨.在烟草中,GA与种皮,胚乳裂解导致的休眠解除相关,GA促进与休眠解除有关的报告基因B一1,3一葡聚糖酶基因的表达,促进种子萌发,而ABA延迟胚乳裂解,种皮破裂,抑制GLUI基因的诱导,保持种子处于休眠状态.在水稻细长型突变体(slrl突变体)内,具有组成性的GA反应和不依赖于GA的仅一淀粉酶的表达,但这个不依赖GA的表达却被外源ABA所抑制,提示种胚周围组织中GA的作用不能排除在ABA信号之外.此外,在黄杉种子萌发过程中,GA刺激果胶甲酯酶的合成和活性增加,而ABA却起抑制作用.总之,GA有解除种子休眠的作用,ABA有保持种子休眠的作用.种胚中ABA和GA的信号通路非常相似,而且用拟南芥研究的结果显示这两个信号通路间存在很多的相互作用.ABA不敏感性突变体abil一1无休眠性,萌发正常,在这些突变体中进一步筛选到具有休眠性的GA合成或敏感性下降的突变体(如gal,sly1);拟南芥ABA缺限型突变体和ABA不敏感型突变体种子萌发无需GA的作用,此外,提高GA 信号通路的拟南芥SPY1基因的突变,导致对ABA 的敏感性下降.对休眠性降低的拟南芥突变体rdol和rdo2的研究结果表明,突变体ABA含量及对ABA的敏感性并未发生明显变化,但对GA合成的抑制剂Tetcyclacis的敏感性却显着降低,提示这些突变体内源赤霉素含量可能升高.这些试验表明决定种子休眠还是萌发,主要取决于ABA和GA激素的相互的平衡…,曹雅君等报道高GA/ ABA比值使水稻种子休眠解除,相反低GA/ABA 比值维持水稻种子的休眠.高ABA或低GA敏感性水平导致休眠的种子增加,相反低ABA或高GA 敏感性水平导致休眠种子的减少.然而在鉴定筛选萌发受抑制的突变体时,发现萌发部分被抑制的突变体具有多种恢复突变的途径,提示存在多种信号通路.因此,种子休眠中ABA和GA的关系极为复杂,可能还存在其它激素的合成和信号转导途径,如乙烯(Ethylene,Eth)和油菜素内脂(Brassinosteroid, BR)均影响ABA和GA在种子中的作用¨J.4GA和ABA对一淀粉酶表达信号通路的调控目前,关于GA和ABA对种子休眠和萌发调控的信号通路,研究得较为深入的是禾本科植物种子萌发过程糊粉层组织中仅一淀粉酶诱导表达的信号通路.已鉴定糊粉组织中GA信号通路包括三个关键的调节分子:异源三聚体G一蛋白,GRAS家族调节蛋白SLENDER(SIN1/SLR1)和转录因子GAMyb.研究发现,糊粉层组织中,GA诱导仅一淀粉酶表达的过程,首先是GA与其膜受体相互作用,激活异源三聚体G一蛋白,随后,导致SLR1/SLN1去稳定化,从而使GAMyb表达及下游事件的发生,包括仅一淀粉酶,蛋白酶,核酸酶,细胞壁降解酶等的合成.Jones等用Mas7(一种两亲的阳离子十四肽,可通过异源三聚体G一蛋白刺激GDP/GTP的转换)处理野燕麦糊粉层细胞原生质体,可特异诱导仅一淀粉酶基因的表达.水稻dl矮秆突变体缺乏异源三聚体G一蛋白仅一亚基单拷贝基因,造成茎的伸长受阻,并影响GA对糊粉组织仅一淀粉酶的诱导J.水稻和大麦纤细型突变体(Slender)中存在不依赖GA的茎伸长和糊粉组织仅一淀粉酶的合成;大麦SLN1/slnl杂合子个体自交后代中,有1/4的个体表现出,即使无GA存在,slnl/slnl/sln1种子仍合成和分泌仅一淀粉酶J.此外,在没有GA存在时,GAMyb的过量表达也足以启动其下游的信号事件l4.但关于GAMyb蛋白在信号转导途径中的详细作用远没有清楚,需进一步的研究.ABA在萌发中的主要作用是拮抗GA诱导贮藏物质的转化.Ritchie等报道,在大麦糊粉层细胞中ABA抑制GA诱导的仅一淀粉酶沿I生的过程,涉及G一蛋白介导的磷脂酶D的活化和由多胺(Poly—amine,PA)和ca¨作为第二信使的信号通路.在萌发的成熟大麦种子糊粉层细胞中,ABA诱导Ser/Thr蛋白激酶(PKABA1)的表达,它抑制了GA对GAMyb的诱导,但PKABA1的抑制作用不能被由slender突变体的组成性GA反应所拮抗J,表明江玲等:植物激素ABA和GA调控种子休眠和萌发的研究进展PKABA1作用于SLENDER调节步骤的下游.ABA对(PKABA1)的诱导表达可被GA逆转,因此,PKA-BA1的诱导可能涉及到GA和ABA间的互作.当PKABA1过量表达时,它能模拟ABA效应,抑制Or.-淀粉酶的表达,并且具有基因的剂量效应.在slnl突变体种子中,PKABA1的过量表达也能阻断不依赖GA的0/..淀粉酶的表达,且这种效应具有明显的特异性,但PKABA1对GAMyb激活的Or.-淀粉酶的表达没有影响.利用PKABA1的RNAi敲除技术阻断PKABA1的表达,并不影响ABA对Or.-淀粉酶表达的抑制效应,表明可能存在另一种类似PKABA1的蛋白激酶,或者ABA处理之前,组织中也存在一定水平的PKABA1,由于PKABA1是非常稳定的酶,因此,即使RNAi敲除新PKABA1的合成,仍不影响ABA对Or.-淀粉酶的抑制效应.通过转组成性启动子驱动的GAMyb编码区的转基因使GAMyb异位表达,能促进不依赖GA模式的仅.淀粉酶表达,ABA在阻断GA诱导Or..淀粉酶中非常有效,而对GAMyb激活的Or.-淀粉酶表达没有作用,但ABA在转录水平上可阻断GA诱导的GAMyb的表达,因此,ABA在GA信号通路中的作用位点介于SLR1/SLN1与GAMyb之间的某个位置.然而关于这两者之间的信号通路还知之甚少.虽然GA能在转录水平上诱导GAMyb的表达,但对GAMyb的诱导水平(3~5倍)远低于对Or..淀粉酶的诱导水平(50~100倍),因此可能还存在GA调节GAMyb的其它途径,这方面还需进一步研究.5展望综上所述,种子休眠和萌发是一个十分复杂的生理过程,期间众多基因的表达受到ABA和GA的精确调控,以应对种子发育状态的转变和环境条件的变化.借助遗传学,分子生物学,生理生化的方法和大量突变体,已初步阐明GA诱导种子萌发的信号通路,包括异源三聚体G.蛋白的活化,抑制子SLR1/SLN1的去稳定化,转录因子GAMyb的诱导, ABA通过诱导合成PKABA1或未知因子的表达,进一步作用于SLR1/SLN1与GAMyb之间的GA信号通路而起作用.种子休眠或萌发取决于ABA和GA 这两种激素信号的平衡…,然而激素对种子休眠或萌发的调节是怎样通过一个网络式的调节网(Spi—derweb)进行的?与种子休眠和萌发过程信号通路相关的事件,如SLR1/SLN1的去稳定与GAMyb诱导之间的关系?ABA如何影响这个过程?糊粉层系统研究的信息对理解其他组织中GA与ABA的相互作用有借鉴吗?这些细节问题均需更多的遗传分析和分子鉴定来阐明.随着水稻基因组计划的完成以及更多GA和ABA突变体的鉴定,水稻已成为研究ABA和GA调控种子休眠和萌发的模式植物. 利用酵母单杂交,双杂交技术,分离鉴定ABA和GA 调控水稻种子休眠和萌发的信号通路中与赤霉素响应元件(GAresponseelement,GARE)和脱落酸响应元件(ABAresponseelement,ABRE)相结合的转录因子,并研究其功能及其互作,可加快水稻种子休眠和萌发机理的研究,为水稻抗穗发芽育种提供新的思路和手段.参考文献:[1]BRADYSM,MCCOURTPHormonecross—talkinseeddormancy [J].JPlantGrowthRegu1,2003,22:25—31.[2]WANGH,QIQ,SCHORRP,eta1.ICK1,acyclin—dependentpro—teinkinaseinhibitorfromArabidopsisthalianainteractswithbothCdc2aandCycD3.anditsexpressionisinducedbyabscisicacid [J].PlantJ,1998,l5:501.510.[3]LIUY,BERGERVOETJHW,RICDEVOSCH,eta1.Nuclear replicationactivitiesduringimbibitionofabscisicacidandgibber- ellindeficienttomato(LycopersiconesculentumMil1.)seed[J]. Planta,1994,194:368-373.[4]KARSSENC,BRINKHORST—V ANDERSD,BREEKLANDA,et a1.Inductionofdormancyduringseeddevelopmentbyendogenous abscisicacid:studiesofabscisicaciddeficientgenotypesofArabi—dopsisthaliana(1|_)Heynh[J].Planta,1983,157:158—165.[5]FINKELSTEINR,TENBARGEK,SHUMWA YJ,eta1.Roleofab. scisicacidinmaturationofrapeseedemb~os[J].PlantPhysiol,1985,78:630-636.[63RAZV,BERGERVOETJ,KOORNNEEFM.Sequentialstepsfor developmentalarrestinArabidopsisseeds[J].Development,2001, 128:243-252.[7]NAMBARAE,HAY AMAR,TSUCHIY A Y,eta1.TheroleofAB13 andFUS3lociinArabidopsisthalianaonphasetransitionfromlateemb~odevelopmenttogermination[J].DevBiol,2000,220:421—423.[8]LEPAGE—DEGIVRYMT,GARELLOG.Insituabscisicacidsyn. thesis:arequirementforinductionofemb~odormancyinHelian—thusannuus[J].PlantPhysiol,1992,98:1386—1390.[9]WANGM,HEIMOV AARA—DUKSTRAS,V ANDERMEULENR M.eta】.ThemonoclonalantibodyJIM19modulatesabscisicacid actioninbarleyaleuroneprotoplasts[J].Planta,1995,196:271—364江苏农业2007年第23卷第4期276.[1O]GRAPPINP,BOUINOTD,SO3TAB,eta1.Controlofseeddor—mancyinNicotianaplumbaginifolia:post-imbibitionabscisicacid synthesisimposesdormancymaintenance[J].Planta,2000,210:279-285.[11jKAWAKAMIN,MIY AKEY,NODAK.ABAinsensitivityandlowABAlevelsduringseeddevelopmentofnon—dormantwheatmutants [J].JExpBot,1997,48:1415.1421.[12]PARCYF,V ALONC,KOHARAA,eta1.TheAbscisicAcidinsen. sitive3,fusca3,andleafycotyledonllociactinconcerttocontrol multipleaspectsofarabidopsisseeddevelopment[Jj.PlantCell, 1997,9:1265I277.[13]BUSKPK,PAGESM.Regulationofabscisicacidinducedtran- scription[J].PlantMolBiol,1998,37:425-435.[14]FINKELSTEINRR,GAMPALASSL,ROCKCD.Abscisicacid signalinginseedsandseedlings[Jj.PlantCell,2002,14:15-45. [15]HA TFORIT,TERADA T,HAMASUNAST,Sequenceandrune- tionalanalysesofthericegenehomologoustothemaize[J]. PlantMolBiol,1994,24:805—810.[16]SHIOTAH,SA TOHR,WA TABEKI,eta1.C.ABI3,thecarrot homologueoftheArabidopsisABI3isexpressedduringbothzygotic andsomaticembryogenesisandfunctionsintheregulationofem—bryogenesis-specificABA—induciblegenes[J].PlantCellPhysiol, 1998,39:1184-1193.[17]LUERSSENH,KIRIKV,HERRMANNP,eta1.FUSCA3encodes aproteinwithaconservedVP1/ABI3-likeB3domainwhichisof functionalimportancefortheregulationofseedmaturationinAra bidopsisthaliana[J].PlantJ,1998,15:755-764.[18]BAILEYPC,MCKIBBINRS,LENTONJR,eta1.Geneticmap locationsfororthologousgenesinwheatandrice[J].Theor ApplGenet,1999,98:281-284.[19]JONESHD,PETERSNCB,HOLDSWORTHMJ.Genotypeand environmentinteracttocontroldormancyanddifferentialexpression oftheviviparous1homologueinembryosofAvenafatua[J].PlantJ,1997,12:911-920.[20]BOBBAJ,EIBENHG,BUSTOSMM.PvAlf,anembryo-specific acidictranscriptionalactivationenhancesgeneexpressionfrom phaseolinandphytohemagglutininpromoters[J].PlantJ,1995,8:331-343.[21]HOECKERU,VASILIK,MCCARTYDR.Singalingfromtheem- bryoconditions—mediatedrepressionof—amylasegenesinthe aleuroneofdevelopingmaizeseeds[J].PlantJ,1999,19:371—377.[22]KOORNNEEFM,VANDERVEENJH.Inductionandanalysisof gibberellinsensitivemutantsinArabidopsisthaliana(L.)Heynh [J].TheorApplGenet,1980,58:257-263.[23]NAMBARAE,AKAZAWA T,MCCOURTP.Effectsofthegibber- ellinbiosyntheticinhibitoruniconazolonmutantsofArabidopsis [J].PlantPhysiol,1991,97:736-738.[24]YAMAGUCHIS,KAMIYA Y.Gibberellinsandlight-stimulatedseedgermination[J].JPlantGrowthRegul,2002,20:369-376.[25]OGAWAM,HANADAA,YAMAUCHIY,eta1.Gibberellinbio. synthesisandresponseduringArabidopsisseedgermination[J]. PlantCell,2003,15:1591-1604.[26]OLSZEWSKIN,SUNTP,GUBLERF.Gibberellinsignaling:bio- synthesis,catabolism,andresponsepathways[J].PlantCell,2002,14?61-8O.[27]LEES,CHENGH,KINGKE,eta1.GibberellinregulatesArabi- dopsisseedgerminationviaRGL2,aGA//RGA-likegenewhoseex- pressionisup-regulatedfollowingimbibition[J].Genes&Devel opment,2002,16:646-658.[28]JACOBSENSE,BINKOWSKIKA,OLSZEWSKINE.Spindly,a tetratrieopetiderepeatproteininvolvedingibberellinsignaltrans- ductioninArabidopsis[J].ProcNatlAcadSci,1996,93:9292-9296.[29]KOORNNEEFM,JORNAML,BRINKHORST.V ANDERSWAN DLC,eta1.Theisolationandanalysisofabscisicacid(ABA)-deft—cientmutantsbyselectionofinducedrevertantsinnongerminating gibberellin-sensitivelinesofArabidopsisthaliana(L.)Heynh[J]. TheorApplGenl,1982,61:385—393.[3O]DEBEAUJONI,KOORNNEEFM.GibberellinrequirementforAra. bidops~seedgerminationisdeterminedbothbytestacharacteristicsandembryonicabscisicacid[J],PlantPhysiol,2000,122:415-424.[31]DUBREUCQB,BERGERN,VINCENTE,eta1.TheArabidopsis AtEPR1extensinlikegeneisspecificallyexpressedinendosperm duringseedgermination[J].PlantJ,2000,23:643-652.[32]LEUBNER—METZGERG.Seedafter—ripeningandover-expression ofclassIt3-1,3-glucanaseconfermaternaleffectsontobaccotesta ruptureanddormancyrelease[J].PlantaMed,2002,215:959—968.[33]IKEDAA,SONODA Y,VERNIERIP,eta1.Theslenderricemu. rantwithconstitutivelyactivatedgibberellinsignaltransdaction,has enhancedcapacityforabscisicacidlevel[J].PlantCellPhysiol,2002,43:974-979.[34]SCHMITZN,ABRAMSSR,KERMODEAR.ChangesinABA turnoverandsensitivitythataccompanydormancyterminationof yellow—cedar(Chamaecyparisnootkatensis)seeds[J].JExpBot, 2002,53:89-101.[35]STEBERCM,COONEYSE,MCCOURTP.IsolationoftheGA responsemutantsUasasuppressorofabil-inArabidopsisthali一∞0[J].Genetics,1998,149:509-521.[36]LEON.KLOOSTERZIELKM,V ANDEBUNTGA,ZEEV AARTJ A,eta1.Arabidopsismutantswithareducedseeddormancy[J].PlantPhysiol,1996,110:233-240.[37]曹雅君,江玲,罗林广,等.水稻品种休眠特性的研究[J].南京农业大学,2001,24(2):1.5.[38]ITOHH,UEGUCHI—TANAKAM,SA TOY,eta1.Gibberellinsig- halingisregulatedbytheappearanceanddisappearanceofslender riceIinthenucleus[J].PlantCell,2002,14:57-70.江玲等:植物激素ABA和GA调控种子休眠和萌发的研究进展[39]JONESHD,SMITHSJ,DESIKANR,eta1.HeterotrimericGpro—teinsareimplicatedingibberellininductionofa—amylasegeneex—pressioninwildoataleurone[J].PlantCell,1998,10:245254.[4O]UEGUCHI—TANAKAM,FUJISAWA Y,KOBAY ASHIM,eta1. Ricedwarfmutantdl,whichisdefectiveinthealphasubunitof tbeheterotrimericGprotein,affectsgibbcrellinsignaltransduction [J].ProcNatlAcadSci,2000,97:11638—11643.[41]IKEDAA,UEGUCHI—TANAKAM,SONODA Y,eta1.Slertder rice,aconstitutivegibberellinresponsemutant,iscausedbyanull mutationoftheSLRIgene,anoflhologoftheheight—regulating geneGAI/RGA/RHT/D8[J].PlantCell,2001,13:999—1010. [42]HOTD,GOMEZ—CADENASA,ZENTELLAR,eta1.Crosstalk betweengibberellinandabscisicacidincerealaleurone[J].J PlantGrowthRegul,2003,22:185—194.[43]GOMEZ—CADENASA,ZENTELLAR,WALKERSIMMONSMK, eta1.Gibberellin/Abscisicacidantagonisminbarleyaleuroneceils:siteofactionoftheproteinkinasePKABA1inrelationto gibberellinsignalingmolecules[J].PlantCell,2001,13:667-679.[44]RITCHIES,GILROYS.Abscisicacidsignaltransductioninthe barleyaleuroneismediatedbyphosphollpaseDactivity[J].Proc NatlAcadSci,1998,95:3697-3702.[45]YAMAUCHID,ZENTELLAR,HOT—HD.Molecularanalysisof thebarley(HordeumvulgateL.)geneencodingtheproteinkinascPKABA1capableofsuppressinggibberellinactioninaleuronelayers[J].Planta,2002,215:319-326.f46]ZENTELLAR.Y AMAUCHID.HOT—HD.Moleculardissectionof thegibberellin/abscisicacidsignalingpathwaysbytransientlyex—pressedRNAinterferenceinbarleyaleuronecells[J].PlantCell,2002,14:2289—2301.[47]GUBLERF,CHANDLERPM,WHITERG,eta1.Gibberellinsig- nalinginbarleyaleuronecells,controlofsinlandGaMybexpres—sion[J].PlantPhysiel,2002,129:191—200.。


高师理科学刊Journal of Science of Teachers * College and University 第41卷第1期2021年 1月Vol. 41 No.1Jan. 2021文章编号:1007-9831( 2021)01-0043-06油菜素甾醇受体蛋白BRI1的研究进展卫杰1>2,马天意1>2,沙伟“(齐齐哈尔大学1.生命科学与农林学院,2.抗性基因工程与寒地生物多样性保护黑龙江重点实验室,黑龙江齐齐哈尔161006)摘要:在生物体中很多信号的感知是由具有蛋白激酶功能的受体蛋白完成的.油菜素甾醇 (Brassinosteroids, BR )是一种重要的植物激素,对植物的生长发育具有重要的作用.BRI1 ( protein brassinosteroid insensitive 1 )是BR 的受体蛋白,定位在细胞膜上,在BR 信号被胞外结构感知到 以后,胞内部分的激酶活性被启动,从而导致抑制因子BKI1(BRI1 kinase inhibitor 1 )脱离BRI1, 随后通过一系列的激酶和磷酸酶的级联反应,继续向下传递BR 信号.通过介绍BRI1蛋白的结构、 生物学功能及在BR 信号通路中的分子机制,为今后的研究提供参考.关键词:油菜素甾醇;BRI1;植物激素中图分类号:Q946.885 文献标识码:A doi : 10.3969/j.issn.1007-9831.2021.01.011Research progress of brassinosteroid receptor protein BRI1WEI Jie 1,2, MA Tianyi 1, 2, SHA Wei 1,2(1. School of Life Sciences , Agriculture and Forestry , 2. Heilongjiang Provincial Key Laboratory of Resistance Gene Engineering andProtection of Biodiversity in Cold Areas , Qiqihar University , Qiqihar 161006, China )Abstract : The sensing of signals in organisms is usually done by receptor proteins with protein kinase function. Brassinosteroids ( BR ) are important plant hormones , which play important roles in the growth and development of plants. BRI1 ( protein brassinosteroid insensitive 1)is the receptor protein for brassinosteroids. BRI1 locates in the plasma membrane. Its extracellular domain senses the BR signal and activates the kinase activity of the intracellular part ,causing the inhibitor BKI1 ( BRI1 kinase inhibitor 1 ) dissociated from BRI1,and then continue to transmit the BR signal through the kinases and phosphatases cascade reactions. Through introduce the structure , biological function and molecular mechanism in BR signaling pathway ,in order to provide a reference to researches in the future.Key words : brassinosteroids ; BRI1; plant hormone油菜素甾醇(brassinosteroids ,BR )于20世纪70年代在油菜(Brassica napus )花粉中首次被发现⑴.BR 不仅在植物的细胞伸长、分化,开花时间,花粉发育,种子大小等发育过程中起到重要作用,而且在 植物的抗逆过程中发挥了更为突岀的作用叩8.油菜幼苗经外源BR 处理后,油菜的耐热性显著增强,这可 能与其体内的热休克蛋白含量增加相关[3]682 ;大麦(Hordeum vulgare )经外源BR 处理后对赤霉病危害的抵收稿日期:2020-10-13基金项目:齐齐哈尔大学研究生创新科研项目(YJSCX2019049);黑龙江省省属高等学校基本科研业务费科研项目植物性食品加工技术特色学科专项(YSTSXK201876);黑龙江省省属高等学校基本科研业务费青年创新人才项目( 135309364);黑龙江省人力资源和社会保 障厅2018年省级留学回国人员择优资助项目作者简介:卫杰( 1993-),女,黑龙江绥化人,在读硕士研究生,从事植物分子遗传学研究.E-mail : *****************通信作者:沙伟(1963-),女,黑龙江齐齐哈尔人,教授,博士,从事植物分子遗传学研究.E-mail : ***************44高师理科学刊第41卷抗力增强,使产量损失得以减轻[4]1266.拟南芥(Arabidopsis thaliana)的BR突变体会出现多种发育不良的性状[5]1224.受体蛋白在生物体中能够控制多种信号的感知和传导,这是由于受体蛋白具有蛋白激酶功能和其它一些特殊结构[6]-类受体蛋白激酶(receptor-like kinases,RLKs)是存在于植物细胞表面的一类蛋白质大家族,其基本作用是传递细胞表面的调节信号[71.在动物中,也有一个受体酪氨酸激酶(receptor protein tyrosine kinase,RTKs)[8].RLKs和RTIKs都含有可结合配体的胞外区、调控区、激酶区以及单一的跨膜序列冋油菜素甾醇作为一种胞外的信号分子,其代谢通路的开启首先被认为与相应的RLKs结合而启动,目前发现作用最显著的类受体蛋白激酶就是BRI1(protein brassinosteroid insensitive1)[10I125°.BRI1是一种具有特殊结构的类受体激酶,复含亮氨酸重复序列[11],被发现是BR的受体蛋白,在BR 信号通路中至关重要[1°]1247.BRI1被活化后会使胞内蛋白酶发生磷酸化反应,进而引起一系列级联反应,最后使一些转录因子的功能被启动,使一些调控生长发育相关基因的表达情况发生改变,进而改变植物体的生长生活状态[12].本文介绍了BRI1蛋白的结构特点、生物学功能及在BR信号通路中的分子机制,为其在植物抗逆、抗病遗传育种中的利用提供参考.1BRI1的发现及结构1.1BR11的发现1996年通过甲基磺酸乙酯(Ethyl methyl sulfone,EMS)化学诱变,在BR处理的情况下,对拟南芥进行筛选得到了一系列突变体,其中突变体bri1的根伸长且对外源BR不敏感,是植株成侏儒状、叶片厚且呈墨绿色、雄性不育的突变体,控制这个突变体的基因被命名为BRI1,该突变体对其它植物激素处理的响应无显著变化,唯独对外源BR的处理表现为不敏感[1°,13-16].BRI1在拟南芥所有的幼嫩组织中都有表达,如顶端分生组织、根、茎、下胚轴等[1°,17].有研究表明,BRI1对于BR的感知很重要,BRI1胞外域的ID (island domain)结构域可能在这个过程中起到关键作用问2000年,He何等借助带有放射性标记的油菜素内酯(Brassinolide,BL)和过表达BRI1-GFP融合蛋白质的转基因植株证明BRI1是BR受体.1.2BR11的结构1997年Li[15]等筛选得到了拟南芥在下胚轴伸长方面对BR处理不敏感的突变体,克隆了BRI1基因并预测了其蛋白质结构,推测该类受体激酶在细胞表面感知BR.BRI1基因编码1个膜受体蛋白质激酶属于LRR(leucine-rich repeat)-RLKs中的一种[10]1247.BRI1由胞外区、胞内区及1个单跨膜区域组成,BRI1的胞外区域对BR具有感知作用,而胞内区决定信号途径的不同[19]1890.BRI1胞外区域有N端的信号肽、25个重复的亮氨酸序列、2个串联的LRR序列,在2个LRR之间还有1个由70个氨基酸残基组成的ID结构域,以及位于其首尾的2个半胱氨酸残基,其中LRR对于BR的结合是必需的[20]167.胞内区有一个丝氨酸/苏氨酸激酶域(serine/threonine kinase domain,KD),它具有激酶活性且相对保守,起到向下游组分传递信号的功能[21]-胞内区还包含近膜区(juxtamembrane region,JM)和C末端,近膜区正调控BRI1的生理功能,相反C末端抑制BRI1的激酶活性[21].由跨膜区(Transmembrane,TM)将胞内胞外2个区域连接起来[15,22]2BRI1在BR信号通路中的作用机制当细胞中没有感知到BR信号时,BRI1的C端结构和BKI1(BRI1kinase inhibitor1)均对BRI1产生抑制作用,使BRI1处于失活状态[23].当BR信号启动时,BR结合到BRI1中与ID结构域临近的LRR中由94个氨基酸残基形成的超螺旋疏水结合域上[20,24-25],然后BRI1胞内域的构象发生改变并初步激活BRI1的激酶活性,初步激活的BRI1通过磷酸化自身的C末端和BKI1,使BIK1对BRI1的抑制作用消失,使BAK1 (BRI1associated receptor kinase1)的激酶域能够与BIK1移开后暴露出的BRI1激酶域进行结合㈣BRI1与BR结合后形成的BRI1-BR复合体会在胞外形成互作界面诱导共受体BAK1胞外域的结合与其形成BRI1-BR-BAK1复合物,BRI1和BAK1的激酶区之间发生相互磷酸化,从而使BRI1完全被激活,由此第1期卫杰,等:油菜素甾醇受体蛋白BRI1的研究进展45BR信号可以继续传递下去[27].而且,在BSK1(brassinosteroid-signalling kinase1)和CDG1(constitutive differential growth1)发生磷酸化的过程中BRI1也发挥了重要的作用,被磷酸化的CDG1和BSK1将进一步参与BR信号的抑制与激活[28].3BRI1功能的研究进展3.1在植物生长发育过程中的作用BRI1基因被发现对植株的株高及形态有很大的影响,对水稻(Oryza stative)和大麦的BRI1基因进行研究时发现,BRI1基因的表达量对植株高度影响很大,可以用来培育半矮化植株,进而增加种植密度使产量增高[29-30].大麦的BRI1突变体uzu同样具有矮化性状,植株高度比正常栽培品种植株高度低约80%,花器官畸形,而且对外源BR不敏感,由于植株的矮化,该突变体更适合密集种植,且具有抗倒伏特点[29]1217.水稻的BRI1突变体称为d61,该突变体具有叶片直立、第二节间不伸长、叶鞘缩短、微管排列紊乱等性状,且对外源BR不敏感,水稻内源OsBRI1基因表达量降低的转基因水稻也表现出同样的性状[30-31].玉米(Zea mays)基因组中有5个BRI1的同源基因,当这5个同源基因的表达量被同时下调时,该株系对外源BR 不敏感且出现节间缩短、叶片深绿且卷曲、植株矮化等表型[32]828.过表达ZmBRI1基因可以修复拟南芥对BR不敏感突变体bri1-5的表型,特别是株高、叶片形态和果荚大小,且同时修复了BR的信号通路[32-33].马铃薯(Solanum tuberosum)StBRI1全株沉默系整体表现出植株矮化,叶片皱缩且呈深绿,株型紧凑,茎直径和叶片变小,叶柄、节间距、茎细胞长度均明显缩短等性状[34]41.番茄(Solanum lycopersicum)的BRI1突变体curl3表型与拟南芥bri1突变体的表型相似,表现出植株极端矮化、叶片畸形等性状;在curl3突变体中SlBRI1的过表达则可以恢复curl3株高、叶片表型以及对外源BR响应的性状[35-36].研究发现BRI1基因可能参与细胞分裂和维管组织分化.玉米的ZmBRI1基因在各个组织中都有表达,但是在幼嫩的组织表达量相对较高[32]828.大豆(Glycine max)GmBRI1基因在细胞分裂和维管束发育活跃的部位表达量较高,如子叶和下胚轴,这也与BR激素促进植物细胞伸长、分裂和维管组织分化相对应,GmBRI1基因在拟南芥BRI1弱突变体bri1-5中的表达能够恢复后者的表型[37].杜仲(Eucommia ulmoides)的EuBRI1基因在各个组织中均有表达,其中表达量最高的部位是杜仲皮,在春季组织中的表达量高于其它季节,推测EuBRI1基因可能为组成型表达的基因,可能参与韧皮部组织形成;此外发现EuBRI1基因表达量高的植株出现多分枝的性状,推测杜仲BRI1基因具有促进植物分枝发生的功能[38].此外,发现BRI1基因对植物的生殖生长与开花途径造成一定的影响,许多植物的BRI1突变体中雄性器官的育性降低[29]1210.Montoya佝3173发现番茄的BRI1突变体curl3有育性降低的特征.BR对玉米植株的性别发育有一定的影响[39].拟南芥突变体bri1表现出开花延迟、雄性不育的特点[13]673.Tax研究组在1999年筛选出7个拟南芥bri1突变体,命名为bri1-3至bri1-9,这些突变体中的纯合体具有育性,与之前在其它物种发现的突变体完全不同,这个发现将对遗传筛选提供极大的便利[40].BRI1还可以在不同的发育时期影响花粉和花药的发育,在麻风树(Jatropha curcas)中,JcBRI1很可能参与了其雌花大抱子母细胞的发育过程[41].将小麦(Triticum aestivum)的BRI1基因转入拟南芥中,该转基因植株开花提前,并且结实率增加[42].3.2BRI1基因在植物逆境胁迫响应中的研究进展在拟南芥中,bri1突变体在应对丁香假单胞菌(Pesudomonas syringae)侵染时表现出抗性,BRI1缺失突变体bak1-4和bak1-5对油菜花叶病毒(oil-seed rape mosaic virus,ORMV)、烟草花叶病毒(cobacco mosaic virus,TMV)和芜菁皱缩病毒(Turnip crinkle virus,TCV)敏感[43].在西葫芦(Cucurbita pepo)中,使用2,4-表油菜素内酯(2,4-epibrassinolide,EBR)进行处理后,发现植株提高了对花叶病毒(cucumber mosaic virus,CMV)的抗性网有学者发现,高浓度的BL与水稻对根结线虫(Meloidogyne)的系统防御呈正相关,但同时发现水稻BRI1缺失突变体d61则对根结线虫也具有较高抗性[45],这些相互矛盾的现象还需要进一步研究.在番茄中,BR对植株抵抗根结线虫过程起到了正调节作用,外源BR处理降低了番茄植物对南方根结线虫的敏感性,表明BR信号途径参与了植物抵御根结线虫侵染[46].46高师理科学刊第41卷在桉树(Eucalyptus robusta)中,grBRI1基因能对盐胁迫和冷胁迫做出应答旳.甘蓝型油菜(Brassica napus)中,BnBRI1基因的表达量响应低温诱导成上调趋势跑,BRI1基因在各个组织中均有所表达,其中表达量的峰值出现在花期嫩茎[49].拟南芥BRI1基因的突变体具有更强的抗寒能力[50].在苗期的烟草(Nicotiana tabacum冲,NtBRI1基因的表达量会被低温处理诱导,表达量的升高与低温处理时间相关[51].温度升高造成的植物伸长生长依赖于完整的BR信号通路,但最近的研究表明,温度上升的同时也会负向调节拟南芥根中的BR信号途径,高温下BR受体BRI1蛋白质量降低[52].3.3BRI1基因对植物激素的响应BRI1突变体一般都表现出对外源BR不敏感.拟南芥BRI1突变体bri1、水稻BRI1突变体d61、玉米BRI1同源基因沉默株系、番茄BRI1突变体curl3、大麦BRI1突变体uzu等均表现出对外源BR处理不敏感,而其它激素的处理无明显变化[29]1216.curl3突变体对生长素、赤霉素、细胞分裂素、脱落酸的敏感程度不变[53].uzu突变体在种子萌发率上对脱落酸(abscisic acid,ABA)更加敏感,拟南芥b r i1-301是一个BRI1基因突变的弱突变体植株,该突变植株对ABA更加敏感[29]1216.在拟南芥中,超表达玉米ZmBIR1基因的株系line2和line5对ABA的敏感程度降低,显著缓解了ABA对种子萌发和根长的抑制,ABA响应基因RD29A, RD29B,ABI5,RAB18的表达有所下调,从而证明ZmBRI1参与了植物对ABA的响应[33]1270.在葡萄(Vitis vinifera)中,外源芸苔素唑(brassinaole,Brz)在转色、成熟过程中降低了VvBRI1表达量;外源2,4-表油菜素内酯处理显著促进了果皮及果肉中VvBRI1基因的表达,Brz+EBR处理在糖快速运输期显著增加了VvBRI1的表达量[54]46.3.4BRI1的其他作用在龙眼(Dimocarpus longan)中,蓝光信号使BRI1-3基因的表达量上升,导致龙眼功能性代谢产物积累,DlBRI1可能在龙眼响应光信号、激素信号、非生物胁迫及代谢调控中发挥作用[55].在mRNA水平,光周期可以调节拟南芥幼苗早期发育过程中BRI1的mRNA丰度[56].VvBRI1基因表达量及葡萄种子中6-脱氧栗甾酮(6-deoxocastasterone,6-deoxo CS)含量呈现出与Brz处理相反的作用,进一步验证了葡萄成熟过程中内源BR对糖卸载的调控作用[54]49.马铃薯StBRI1在块茎生长发育过程中主要影响块茎的数量,抑制或降低StBRI1的表达量时会使马铃薯块茎的数量减少,但块茎中的淀粉含量有所升高[34]40.4展望近些年来,人们对油菜素甾醇的研究越来越多,发现油菜素甾醇的功能涉及细胞的膨大和分裂、调节衰老、雄性生育力、花粉发育、果实成熟等,几乎涵盖了所有植物的生长和发育过程[2-5],确立了油菜素甾醇在植物激素中的重要地位.BRI1作为油菜素甾醇的受体自然就被学者广泛研究.在过去的数年中,BRI1在越来越多的植物中被发现并研究,其越来越多的生物学功能陆续被发现,进一步研究BRI1的作用机制及工作模式具有迫切性和必要性的.本文致力于植物抗逆境胁迫的研究,为后续研究更好地了解BRI1在植物生长发育及抗逆境胁迫中发挥的作用提供基础.参考文献:[1]Grove M D,Spencer G F,Rohwedder W K.Brassinolide,a plant growth-promoting steroid isolated from Brassica napuspollen[J].Nature,1979(5728):216-217[2]李元元,曹清河.油菜素内酯参与调控植物生长发育与抗逆性的机制及其育种应用研究[J].中国农业科技导报,2015,17(2):25-32[3]Dhaubhadel S,Browning K S,Gallie D R,et al.Brassinosteroid functions to protect the translational machinery and heat-shockprotein synthesis following thermal stress[J].The Plant Journal,2002(6):681-691[4]Ali S S,Kumar G B S,Khan M,et al.Brassinosteroid enhances resistance to f usarium diseases of barley[J].Phytopathology,2013,103(12):1260-1267[5]Clouse S D.Brassinosteroid signal transduction:from receptor kinase activation to transcriptional networks regulating plantdevelopment[J].The Plant Cell,2011,23(4):1219-1230第1期卫杰,等:油菜素甾醇受体蛋白BRI1的研究进展47[6]Shiu S H,Bleecker A B.Plant receptor-like kinase gene family:diversity,function and signaling[J].Science s STAKE,2001,113:22[7]Walker J C,Zhang R.Relationship of a putative receptor protein kinase from maize to the S-locus glycoproteins ofBrassica[J].Nature,1990(6277):743-746[8]Robinson D R,Wu Y M,Lin S F.The protein tyrosine kinase family of the human genome[J].Oncogene,2000,19:5548-5557[9]Anne D,Clark S E.LRR-containing receptors regulating plant development and defense[J].Development,2004,131(2):251-261[10]Friedrichsen D M,Joazeiro C A,Li J,et al.Brassinosteroid-insensitive-1is a ubiquitously expressed leucine-rich repeat receptorserine/threonine kinase[J].Plant Physiology,2000(4):1247-1256[11]Bojar D,Martinez J,Santiago J,et al.Crystal structures of the phosphorylated BRI1kinase domain and implications forbrassinosteroid signal initiation[J].The Plant Journal,2014(1):31-43[12]Kim T W,Guan S H,Burlingame A L,et al.The CDG1kinase mediates brassinosteroid signal transduction from BRI1receptorkinase to BSU1phosphatase and GSK3-like kinase BIN2[J].Molecular Cell,2011,43(4):561-571[13]Clouse S D,Langford M,McMorris T C.A brassinosteroid-insensitive mutant in Arabidopsis thaliana exhibits multiple defects ingrowth and development[J].Plant Physiology,1996(3):671-678[14]Kauschmann A,Jessop A,Koncz C,et al.Genetic evidence for an essential role of brassinosteroids in plant development[J].ThePlant Journal,1996(5):701-713[15]Li J M,Chory J.A putative leucine-rich repeat receptor kinase involved in brassinosteroid signal transduction[J].Cell Press,1997,90(5):929-938[16]Noguchi T,Fujioka S,Choe S,et al.Brassinosteroid-insensitive dwarf mutants of A rabidopsis accumulate brassinosteroids[J].Plant Physiology,1999(3):743-752[17]Geldner N,Hyman D L,Wang X,et al.Endosomal signaling of plant steroid receptor kinase BRI1[J].Genes&Development,2007,21(13):1598-1602[18]He Z,Wang Z Y,Li J,et al.Perception of brassinosteroids by the extracellular domain of the receptor kinase BRI1[J].Science,2000,288(5475):2360-2363[19]Sun C,Yan K,Han J T,et al.Scanning for new BRI1receptor mutations via TILLING analysis[J].Plant Physiology,2017(3):1881-1896[20]Kinoshita T,Ca n o-Delgado A,Seto H,et al.Binding of brassinosteroids to the extracellular domain of plant receptor kinaseBRI1[J].Nature,2005(7022):167-171[21]Wang X,Goshe M B,Soderblom E J,et al.Identification and functional analysis of in vivo phosphorylation sites of the ArabidopsisBRASSINOSTEROID-INSENSITIVE1receptor kinase[J].The Plant Cell,2005,17(6):1685-1703[22]Vert G,Nemhauser J L,Geldner N,et al.Molecular mechanisms of steroid hormone signaling in plants,Annual Review of Celland Developmental Biology[J].Annual Review of Cell&Developmental Biology,2005,21(1):177-201[23]Eckardt N A.Phloem-borne FT signals flowering in cucurbits[J].The Plant Cell,2007,19(1):1435-1438[24]Hothorn M,Belkhadir Y,Dreux M,et al.Structural basis of steroid hormone perception by the receptor kinase BRI1[J].Nature,2011(7352):467-471[25]She J,Han Z,Kim T W,et al.Structural insight into brassinosteroid perception by BRI1[J].Nature,2011(7352):472-476[26]Jaillais Y,Hothorn M,Belkhadir Y,et al.Tyrosine phosphorylation controls brassinosteroid receptor activation by triggeringmembrane release of its kinase inhibitor[J].Genes&development,2011,25(3):232-237[27]Wang X F,Kota U,He K,et al.Sequential transphosphorylation of the BRI1/BAK1receptor kinase complex impacts early eventsin brassinosteroid signaling[J].Developmental Cell,2008(2):220-235[28]Wang Z Y,Nakano T,Gendron J,et al.Nuclear-localized BZR1mediates brassinosteroid-induced growth and feedbacksuppression of brassinosteroid biosynthesis[J].Developmental Cell,2002(4):505-513[29]Chono M,Honda I,Zeniya H,et al.A semidwarf phenotype of barley uzu results from a nucleotide substitution in the geneencoding a putative brassinosteriod receptor[J].Plant Physiology,2003(3):1209-1219[30]Morinaka Y,Sakamoto T,Inukai Y,et al.Morphological alteration caused by brassinosteroid insensitivity increases the biomassand grain production of rice[J].Plant Physiology,2006(3):924-931[31]Yamamuro C,Ihara Y,Wu X.Loss of function of a rice brassinosteroid insensitive1homolog prevents internode elongation andbending of the lamina joint[J].The Plant Cell,2000,12(9):1591-1606[32]Kir G,Ye H,Nelissen H.RNA interference knockdown of BRASSINOSTEROID INSENSITIVE1in maize reveals novel functionsfor brassinosteroid signaling in controlling plant architecture[J].Plant Physiology,2015(1):826-83948高师理科学刊第41卷[33]郝岭,张钰石,段留生,等.玉米ZmBRI1基因的克隆、表达及功能分析[J].作物学报,2017,43(9):1261-1271[34]李骐.马铃薯油菜素内酯受体StBRI1的基因沉默和功能研究[D].杨凌:西北农林科技大学,2017[35]Montoya T,Nomura T,Farrar K,et al.Cloning the tomato curl3gene highlights the putative dual role of the leucine-rich repeatreceptor kinase tBRI1/SR160in plant steroid hormone and peptide hormone signaling[J].The Plant Cell,2002,14(12):3163-3176[36]Holton N,Ca n o-Delgado A,Harrison K,et al.Tomato BRASSINOSTEROID INSENSITIVE1is required for systemin-inducedroot elongation in Solanumpimpinellifolium but is not essential for wound signaling[J].The Plant Cell,2007,19(5):1709-1717[37]王妙.GmBRI1和GmCPD基因的克隆及在大豆开花过程中的功能研究[D].长春:吉林大学,2015[38]刘明月.杜仲BR受体蛋白编码基因EuBRI1克隆及功能分析[D].贵阳:贵州大学,2018[39]Hartwig T,Chuck G S,Fujioka S,et al.Brassinosteroid control of sex determination in maize[J].Proceedings of the NationalAcademy of Sciences of the United States of America,2011,108(49):19814-19819[40]孙超.拟南芥中bri1新型TILLING突变体的筛选及其机理研究[D].兰州:兰州大学,2015[41]雷世康,徐刚.麻疯树BRI1基因的鉴定及其在不同发育时期花蕾中的表达分析[J].林业科学研究,2019,32(5):121-129[42]Singh A,Breja P,Khurana J P,et al.Wheat Brassinosteroid-Insensitive1(TaBRI1)Interacts with members of TaSERK genefamily and cause early flowering and seed yield enhancement in Arabidopsis[J].Plos One,2016,11(6):e0153273[43]Korner C J,Klauser D,Nieh A,et al.The immunity regulator BAK1contributes to resistance against diverse RNAviruses[J].Molecular Plant-Microbe Interactions,2013,26(11):1271-1280[44]陶媛.表油菜素内酯提高西葫芦病毒病抗性的生理机制研究[D].杭州:浙江大学,2005[45]Nahar K,Kyndt T,Hause B,et al.Brassinosteroids suppress rice defense against root-knot nematodes through antagonism withthe jasmonate pathway[J].Molecular Plant-Microbe Interactions,2013,26(1):106-115[46]Song L X,Xu X C,Wang F N,et al.Brassinosteroids act as a positive regulator for resistance against root knot nematode involvingRESPIRATORY BURST OXIDASE HOMOLOG dependent activation of MAPKs in tomato[J].Plant Cell&Environment,201& 41(5):1113-1125[47]Goddard R,Peraldi A,Ridout C,et al.Enhanced disease resistance caused by BRI1mutation is conserved between Brachypodiumdistachyon and barley(Hordeum vulgare)[J].Molecular Plant-Microbe Interactions,2014,27(10):1095-1106 [48]阳治国,谢甜,王浩杰,等.甘蓝型油菜BnBRI1基因过量表达载体和RNA干扰载体的构建及遗传转化[J].四川大学学报,2016,53(3):689-694[49]刘彩霞,程文财,王茂林.甘蓝型油菜BnBRI1基因的克隆及表达分析[J].四川大学学报,2014,51(2):31[50]Kim S,Kim B H,Lim C J,et al.Constitutive activation of stress-inducible genes in a brassinosteroid-insensitive1(bri1)mutantresults in higher tolerance to cold[J].Physiologia Plantarum,2010(2):191-204[51]肖立增.苗期低温对烟草BR信号通路关键基因表达及发育进程的影响[D].重庆:西南大学,2016[52]Martins S,Dohmann E M N,Cayrel A,et al.Internalization and vacuolar targeting of the brassinosteroid hormone receptor BRI1are regulated by ubiquitination[J].Nature Communications,2015(6):6151[53]Koka C V,Cerny R E,Gardner R G,et al.Aputative role for the tomato genes DUMPY and CURL-3in brassinosteroidbiosynthesis and response[J].Plant Physiology,2000(1):85-98[54]徐凡.油菜素内酯对葡萄成熟过程中糖卸载的影响[D].杨凌:西北农林科技大学,2015[55]李汉生,孙刚,陈晓慧,等.龙眼BRI1基因家族的全基因组鉴定及光照响应表达[J].应用与环境生物学报,2020,26(1):125-134[56]Hategan L,Godza B,Kozma-Bognar L,et al.Differential expression of the brassinosteroid receptor-encoding BRI1gene inArabidopsis[J].Planta,2014,239:989-1001。
武汉市2014届髙中毕业生二月调研测试生物(含答案)一、选择题:1、下列有关生物大分子的叙述,不正确的是:A.生物大分子都是以碳链为骨架B.生物大分子以主动运输方式出入细胞膜C.多糖、蛋白质、核酸都可以水解生成大量的单体D.DNA双螺旋结构解旋后仍可表达遗传信息2、下列有关生物学实验的叙述,正确的是:A.探究培养液中酵母菌种群数量随时间变化的实验中需要另设置对照实验B.模拟细胞大小与物质运输的关系实验表明细胞体积越大,物质运输效率越高C.绿叶中色素的分离原理是色素能溶解在无水乙醇中,且不同色素溶解度不同D.恩格尔曼的水绵实验中好氧细菌的作用是确定水绵光合作用释放氧气的部位3、下图是研究物质A和物质B对某种酶活性影响的变化曲线,下列叙述正确的是:A.物质A能提高该化学反应的活化能B.物质B能提高该种酶的催化活性C.减小底物浓度可以消除物质A对该种酶的影响D.增大底物浓度可以消除物质B对该种酶的影响4、将甲种伞形帽伞藻的A部分与乙种菊花形帽伞藻的B部分(如图)嫁接在一起,第一次长出的帽状体呈中间类型,若切除这一帽状体,第二次长出的帽状体为与甲相同的伞形帽。
下列分析不正确的是:A.甲、乙两种伞藻细胞均含有多种具膜的细胞器B.中间类型可能同时含甲、乙两种伞藻的蛋白质C.若再次切除帽状体,长出的帽状体仍为伞形帽D.该实验证明了帽状体的形态建成只受细胞核控制5、某健康人感染流感病毒后,出现了发热、肌肉酸痛等症状。
该患者体内一般不会发生的是:A.浆细胞通过与病毒结合抑制其增殖B.效应T细胞裂解被病毒侵入的细胞C.下丘脑的部分神经细胞活动增强D.肌肉细胞中无氧呼吸的比例增加6、玉米属雌雄同株异花植株,雄穗着生于植株顶端,雌穗位于茎杆中部叶腋间。
隐性突变b 基因纯合使植株不出现雌穗而变成雄株,隐性突变t基因纯合会使原来产生花粉的雄穗变成雌穗而转变成雌株。
若要后代只获得雄株和雌株,则最佳的杂交组合是:A.BbTt(♂)XBBtt(♀)B.BbTt(♂)Xbbtt(♀)C.bbTt(♂)Xbbtt(♀)D.bbTt(♂)XBBtt(♀)二、非选择题29、(10分)酵母菌是一种单细胞真菌,在有氧条件和无氧条件下都能生存,常用于科学研究。
植物激素研究的一般方法
1. 激素的提取和分离,研究人员通常会从植物组织中提取激素,并通过化学方法或生物学方法进行分离纯化,以便进行后续的分析
和实验。
2. 生物测定法,生物测定法是研究植物激素活性的重要方法,
包括生物学活性测定、生长调节测定等,常用的方法包括生长曲线
实验、生物测定实验等。
3. 分子生物学方法,利用分子生物学技术对植物激素进行研究,包括克隆激素合成基因、激素受体基因、信号转导途径相关基因等,通过转基因技术和基因敲除技术研究植物激素的功能。
4. 生化分析方法,利用生化分析方法对植物激素进行研究,包
括高效液相色谱法、质谱法、酶联免疫吸附实验等,用于检测和定
量植物激素的含量。
5. 组织培养技术,利用植物组织培养技术研究植物激素的生物
学功能,包括激素的促进生长、诱导愈伤组织等,通过组织培养的
方式研究植物激素的作用机制。
总的来说,植物激素研究的一般方法涉及到多个学科领域的知识和多种实验技术的应用,通过综合运用这些方法,可以全面深入地研究植物激素在植物生长发育中的作用机制和调控网络。
高三植物激素知识点植物激素是一类由植物自身合成的化学物质,可以调控植物的生长和发育。
它们在植物体内起着重要的作用,影响植物的形态生成、生理代谢和生殖发育等方面。
本文将介绍高三生物课程中涉及的植物激素的主要类型和其作用。
一、植物激素的分类1. 生长素(IAA):生长素是最早被发现并研究的植物激素,它广泛存在于植物体内,能够促进细胞的伸长和分裂,影响植物的营养运输和生长方向。
2. 赤霉素(GA):赤霉素促进植物的营养物质的合成和运输,促进花粉管的伸长和根系的生长。
3. 细胞分裂素(cytokinins):细胞分裂素调节植物的细胞分裂和分化,促进组织的生长和再生。
4. 脱落酸(ABA):脱落酸参与植物的抗逆应答,抑制种子发芽和幼苗的生长,调节植物的休眠和防御机制。
5. 乙烯(ethylene):乙烯有促进果实成熟和呼吸的作用,可以调节植物的落叶和干旱防御。
6. 顶端生长素(apical dominance factors):顶端生长素抑制侧芽和侧根的生长,维持植物的主干生长。
二、植物激素的作用机制1. 激素与受体结合:植物细胞上存在着与激素能结合的受体,当激素与受体结合后,会触发一系列信号传导路径的激活。
2. 信号传导路径:激素结合受体后,会通过细胞内的信号传导路径传递信息,触发细胞内的相应反应。
3. 基因调控:激素作用的最终效应通常是通过调控基因表达来实现的,植物通过调控特定的基因来实现对激素的响应。
三、植物激素的应用1. 促进植物生长:植物生长素能够促进植物的根系和茎的生长,可以应用于农业生产中,提高作物产量和品质。
2. 抗逆应答:脱落酸和乙烯可以调节植物的抗逆应答机制,在干旱、盐碱等恶劣环境条件下提高植物的存活能力。
3. 控制果实成熟和脱落:乙烯能够促进果实的成熟和脱落,在农业生产中可以控制果实的采收时间和储存过程。
四、植物激素的研究方法1. 生物测定法:通过观察植物在不同植物激素浓度下的生长情况,比较植物的形态和生理指标的变化,来推断不同激素对植物的作用效应。
植物激素调控拟南芥根系发育的研究进展 作者:郭瑾等来源:《江苏农业科学》2014年第05期摘要:植物激素在拟南芥的根系发育过程中起着非常重要的作用,近年来关于植物激素对拟南芥根系发育调控机理的研究越来越多,且大量研究表明,在拟南芥根系的发育过程中,激素作为重要的信号分子参与了调控。
本文主要介绍了生长素、细胞分裂素、乙烯、脱落酸、赤霉素对拟南芥根系生长发育调控作用的研究进展,并对拟南芥根系发育的研究前景提出展望。
关键词:植物激素;拟南芥;根系发育中图分类号: Q946.885文献标志码: A文章编号:1002-1302(2014)05-0007-04植物激素(phytohormone)是在植物特定的组织内合成,而以极低的浓度在其他组织中发挥作用的活性物质,它通过与特定蛋白受体的相互作用来调节其他细胞的生理过程。
主要的植物激素有五大类,分别是生长素、细胞分裂素、乙烯、脱落酸、赤霉素,它们都参与调控植物的生长发育[1-5]。
根系作为植物体的重要组成部分,其主要功能是从土壤中获取养分和水分,并合成氨基酸等含氮有机化合物、激素以及其他有机养分,同时也能起到固定植株的作用,因此根系的生长情况与活力会直接影响整个植株的生长发育和营养状况。
拟南芥(Arabidopsis thaliana)是十字花科(Cruciferae)拟南芥属(Arabidopsis)植物,因其具有基因组简单、突变体众多、生长发育指标全面等特点,长期以来一直被用作植物生物学研究的模式材料,在科学研究中具有重要作用。
同时,关于拟南芥根系发育的激素调控机制的研究对于其他植物根系发育的研究有非常重要的借鉴意义。
1生长素对拟南芥根系发育的影响生长素(auxin)是植物中研究最早的促进生长的激素,主要以吲哚-3-乙酸(indole-3-acetic acid,IAA)的形式存在。
生长素参与调控植物主根的生长,能促进侧根、不定根及根毛的形成,并且能够诱导维管分化,对植物生长发育的各方面起着重要的作用。