_药典临床用药须知_中药卷_2005年版_中含反药药对成方制剂收载情况与分析
- 格式:pdf
- 大小:218.27 KB
- 文档页数:5

发布日期20051015栏目化药药物评价>>化药质量控制标题中国药典2005年版的变化对药品研发的影响分析——固体制剂相关改变带来的影响作者马磊部门正文内容审评三部马磊摘要:以中国药典2005年版二部片剂通则的变化为例,探讨新版药典制剂通则的变化对口服固体制剂研发可能带来的影响。
关键词:中国药典2005年版制剂通则口服固体制剂2005年版二部附录的制剂通则中收载的口服固体制剂包括以下几类:片剂、胶囊剂、颗粒剂、散剂和丸剂,与2000版药典二部制剂通则相比,各制剂项下均有不同程度的变化。
其中以片剂和胶囊剂的修改内容最多,下面以片剂通则的变化为例,讨论这些变化可能对药品审评和研发带来的影响。
与上版中国药典(2000年版)相比,新版药典片剂通则的主要变化见下表:可溶片为2005年版中国药典的新增制剂,系指能溶解于水的非包衣片或薄膜包衣片。
可溶片在用前须溶于水中,以供口服、涂抹或含漱用。
可溶片应进行崩解时限检查,介质为水,温度15~25℃,除另有规定外,各片均应在30分钟内完全崩解并溶化。
如有1片不能完全溶解,应另取6片复试,均应符合规定。
所以可溶片的主药及辅料应具有较好的水溶性,对于水溶性差的药物,则不宜制成该类剂型;另外,还应综合考虑药品的适应症、给药途径及临床用药的需求情况,避免盲目开发。
以往药典中均未对薄膜衣片的包衣液残留问题提出相关的要求,新版药典对此进行了原则性规定:“必要时,薄膜包衣剂应检查残留溶剂”。
所以研发者今后应对包衣材料及溶剂的安全性给予充分关注,尽可能避免使用有毒有害的有机溶剂作为包衣液的溶剂。
从整体上讲,新版药典对各种剂型的定义更加清晰,要求更为明确。
如规定缓释片(控释片)系指在水中或规定的释放介质中缓慢地(恒速或接近恒速地)释放药物的片剂。
缓(控)片应进行释放度检查,缓释片的释放度曲线应不少于3个点,控释片的释放度曲线应不少于5个点。
药品研发者在考虑开发该类制剂时应当注意:与其相应的普通制剂比较,缓、控释制剂的给药频率应至少减少一半,或给药频率比普通制剂有所减少,但能显著增加患者的顺应性或疗效。

中国药典2005年版的变化对药品研发的影响分析★注射制剂相关改变带来的影响N中国药典2005年版已经于2005年7月1日正式执行,从整体上看,经过近年的发展,我国药典已经大大缩短了与医药发达国家的差距,并充分体现了我国的特色,上述特点在新版药典中得到了充分的体现,以注射制剂为例,与中国药典2000年版相比,新版药典在原基础上,根据是否可以直接使用和药物在制剂中的存在形式对注射剂型进行了细分,上述调整有利于药物研发设置质量控制指标时进一步模块化和规范化,充分体现了现代工程设计的优秀思路。
另一方面,在检查项目中,也参考国外医药研发发达国家经验,并结合我国实际,增加了可见异物检查项、调整了液颜色检查法和澄明度检查法,并删减了异常毒性和降压物质检查项。
进一步体现了目前注射制剂的制备和质控特点。
($Gv%x 以下,本文主要谈谈新版药典在注射制剂及其质控项目等方面所发生的变化。
一、制剂通则的变化F-8.Q与中国药典2000年版相比,新版药典在该部分进行了比较大的调整。
下表是中国药典1995、2000和2005年版在注射制剂方面的变化情况:Ihn从上表可以看出,新版药典仍然保留了注射液,静脉输液、注射用无菌粉针等内容,增加了供静脉滴注用大体积(除另有规定外,一般不小于100ml)注射液,也称为输液。
将直接使用的注射剂按容量大小进行了分类,并按药物在制剂中的存在形式划分为溶液型、混悬型和乳剂型,较旧版药典更为明晰。
由于上述变化,在质量控制方法,增加了对静脉用乳状液型注射液分散相的粒度控制-“90%应在1um以下,不得有大于5um的球粒”的描述。
并在原中国药典2000年版附加剂基础上增加了乳化剂、助悬剂。
1o\另外,间接使用的注射剂中在原无菌粉末基础上增加了浓溶液(Concentrates),体现了现代制药工业的需要。
并将前者的制备工艺进行了划分,分为喷雾干燥、溶媒结晶和冷冻干燥型。
i浓溶液在美国药典和日本药典没有收载,但欧洲药典和英国药典纳入了该制剂类型。


执行《中国药典》2005版一部附录中遇到的问题《中国药典》2005版一部附录在丸剂重量差异检查项、水分测定法、栓剂融变时限检查、中药分散片检查、中药片剂脆碎度检查方面有不完善的地方,本文旨在对这些问题进行探讨,为《中国药典》2010年版的完善提供参考。
[Abstract] Pill weight variation check, moisture test, suppository melt time limit test, dispersible tablet of Chinese medicine test, tablets of Chinese medicine broke brittle test in Chinese Pharmacopoeia edition 2005 appendix 1 had imperfect places, and the problems were discussed in this paper, hoping to provide basis for the improvement of Chinese Pharmacopoeia edition 2010.[Key words] Chinese Pharmacopoeia edition 2005; Appendix; Problem《中国药典》2005版在凡例、品种的标准要求、附录的制剂通则和检验方法等方面均有较大的变化和进步。
《中国药典》2005版一部共收载品种1 146种,其中,新增154种,修订453种。
本版药典附录较2000版进行了较大的增修订,如农药残留测定法中增订了对12种有机磷和3种拟虫菊酯类农药的测定方法,不溶性微粒检查法中增订了小容量注射剂的检查,薄层色谱法中增订了系统适用性试验,微生物限度检查修订为按给药途径要求,并增加了方法验证试验。
《中国药典》2005版自2005年7月1日开始执行至今已3年多,作为基层药检所,在执行一部附录过程中有些不明确的地方,本文参考相关文献对此进行探讨,希望2010版药典能够明确。

中华人民共和国药典临床用药须知,2010版临床用药须知,中国药典,中华人民共和国兽药典《中华人民共和国药典临床用药须知》作者: 国家药典委员会出版社: 中国医药科技出版社加入时间: 2011年7月13日总定价:1980元按批发价:1200元(五套团购价格可再议)中华人民共和国药典临床用药须知:2010年版中药饮片卷定价592元中华人民共和国药典临床用药须知: 2010年版化学药和生物制品卷定价:798元中华人民共和国药典临床用药须知:2010年版中药成方制剂卷定价:590元《中华人民共和国药典临床用药须知》(以下简称《临床用药须知》)是《中华人民共和国药典》(以下简称《中国药典》)配套丛书之一。
本版《临床用药须知》由国家药典委员会组织国内200多位一流的临床各科专家及相关药学专家编写,分三卷出版:①中药饮片卷,正文1268页,共介绍了656种药物,其中包括正品药物547种,附药109种。
正品药物按中文名称、汉语拼音名、药材来源、炮制、性味归经、功能主治、效用分析、配伍应用、鉴别应用、方剂举隅、成药例证、用法与用量、不良反应、使用注意、化学成分、药理毒理、本摘要、参考文献等分别撰写;②中药成方制剂卷,正文1068页,收载品种约1565个。
针对每类药物的方解、临床应用、药理毒理、不良反应、注意事项、用法与用量、参考文献等方面进行系统介绍。
为了便于临床使用,附录中还介绍了病证索引;③化学药和生物制品卷,正文1577页,收载品种1440余种。
本版的最大特点是对儿童用药剂量进行了全面的审查和修订。
同时,对每种药物的出处均作了标注,即是否是《中国药典》收录的药品,是否是国家基本药物,是否是医保药物,等等。
《临床用药须知》2010年版在继承前版的基础上,做了大量发展和创新性的工作,具有以下鲜明特色:①首次将“中药饮片”独立成卷,为中药材、饮片的规范使用提供了标准和依据。
②中药成方制剂卷、中药材与饮片卷对收载品种的药理毒理进行了独立介绍。

评《中国药典》2005年版(一部)
周富荣
【期刊名称】《中国药品标准》
【年(卷),期】2005(6)4
【摘要】《中华人民共和国药典》2005年版(一部)(以下简称“新版《药典》”),是按第八届药典委员会确定的设计方案和要求编制而成的,经国家食品药品监督管理局批准颁布实施。
于2005年7月1日起正式执行。
是建国以来第
八版药典,也是21世纪的第一版。
【总页数】5页(P26-30)
【作者】周富荣
【作者单位】北京市药品检验所,100035
【正文语种】中文
【中图分类】R9
【相关文献】
1.对2005年版《中国药典(一部)》的几点建议 [J], 萧汉文
2.对《中国药典》(2005年版一部)薄层色谱法中部分含苯、甲苯展开剂的改进 [J], 陈蔼;梁洁莹;李书渊
3.对《中国药典》2005年版一部成方制剂含量测定标准存在问题的探讨 [J], 刘德军
4.对《中国药典》2005年版一部存在问题的浅见 [J], 王幼鹏
5.试论按《中国药典》2005年版一部检验中药饮片的局限性 [J], 郭全兴
因版权原因,仅展示原文概要,查看原文内容请购买。

国家食品药品监督管理局关于执行《中国药典》2005年版有
关问题的补充通知
【法规类别】药品管理
【发文字号】国食药监注[2006]59号
【发布部门】国家食品药品监督管理局(原国家药品监督管理局)(已撤销)
【发布日期】2006.02.27
【实施日期】2006.02.27
【时效性】现行有效
【效力级别】部门规范性文件
国家食品药品监督管理局关于执行《中国药典》2005年版有关问题的补充通知
(国食药监注[2006]59号)
各省、自治区、直辖市食品药品监督管理局(药品监督管理局):
根据《关于颁布和执行中国药典2005年版有关事宜的通知》(国食药监注﹝2005〕234号),《中国药典》2005年版已于2005年7月1日执行,现就执行《中国药典》2005年版的有关事宜补充通知如下:
一、《中国药典》2005年版(一部)对《中国药典》2000年版(一部)收载的葛根、黄柏、金银花三个多来源药材品种,按植物不同来源分列为两个药材品种,在中成药处方中亦将按两味药材管理。
生产含分列药材的中成药生产企业,应根据《中国药典》2005年版(一部)的药材来源及名称,重新确认处方中使用的药材名称。
凡处方中药味名称
需变更的中成药品种,应于2006年8月1日前向国家局提出修订国家药品标准的药品注册补充申请,其技术审核工作由国家药典委员会统一负责。
目前需中成药企业确认的分列药材名单如下:。



行,而探讨其相似度变化原因时,可进行镜像分析,由于药材11号样本的指纹图谱与标准指纹图谱在色谱峰比例上存在差异,造成相似度相对较低。
REFERENCES[1] MA C Y, DAI B C, LIN R C. HPLC quantitative analysis andfingerprint study of four flavonoids in Scutellaria baicalensis[J].Chin J Pharm Anal(药物分析杂志), 2003, 23(2): 83-86. [2] XIAO L H, WANG H Y, LI F M, et al. Comparative study onHPLC-FPS of Radix Scutellatiae of various sources [J]. J Shenyang Pharm Univ(沈阳药科大学学报), 2004, 21(1): 28.收稿日期:2008-09-05中国药典2005年版药材与饮片妊娠禁用、忌用和慎用药的分析白晓菊(国家药典委员会,北京 100061)摘要:本文在中国药典1995年版、2000年版和2005年版对妊娠禁用、忌用和慎用药材与饮片收载情况比较的基础上,探讨了妊娠禁用、忌用和慎用药与毒性和功能的关系,并对新版中国药典收载妊娠禁用、忌用和慎用药的表述提出了几点建议。
关键词:中国药典;药材与饮片;妊娠禁用;妊娠忌用;妊娠慎用;分析中图分类号:R921.2 文献标志码:A 文章编号:1007-7693(2009)09-0724-04Analysis of Medicinal Substances and Cut Crude Drugs with Forbidding, Contraindication or Caution for Pregnancy in Chinese Pharmacopoeia (2005)BAI Xiaoju(State Pharmacopoeia Commission, Beijing 100061, China)ABSTRACT: In this paper, Chinese medicinal substances and cut crude drugs with forbidding, contraindication or caution for pregnancy were analyzed, basing on comparison of Chinese Pharmacopoeia(CP) 1995, 2000 and 2005. Furthermore, relation between toxicity and function were discussed, and several suggestions on the description of drugs that were forbidden, contraindicated or cautious in pregnancy, which would record in CP2010 were pointed out.KEY WORDS: Chinese Pharmacopoeia; medicinal substances and cut crude drugs; be forbidden in Pregnancy; be contraindicated in pregnancy; be cautious in pregnancy; analysis中国药典2005年版收载药材与饮片551种,其中在【注意】项下收载孕妇慎用、忌服(用)和禁用的药材与饮片总计70种。
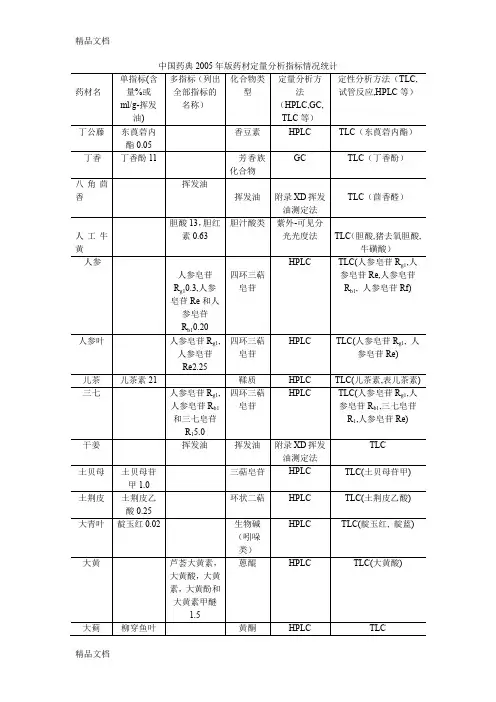
对2005年版《中国药典》中药品种变化的探讨
范世明;黄泽豪;蔡珍华
【期刊名称】《福建中医药大学学报》
【年(卷),期】2006(016)002
【摘要】中国药典2005年版已于2005年7月1日正式执行了,本版药典较2000年版相比作了较大改动,质量标准也有了大幅度提高。
其中中药材品种及质量是整个中药产业链的首要一环,要确保中药饮片和中成药质量,首先必须抓好中药材这个最根本的源头。
在以往的《中国药典》中,中药材部分问题众多:一药多基原现象极为普遍;中药材的质量标准低下,与国际天然药物质量标准有些差距等。
鉴于此,2005年版《中国药典》以大量的调查研究为基础,对收载的中药材品种进行一系列修订和增订。
为了更好地学习并执行新版药典,笔者对其中有关“中药材品种变动”的内容做了认真的学习,并结合自身从事的药用植物学的工作特点进行了探讨。
【总页数】2页(P34-35)
【作者】范世明;黄泽豪;蔡珍华
【作者单位】福建中医学院药学系,福建,福州,350108;福建中医学院药学系,福建,福州,350108;福建中医学院药学系,福建,福州,350108
【正文语种】中文
【中图分类】R282
【相关文献】
1.2005年版《中国药典》中药标准的变化 [J], 钱忠直
2.关于2005年版《中国药典》附录部分的几点探讨 [J], 王红梅;陈启荣
3.中国药典2005年版(二部)主要变化 [J], 张培培;王平;王国荣
4.《中国药典》2005年版(二部)外用制剂相关变化及其意义 [J], 张星一;王平;左舒
5.对《中国药典》2010年版毒性中药品种的探讨 [J], 李红念;梅全喜
因版权原因,仅展示原文概要,查看原文内容请购买。
复方阿米三嗪片(萝巴新)(二甲硫酸阿米三嗪)33≯410≯215萝巴新3≯3≯115盐酸马普替林3≯2≯110盐酸米托蒽醌3≯3≯710盐酸异丙嗪片4 ≯215盐酸异丙嗪注射液4 ≯215盐酸雷尼替丁4 ≯215盐酸雷尼替丁片4 ≯410盐酸雷尼替丁胶囊4 ≯410盐酸雷尼替啶注射液4 ≯610盐酸萘甲唑林3 ≯210柳氮磺吡啶4 ≯410 配制对照品溶液检查已知杂质的品种有盐酸乙胺丁醇、盐酸小檗碱、盐酸左旋咪唑、盐酸吗啡、癸氟奋乃静和氯硝西洋等40余个。
此外配制自身稀释对照溶液和配制对照品溶液,用以检查未知杂质及已知杂质并控制杂质斑点数的品种有盐酸氯米帕明(杂质斑点≯4个)和贝诺酯(杂质斑点≯4个)。
本版药典在薄层色谱法中增加了系统适用性试验和测定法,上述列举的国内外药典的实例可供采用薄层色谱法作为鉴别与有关物质测定的品种正文,在修订或方法研究时参考,可根据品种自身的特点与具体情况,选择系统适用性试验项下的有关要求订入标准中,以使检测方法严谨和完善,确保方法的准确性和重现性,以利于药品质量控制。
《中国药典》2005年版(二部)残留溶剂检查法介绍胡昌勤 刘颖(中国药品生物制品检定所,北京100050)I n troduction of Residua l Solven ts Test i n Ch i nese Pharmacopoe i a2005Ed ition(Volu m e ) H u Changqin and L iu Y ing(N ational Institu te f or the Control of P har m aceu tical and B iolog ical P rod ucts,B eij ing100050) 药品中的残留溶剂系指在原料药、辅料以及制剂生产中使用的,但在工艺过程中未能完全去除的有机挥发性化合物。
I CH(人用药品注册技术要求国际协调会)对残留溶剂的这一定义,明确了药品中残留溶剂的最基本特征,同时也包含了药品残留溶剂的测定具有如下特点:(1)残留溶剂的种类相对固定(I CH规定了69种);(2)在具体样品中具有不确定性;(3)残留量相对较低,一般在痕量或微量范围;(4)同一样品中不同溶剂的残留量相差较大。
对2005年版《临床用药须知》中药卷若干问题的商榷
孙桂明;孙世成
【期刊名称】《中国药品标准》
【年(卷),期】2010(011)004
【摘要】@@ 为了推动中成药的临床应用,促进我国中医药学科的发展,国家药典
委员会2005年编写的<临床用药须知>中药卷(以下简称<中药卷>)为第一版指导
临床中、西医合理使用中成药的专业书籍.该书是<中国药典>配套丛书之一.全书共收载1423种药品,每种药品的功能主治、方解、临床应用、药理毒理、不良反应、注意事项、用法用量都比较详细,这对指导我国卫生工作人员准确了解和全面使用<中药卷>中的各类药品,保证临床用药安全有效必将起到重大作用.因初次编写,时间紧、任务重,出现问题和错误也在所难免.
【总页数】3页(P243-245)
【作者】孙桂明;孙世成
【作者单位】威海现代妇科医院,威海,264200;威海市中医院,威海,264200
【正文语种】中文
【中图分类】R921.2
【相关文献】
1.关于《中国药典》2005年版中药材杂质检查项的商榷 [J], 王红;韦云川;韦继雯;李伟
2.对2005年版《临床用药须知》中有关问题的商榷 [J], 曾志海;李小龙
3.对《中国药典》2000年版二部临床用药须知的商榷 [J], 段利生;虎安定
4.2005年版《中国药典》(一部)中有关中药颗粒剂收录现状及存在问题商榷 [J], 周志祥
5.《2005年版中国药典临床用药须知》必须做皮试的药物 [J],
因版权原因,仅展示原文概要,查看原文内容请购买。