TG1大肠杆菌克隆菌株使用说明
- 格式:pdf
- 大小:96.84 KB
- 文档页数:2

大肠杆菌表达操作规程大肠杆菌表达操作规程一、实验材料和仪器准备1. 大肠杆菌菌株:选择适合表达目标蛋白的大肠杆菌菌株,如BL21(DE3)、Rosetta(DE3)等。
2. 表达载体:选择适合目标蛋白表达的载体,如pET 系列、pBAD系列等。
3. 目标蛋白基因:基因可以通过PCR扩增获得,或者从其他载体中克隆。
4. 培养基:溶液制备LB培养基,配制好含有适当抗生素的LB琼脂板,另外还需要制备适用于大肠杆菌表达的诱导培养基,如TB、SB等。
5. 抗生素:根据载体的需要,选用适当浓度的抗生素。
二、诱导表达实验操作流程1. 预先培养:取一株原始菌落接种到含有适当抗生素的LB液体培养基中,为了避免突变株的污染,建议每次都从冷冻保存的单一菌落开始。
培养条件为37℃,180rpm,过夜培养。
2. 选取合适菌液接种量:从过夜的预培养液中取2ml,用于接种适当量的诱导培养基。
3. 诱导表达:根据所用的表达载体,将接种量转移到含有适当抗生素的诱导培养基中,继续培养。
4. 培养条件:培养条件根据所选表达载体的要求进行设置,一般为37℃,180rpm。
5. 收集细胞:在适当的时间点,如在菌液浓度达到指定值或培养时间达到一定程度后,通过离心收集细胞。
6. 细胞破碎:采用适当的方法破碎细胞膜,如超声波破碎、冻融法等。
7. 蛋白质提取:以适当的缓冲液提取目标蛋白质。
8. 蛋白质纯化:采用各种纯化方法(如亲和层析法、凝胶过滤法等)对蛋白质进行纯化。
9. 检测和分析:对蛋白质进行SDS-PAGE、Western blot等分析方法进行检测。
三、注意事项1. 培养条件的控制:控制好培养温度、转速和时间等条件,以保证表达的效果。
2. 抗生素浓度的选择:根据所用载体对抗生素的要求,选择适当的浓度以抑制非目标菌株的生长。
3. 提取和纯化条件的选择:选择适当的缓冲液、酶和抑制剂,以保持目标蛋白的活性和稳定性。
4. 实验材料的无菌处理:所有实验材料(包括培养基、平板、显微镜片等)都要经过严格的无菌处理,以防止外源性污染。


大肠杆菌克隆表达人类基因的注意事项大肠杆菌是常用的真核表达系统之一,具有优点如易于培养、遗传稳定和高表达水平等。
在进行大肠杆菌克隆表达人类基因的过程中,需要注意以下几个方面:1.选择合适的质粒载体:质粒载体是将目标基因插入宿主细胞中的工具。
选择具有致密复制位点和特定启动子的质粒,可以提高基因的稳定性和表达水平。
一般建议选择常用的表达载体,如pET系列、pGEX系列等。
2.制备合适的基因片段:将人类基因转入大肠杆菌前,需要利用PCR或其他方法从人类细胞中扩增得到基因片段。
合理设计引物,包含适当的启动子和终止子序列,避免产生GC丰富的片段,以免影响大肠杆菌的转化和表达效率。
3.优化启动子和终止子:为了提高目标基因的表达水平,可以选择合适的启动子和终止子来调控基因的转录和翻译。
常用的启动子包括T7、lac、trp等,终止子一般选择T7终止子。
4.确定正确的大肠杆菌菌株:大肠杆菌有多个常用的表达菌株,如BL21(DE3)、XL1-Blue、TOP10等。
根据实验要求选择合适的菌株,包括产蛋白质的溶解度、转化和表达效率、内毒素含量等因素。
5.优化诱导条件:为了获得最佳的基因表达效果,需要优化诱导条件。
常用的诱导剂有IPTG、Lactose等。
优化诱导时间、温度和诱导剂浓度等条件,可根据目标蛋白的特性进行调整。
6.加入相关辅助单元:在大肠杆菌中表达人类基因时,可能需要加入辅助单元,如信号肽序列、标签序列、分泌酶等。
信号肽序列可以帮助蛋白质定位和转运,标签序列如His-tag、GST-tag可以辅助蛋白质纯化和检测。
7.注意避免内毒素产生:大肠杆菌属于革兰氏阴性菌,其细胞壁含有内毒素。
内毒素可引起细胞毒性和炎症反应,影响目标蛋白的纯化和性质。
因此,在表达人类基因时,需要注意控制内毒素的产生,如选择低内毒素菌株、减少诱导剂的使用量等。
8.合理的蛋白质纯化策略:在成功表达目标蛋白后,需要进行蛋白质的纯化。
根据蛋白质的性质,选择合适的纯化方法,如亲和层析、离子交换层析、凝胶过滤层析等。

大肠杆菌基因克隆的基本步骤嘿,咱今儿个就来聊聊大肠杆菌基因克隆那些事儿!你可别小瞧这大肠杆菌,它在生物领域那可是有着相当重要的地位呢!要进行大肠杆菌基因克隆,第一步,得先找到咱要克隆的那个基因吧。
这就好比你要去一个陌生的地方,得先知道目的地在哪儿呀!得通过各种技术手段,像侦探破案似的,把那个特定的基因给揪出来。
然后呢,就该准备载体啦。
载体就像是一辆小货车,要把基因这个“宝贝”给装进去,拉到它该去的地方。
这小货车可得选好喽,得合适才行,不然基因在里面不舒服可不行。
接下来,把基因和载体连接到一块儿。
这就好像给基因找了个“家”,让它安稳地待在里面。
这连接的过程可得仔细着点儿,不能有一丁点儿差错。
之后,把连接好的载体导入大肠杆菌里。
这就好比把货物运进了仓库。
这导入的方法也有好几种呢,就看哪种适合咱啦。
导入之后,就得让大肠杆菌好好生长啦。
给它提供适宜的环境,就像咱人得住在舒服的房子里一样。
让大肠杆菌在里面开开心心地生活,把咱的基因好好复制。
这时候你可能会问啦,那怎么知道基因克隆成功没呀?嘿嘿,这就得检测啦。
就像考试要看看成绩一样,得知道自己做得对不对。
咱再想想,这基因克隆就像是搭积木,一块一块地搭起来,最后搭成一个漂亮的城堡。
每一步都得小心翼翼,不能马虎。
你说要是中间出了差错会咋样?那可就麻烦啦,就像搭积木搭错了一块,整个城堡可能就歪了或者倒了。
所以每一个步骤都得认真对待呀!你想想,通过这些步骤,咱就能把一个小小的基因复制好多好多份,这多神奇呀!这就是科学的魅力,能让不可能变成可能。
总之呢,大肠杆菌基因克隆虽然听起来挺复杂,但只要咱一步一步慢慢来,肯定能成功。
咱可不能怕困难,要像勇士一样勇往直前!咱要相信,通过咱的努力,一定能在这个领域做出一番大成就!。

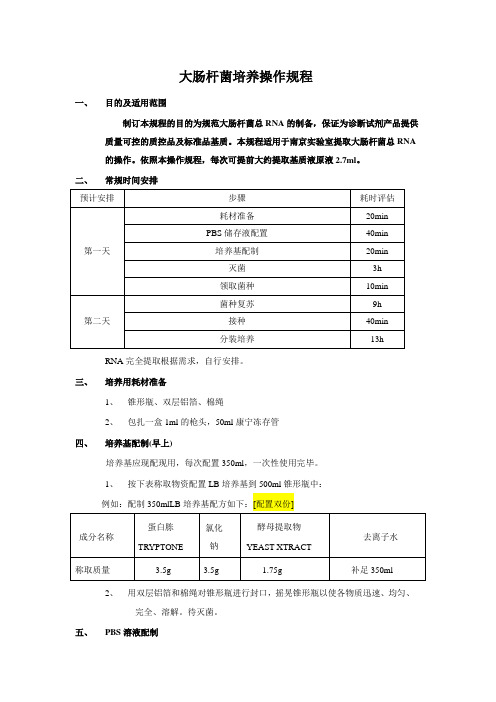
大肠杆菌培养操作规程一、目的及适用范围制订本规程的目的为规范大肠杆菌总RNA的制备,保证为诊断试剂产品提供质量可控的质控品及标准品基质。
本规程适用于南京实验室提取大肠杆菌总RNA 的操作。
依照本操作规程,每次可提前大约提取基质液原液2.7ml。
二、常规时间安排RNA完全提取根据需求,自行安排。
三、培养用耗材准备1、锥形瓶、双层铝箔、棉绳2、包扎一盒1ml的枪头,50ml康宁冻存管四、培养基配制(早上)培养基应现配现用,每次配置350ml,一次性使用完毕。
1、按下表称取物资配置LB培养基到500ml锥形瓶中:2、用双层铝箔和棉绳对锥形瓶进行封口,摇晃锥形瓶以使各物质迅速、均匀、完全、溶解。
待灭菌。
五、PBS溶液配制1、10XPBS不需要每次生产都配置,生产前跟检查PBS量是否充足,如充足则可跳过该步骤。
2、配制10XPBS缓冲液备用;例如配制1000L10XPBS储存液,取1000ml配液瓶,根据下表称取各物质。
用去离子水定容至1000ml。
3、将PBS溶液混合均匀,包扎好,待灭菌。
六、灭菌1、将配置好的PBS溶液,培养基,1ml枪头准备好。
2、确认灭菌锅内水位是否达到标准水位,若未达到,则加入纯化水至标准水位。
3、将包扎好的培养基、PBS溶液和枪头盒一同放入灭菌锅。
注意PBS盖不可太紧,盖紧灭菌锅盖,须旋紧;设置各参数:121℃,20min。
4、灭菌结束后,待灭菌锅压力降至“0”,打开灭菌锅盖;取出灭好菌的培养基和枪头盒。
5、PBS、培养基放置于室温静置2h,待完全冷却。
枪头盒放入80°C鼓风干燥箱三小时烘干。
备用。
6、冷却至室温后,进行活化。
七、菌种复苏(下班前)1、打开超净工作台紫外灯,紫外照射半小时,关闭紫外灯。
2、在超净工作台内进行菌种复苏接种操作,打开50ml冻存管管盖后,用酒精灯外焰灼烧灭菌处理冻存管管口,打开处理好的培养基瓶,用酒精灯外焰灼烧灭菌处理培养基瓶瓶口,倒10ml培养基至50ml冻存管中,用酒精灯外焰灼烧灭菌处理培养基瓶瓶口后将培养基瓶密封待用。
常用大肠杆菌基础信息及使用说明菌株目录BL21 (2)BL21(DE3) (4)BL21(DE3)pLysS (6)BL21 Star(DE3) (8)BL21(AI) (10)OverExpress C43(DE3) (13)M15(pREP4) (15)CopyCutter EPI400 (16)Rosetta(DE3) (18)XL10 (20)Mach1-T1 (22)DH5a (23)TOP10 (24)BL21基因型F- dcm omp T hsd S(r B- m B-) gal产品说明作为E.coli B宿主菌,主要用来进行蛋白表达,细胞内缺少lon蛋白酶和ompT外膜蛋白酶,能够有效避免目的蛋白的降解;当使用CE6噬菌体启动子时,BL21感受态细胞对目的蛋白在未诱导情况下的蛋白表达严密控制;用于非T7启动子驱动的基因表达,表达水平极高。
操作方法1.BL21感受态细胞从-80℃拿出,迅速插入冰中,5分钟后待菌块融化,加入目的DNA(质粒或连接产物)并用手拨打EP管底轻轻混匀(避免用枪吸打),冰中静置25分钟。
2.42℃水浴热激45秒,迅速放回冰上并静置2分钟,晃动会降低转化效率。
3.向离心管中加入700μl不含抗生素的无菌培养基(2YT或LB),混匀后37℃,200rpm复苏60分钟。
4.5000rpm离心一分钟收菌,留取100μl左右上清轻轻吹打重悬菌块并涂布到含相应抗生素的2YT或LB培养基上。
5.将平板倒置放于37℃培养箱过夜培养。
Sample Induction Protocol (for reference only)1. Inoculate a single colony from a freshly streaked plate into 5 ml of LB medium containing the appropriate antibiotic for the plasmid and host strain.2. Incubate with shaking at 200 rpm at 37℃overnight.3. Inoculate 50 ml of LB medium containing the appropriate antibiotic with 0.5 ml of the overnight culture prepared in step 2(use the 500 ml triangular flask as the container would be better).4. Incubate with shaking at 150 rpm at 37℃until the OD 600 reaches 0.5-0.8.5. (Optional)Pipet 1ml of the cultures into clean microcentrifuge tubes and place the tubes on ice until needed for gel analysis or storage at -20℃. These will serve as the non-inducedcontrol samples.6. Add IPTG to a final concentration of 1 mM. Optimal time for induction of the target protein may vary from 2-16 hours, depending on the protein.7. Incubate with shaking at 120 rpm at 37℃for 3-4 hours. To determine the optimal time for induction of the target protein, it is recommended that a time course experiment be performed varying the induction from 2-16 hours.8. Place the culture on ice for 10 minutes. Harvest cells by centrifugation at 5,000×g for 10 min at 4℃.9. Remove the supernatant and store the cell pellet at -20℃(storage at lower temperatures is also acceptabl e).IPTGPrepare a 1 M solution of IPTG (Isopropyl-β-D-thiogalactoside; Isopropyl-β-D-thiogalactopyranoside) bydissolving 2.38 g of IPTG in dd water and adjust the final volume to 10 ml. Filter sterilize before use.BL21(DE3)基因型F- omp T hsd S B(r B- m B- ) gal dcm(DE3)产品说明BL21(DE3)菌株用于高效表达克隆于含有噬菌体T7启动子的表达载体(如pET系列)的基因。
TG1感受态细胞说明书一、简介大肠杆菌经Ca离子处理后可摄取外源DNA(Plasmid、Phage DNA),处于这种状态的细胞称作感受态细胞(Competent Cells)。
在进行基因重组实验时,使用感受态细胞的转化实验应用十分广泛。
制作基因文库、重组质粒体以及进行亚克隆实验时,特别是在目的基因含量十分低的情况时,使用高效的感受态细胞十分重要。
而TG1菌株常常用于噬菌体的制备。
本公司生产的感受态细胞是采用氯化钙处理得到的感受态细胞,使用pUC19质粒检测,转化效率可达107-108,在-70℃下保存几个月转化效率不发生改变。
二、使用方法(1)取出感受态细胞,置于冰上5min,解冻。
(2)然后将连接体系(5~10ul)加入感受态中(~100ul),轻弹感受态离心管底部,混匀,冰浴30分钟。
(3)将离心管放入42℃水浴90秒后,迅速放于冰上。
(4)每管中加500μl LB(SOC)培养基(不含抗生素),37℃振荡培养1小时。
目的是使质粒上相关的抗性标记基因表达,使菌体复苏。
(5)室温4,500rpm离心5分钟,弃去900μl上清后,用剩余100μl 培养基重悬细胞并涂布到含Amp的LB琼脂平板或含X-gal、IPTG、Amp的LB琼脂平板表面。
(6)将平板置于室温直至液体被吸收。
(7)倒置平皿,于37℃培养,12~16小时后可出现菌落。
三、注意事项1. 用此感受态进行转化需要热激,不能电转化,请勿分装。
2 . 感受态细胞应保存在-70 ℃,不可多次冻融和放置时间过长,以避免降低感受态细胞的转化效率。
3 . 为防止转化实验不成功,可以保留部分连接反应液,以重新转化,将损失降到最低。
4 .所有操作均需注意无菌操作。
大肠杆菌活化操作规程1. 引言大肠杆菌(Escherichia coli)是一种常见的细菌,在分子生物学研究中广泛应用。
本文档旨在介绍大肠杆菌的活化操作规程,以确保实验的准确性和安全性。
2. 实验材料和设备•大肠杆菌冻存菌•LB培养基•离心管•无菌吸管•烧杯•恒温培养箱•培养皿3. 操作步骤3.1 准备工作•清洗实验台面,并用消毒液擦拭干净。
•穿戴实验手套和实验服。
•准备所需的实验材料和设备。
3.2 活化大肠杆菌1.取出冻存菌样,以无菌吸管悬浮于10 ml LB培养基中。
确保冻存菌样完全融化。
2.将悬浮的大肠杆菌培养液转移到无菌离心管中。
3.进行高速离心,以1500 g离心10分钟,以沉淀菌细胞。
4.弃去上清液,保留菌细胞沉淀。
5.加入适量的预热(37℃)的LB培养基,用吸管轻轻悬浮菌细胞。
6.取一小部分悬浮液,在无菌培养皿表面均匀涂布。
7.将培养皿放入恒温培养箱中,以37℃孵育24小时。
4. 结果记录与分析观察培养皿表面是否有细菌生长,检查菌落的形态和颜色。
5. 实验注意事项•操作过程中要保持无菌环境,避免细菌污染。
•注意个人安全,保护眼睛和皮肤,避免直接接触培养物。
•严格执行实验室安全规章制度,如正确处理废弃物。
•实验结束后,进行器械的清洗和消毒。
6. 结论通过以上活化操作规程,我们能够成功地从冻存菌样中活化大肠杆菌,为后续实验提供研究材料。
在实验中,严格遵循操作规程和注意事项是确保实验准确性和安全性的关键。
本文档提供了大肠杆菌活化的详细步骤说明,供实验人员参考。
需要注意的是,操作规程可能会因实验目的和实验设备的不同而有所变化,因此在具体操作前请查阅相关实验文献,并根据实际情况进行调整。