晶体结构与晶体中的缺陷
- 格式:doc
- 大小:307.00 KB
- 文档页数:11

材料科学中的晶体结构与缺陷材料科学是一门研究物质性质与结构之间关系的学科。
在材料科学中,晶体结构与缺陷是一个重要的研究领域。
晶体结构是指物质中原子或离子的排列方式,而缺陷则是指晶体中存在的不完美或缺失的部分。
晶体结构与缺陷的研究对于了解材料的性质、改善材料的性能以及开发新的材料具有重要意义。
晶体结构是材料科学中的基础概念之一。
晶体是由原子、离子或分子按照一定的规则排列而成的有序固体。
晶体结构的研究可以通过X射线衍射、电子显微镜等技术手段来进行。
通过这些手段,科学家可以确定晶体中原子或离子的位置、间距以及晶体的晶格常数等参数。
晶体结构的研究不仅可以帮助我们了解材料的基本性质,还可以为设计新的材料提供理论依据。
晶体中存在着各种各样的缺陷。
缺陷可以分为点缺陷、线缺陷和面缺陷。
点缺陷是指晶体中原子或离子的位置发生偏移或缺失,如空位、间隙原子等。
线缺陷是指晶体中存在的一维缺陷,如位错、螺旋位错等。
面缺陷是指晶体中存在的二维缺陷,如晶界、孪晶等。
缺陷的存在对材料的性能有着重要的影响。
例如,点缺陷可以影响材料的导电性、热传导性等;线缺陷可以影响材料的机械性能;面缺陷可以影响材料的塑性变形行为。
因此,研究晶体中的缺陷对于改善材料的性能具有重要意义。
在材料科学中,晶体结构与缺陷的研究不仅限于理论模拟和实验观察,还包括对材料的制备和处理技术的研究。
通过合适的制备和处理技术,可以控制晶体的结构和缺陷,从而改善材料的性能。
例如,通过控制晶体生长条件,可以获得高质量的单晶材料;通过合适的热处理工艺,可以改善材料的机械性能;通过控制材料的成分和微观结构,可以实现材料的特定功能。
因此,晶体结构与缺陷的研究不仅对于基础科学有着重要意义,还对于应用材料科学具有重要的指导作用。
总之,晶体结构与缺陷是材料科学中的重要研究领域。
晶体结构的研究可以帮助我们了解材料的基本性质,缺陷的研究可以改善材料的性能。
通过合适的制备和处理技术,可以控制晶体的结构和缺陷,从而实现材料的特定功能。

晶体结构与缺陷晶体是一种有着高度有序排列的原子、离子或分子的固体材料。
晶体的结构对其性质和应用具有重要影响,而缺陷则是晶体中不完美的部分。
本文将探讨晶体结构、晶格缺陷和它们在材料中的影响。
一、晶体结构晶体结构是指晶体中原子、离子或分子的排列方式。
晶体的结构可以通过晶体学方法(如X射线衍射)来表征。
根据晶体的结构特征,可以将晶体分为多种类型,包括立方晶系、正交晶系、单斜晶系等。
晶体结构的基本单位是晶胞,晶胞由晶体中最小的重复单元构成。
在晶体结构中,晶胞有各种不同的排列方式,例如简单立方晶胞、面心立方晶胞和体心立方晶胞。
这些不同的排列方式导致了不同类型的晶体结构。
二、晶格缺陷晶格缺陷是指晶体中原子、离子或分子位置的非理想性质。
晶格缺陷可以通过外部环境和材料制备过程中的条件引入。
晶格缺陷可以分为点缺陷、线缺陷和面缺陷三类。
1. 点缺陷点缺陷是指晶体中少数几个原子、离子或分子的位置与理想排列位置有所偏离。
最常见的点缺陷是空位缺陷和杂质缺陷。
空位缺陷是指晶体中某个位置上的原子或离子缺失,而杂质缺陷是指原子或离子被其他类型的原子或离子替代。
点缺陷可以对晶体的性质和行为产生重要影响。
例如,在半导体材料中,控制杂质缺陷的浓度可以改变材料的电导率。
在金属材料中,点缺陷可以影响金属的硬度、延展性和热导率等物理性能。
2. 线缺陷线缺陷是指晶体中沿某个方向出现的缺陷线。
常见的线缺陷包括位错和螺旋位错。
位错是晶体中原子排列顺序的偏移,而螺旋位错则是沿某个方向上原子排列的扭曲。
线缺陷可以导致晶体的塑性变形和断裂行为。
位错的运动可以使晶体发生滑移,从而导致材料的塑性变形。
而螺旋位错则可以在晶体中形成螺旋状的断裂。
3. 面缺陷面缺陷是指晶体中的平面缺陷。
最常见的面缺陷是晶界和孪晶。
晶界是两个晶粒之间的界面,它们的晶体结构可能有所不同。
孪晶是指两个对称的晶体结构在某个面上镜面对称的结合。
面缺陷可以对晶体的物理性能产生重要影响。
晶界可以影响晶体的弹性模量和导电性能。


第一章晶体结构与晶体中的缺陷一、名词解释1.正尖晶石与反尖晶石;2.弗伦克尔缺陷与肖特基缺陷;3.刃位错与螺位错;4.固溶体;5.非化学计量化合物:二、填空与选择2.在硅酸盐结构分类中,下列矿物Ca[Al2Si2O8];CaMg[Si2O6];β-Ca2SiO4和Mg3[Si4O10](OH)2,分别属于;;;和四类。
3.在负离子作立方密堆的晶体中,为获得稳定的晶体结构,正离子将所有八面体空隙位置填满的晶体有,所有四面体空隙均填满的晶体有,填满一半八面体空隙的晶体有,填满一半四面体空隙的晶体有。
4.在尖晶石(MgAl2O4)型晶体中,O2-作面心立方最紧密堆积,Mg2+填入了;金红石晶体中,所有O2-作稍有变形的六方密堆,Ti4+填充了。
(A全部四面体空隙;B 全部八面体空隙;C四面体空隙的半数;D八面体空隙的半数;E四面体空隙的八分之一;F八面体空隙的八分之一)5.构成层状硅酸盐的[Si2O5]片中的Si4+,通常被一定数量的Al3+所取代,为满足鲍林第二规则(静电价规则),在层状结构中结合有(OH)-离子和各种二价正离子或三价正离子。
这种以Al3+取代Si4+的现象,称为。
( A同质多晶(同质多象);B类质同晶;C有序-无序转化;D同晶置换(同晶取代))6.高岭石与蒙脱石属于层状硅酸盐结构,前者的结构特征是,后者的结构特征是。
(A二层型三八面体结构;B三层型三八面体结构;C二层型二八面体结构;D 三层型二八面体结构)7.在石英的相变中,属于重建型相变的是,属于位移式相变的是。
(A α-石英→α-鳞石英;B α-石英→β-石英;C α-鳞石英→α-方石英;D α方石英→β-方石英)8.晶体结构中的热缺陷有和二类。
9.CaO掺杂到ZrO2中,其中置换了。
由于电中性的要求,在上述置换同时产生一个空位。
以上置换过程可用方程式表示。
10.由于的结果,必然会在晶体结构中产生"组分缺陷",组分缺陷的浓度主要取决于:和。

晶体的结构和晶格缺陷晶体是具有规则、有序排列的原子、离子或分子的物质。
它们在自然界中广泛存在,包括矿物、金属、合金等。
晶体的结构和晶格缺陷对其性质和应用起着至关重要的作用。
晶体的结构是由周期性排列的结构单元(晶胞)组成的。
晶胞是晶体的最小重复单元,通过平移操作可以生成整个晶体。
晶体结构可以分为两类:晶体属于晶胞内原子、离子或分子之间具有长程有序排列的晶体称为晶态;而在晶胞内部分子之间没有长程有序排列的晶体则称为非晶态。
晶体的结构具有高度的有序性,可以通过X射线衍射等技术进行解析。
晶体的结构决定了其物理、化学性质以及机械性能。
不同原子或离子之间的键合方式和键长决定了晶体的硬度、熔点和导电性等。
晶格缺陷是晶体结构中的缺陷,它们可以分为点缺陷、线缺陷和面缺陷三类。
点缺陷是晶胞内单个原子、离子或分子的缺失或替代。
最常见的点缺陷包括空位、间隙原子和替位原子。
空位是晶胞中缺少一个原子,它会导致晶体特定的电学、热学和光学性质发生改变。
间隙原子是晶胞中多余的原子,它会引起晶体的固溶度变化。
替位原子则是晶胞中某个原子被另一种原子替代,这种缺陷会对晶体的磁性和电性产生重要影响。
线缺陷是沿着晶体中一维方向分布的缺陷。
最常见的线缺陷是位错,位错是晶体中原子、离子或分子排列出错的地方。
位错会导致晶体的机械性质发生变化,如增加晶体的可塑性和延展性,降低其硬度和强度。
面缺陷是沿着晶体中二维方向分布的缺陷。
最常见的面缺陷包括晶面偏差、晶界和孪晶等。
晶面偏差是晶格平面相对于理想晶体位置的偏移,它会影响晶体的表面形貌和晶体的性质。
晶界是两个或多个晶粒之间的界面,它是晶体内部结构的交界处。
孪晶是两个不同晶方向生长的晶体在晶界处错配而结合形成的缺陷,它会降低晶体的机械性能。
晶格缺陷在物质的制备和改性过程中起着重要作用。
通过控制晶格缺陷,可以调节晶体的性质和应用。
在材料科学领域,研究晶体中的缺陷可以提高材料的力学性能、电学性能和化学稳定性等。

晶体的缺点和不足
晶体是由原子、分子或离子按照一定的周期性在空间排列形成的固体物质,具有以下缺点和不足:
1. 晶体生长缓慢:晶体的生长通常需要较长的时间,尤其是对于大尺寸、高质量的晶体,生长过程可能非常耗时。
2. 晶体缺陷:在晶体生长过程中,可能会引入各种缺陷,如点缺陷、线缺陷、面缺陷等。
这些缺陷可能会影响晶体的物理、化学和电子性质。
3. 晶体的各向异性:晶体在不同方向上的物理性质可能会有所不同,这被称为晶体的各向异性。
这可能会导致在某些应用中需要对晶体的取向进行控制,增加了制备的难度。
4. 晶体的脆性:大多数晶体材料相对较脆,容易在受到外力作用时发生断裂或破裂。
这限制了它们在需要一定柔韧性或抗冲击性的应用中的使用。
5. 有限的晶体结构:晶体的周期性结构限制了它们在某些方面的性能。
例如,晶体的能带结构决定了它们的电子传输性质,可能无法满足某些特定应用的要求。
需要注意的是,不同类型的晶体可能具有不同的特点和应用领域。
对于特定的应用,人们可以选择合适的晶体材料或通过晶体工程等方法来克服其缺点和不足。
此外,随着科学技术的发展,人们也在不断探索和研究新的晶体材料和制备方法,以满足各种应用需求。


理解物质的晶体结构和晶格缺陷晶体结构是物质内部有序排列的一种形态。
物质的晶体结构对其性质和应用有着重要影响。
同时,晶格缺陷是晶体中不完美的区域,对晶体的性质和行为产生显著影响。
本文将探讨晶体结构的基本特征和晶格缺陷的类型以及其对物质性质的影响。
一、晶体结构的基本特征晶体结构的基本特征包括晶体晶格、晶胞和晶格常数。
晶体晶格是指晶体中重复出现的空间网状结构,其由原子、离子或分子组成。
晶胞是晶体中最小重复单元,通常是一个几何图形。
晶格常数则是描述晶格的参数,反映着晶体内部原子排列的距离和方向。
不同晶体具有不同的晶体结构类型,常见的有离子晶体、共价晶体和金属晶体。
离子晶体由正负电荷的离子通过电静力吸引力形成,典型的例子是氯化钠。
共价晶体是由共用电子键将原子结合在一起,如金刚石。
金属晶体则由金属原子通过金属键结合,典型的例子是铜。
二、晶格缺陷的类型晶格缺陷是晶体内部不完美的区域,可能是由于原子或离子在晶体结构中的位置不正常或缺失导致的。
常见的晶格缺陷包括点缺陷、线缺陷和面缺陷。
点缺陷是指晶格中某些点位置发生了改变,比如原子偏离了理想位置或者被替代。
点缺陷可以分为点位错、空位和固溶体三种类型。
点位错是晶体中原子位置发生偏移或旋转导致的缺陷,它会使晶体中的原子排列出现错位。
空位是晶体中某个位置没有被原子占据的缺陷,导致晶格中的空隙。
固溶体是指晶格中某些原子被替代为其他原子。
线缺陷是指晶格中存在一维缺陷,如位错和螺旋走错。
位错是指晶体中原子面或者原子排列出现偏差,它可以是线性或螺旋状的。
螺旋走错是晶体中原子沿着一个螺旋线排列,而不是按照理想的平行方式。
面缺陷是指晶格中存在二维缺陷,如晶界、取向沟槽和堆垛层错。
晶界是不同晶粒之间的交界面,其原子排列比较杂乱。
取向沟槽是晶体中沿着特定方向原子排列比较紊乱的缺陷。
堆垛层错则是晶体中原本平行的晶面在某些位置上错位。
三、晶格缺陷对物质性质的影响晶格缺陷对物质性质的影响是多方面的。

晶体结构与缺陷晶体是由原子或离子按照一定的空间排列规律组成的。
晶体结构的决定因素是每个离子或原子的电荷、大小、排列方式等。
晶体中还存在各种类型的缺陷,它们对晶体的物理、化学性质产生着深刻的影响。
本文介绍晶体结构和常见的晶体缺陷类型。
晶体结构晶体结构的研究是材料科学的重要组成部分。
晶体结构的基本特征是周期性结构和各向同性。
晶体结构的周期性结构可以用晶格来描述,而各向同性则表现为晶体结构在各个方向都有相同的物理和化学性质。
晶格是晶体结构的一个重要概念,它是通过一系列点阵使晶体结构排列有序的几何体系。
晶格可以分为7种类型,分别为简单立方晶格、面心立方晶格、体心立方晶格、三斜晶系晶格、正交晶系晶格、单斜晶系晶格和六角晶系晶格。
每种晶格有其特有的周期性结构。
在晶格之上,晶体还有原子或离子,它们按照一定的规律排列,形成了晶体的基本单位——晶体胞。
不同晶体胞的形状和大小不同,但其原子或离子的排列方式是相同的。
晶体结构的描述方式可以分为两种,一种是几何描述方式,一种是结构描述方式。
几何描述方式主要是通过晶格参数来描述晶格的形态和大小,结构描述方式通过具体的晶体结构来描述晶体基本单位的排列方式。
晶体缺陷晶体缺陷是指晶体中原子在排列方式上的失序或错误。
晶体缺陷是不可避免的,因为完美的晶体无法在实验条件下合成。
晶体缺陷可以改变晶体的物理和化学性质,严重的缺陷甚至会导致晶体失去结构完整性。
常见的晶体缺陷包括点缺陷、面缺陷和体缺陷。
点缺陷是晶体结构中位置上的失序或错误,如空位、插入物和替代物等。
面缺陷包括晶界、位错和孪晶等。
体缺陷是晶体中局部形成的缺陷,如空泡、裂纹、孔洞和夹杂等。
晶体缺陷的产生有多种原因,主要包括制备过程中的失误和温度、压力等外界条件的变化。
晶体缺陷对晶体的物理和化学性质产生深刻影响,如制备材料中的一些关键性质可能由于缺陷而发生变化。
晶体结构和晶体缺陷是材料科学中的重要概念。
晶体结构的周期性结构和各向同性为晶体的物理和化学性质提供了基础保障,晶体缺陷则可以改变晶体的物理和化学性质。

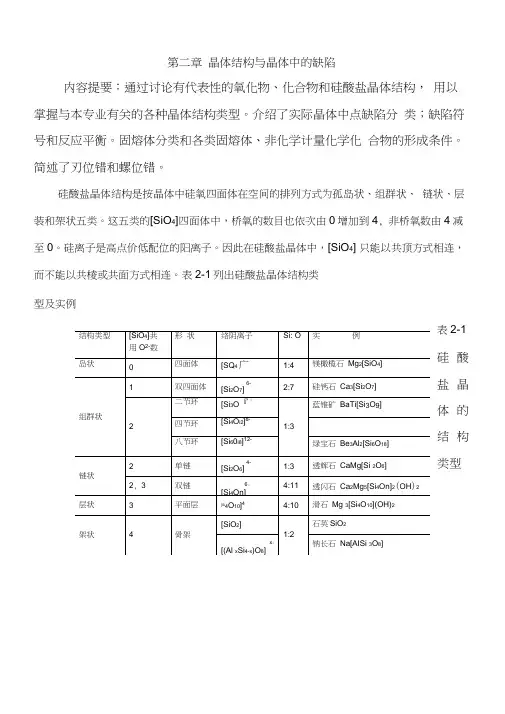
第二章晶体结构与晶体中的缺陷内容提要:通过讨论有代表性的氧化物、化合物和硅酸盐晶体结构,用以掌握与本专业有关的各种晶体结构类型。
介绍了实际晶体中点缺陷分类;缺陷符号和反应平衡。
固熔体分类和各类固熔体、非化学计量化学化合物的形成条件。
简述了刃位错和螺位错。
硅酸盐晶体结构是按晶体中硅氧四面体在空间的排列方式为孤岛状、组群状、链状、层装和架状五类。
这五类的[SiO4]四面体中,桥氧的数目也依次由0增加到4, 非桥氧数由4减至0。
硅离子是高点价低配位的阳离子。
因此在硅酸盐晶体中,[SiO4] 只能以共顶方式相连,而不能以共棱或共面方式相连。
表2-1列出硅酸盐晶体结构类型及实例表2-1 硅酸盐晶体的结构类型真实晶体在高于0K的任何温度下,都或多或少地存在着对理想晶体结构的偏离,即存在着结构缺陷。
晶体中的结构缺陷有点缺陷、线缺陷、面缺陷和复合缺陷之分,在无机材料中最基本和最重要的是点缺陷。
点缺陷根据产生缺陷的原因分类,可分为下列三类:(1)热缺陷(又称本征缺陷)热缺陷有弗仑克儿缺陷和肖特基缺陷两种基本形式。
弗仑克儿缺陷是指当晶格热震动时,一些能量足够大的原子离开平衡位置而挤到晶格点的间隙中,形成间隙原子,而原来位置上形成空位,这种缺陷称为弗仑克儿缺陷。
肖特基缺陷是指如果正常格点上原子,热起伏后获得能量离开平衡位置,跃迁到晶体的表面,而在原正常格点上留下空位,这种缺陷称为肖特基缺陷。
(2)杂质缺陷(非本征缺陷)(3)非化学计量化学化合物为了便于讨论缺陷反应,目前广泛采用克罗格-明克(Kroger-Vink)的点缺陷符号(见表2-2)。
表2-2 Kroger-Vink 缺陷符号(以MTX2-为例)缺陷反应方程式书写规则:(1)位置关系。
(2)质量平衡。
(3)电荷守恒。
热缺陷平衡浓度n/N :n/N二exp(- : G t/2kT)其中n——TK时形成n个孤立空位;G t――热缺陷形成自由焓;h――波儿兹曼常数。
化学物质的晶体结构与晶体缺陷化学物质的晶体结构与晶体缺陷是固体材料科学中重要的研究领域。
通过研究晶体结构和晶体缺陷,人们可以深入了解材料的性质、性能以及它们在应用中的表现。
本文将探讨晶体结构和晶体缺陷的基本概念、分类以及对材料性质的影响。
一、晶体结构的基本概念晶体是由原子、离子或分子有序排列而形成的固体物质。
晶体结构是指晶体中原子、离子或分子的排列方式和周期性。
晶体结构的基本单位是晶胞,其几何形状由晶格常数决定。
不同元素或化合物的晶体结构类型多种多样,常见的有立方晶系、正交晶系、单斜晶系、三斜晶系、四方晶系、六方晶系和三角晶系等。
每种晶体结构类型都有其特定的晶胞和晶格常数。
二、晶体缺陷的分类晶体缺陷是指晶体中存在的与完美晶体结构不符的缺陷或不规则性。
晶体缺陷可以按照其性质和形成机制进行分类。
1. 点缺陷:指晶体中晶体点位上原子的缺失、取代或夹杂。
点缺陷主要包括空位、取代和间隙原子等。
空位是晶体点位上原子缺失而形成的缺陷,取代是指晶体点位上某种原子被其他原子取代,间隙原子是指位于两个晶体点位之间的原子。
2. 线缺陷:指晶体中沿特定方向出现的线状缺陷。
线缺陷主要包括位错和蚀刻管道。
位错是晶格中原子排列出现错位的地方,蚀刻管道是晶体内部形成的空穴通道。
3. 面缺陷:指晶体中存在的平面缺陷,如晶界和层错。
晶界是由于晶格结束或晶粒长大过程中产生的不连续面,层错是晶体中平行晶面错位形成的层状缺陷。
三、晶体缺陷对材料性质的影响晶体缺陷对材料性质和性能有着显著的影响。
不同类型的晶体缺陷会导致材料的导电性、机械性能、热稳定性和光学性能等发生变化。
1. 点缺陷:点缺陷可以影响晶体的导电性和热稳定性。
取代原子引入的杂质可以改变材料的导电性和热导率。
空位和间隙原子可以影响材料的机械性能和热膨胀系数。
2. 线缺陷:位错可以增加晶体的塑性变形能力,增强材料的韧性和强度。
蚀刻管道可以导致材料的腐蚀和断裂。
3. 面缺陷:晶界是材料晶粒生长过程中的不连续面,会导致晶体的断裂韧性下降。
无机化学中的晶体结构与晶格缺陷晶体是由周期性排列的原子、离子或分子组成的固体,具有长程有序性和对称性。
在无机化学中,晶体结构是一个重要的研究对象。
对于一种物质来说,了解其晶体结构可以揭示其化学和物理性质,并且为其制备及应用提供指导。
本文将探讨无机化学中的晶体结构及其缺陷。
1. 晶体结构的分类在无机化学中,晶体结构可以根据其元素和化学键的不同而分为离子晶体、共价晶体和分子晶体。
其中,离子晶体以离子间的静电作用为主要力,具有高的熔点和硬度,例如氯化钠。
共价晶体以共价键为主要力,例如金刚石。
分子晶体以分子间的相互作用为主要力,具有低的熔点和硬度,例如硫酸甘油。
2. 晶体的晶格和晶胞晶体中原子、离子或分子的周期性排列构成了晶格结构。
晶格是由晶体单位中重复出现的空间点组成的。
晶格由三个相互垂直的轴和各自上的点阵构成。
晶格用一组指标(如a、b、c、α、β、γ)来描述。
晶胞是晶体的基本结构单元,是一系列被原子或离子占据的几何空间。
晶胞可以是立方、四方、正交、单斜、三角、六方和三斜等类型。
不同的晶胞形状影响晶体物理和热力学性质。
3. 晶体的晶格缺陷理想的晶体结构是由规律的周期排列的原子、离子或分子组成的。
然而,在实际晶体中,由于各种因素的影响,晶体结构会出现缺陷,这些缺陷被称为晶格缺陷。
这些晶格缺陷会直接影响晶体的物理和化学性质。
晶格缺陷可分为点缺陷、线缺陷和面缺陷。
点缺陷是晶体中单个原子、离子或空位的缺失或存在。
例如,氧化铝中的阳离子晶格中可能存在空位缺陷。
线缺陷是晶体中沿着一定方向具有局部偏差的缺陷。
例如,在氧化铝中,局部偏移的氧离子构成线缺陷。
面缺陷是晶体中平面上存在的缺陷,例如晶格错位或位错等。
晶格缺陷的存在可以导致物理和化学性质的改变。
例如,缩小晶胞之间距离的面缺陷催化剂可以提高反应速率。
结论在无机化学中,晶体结构和晶格缺陷是有重要意义的。
通过对晶体结构和缺陷的研究,可以深入了解物质的物理和化学性质,并指导其制备和应用。
晶体结构与晶体缺陷晶体是物质的一种固态形态,具有有序的排列结构。
其内部的原子、离子或分子按照一定的规律排列,形成晶体的结构。
晶体结构对于物质的性质和应用具有重要影响。
然而,即使在完美的晶体中,也难免存在一些缺陷。
本文将以晶体结构与晶体缺陷为主题,介绍晶体的基本结构和常见的晶体缺陷,探讨它们对于晶体性质的影响。
一、晶体结构晶体结构是晶体内部原子、离子或分子的有序排列方式。
根据晶体结构的不同,可以分为几种常见的晶体类型,包括立方晶系、四方晶系、六方晶系、正交晶系、单斜晶系和三斜晶系等。
每种晶体类型都有其特定的晶体结构特征和晶胞参数。
晶体结构的基本单位是晶胞,晶胞是由若干个晶体格点组成的最小重复单元。
晶格点是表示晶体结构的点,晶格点的排列规则形成了晶体的结构。
晶体结构中有各种键的存在,包括离子键、共价键、金属键等,这些键的类型和强度直接影响晶体的性质。
二、晶体缺陷即使是在完美的晶体中,也不可避免地存在着各种缺陷。
晶体缺陷可以分为点缺陷、线缺陷和面缺陷三种类型。
1. 点缺陷点缺陷是晶体中原子、离子或分子的位置发生了偏离,形成了缺陷点。
常见的点缺陷包括晶格缺陷和间隙缺陷。
晶格缺陷是晶体中原子、离子或分子替换或缺失造成的缺陷。
替代缺陷发生在晶体中的一个位置被其他原子替换,导致原子数量和类型的改变。
缺失缺陷指的是晶体中的某个位置没有被原子、离子或分子占据。
间隙缺陷是晶体中晶格位置周围存在空隙或异位原子、离子或分子的缺陷。
空位缺陷是指晶格位置周围存在未被占据的空位,而异位缺陷则是指晶体中的某个位置被不同类型的原子、离子或分子占据。
2. 线缺陷线缺陷是晶体中原子、离子或分子排列出现错乱或断裂的缺陷,形成了缺陷线。
常见的线缺陷包括位错和蚀刻缺陷。
位错是晶体中晶面的错位,导致原子排列出现错乱的缺陷。
位错可以分为位错线和位错面,具有重要的力学、电学和光学性质。
蚀刻缺陷是晶体中由于外界因素(如化学蚀刻)导致晶体表面形成凹凸不平、出现凹陷或凸起的缺陷。
第二章晶体结构与晶体中的缺陷1、证明等径圆球面心立方最密堆积的空隙率为25.9%。
解:设球半径为a,则球的体积为4/3 n3a求的z=4,则球的总体积(晶胞)4X 4/3 n, 立方体晶胞体积:(2.2a)‘=16・2『,空间利用率=球所占体积/空间体积=74.1%, 空隙率=1-74.1%=25.9%。
2、金属镁原子作六方密堆积,测得它的密度为1.74克/厘米3,求它的晶胞体积。
解:p =m/V=1.74g/cm3, V=1.37X10-22。
3、根据半径比关系,说明下列离子与02-配位时的配位数各是多少?解:Si4+ 4; K+ 12; Al 3+ 6; Mg2+ 6。
4、一个面心立方紧密堆积的金属晶体,其原子量为M,密度是8.94g/cm3。
试计算其晶格常数和原子间距。
解:根据密度定义,晶格常数a0=34M/(6.023 10238.94 =0.906 10 *M 1/3(cm) =0.0906M 1/3(nm)原子间距=2r=2 (、2a/4) =0.0906M1/3/. 2 =0.0641M 1/3(nm)5、试根据原子半径R计算面心立方晶胞、六方晶胞、体心立方晶胞的体积。
解:面心立方晶胞:V =a03 =(2 ..2R)3 =16. 2R3六方晶胞(1/3):V 二a02c — 3/2 = (2R)2•(、8/3 ・2R) • .3/2 =8、2R3体心立方晶胞:V 二a。
3 = (4R/、3)3 =64/3、3R3& MgO具有NaCI结构。
根据O2-半径为0.140nm和Mg2+半径为0.072nm,计算球状离子所占据的体积分数和计算MgO的密度。
并说明为什么其体积分数小于74.05%?解:在MgO晶体中,正负离子直接相邻,a0=2(r++r-)=0.424(nm)体积分数=4X (4 n /3) X (0+040723)/0.4243=68.52%密度=4X(24.3+16)/[6.023 1衣3«0.424 X)-7)3]=3.5112(g/cm3)MgO 体积分数小于74.05%,原因在于r+/r-=0.072/0.14=0.4235>0.414,正负离子紧密接触,而负离子之间不直接接触,即正离子将负离子形成的八面体空隙撑开了,负离子不再是紧密堆积,所以其体积分数小于等径球体紧密堆积的体积分数74.05%。
第二章晶体结构与晶体中的缺陷内容提要:通过讨论有代表性的氧化物、化合物和硅酸盐晶体结构,用以掌握与本专业有关的各种晶体结构类型。
介绍了实际晶体中点缺陷分类;缺陷符号和反应平衡。
固熔体分类和各类固熔体、非化学计量化学化合物的形成条件。
简述了刃位错和螺位错。
硅酸盐晶体结构是按晶体中硅氧四面体在空间的排列方式为孤岛状、组群状、链状、层装和架状五类。
这五类的[SiO4]四面体中,桥氧的数目也依次由0增加到4,非桥氧数由4减至0。
硅离子是高点价低配位的阳离子。
因此在硅酸盐晶体中,[SiO4]只能以共顶方式相连,而不能以共棱或共面方式相连。
表2-1列出硅酸盐晶体结构类型及实例。
表2-1 Array硅酸盐晶体的结构类型真实晶体在高于0K的任何温度下,都或多或少地存在着对理想晶体结构的偏离,即存在着结构缺陷。
晶体中的结构缺陷有点缺陷、线缺陷、面缺陷和复合缺陷之分,在无机材料中最基本和最重要的是点缺陷。
点缺陷根据产生缺陷的原因分类,可分为下列三类:(1)热缺陷(又称本征缺陷)热缺陷有弗仑克儿缺陷和肖特基缺陷两种基本形式。
弗仑克儿缺陷是指当晶格热震动时,一些能量足够大的原子离开平衡位置而挤到晶格点的间隙中,形成间隙原子,而原来位置上形成空位,这种缺陷称为弗仑克儿缺陷。
肖特基缺陷是指如果正常格点上原子,热起伏后获得能量离开平衡位置,跃迁到晶体的表面,而在原正常格点上留下空位,这种缺陷称为肖特基缺陷。
(2)杂质缺陷(非本征缺陷)(3)非化学计量化学化合物为了便于讨论缺陷反应,目前广泛采用克罗格-明克(Kroger-Vink)的点缺陷符号(见表2-2)。
表2-2 Kroger-Vink缺陷符号(以M2+X2-为例)缺陷反应方程式书写规则:(1)位置关系。
(2)质量平衡。
(3)电荷守恒。
热缺陷平衡浓度n/N:n/N=exp(-∆G t/2kT)其中n——TK时形成n个孤立空位;∆G t——热缺陷形成自由焓;h——波儿兹曼常数。
固溶体:凡在固态条件下,一种组分(溶剂)内溶解了其它组分(溶质)而形成的单一、均匀的晶态固体。
表2-3列出固溶体、化合物和机械混合物之间的区别。
固溶体、化合物和混合物比较表2-3(以AO溶质溶解在B2O3溶剂中为例)固溶体按溶质原子在溶剂晶格中的位置分类,可分为溶质原子进入溶剂正常格点位置的置换型固溶体和溶质原子进入溶剂晶格的间隙位置的填隙型固溶体两类。
固溶体按溶质原子在溶剂晶体中的溶解度分类,可分为连续固溶体和有限固溶体两类。
形成连续置换型固溶体的条件:(1)离子尺寸因素。
(2)晶体的结构类型。
(3)电价因素。
(4)电负性与极化性质相近。
置换型固溶体若发生不等价离子替代,为了保持晶体的电中性,必然会在晶体中产生“组分缺陷”。
即在原来结构的结点位置上产生空位或嵌入新质点。
这种组分缺陷与热缺陷不同。
热缺陷浓度只是温度的函数,组分缺陷浓度取决于掺杂度和固溶度。
不等价置换固溶体中,出现四种“组分缺陷”归纳如下:高价置换低价非化学计量化合物是同一种离子中高价态与低价态相互置换而形成的固溶体。
它的形成与环境中氧分压直接有关,非化学计量化合物的四种类型及形成的缺陷方程如下:(1)阳离子缺位型M 1-x OO M O h V O ++=∙221"2 (2)阴离子缺位型MO 1-y ↑++=∙∙2'212O e V O O X O(3)阳离子间隙型M 1+x O ↑++=∙∙2'212O e M MO i(4)阴离子间隙型MO 1+y ∙+=h O O i 221"2鉴别固溶体的类型常用X 射线结构分析测定晶胞参数并计算出固溶体的密度和由实验精确测定的密度数据对比来判断。
固溶体理论密度计算方法:首先写出固溶的缺陷反应式,再写出固溶式,按下列公式计算固溶体密度。
阿佛加德罗常数(原子质量)(占有因子)原子数目)ii i i g (=∑=++++=ni i ig g g g g1321i g 表示单位晶胞内,第i 种原子(离子)的质量(g )。
∑==ni i V g D 10 3cm g0D ——固溶体的理论密度;V——单位晶胞的体积(由X 射线分析测定固溶体晶胞参数求得)。
对于立方晶系30a V =;六方晶系02023c a V =。
线缺陷(位错):滑移方向与位错线垂直的位错称为刃型位错,用符号⊥表示。
垂直指向额外平面。
位错线与滑移方向相互平行的位错称为螺位错。
例题2-1、由三种硅酸盐矿物的结构式可以表示如下:(1)KAl 2[AlSi 3O 10](OH,F)2; (2)NaMg 3Al 6(BO 3)3[Si 6O 18](OH)4; (3)Ca 2(Mg,Fe)4Al(Si 7Al)O 22(OH)2。
试分别判定它们属哪一类硅酸盐矿物?解:算出判据为1,故为层状结构;判据为2,且结构式中有6个硅,故为六元环状结构;判据为1.5,故为双链结构硅酸盐。
2-2、试解释为什么在BaTiO 3(ABX 3钙钛矿型) 晶体结构中没有X 的四面体空隙,X的八面体空隙也只有正常最紧密排列的三分之一(根据结构图并结合鲍林规则讨论)。
解:由于该结构是由A 正离子和X 负离子共同密堆组成,四面体间隙都是由A 和X 两种离子共同组成的,根据鲍林规则,正离子不可能填入由正离子组成的空隙;同样,八面体空隙中只有三分之一是由全部负离子X 组成,这部分八面体空隙中才能填入正离子B 。
2-3、ThO 2具有CaF 2结构,Th 4+离子半径为0.100nm ,O 2-半径为0.140nm 。
(1)实际结构中的Th 4+离子配位数与预计配位数是否一致?(2)结构满足鲍林规则否? 解:(1)732.0714.0140.0100.0<==-+r r ,所以预计配位数应为六,而实际为八。
(2)静电键强度2184===CN Z EBS ,所以每个O 周围应有4个正离子配位,与结构符合。
(为该阳离子的配位数为阳离子的电价,CN Z .)2-4、(a )在MgO 晶体中,肖特基缺陷的生成能为6eV ,计算在25ºC 和1600ºC 时热缺陷的浓度。
(b )如果MgO 晶体中,含有百万分之一的Al 2O 3杂质,则在1600ºC 时,MgO 晶体中是热缺陷占优势还是杂质缺陷占优势?解:(a )根据热缺陷浓度公式:)2/e x p (kT E Nn-= 由题意E =6Ev=6⨯1.602⨯10-19=9.612⨯10-19J T 1=25+273=298K T 2=1600+273=1873K298K: 5123191092.1)2981038.1210612.9exp(---⨯=⨯⨯⨯⨯-=N n 1873K: 92319108)18731038.1210612.9exp(---⨯=⨯⨯⨯⨯-=N n (b )在MgO 中加入百万分之一的Al 2O 3,缺陷方程如下:Al 2O 3−−→−MgO 2Al ∙Mg +V "Mg +3O o此时产生的缺陷为[V "Mg ]杂质。
而[Al 2O 3]= [V "Mg ]杂质=10-6,由(a )知在1873K 时,[V "Mg ]热=8⨯10-9所以[V "Mg ]杂质>[V "Mg ]热在1873K 时杂质缺陷占优势。
2-5、试写出少量MgO 掺杂到Al 2O 3中和少量YF 3掺杂到CaF 2中的缺陷方程。
(a )判断方程的合理性。
(b )写出每一方程对应的固溶式。
解: 3MgO −−→−32O Al 2Mg 'Al +Mg ∙∙i +3O o (1)2MgO −−→−32O Al 2Mg 'Al +V ∙∙O +2O o (2)YF 3−−→−2CaF Y ∙Ca +F 'i +2F F (3)2YF 3−−→−2CaF 2Y ∙Ca +V "Ca +6 F F (4)(a)书写缺陷方程首先考虑电价平衡,如方程(1)和(4)。
在不等价置换时,3Mg 2+=2Al 3+;2Y 3+=3Ca 2+。
这样即可写出一组缺陷方程。
其次考虑不等价离子等量置换,如方程(2)和(3)2Mg 2+=2Al 3+;Y 3+=Ca 2+。
这样又可写出一组缺陷方程。
在这两组方程中,从结晶化学的晶体稳定性考虑,在离子晶体中除萤石型晶体结构可以产生填隙型固溶体以外,由于离子晶体中阴离子紧密堆积,填隙阴离子或阳离子都会破坏晶体的稳定性。
因而填隙型缺陷在离子晶体中(除萤石型)较少见。
上述四个方程以(2)和(3)较合理。
当然正确的判断必须用固溶体密度测定法来决定。
(b ) (1)AlX 322-Mg X O 3(2)Al X -2Mg X O23X -(3)Ca X -1Y X F X +2 (4)CaX 231-Y X F 22-6、用0.2mol YF 3加入CaF 2中形成固溶体,实验测得固溶体的晶胞参数0a =0.55nm测得固溶体密度ρ=3.64g/cm 3,试计算说明固溶体的类型?(元素的相对原子质量:Y=88.90;Ca=40.08;F=19.00)。
解:YF 3加入CaF 2的缺陷方程如下:YF 3−−→−2CaF Y ∙Ca +F 'i +2F F (1)2YF 3−−→−2CaF 2Y ∙Ca +V "Ca +6 F F (2)方程(1)和(2)的固溶式:(1)Ca X -1Y X F X +2 (2)CaX 231-Y X F 2按题意X =0.2代入上述固溶式得:填隙型固溶体分子式为Ca 8.0Y 2.0F 2.2;置换型固溶体分子式为Ca 7.0Y 2.0F 2;它们的密度设分别为ρ1和ρ2。
CaF 2是萤石型晶体,单位晶胞内含有4个萤石分子。
ρ1=3723)1055.0(10023.61922.289.882.0408.408.04-⨯⨯⨯⨯⨯+⨯⨯+⨯⨯=3.659g/cm 3ρ2=3723)1055.0(10023.6192289.882.0408.407.04-⨯⨯⨯⨯⨯+⨯⨯+⨯⨯=3.346 g/cm 3由ρ1与ρ2计算值与实测密度ρ=3.64g/cm 3比较,ρ1值接近 3.64g/cm 3,因此0.2mol YF 3加入CaF 2中形成填隙型固溶体。
2-7、一块金黄色的人造黄玉,化学分析结果认为,是在Al 2O 3中添加了0.005molNiO和2⨯10-4molCr 2O 3。
试写出缺陷方程(置换型)及固溶分子式。
解:NiO 和Cr 2O 3固溶入Al 2O 3中的缺陷反应(置换型)为:2NiO −−→−32O Al 2Ni 'Al +V ∙∙O +2O oCr 2O 3−−→−32OAl 2Cr X Al +3O o固溶分子式:Al y x 22--Ni x Cr y 2O23x-x =0.005 y =0.0002代入上式得:Al 9946.1Ni 005.0Cr 0004.0O 9975.22-8、假如空位周围没有晶格驰豫,如何预测2O P 和T 与(a )Fe X -1O 及(b )UO X +2的密度之间的关系。