缓控释制剂介绍
- 格式:doc
- 大小:115.50 KB
- 文档页数:17


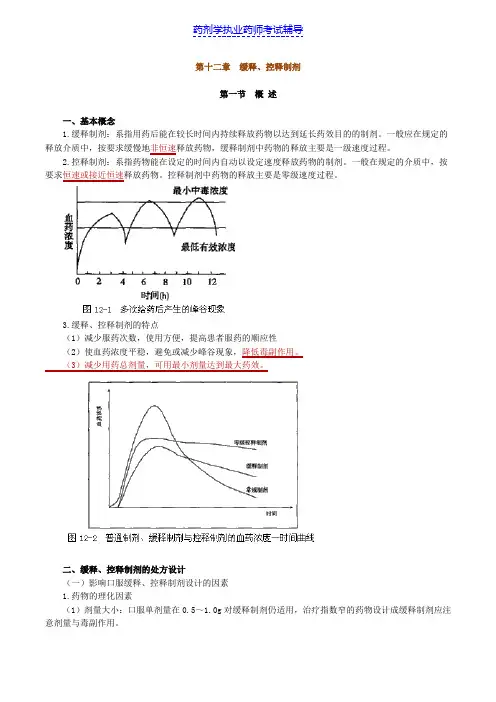
第十二章缓释、控释制剂第一节概述一、基本概念1.缓释制剂:系指用药后能在较长时间内持续释放药物以达到延长药效目的的制剂。
一般应在规定的释放介质中,按要求缓慢地非恒速释放药物,缓释制剂中药物的释放主要是一级速度过程。
2.控释制剂:系指药物能在设定的时间内自动以设定速度释放药物的制剂。
一般在规定的介质中,按要求恒速或接近恒速释放药物。
控释制剂中药物的释放主要是零级速度过程。
3.缓释、控释制剂的特点(1)减少服药次数,使用方便,提高患者服药的顺应性(2)使血药浓度平稳,避免或减少峰谷现象,降低毒副作用。
(3)减少用药总剂量,可用最小剂量达到最大药效。
二、缓释、控释制剂的处方设计(一)影响口服缓释、控释制剂设计的因素1.药物的理化因素(1)剂量大小:口服单剂量在0.5~1.0g对缓释制剂仍适用,治疗指数窄的药物设计成缓释制剂应注意剂量与毒副作用。
(2)pKa、解离度和水溶性:非解离型、脂溶性大的药物易通过脂质生物膜,应注意消化道pH对药物释放的影响。
溶解度<0.01mg/ml,本身具有缓释作用。
设计缓释制剂时药物溶解度<0.1mg/ml不适宜。
(3)药物的油、水分配系数:药物的油、水分配系数大的,在机体内滞留时间长。
油、水分配系数小时,不易透过脂质膜,故油、水分配系数应适中。
(4)稳定性:不稳定药物制成固体制剂较好2.生物因素(1)生物半衰期:24h<t1/2<1h不宜制成缓释制剂,t1/2>24h的药物本身就具有缓释作用。
(2)吸收:吸收的半衰期应控制3~4h的药物,否则不利于吸收。
(3)代谢:吸收前有代谢的药物,不适宜制成缓释制剂,如要制成缓释制剂,需加入代谢的抑制剂。
(二)缓释、控释制剂的设计1.药物选择(1)t1/2=2~8h适宜;12h<t1/2<1h,不适宜制成该类制剂。
(2)剂量很大、药效很激烈、溶解吸收很差、剂量需精密调节的药物不宜制成缓释、控释制剂。
2.设计要求(1)生物利用度:缓控制剂的相对生物利用度应为普通制剂的80~120%(2)峰谷浓度比:稳定时,峰、谷浓度应小于或等于普通制剂。





缓、控释制剂第十五讲缓、控释制剂本讲教学要求1. 了解缓控释制剂的试验方法。
2. 掌握各类缓/控释制剂的含义、特点。
3. 重点掌握缓/控释制剂含义、差异及其特点及缓/控释的原理和方法。
一、缓、控释制剂的含义与特点(一)缓释制剂●用药后能在较长时间内持续释放药物达到延长药效的一类制剂称为缓释制剂。
●中国药典的定义:●缓释制剂(sustained release preparations):指口服药物在规定释放介质中,按要求缓慢地非恒速释放,且每24小时用药次数与相应的普通制剂比较从3-4次减少至1-2次的制剂。
●缓释制剂的特点1、减少服药次数,减少用药总剂量●每日一次或数日一次,特别适用于慢性疾病需要长期服药的患者。
制成缓释制剂可以用最小的剂量达到最大的药效,减少了总剂量。
2、保持平稳的血药浓度,避免峰谷现象●为了延缓药物在胃肠的吸收,较早开发的是缓释制剂。
●缓释制剂虽然减少了服药次数,但是不能达到在服药间隔保持平稳的血药浓度,并且其药代动力学易受胃肠道环境(如胃肠道动力与排空速度,胃肠道pH,与食物共同服用,患者年龄)的影响,血药浓度的可预计性较差,胃肠道环境对缓释制剂的血药浓度有非常大的影响。
●例如:食物可通过与药物直接的化学作用或通过影响胃肠道动力及PH间接地影响缓释药物的吸收。
●缓释制剂与食物同服时有可能造成“药物倾泻”现象,即大幅度增加药物吸收的速率,造成血药浓度的陡升,从而增加药物的副作用。
因此,患者服用缓释制剂时常会受到限制,如必须空腹服药等。
●理想的缓释制剂应既有普通制剂奏效快的优点,又应有普通制剂不具备的药效持久的特点,因此缓释制剂应包括速释和缓释两个组成部分。
为克服缓释剂的这些缺点,控释制剂应运而生。
(二)控释制剂●是指药物在预定的时间内自动以预定速度释放,使血药浓度长时间恒定维持有效浓度范围的制剂。
●中国药典的定义:●控释制剂(controlled release preparation) :指口服药物在规定释放介质中,按要求缓慢地恒速或接近恒速释放,且每24小时用药次数与相应的普通制剂比较从3-4次减少到1-2次的制剂。



缓控释制剂缓控释制剂是一种药物制剂的类型,它具有控制药物释放速度的特点。
在药物领域有着广泛的应用。
本文将介绍缓控释制剂的概念、分类、制备方法、应用领域以及相关的优势和不足之处。
一、概念缓控释制剂是一种通过调节药物释放速度,使药物在体内达到持续稳定的浓度的药物制剂。
它能够延长药物在体内的作用时间,减少用药频率,提高药物疗效。
二、分类根据药物释放速度的不同,缓控释制剂可分为缓释制剂和控释制剂。
缓释制剂是指药物以恒定速率释放,使药物在体内维持一定的血药浓度。
控释制剂则是指药物以可变速率释放,能够根据需要调整药物释放的速度和时间。
三、制备方法缓控释制剂的制备方法有许多种,常见的包括溶胶凝胶法、微球化法、流体床法、负载固体分散体系法等。
其中,溶胶凝胶法是一种常用的方法,它通过将药物溶解在溶胶(如聚合物溶液)中,然后通过凝胶化制备成缓控释制剂。
四、应用领域缓控释制剂在药物领域有着广泛的应用。
例如,它可以用于治疗慢性疾病,如高血压、糖尿病等。
通过控制药物的缓慢释放,可以使药物在体内保持稳定的浓度,从而提高治疗效果。
此外,缓控释制剂还可以用于控制药物在特定部位的释放,如口腔黏膜、皮肤等,以实现局部治疗的效果。
五、优势和不足缓控释制剂相比传统的制剂具有一些明显的优势。
首先,它能够延长药物的作用时间,减少用药频率,提高患者的依从性。
其次,缓控释制剂能够减少药物的副作用,降低患者的心理和生理负担。
此外,缓控释制剂还可以提高药物的生物利用度,增加药效。
然而,缓控释制剂也存在一些不足之处。
首先,制备过程较为复杂,需要考虑药物的物理化学性质、药物的释放机制等因素,增加了制剂的研发难度。
其次,制备成本较高,无法被广泛应用。
此外,缓控释制剂可能存在药物浓度不均匀、释放速率不稳定等问题,影响药物的治疗效果。
综上所述,缓控释制剂是一种在药物领域具有重要意义的药物制剂类型。
通过调节药物释放速度,它能够延长药物的作用时间,提高药效。
虽然制备过程复杂、制备成本较高,但缓控释制剂的广泛应用将为慢性疾病的治疗和药物的局部治疗提供更多的选择和可能性。
第十六章缓控迟释制剂教学目的:通过介绍缓控释制剂的定义、特点及应用,学习缓释、控释制剂的类型、释药原理,熟悉缓释、控释制剂的处方设计原理和制备工艺、常用辅料及体内外评价方法。
教学要求:1、掌握缓释、控释制剂的定义、特点。
2、熟悉缓释、控释制剂的类型和原理。
3、熟悉缓释、控释制剂的处方设计原理和制备工艺、常用辅料。
4、掌握缓(控)释制剂的体内外评价方法。
5、了解口服定时和定位释药系统。
6、掌握靶向制剂的定义、分类、特点、结构及体内作用机制、靶向性评价。
7、了解主动靶向制剂和前体药物;物理化学靶向制剂。
§1概述背景:剂型的发展经历四个阶段:第一代为普通制剂;第二代为缓释制剂、肠溶制剂等;第三代为控释制剂,以及靶向制剂;第四代为基于体内反馈情报靶向于细胞水平的给药系统。
其中第二代至四代药物制剂,统称为药物传递系统。
药物传递系统分为速度控制型给药系统,方向控制型给药系统,应答式给药系统。
对于TI值为2-4的药物以及消除半衰期短的药物在以普通释药系统给药时常出现以下三种情况:①小剂量频繁给药以维持血药浓度;②剂量较大,峰浓度达到有效治疗浓度但给药间隔超过药物消除时间,血药浓度长时间低于有效治疗浓度。
③剂量大,给药次数减少,有效治疗浓度的维持时间长,但峰浓度超出治疗窗,导致副反应。
(1)缓释制剂:指用药后能在较长时间内持续释放药物以达到长效作用的制剂。
控释制剂:指药物能在预定的时间内自动以预定速度释放,使血药浓度长时间恒定维持在有效浓度范围的制剂。
广义的讲,控释制剂包括控制药物的速度、方向和时间,靶向之际、透皮吸收制剂均属此列。
狭义的控释制剂则一般是指在预定时间内以零级或接近零级速度释放药物的制剂。
(2)特点:① 对半衰期短的或需要频繁给药的的药物可减少服药次数,提高病人的顺应性,尤其适合慢性病病患者及中老年患者。
② 血压浓度平稳,避免峰谷现象,降低药物的毒副作用,尤其适合治疗指数窄的药物。
2ln TIln ≤τ,治疗指数(TI)指产生副反应的血药浓度与最低有效治疗浓度的比值,反映药物的相对安全性。
③ 减少用药总剂量,最小剂量、最大疗效;④ 剂量很大(>1g)、半衰期过长(>24h)或过短(<1h)、不能在小肠下端有效吸收的药物、溶解度差的药物不宜制成缓、控制剂。
⑤ 对剂量调节的灵活性降低,不能灵活调节给药方案。
多剂量规格进行应对。
一、缓释、控释制剂的设计原则基本程序:对背景资料进行充分的了解,应用药动学原理对剂型、剂量、释药模式、释药时间、释药速率、以及速释与缓释部分比例等加以综合设计,尽量具有平稳的血药浓度和较长的维持时间。
多数情况下假设药物的吸收速率常数Ka 远大于释药速率常数Kr ,及药物一经释放就被吸收,可利用Kr 代替Ka 进行设计。
也可假定药物符合单室模型配置,一级或零级吸收,在根据实验结果进行校正。
1、理化因素(1)剂量:0.5-1.0g 是普通口服制剂单次给药的最大剂量。
(2)药物的理化性质:考虑药物的溶解度、pKa 和油水分配系数。
(3)胃肠道稳定性:血药浓度2、生物因素(1)生物半衰期:半衰期小于1h,大于24h的药物不宜制成缓控释制剂。
(2)释药速度必须比吸收速度慢,所以吸收的最大半衰期应近似于3-4h,吸收速度常数小的药物,不宜制成缓控释制剂。
(3)代谢:吸收前有代谢的药物,生物利用度会降低。
2、设计要求:(1)药物的选择:半衰期短的药物2—8h。
剂量很大、药效剧烈、溶解吸收很差的药物以及剂量需要紧密调节的药物不适合制成缓、控释制剂。
抗生素类不适合制成缓、控释制剂。
(2生物利用度:是普通制剂的80%—120%;胃、小肠吸收则12hr服药一次,大肠也吸收则24hr一次。
(3峰浓度与谷浓度之比:应等于或小于普通制剂;半衰期短、治疗指数窄者12hr服药一次,反之则24hr一次。
3、缓释、控释制剂的剂量计算①仅含缓释或控释部分,无速释部分A零级释放:在稳态时,为了维持血药浓度平稳,体内消除速度必须等于药物的释放速度。
设释放速度常数k r0,体内药量X,消除速度常数k,V表观分布容积,C为有效浓度,t d维持时间,则缓释或控释Dm= k r0t d=Xkt d=CVkt dB一级释放:稳态时Dmk r1=CVk →Dm=CVk/k r1C近似计算:Dm=X0kt d=X0(0.693/t1/2)t d②缓释或控释部分(Dm)+速释部分(Di):A对于零级释放:D T=Dm+Di=X0-CVkT Max+ CVkt dB一级释放:DT=( X0-Dmk r1T Max+ kCV/k r1)C近似计算:D T=Dm+Di=X0+X0kt d=X0[1+(0.693/t1/2)t d]二、缓释、控释制剂的辅料:多为高分子化合物,主要有阻滞剂、骨架材料、增粘剂。
①缓释包衣材料。
不溶性材料、肠溶材料:CAP、丙烯酸树脂L、S型、羟丙甲纤维酞酸酯(HPMCP)、醋酸羟丙甲纤维素琥珀酸酯(HPMCAS)。
②骨架材料:生物溶蚀性骨架材料(脂肪、蜡类)、亲水胶体骨架材料(MC、CMC-Na、HPMC、PVP、卡波普、海藻酸盐、脱乙酰壳聚糖)、非溶蚀性骨架材料(EC、聚甲基丙烯酸酯、无毒聚氯乙烯、聚乙烯、乙烯醋酸乙烯共聚物、硅橡胶)。
③增粘剂:延长液体药剂的药效。
明胶、PVP、CMC、PVA、右旋糖苷。
三、 缓释、控释制剂释药原理 (一)溶出原理1、原理:Noyes-Whitney 方程:)(t s C C V DS dt dC -=σ, 当Cs>>Ct 时,s KSC dtdC=。
Cs ↘,dC/dt ↘。
2、延缓药物的溶出方法:① 制成溶解度小的盐或酯:青霉素的普鲁卡因盐或二苄基乙二胺盐;醇类药物酯化,药效延长,睾丸素丙酸酯、环戊丙酸酯、庚酸酯,油性注射液。
② 与高分子化合物生成难溶性盐:鞣酸与生物碱成盐;③ 控制粒子大小:超慢性胰岛素中含胰岛素锌晶粒(>10um ,30小时);半慢性胰岛素中含胰岛素锌晶粒(<2um ,12-14小时)。
难溶性药物溶于丙二醇、水、乙醇的混合溶剂,注射后析出结晶颗粒,延效。
(二)扩散原理 1、原理:h)C C (DF dt dMt s--= ①水不溶性膜材包衣的制剂: Fick ’s 第一定律:LCADK dt dM ∆=dM/dt —释放速度;A —面积;D —扩散系数;K —药物在膜与囊心之间的分配系数; L —包衣层厚度;△C —膜内外药物的浓度差。
都不变则为恒速释药,否则为非恒速释药。
② 包衣膜中含有部分水溶性聚合物:EC 与MC 的混合物,LCAD dt dM ∆=③ 水不溶性骨架片:Higuchi 方程,假设:药物释放伪稳态,存在过量的溶质,理想的漏槽状态,药物颗粒比骨架小得多,药物与骨架材料无相互作用,则Q=k H t 1/2注意:1、应用扩散原理可获得零级释放,但注意贮库所含药量比常规制剂大得多,工艺差错可导致严重毒副反应,植入型骨架制剂需取出骨架材料。
2、骨架型结构中药物的释放特点是不呈零级释放,骨架中药物的溶出速度必须大于药物的扩散速度。
这一类制剂的优点是制备容易,可用于释放大分子量的药物。
2、 用扩散原理达到缓、控释作用的方法:① 包衣:小丸或片剂包衣、不包衣、包不同厚度的衣。
肠溶材料:利用其溶解特性使产生缓释作用。
如Eudragit L 、S ,L 不溶于强酸但在含盐的中性溶液中可溶,S在酸性、中性介质中难溶,在碱性介质中可溶。
适当比例的L、S配合,可获得在一定pH介质中可溶的包衣材料,与增塑剂混合,用适当方法包衣可制成接近零级的的控释制剂。
阻滞剂:疏水性高分子物质,石蜡、高级脂肪酸、醇、单硬脂酸甘油酯,硬脂酸、镁、钙盐、虫胶。
②制成微囊:微囊膜为半透膜,形成饱和溶液扩散。
药物释放度的决定因素有囊膜的厚度、微孔的孔径、微孔的弯曲度。
③制成不溶性骨架片:以不溶性塑料例如无毒聚氯乙烯、聚乙烯、聚乙烯乙酸酯、聚甲基丙烯酸酯、硅橡胶为骨架,适合水溶性药物,药物释放度的决定因素有药物的溶解度、骨架的孔率、孔径和孔的弯曲度。
制备方法:药物与塑料混合;湿法制粒;溶剂法制颗粒、压片。
④增加粘度以减少扩散速度:主要用注射剂及其它液体制剂。
如明胶用于肝素、CMC(1%)用于盐酸普鲁卡因注射液(3%)。
⑤制成植乳剂:将不溶性药物熔融后倒入模型中形成,一般不加赋形剂。
⑥制成药树脂:阳离子交换树脂与有机胺类、阴离子交换树脂与有机羧酸盐或磺酸盐交换即成药树脂。
作成胶囊、片剂。
只有解离性药物才适用于制成药树脂。
交换容量有限,故大剂量药物不易制成药树脂。
⑦制成乳剂:水溶性药物可制成W/O型乳剂。
水相→油相→体液。
(三)溶蚀与扩散、溶出结合:1、生物溶蚀性给药系统中的骨架型制剂:药物溶出、聚合物溶蚀,药物的扩散路径改变,不会形成空骨架,释药动力学难以控制。
2、药物与聚合物通过化学键直接结合,通过酶解、水解释药;载药量高,释药速率易控制。
3、膨胀性控释骨架,释药速度很大程度取决于聚合物膨胀速率、药物的溶解度、骨架中可溶部分的大小,可减少突释效应。
(四)渗透压原理:1、原理:与水接触,水通过半透膜进入,片芯成饱和溶液,浓度差,药物由细孔持续流出,其量与渗进的水量相当,直到片芯的药物溶解殆尽为止。
2、吸水速度取决于膜的渗透性能和片芯的渗透压,先控释(饱和溶液)后缓释(不饱和溶液),释药速率与pH 无关。
π∆=LKAdt dV , dV/dt —水渗透进入膜内的流速,K —膜的渗透性,A —面积,L —厚度。
关键因素:膜的厚度、孔径、孔率、片芯的处方、释药小孔的直径。
3、 有两种类型:① 片芯为固体药物和电解质;② 非渗透弹性囊内有药物溶液,囊外为电解质。
特点:传递体积大,药物的释放与药物的性质无关,但价贵,对溶液状态不稳定的药物不适用。
(五)离子交换作用:有水不溶性交联聚合物组成的树脂,其聚合物链的重复单元上含有成盐基团,药物可结合于树脂上。
树脂+—药物- + X -→树脂+—X - +药物-树脂-—药物++ X +→树脂- —X++药物+扩散速度受扩散面积、扩散路径长度、树脂刚性的控制。
四、缓释、控释制剂的处方和制备工艺 一、骨架型缓释、控释制剂 (1)骨架片的处方与工艺1)凝胶骨架片:不同规格HPMC(4000cPa.s),水溶性药物的扩散取决于药物在凝胶层的扩散,溶解度小的药物的扩散速度取决于凝胶层的溶蚀。
药物释放完全,生物利用度高。
含药量低时调节HPMC 的比例及规格调节释放速度,含药量高时溶蚀速度决定释放速度。
直接压片或湿法制粒压片。
此外还由MC 、羟乙基纤维素、CMC-Na 、海藻酸钠。
2)蜡质类骨架片:骨架材料不溶解但溶蚀。
孔道扩散与蚀解控制释放。