单一金属离子被准确滴定的条件教案(精)
- 格式:doc
- 大小:65.50 KB
- 文档页数:1



高中化学离子检验教案
目标:学生能够理解离子检验的原理和方法,并能独立进行离子检验实验。
教学内容:
1. 离子检验的基本原理
2. 常见离子的检验方法
3. 实验操作步骤
教学步骤:
一、导入(5分钟)
引导学生回顾之前学过的离子化合物的性质,为今天的离子检验实验做铺垫。
二、理论讲解(15分钟)
1. 介绍离子检验的原理:离子在特定条件下与特定试剂发生反应,产生可观察的沉淀或气体,从而确定其存在。
2. 详细介绍常见离子的检验方法,包括氯离子、硫酸根离子、碳酸根离子、铁离子等。
三、实验操作(30分钟)
1. 准备实验物品:氯化铁、硝酸银、硫酸氢钠、硫酸铵等。
2. 进行离子检验实验,根据离子的性质选择适当的试剂,观察并记录反应现象。
3. 利用观察结果确定离子的存在或不存在。
四、讨论与总结(10分钟)
1. 学生讨论实验结果,总结各离子的检验方法。
2. 引导学生思考离子检验在实际应用中的重要性。
五、作业布置(5分钟)
布置作业:根据学生掌握的离子检验方法,设计一个离子检验实验方案,并写出实验步骤和预期结果。
六、结束语(5分钟)
总结本节课的重点内容,鼓励学生在课后多加练习,加深对离子检验的理解与掌握。
教学评价:
1. 学生能够独立进行离子检验实验,准确观察和记录实验现象。
2. 学生能够运用所学知识设计离子检验实验方案,加深对离子性质的理解。
3. 学生积极参与讨论,提出问题,让课堂更加生动有趣。
以上是一份高中化学离子检验教案范本,希望对您有所帮助。
祝您教学顺利!。

配位滴定法大纲要求:1.了解配位滴定法的特点及应用;2.掌握条件稳定常数的概念及其应用;3.了解金属指示剂的变色原理,常用指示剂及指示剂使用条件;4.掌握单一金属离子能被准确滴定的条件,配位滴定所允许的最低pH 及提高配位滴定选择性的方法;5.掌握配位滴定的有关计算。
基本内容:一.配位滴定法概述配位滴定法是以形成配位化合物的配位反应为基础的滴定分析方法。
它是用配位剂作标准溶液直接或间接地滴定被测物质,形成配合物,并选用适当的指示剂来确定滴定终点。
用于配位滴定的配位反应应具备的条件:1) 形成的配合物(或配离子)要相当稳定;2) 在一定反应条件下,配位数须固定;3) 配位反应速度要快;4) 有适当的方法确定滴定终点。
作为滴定用的配位剂可分为无机配位剂和有机配位剂两类:无机配位剂:如: Ag + + 2CN - = [Ag(CN)2]-Ag + + [Ag(CN)2]- = Ag[Ag(CN)2]↓(白色)有机配位剂:使用较广泛的为氨羧配位剂( 含有氨基二乙酸基团的有机化合物 ―N COOH CHCOOH CH 22)此配位剂中同时含有氨基氮和羧基氧两种配位能力很强的配位原子,故它几乎可以和所有的金属离子相配位。
目前研究过的氨羧配位剂有30多种,其中重要的有:氨基乙酸(NTA)乙二胺四乙酸(EDTA)、 乙二胺四丙酸(EDTP) …………其中,乙二胺四乙酸(EDTA)是应用最广的一种,故通常所说的配位滴定法主要是指以EDTA 为滴定剂的EDTA 滴定法。
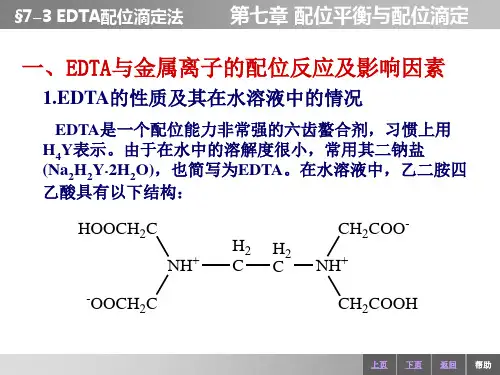
二.EDTA 的性质及其配合物(一).EDTA 的性质EDTA 为四元酸,常用H 4Y 表示,它在水溶液中分四步电离:H 4Y = H + + H 3Y - K θ=10-2.0 H 3Y - = H + + H 2Y 2- K θ=10-2.67H 2Y 2- = H + + HY 3- K θ=10-6.16 HY 3- = H + + Y 4- K θ=10-10.26 可见,EDTA 具有中强二元酸的性质。



第十二章配位滴定法§12-1 概述配位滴定法是以配位反应为基础的滴定分析方法。
它是用配位剂作为标准溶液直接或间接滴定被测物质。
在滴定过程中通常需要选用适当的指示剂来指示滴定终点。
本章重点介绍以乙二胺四乙酸(EDTA)为滴定剂的配位滴定分析方法。
一、配位滴定剂(EDT A)大多数金属离子都能与多种配位剂形成稳定性不同的配合物,但不是所有的配位反应都能用于配位滴定。
能用于配位滴定的配位反应除必须满足滴定分析的基本条件外,还能生成稳定的、可溶于水的中心离子与配体比例恒定的配合物。
由多基配体与金属离子形成的具有螯合环结构的配合物称为螯合物。
螯合物稳定性高,螯合比恒定,能满足滴定分析的基本要求。
目前应用最多的滴定剂是乙二胺四乙酸等氨羧有机配位体,它们能与大多数的金属离子形成稳定的可溶的螯合物,能满足配位滴定的要求。
因此配位滴定法主要是指形成螯合物的配位滴定法。
乙二胺四乙酸简称EDTA,或EDTA酸,常用H4Y表示。
其结构式为:在水溶液中,乙二胺四乙酸两个羧基上的质子转移到氮原子上,形成双偶极离子:在酸度较高的溶液中,H4Y的两个羧基可再接受两个H+而形成H6Y2+,这样它就相当于一个六元酸,有六级离解平衡。
H4Y在水中的溶解度低(22 0C时每100ml水溶解0.02g),所以常用的是其二钠盐Na2H2Y·2H2O,(也称EDTA)作为滴定剂。
它在水溶液中的溶解度较大,22 0C时每100ml水可溶解11.2g,此时溶液的饱和浓度约为0.3mol·L-1,pH值约为4.4。
在水溶液中,EDTA有H6Y2+、H5Y+、H4Y、H3Y-、H2Y2-、HY3-、Y4-七种型体存在,但是在不同的酸度下,各种型体的浓度是不同的,他们的浓度分布与溶液pH的关系如图12-1所示。
由图可见,在pH<1的强酸性溶液中,EDTA主要以H6Y2+型体存在;在pH为2.67~6.16的溶液中,主要以H2Y2-型体存在;在pH>10.26的碱性溶液中,主要以Y4-型体存在。

初中化学物质离子检验教案教学目标:1. 了解离子在化合物中的作用;2. 掌握常见的离子检验方法;3. 能够进行简单的离子检验实验。
教学重点:1. 离子在化合物中的作用;2. 常见的离子检验方法。
教学难点:1. 进行离子检验实验的操作技巧;2. 区分不同离子的检验方法。
教学准备:1. 实验器材:试管、试管夹、酒精灯、滴管等;2. 实验药品:氯化铁、氯化铜、碳酸氢铵等;3. 教师准备好实验操作步骤。
教学内容和步骤:1. 引导学生回顾离子的概念,并介绍离子在化合物中的作用;2. 介绍常见的离子检验方法,如氯离子、铜离子、铁离子等的检验方法;3. 演示离子检验实验的操作步骤,指导学生进行操作;4. 学生自行操作进行离子检验实验,并记录实验结果;5. 教师引导学生讨论实验结果,并总结各种离子的检验方法。
教学方法:1. 演示法:由教师展示实验操作步骤,学生观看并学习;2. 实验操作:让学生亲自操作实验,提高实践能力;3. 思维导引:引导学生发现问题,并引导学生思考解决方法。
教学反馈:1. 教师在学生操作实验时随时观察和指导;2. 学生完成实验后,可让学生进行实验报告或实验结果汇总;3. 教师对学生的实验结果进行评价,提出指导意见。
课后作业:1. 巩固离子检验方法,复习学习内容;2. 思考如何应用离子检验方法解决实际问题。
教学反思:本节课重点在于引导学生掌握离子检验方法,通过实验操作提高学生的实践能力和思维能力,同时激发学生对化学实验的兴趣。
在教学过程中,要注意给予学生充分的实践机会和指导,以达到教学目标。


初中化学离子检验整理教案
一、教学目标
1. 了解化学离子检验的定义和原理。
2. 掌握化学离子检验的方法和步骤。
3. 能够根据实验结果判断离子的存在。
二、教学内容
1. 化学离子检验的定义和原理。
2. 常用的化学离子检验方法和步骤。
三、教学步骤
1. 引入
教师向学生介绍化学离子检验的概念,让学生了解化学离子检验的重要性和应用。
2. 学习化学离子检验的方法和步骤
a. 教师向学生介绍常用的化学离子检验方法,如氯离子检验、硫离子检验、铁离子检验等。
b. 教师演示化学离子检验的步骤,让学生了解实验操作的过程。
c. 学生分组进行化学离子检验实验,记录实验结果。
3. 总结与讨论
a. 教师与学生共同分析实验结果,让学生学会根据实验结果判断离子的存在。
b. 教师总结本节课的内容,强调化学离子检验的重要性并提醒学生应用所学知识。
四、课后作业
1. 回顾本节课学习的化学离子检验方法和步骤。
2. 完成一份离子检验实验报告,包括实验目的、方法、步骤、结果和结论。
五、教学反思
通过本节课的教学,学生应该能够掌握化学离子检验的方法和步骤,能够独立进行化学离
子检验实验,并根据实验结果判断离子的存在。
教师需要及时对学生的实验操作进行指导
和纠正,确保学生掌握了相关实验技能。
单一金属离子能被准确滴定的条件
准确滴定金属离子的条件是,金属离子必须是稳定的,且其表现出一定的易溶解性,这样才能保证滴定产生的结果准确无误。
1.离子的性质和稳定性
金属离子必须是稳定的,才能进行精确的滴定。
在滴定过程中,离子在反应溶液中的稳定性可以由其pH值来体现,只有在pH值不受外界影响的情况下,金属离子才会保持其稳定性,滴定才能取得准确的结果。
2.易溶解性
滴定的反应一般是金属离子和某种溶解媒与原子结合,所以金属离子要被滴定,必须是具有较高的易溶解性。
金属离子在反应能够溶解的前提下,才能保证滴定的准确性,从而取得准确的结果。
3.正确的滴定技术
正确的滴定技术对于确保滴定的准确性至关重要。
正确的滴定技术可以保证反应恒定速率、浓度一定,从而使滴定结果更加准确。
此外,还需要注意的是,滴定实验中使用的标准溶液的浓度也应该合适,以免影响滴定结果的准确度。
- 1 -。
1 1
潍坊职业学院 《化学分析技术》 单一金属离子被准确滴定的条件
教学要点:单一金属离子被准确滴定的条件
在配位滴定中,当目测终点与化学计量点二者pM(pM=-lg[M])的差值ΔpM 为±0.2pM
单位,允许的终点误差为±0.1%时,根据有关公式,可推导出准确测定单一金属离子的条件是
)(g 1MY cK =≥6 式中c 为金属离子的浓度。
对于l0-2 mol·L -l 的Zn 2+,则式)(g 1MY cK =≥6改写为
lg ZnY
K '≥8 将lg ZnY K =16.50,Ig ZnY K '≥8代入式Y(H)MY Y M ]Y [M][[MY]αK K ='=' ,可得lg αY(H)≤8.50,查表2-1-23
可知,当pH ≥4.0时,就可使lg α
Y(H)≤8.50,进而保证lg ZnY K '≥8,满足lg(MY K c ') ≥6的要求,即对l0-2mol·L -1的Zn 2+而言,当pH ≥4.0时,可以进行滴定;而pH<4.0,就不能保证准确测定,因而不能滴定,pH=4.0即为滴定l0-2m ol·L -1Zn 2+的最小pH 值。
实际测定某金属离子时,应将pH 值控制在大于最小pH 值且金属离子又不发生水解的范围之内。