从海水中获得化学物质的方法
- 格式:ppt
- 大小:5.19 MB
- 文档页数:34




《海水中的氯》氯的电解制备在我们生活的这个蓝色星球上,海洋占据了绝大部分的面积,而海水中蕴含着丰富的化学物质,其中氯就是一种重要的元素。
氯在工业、农业、医疗等众多领域都有着广泛的应用,那么如何从海水中获取氯呢?这就不得不提到氯的电解制备方法。
首先,让我们来了解一下为什么要从海水中提取氯。
氯的用途非常广泛,比如在制造塑料(如聚氯乙烯,PVC)时,氯是不可或缺的原料。
在消毒杀菌方面,氯气和含氯化合物也发挥着重要作用,常用于自来水消毒和游泳池水处理。
此外,氯还用于制造农药、药品等。
由于这些广泛的应用需求,从海水中提取氯成为了一种重要的工业生产方式。
那么,电解制备氯的原理是什么呢?这涉及到一些化学知识。
在电解槽中,通过直流电的作用,使海水中的氯化物发生电解反应。
通常,使用的电解质是氯化钠溶液,也就是我们常见的食盐水。
在电解过程中,氯化钠溶液中的钠离子(Na⁺)向阴极移动,在阴极上得到电子被还原为金属钠;而氯离子(Cl⁻)向阳极移动,在阳极上失去电子被氧化成氯气(Cl₂)。
这个电解反应的化学方程式可以表示为:2NaCl + 2H₂O =电解= 2NaOH + H₂↑ + Cl₂↑ 。
接下来,让我们看看电解槽的结构和工作条件。
电解槽一般由阳极、阴极、电解质溶液和隔膜等部分组成。
阳极通常采用耐腐蚀的材料,如钛涂钌等,以保证在电解过程中不会被腐蚀。
阴极则多使用碳钢等材料。
隔膜的作用是将阳极室和阴极室隔开,防止氯气和氢气混合,同时允许离子通过。
为了保证电解过程的顺利进行,还需要控制一系列的工作条件。
例如,电流密度、温度、电解质浓度等都需要在一定的范围内。
电流密度过高可能会导致电极的过度损耗和电能的浪费,过低则会影响生产效率。
温度的控制也很重要,过高或过低都会影响电解反应的速率和效率。
电解质浓度则需要保持在一个合适的水平,以保证良好的导电性和反应速率。
在实际的工业生产中,电解制备氯的过程还需要考虑许多其他因素。
比如,如何有效地收集和处理产生的氯气,以防止对环境造成污染;如何提高电解槽的使用寿命和稳定性,降低生产成本;如何保证生产过程的安全性,防止氯气泄漏等事故的发生。

海水中提取碘的原理海水中提取碘的原理主要是利用两个方法,即氯气氧化法和电解法。
氯气氧化法是最常用的方法之一。
在这个过程中,首先将海水通过多级沉淀和过滤操作,去除杂质和悬浮性物质。
然后,将得到的纯净海水与氯气通入集成釜中。
氯气会与海水中的碘化物发生氧化反应,将碘化物转化为游离的碘气。
通入氯气的速度和温度是控制碘气生成速度和收率的重要因素。
在这个过程中,碘化物(如碘化钠NaI)被氧化为碘气(I2),并且ions损失一个电子成为碘原子。
这个反应的化学方程式可以写为:2NaI + Cl2 →I2 + 2NaCl得到的碘气通过冷凝器冷却,将其从气态转化为液态。
这种液态的碘也被称为碘水。
然后,通过物理方法(如蒸馏、萃取等)将碘从碘水中分离出来并得到纯净的碘。
这个过程中,氯化钠(即食盐)也同时生成并被分离出来。
这种方法可以将海水中的碘含量提高数百倍,并获得比较纯净的碘。
电解法是另一种提取碘的方法。
在这个过程中,将海水与碘负载电极(阳极)和金属(如钛或钛合金)电极(阴极)之间形成一个电解池。
通过电解,海水中的碘化物离子(I-)会在阳极上析出,并生成碘气。
在阴极上,水分子会发生还原反应,生成氢气。
这个过程的化学反应可以写为:在阳极上:2I- →I2 + 2e-在阴极上:2H2O + 2e- →H2 + 2OH-通过这个电解过程,碘会从海水中分离出来,并从阳极上收集碘气。
此时,阴极产生的氢气和产生的氢氧化物(OH-)可以再次被用作生产氯气的原料。
这两种方法本质上是将存在于海水中的碘化物离子氧化为碘气,并将其从海水中分离出来。
不同的方法会根据实际需求和可行性的不同而选择。
氯气氧化法简单易行,但需要较高的氯气消耗。
电解法则相对复杂,但能够提高碘收集效率并同时生产其他有用的化学品。
总结来说,海水中提取碘的原理主要是通过将海水中的碘化物氧化为碘气,然后通过物理和化学方法将其从海水中分离出来,得到纯净的碘。
这种方法具有较高的提取效率和良好的可行性,已经被广泛应用于工业生产和海水淡化等领域。

富集在海水中的元素氯然而,尽管氯在海水中的丰度很高,但目前尚未发现利用氯从海水中提取的实用方法。
主要原因是氯在海水中的浓度相对较低,且与其他离子混合在一起。
提取氯的主要方法是通过卤水中的电解或盐湖提取。
这些方法依赖于地下卤水或盐湖中高浓度的氯离子。
电解方法是通过将卤水置于电解池中,然后通过施加电压来分解水中的氯化物离子。
这个过程称为电解反应。
在电解池中,氯化物离子(Cl-)被氧化成氯气(Cl2),同时还会产生氢气(H2)和水(H2O)。
这种方法可以提取氯气,但是由于需要大量的能源,因此不适合从海水中提取氯。
另一种提取氯的方法是盐湖提取。
一些地区有富含氯离子的盐湖,如美国的盐湖城和印度的拉贾斯坦邦。
在这种方法中,盐湖水先被蒸发,然后通过一系列的盐田进行处理和纯化,最终产生氯和其他盐类。
然而,这种方法只适用于具有高浓度氯离子的盐湖,不适用于海水。
尽管目前从海水中直接提取氯的方法尚不实用,但有一些其他方法可以从海水中提取其他有价值的化学物质,其中包括氯。
例如,目前有一种技术被称为气候工程,可以通过从海水中提取氯化物离子来控制二氧化碳(CO2)的浓度。
通过从海水中提取氯化物离子,可以增加海水中其它离子如碳酸根的含量,这有助于吸收大气中的二氧化碳。
这种方法可以作为一种控制气候变化的手段。
综上所述,虽然氯在海水中存在丰富,但目前尚未开发出直接从海水中提取氯的实际方法。
然而,其他一些方法可以通过从海水中提取氯化物离子,来应用于其他方面,如气候工程。
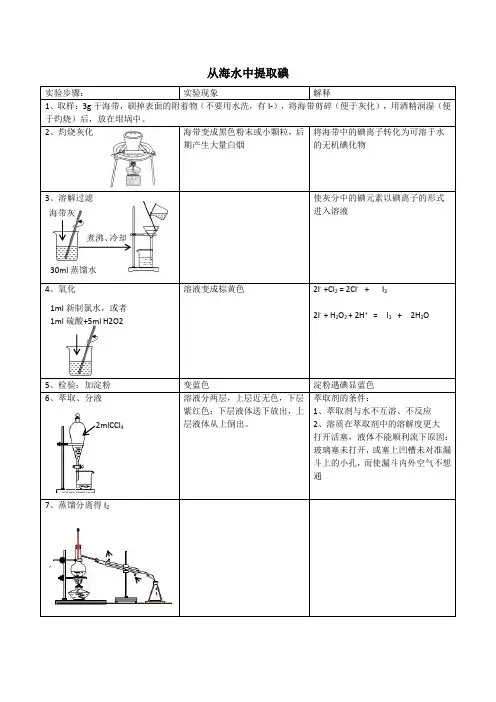
从海水中提取碘实验步骤:实验现象解释1、取样:3g干海带,刷掉表面的附着物(不要用水洗,有I-),将海带剪碎(便于灰化),用酒精润湿(便于灼烧)后,放在坩埚中。
2、灼烧灰化海带变成黑色粉末或小颗粒,后期产生大量白烟将海带中的碘离子转化为可溶于水的无机碘化物3、溶解过滤使灰分中的碘元素以碘离子的形式进入溶液4、氧化溶液变成棕黄色2I- +Cl2 = 2Cl-+ I22I- + H2O2 + 2H+ = I2 + 2H2O5、检验:加淀粉变蓝色淀粉遇碘显蓝色6、萃取、分液溶液分两层,上层近无色,下层紫红色;下层液体送下放出,上层液体从上倒出。
萃取剂的条件:1、萃取剂与水不互溶、不反应2、溶质在萃取剂中的溶解度更大打开活塞,液体不能顺利流下原因:玻璃塞未打开,或塞上凹槽未对准漏斗上的小孔,而使漏斗内外空气不想通7、蒸馏分离得I2海带灰30ml蒸馏水煮沸、冷却1ml新制氯水,或者1ml硫酸+5ml H2O22mlCCl4一、某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取。
实验(一)碘含量的测定取的标准溶液装入滴定管,取海带浸取原液至滴定池,用电势滴定法测定碘含量。
测的的电动势反映溶液中的变化,部分数据如下表:实验(二)碘的制取另制海带浸取原液,甲、乙两种实验方案如下:已知:请回答:(1)实验(一)中的仪器名称:仪器A ,仪器B 。
(2)①根据表中数据绘制滴定曲线:②该次滴定终点时用去溶液的体积为,计算得海带中碘的百分含量为。
(3)①分液漏斗使用前须检漏,检漏方法为:②步骤X中,萃取后分液漏斗内观察到的现象是:③下列有关步骤Y的说法,正确的是:A.应控制溶液的浓度和体积B.将碘转化成离子进入水层C.主要是除去海带浸取原液中的有机杂质D.溶液可以由乙醇代替④实验(二)中操作Z的名称是:(4)方案甲中采用蒸馏不合理,理由是:二、空气吹出法工艺,是目前“海水提溴”的最主要方法之一。
其工艺流程如下:(1)溴在周期表中位于_________周期,_________族。

海水中磷酸盐的去除方法引言磷酸盐是一类常见的无机盐,广泛存在于自然界中的土壤、水体和生物体中。
然而,过量的磷酸盐会导致水体富营养化,引发藻类大量繁殖,对水生态环境造成严重破坏。
海水中的磷酸盐含量相对较低,但大规模海水利用和海洋养殖等活动的发展,使得海水中的磷酸盐浓度逐渐增加,需要采取适当的方法进行去除。
本文将介绍海水中磷酸盐的去除方法,包括物理方法、化学方法和生物方法。
一、物理方法物理方法是通过物理手段将磷酸盐从海水中分离出来,常用的物理方法包括离心、超滤和吸附。
1. 离心离心是利用离心机产生的离心力将磷酸盐颗粒从海水中分离出来的方法。
通过调整离心机的转速和离心时间,可以将磷酸盐颗粒从海水中沉淀出来,然后将上清液倒掉,得到含有磷酸盐的沉淀物。
2. 超滤超滤是利用超滤膜的孔径选择性分离磷酸盐的方法。
超滤膜的孔径通常在0.01-0.1微米之间,可以将磷酸盐颗粒和其他溶解物分离开来。
将海水通过超滤膜进行过滤,可以得到磷酸盐浓度较低的过滤液。
3. 吸附吸附是利用吸附剂将磷酸盐从海水中吸附到固体表面上的方法。
常用的吸附剂包括活性炭、氧化铝和硅胶等。
将海水与吸附剂接触,磷酸盐会被吸附剂表面的活性位点吸附住,从而实现磷酸盐的去除。
二、化学方法化学方法是通过化学反应将磷酸盐转化为难溶性沉淀物,从而实现磷酸盐的去除。
常用的化学方法包括沉淀法、络合沉淀法和电化学法。
1. 沉淀法沉淀法是利用化学反应产生的沉淀物将磷酸盐从海水中去除的方法。
常用的沉淀剂包括氢氧化钙、磷酸铝和氯化铁等。
将沉淀剂加入海水中,与磷酸盐发生反应生成难溶性沉淀物,然后通过沉淀和过滤等步骤将沉淀物与海水分离。
2. 络合沉淀法络合沉淀法是利用络合剂与磷酸盐形成络合物,再与沉淀剂产生沉淀反应将磷酸盐去除的方法。
常用的络合剂包括聚磷酸盐和聚合物等,常用的沉淀剂与上述的沉淀法相同。
络合剂与磷酸盐形成络合物后,再与沉淀剂发生反应生成难溶性沉淀物,最终将磷酸盐去除。

海水提溴流程
海水提溴是一种重要的化学过程,它可以从海水中提取出溴元素,为工业生产和科学研究提供了重要原料。
下面将介绍海水提溴的流程及相关操作步骤。
首先,收集海水样品。
在进行海水提溴实验之前,首先需要收集足够的海水样品作为实验材料。
通常可以使用专业的采样瓶或者其他密封容器来收集海水样品,确保样品的纯净度和新鲜度。
其次,预处理海水样品。
海水中含有大量的杂质和盐类物质,需要进行预处理才能进行后续的提溴操作。
可以通过过滤、沉淀、蒸发等方法将海水中的杂质和盐类物质去除,得到较为纯净的海水样品。
接着,进行提溴操作。
将预处理后的海水样品置于提溴设备中,通常采用电解或化学反应的方式来提取溴元素。
在提溴过程中,需要控制好温度、压力和反应时间等参数,确保提溴反应能够顺利进行并且得到高纯度的溴元素。
随后,分离和提纯溴元素。
提取出的含溴物质需要进行分离和提纯,通常可以采用蒸馏、结晶、萃取等方法来分离和提纯溴元素,得到高纯度的溴化合物或者溴单质。
最后,进行溴元素的分析和检测。
得到溴元素后,需要进行分析和检测,确保其纯度和质量符合要求。
可以采用化学分析方法、光谱分析方法等对溴元素进行定性和定量分析,确保提取的溴元素达到工业或科研应用的标准。
在海水提溴的整个流程中,需要严格控制各个环节的操作条件,确保提取的溴元素具有较高的纯度和质量。
同时,还需要注意安全操作,防止溴元素对人体和环境造成危害。
综上所述,海水提溴是一个复杂而重要的化学过程,需要在实验室或工业生产中进行严格控制和操作,以确保提取的溴元素能够满足实际需求。


海水中蕴含着丰富的元素,元素周期表中列出的110多种元素,有80多种在海水中能找到。
这些元素大部分以盐的形式存在,其中NaCl的含量较高,食盐主要是用海水晒盐的方法获得,氯碱工业就是以食盐为原料进行生产的。
从海水中还可以提取出MgCl2,然后电解MgCl2得到金属镁,还能提炼出溴、碘等,可以说,海水是一个巨大的化学资源宝库。
【重点难点】重点:从海水中获取NaCl、Mg、Br2。
难点:氯碱工业,提取镁、溴的化学原理。
【知识讲解】地壳中含有丰富的元素,而海水占地球表面的70%以上,其中蕴含的元素更丰富,研究海水中的化学资源,就能从海水中得到很多有用的物质。
一、海水——化学元素宝库1、海水中含丰富的元素元素周期表中的110多种元素,海水中含有80多种,而且海水的量又比较多,故有些元素的含量极其丰富,有很大的开采、使用价值。
2、海水中各种元素的来源海水中的这些元素,是通过河流、大气及海底火山活动等途径,从地球的其他圈层进入海洋的。
由陆地河流和大气进入海洋的物质,90%是由江河输入海洋的,10%由冰和大气尘埃输入。
虽然来源不同,输入海洋的物质的数量随地理位置和时间的不同而有所变化,但海水的浩大,还能使某一海区海水的性质趋于一致。
3、海水中的常量元素和微量元素(1)常量元素:每升海水中含量大于1mg 的元素为常量元素。
常见的常量元素有Cl、Na、Mg、S、Ca、K、C、Sr、Br、B、F这11种元素,它们的总量占海水所溶解物质总量的99.9%。
Cl、Na两种元素的含量最高,海水中NaCl 的含量特别丰富。
(2)微量元素:每升海水中含量低于1mg的元素称为微量元素。
虽然微量元素的含量较低,但由于海水的质量很大,故含的这些元素的质量也很可观,还是有很大的开采价值,如:海水中锂元素的含量达到2.5×1011吨,而锂可用于制造心脏起博器中的锂电池,是热核反应的重要材料之一。
铀元素(235U)用做制原子弹和核反应堆的燃料,1kg235U全部裂变释放的能量相当于2500吨优质煤燃烧释放出的能量,故铀的使用价值相当大。
【高中化学】高中化学知识点:海水资源的综合利用海水资源的综合利用:浩瀚的海洋是个巨大的资源宝库,它不仅孕育着无数的生命,还孕育着丰富的矿产,而海水本身含有大量的化学物质,又是宝贵的化学资源。
可从海水中提取大量的食盐、镁、溴、碘、钾等有用物质,海水素有“液体工业原料”之美誉。
海水制盐:(1)海水制盐的方法:从海水中得到食盐的方法有蒸发法(盐田法)、电渗析法等。
目前,以蒸发法(盐田法)为主。
(2)海水晒盐的基本原理:水分不断冷却,氯化钠等盐结晶划出。
(3)海水晒盐的流程氯碱工业:(1)食盐水的精制(2)电极反应阴极:阳极:总反应::(3)主要设备色谱法膜电解槽一一阳极用金属钛(表面涂抹存有钛、绑氧化物层)做成,阴极用碳钢(覆有镍镀层)做成。
阳离子膜具备挑选借由性,只容许na+借由,而cl-、oh一和气体无法借由。
(4)产品及用途烧碱:可以用作造纸、玻璃、肥皂等工业氯气:可用于制农药、有机合成、氯化物的合成氢气:可以用作金属炼钢、有机合成、盐酸的制备海水提溴:(1)氯化氯化氧化溴离子,在ph=3.5的酸性条件下效果最好,所以在氯化之前要将海水酸化。
(2)吹起出来当海水中的br一被氧化成br2以后,用空气将其吹出。
另外,也可以用水蒸气,使溴和水蒸气一起蒸出。
(3)稀释目前比较多的是用二氧化硫作还原剂,使溴单质转化为hbr,再用氯气将其氧化得到溴产品。
化学方程式如下:海水加镁:(1)工艺流程(2)主要化学反应①制备石灰乳:②结晶③制备从海水中抽取重水:提取重水的方法:蒸馏法、电解法、化学交换法、吸附法等。
常用方法:化学交换法(硫化氢一水双温交换法)铀和重水目前就是核能研发中的关键原料,从海水中抽取铀和重水对一个国家来说具备战略意义,化学在研发海洋药物方面也将充分发挥越来越小的促进作用。
潮汐能、波浪能也就是越来越受到重视的新型能源。
从海水中提取食盐的方法
从海水中提取食盐的方法:将海水引入海滩上的盐田里,利用日光和风力逐渐使水蒸发,慢慢浓缩,使食盐呈结晶析出,从盐卤中提取氯化钾晒盐后剩下的盐卤中含有氯化钾、氯化镁,还含有少量氯化钠。
从海水中提取食盐的方法步骤:
一、几千年以前最古老的方法是"火煮盐法",就是用火把海水煮干,得到白色的海盐。
后来又发明了"日晒法",就是在海滩上辟出盐田,趁涨潮从海里引人海水,或者把海水用泵抽入到盐田,天晴时靠阳光把海水晒干,结晶出来的就是盐了。
另外还有一种电渗析的方法,这种方法不需要很大的场地。
二、从海水中提取盐最简单的方法
一个是蒸馏法,将水蒸发而盐留下,再将水蒸气冷凝为液态淡水。
这个过程与海水逐渐变咸的过程是类似的,只不过人类要攫取的是淡水。
另一个海水淡化的方法是冷冻法,冷冻海水,使之结冰,在液态淡水变成固态的冰的同时,盐被分离了出去。
两种方法都有难以克服的弊病。
蒸馏法会消耗大量的能源,并在仪器里产生大量的锅垢,相反得
到的淡水却并不多。
这是一种很不划算的方式,冷冻法同样要消耗许多能源。
三、化学提取法
可利用三种物质溶解度的不同将它们分离开来.分析三种物质的溶解度可知,室温(20℃)时,氯化镁的溶解度(54.3克)大于氯化钾和氯化钠的溶解度.因此,在室温时向混合物中加适量水,就可将大部分氯化镁溶解在水中,从而可分离除去氯化镁.然后根据在27℃以下氯化钾的溶解度小于氯化钠的溶解度的特点,向剩余的混合物中第二次加适量水,就可将氯化钠溶解于水,从而得到氯化钾粗品.将粗品氯化钾进一步进行结晶和重结晶,可得到精制的氯化钾。
用海水提取食盐的原理海水提取食盐是利用海水中含有高浓度的氯化钠(NaCl)来制备食盐的过程。
以下将详细介绍海水提取食盐的原理。
海水是由各种溶解在其中的物质组成的混合物,其中最主要的成分是氯化钠。
海水中的其他溶解物质包括硫酸镁、硫酸钠、硫酸钾、钙、氯化钙、硫酸镍和硫酸锶等。
为了提取食盐,首先需要将海水中的无用溶解物质去除,然后通过蒸发使水分蒸发掉,最终得到纯净的食盐。
海水提取食盐的过程可以分为以下几个步骤:1.初步处理:从海洋中取得海水,将其中的大颗粒杂质如悬浮物、沉积物等通过过滤等方法去除。
2.除去硫酸镁:海水中主要的无机盐之一是硫酸镁(MgSO4),它是一种苦味物质,可能影响食盐的食用品质。
因此,在剩下处理之前需要通过化学反应去除硫酸镁。
这一步可以通过与氢氧化钠反应来实现。
氢氧化钠与硫酸镁作用生成氢氧化镁沉淀(Mg(OH)2)。
反应方程式为:MgSO4 + 2NaOH →Mg(OH)2 + Na2SO4生成的氢氧化镁沉淀可以沉淀出来,从而将硫酸镁从海水中除去。
3.除去其他杂质:海水中还含有一些其他无机盐,如硫酸钠(Na2SO4)、硫酸钾(K2SO4)、钙(Ca)等。
这些无机盐对食盐的品质可能造成影响,因此需要将它们去除。
可通过多效蒸发器、真空蒸发器等方式进行蒸发作用,使海水中的水分逐渐蒸发,而其中的盐分逐渐增加。
为了提高蒸发的效率,可以通过多效蒸发器的返流装置将热蒸汽反复循环利用,从而使得蒸发的效率得到提高。
4.结晶分离:当蒸发过程持续进行,海水中含有的水分逐渐蒸发,最终由盐分组成的饱和溶液形成。
在饱和溶液中盐的浓度很高,因此当继续蒸发时,盐会结晶出来。
这一步需要将饱和溶液放置在结晶容器中,通过自然蒸发或提高温度等方法来催化结晶。
随着结晶的进行,食盐会逐渐形成,而其他杂质则会留在溶液中。
5.干燥收集:经过结晶分离后,得到的食盐结晶还包含有一定的水分。
为了得到干燥的食盐,需要将食盐结晶进行干燥处理,常用的干燥方法有自然干燥和热风干燥等。
第二课时从海水中提取镁从海带中提取碘必备知识基础练进阶训练第一层知识点一海水提镁1.海水中含有MgCl2,是镁的重要来源之一。
从海水中提取镁,可以按照如下步骤:①把贝壳制成石灰乳;②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物;③将沉淀物与盐酸反应,结晶、过滤、干燥产物;④将所得产物熔融后电解。
关于提取镁,下列说法不正确的是()A.此法的优点之一是原料来源丰富B.进行①②③步操作的目的是从海水中提取MgCl2C.第④步电解会产生Cl2D.以上提取镁的过程中涉及到的反应有分解反应、化合反应和置换反应知识点二镁的性质2.下列物质的转化不能通过一步反应实现的是()A.Mg→MgO B.MgO→Mg(OH)2C.MgO→MgCl2D.MgCl2→Mg(OH)23.下列有关说法正确的是()A.镁燃烧发出耀眼的红光,因此常用来制造信号弹和焰火B.自然界中的镁主要以单质的形式存在于地壳和海水中C.镁着火可用泡沫灭火器扑灭D.电解熔融的MgCl2可得到金属镁4.镁条在二氧化碳中剧烈燃烧,瓶壁有黑色和白色粉末,不能说明()A.二氧化碳显氧化性B.二氧化碳中含有碳元素C.二氧化碳是酸性氧化物D.助燃和不助燃是相对的知识点三海带提碘5.海带中含碘元素,有人设计了以下步骤来提取碘:①通足量氯气 ②将海带烧成灰,向灰中加水搅拌 ③加入CCl 4,振荡 ④过滤 ⑤用分液漏斗分液合理的操作顺序为( )A .②④①③⑤B .②①③④⑤C .①③⑤②④D .③①②⑤④6.从海带中提取碘的实验过程中,涉及下列操作,其中正确的是( )知识点四 加碘盐中碘元素的检验7.加碘食盐中碘元素以碘酸根(IO -3 )的形式存在。
已知在酸性条件下,IO -3 离子能跟碘离子(I -)发生反应生成碘(I 2),碘能使淀粉变色。
现提供下列试剂和生活中常见的物质:①碘化钾溶液(溶液中含有I -);②白醋;③白糖;④白酒;⑤纯碱;⑥淀粉。
欲通过实验证明加碘食盐中存在碘酸根离子,必须选用的试剂和物质是( )A .①②③B .①②⑥C .①⑤⑥D .②④⑤关键能力综合练 进阶训练第二层一、选择题:每小题只有一个选项符合题意。