从海水中获得的化学物质a
- 格式:doc
- 大小:60.50 KB
- 文档页数:5
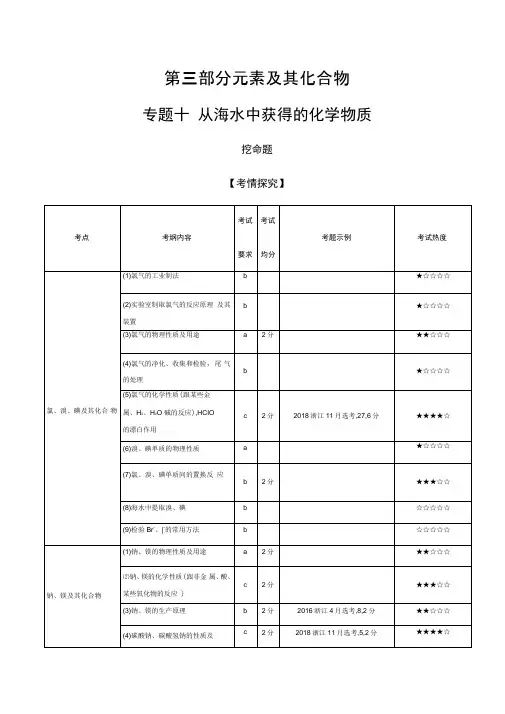
第三部分元素及其化合物专题十从海水中获得的化学物质挖命题【考情探究】分析解读本专题选择题重点考查点有二:一是氯气的性质及用途;二是钠、碳酸钠和碳酸氢钠的性质及用途,试题难度不大。
主观题部分单独命题的可能性不大 ,通常以元素化合物知识为载体,融离子反应、氧化 还原反应、反应速率与化学平衡、电化学及盐类的水解与电离等知识于一体进行考查。
预计今后高考对本 专题内容的考查方式基本不变。
【真题典例】--------------------------------------------------------- 於-(2018^11月选夸.27・6分}已知化讣物耳甫1种无武蛆盛*莘学习小範 进行丁如下实验:① 飙适贲X.加水完全瀋解.无气体产生*擀浚呈喊性;进甘焰色反应、 进过蓝色姑玻璃现泉到火焰呈購色 ②詳溥十水* iDA^HClO^OOftnol 的盐戕恰好屮狗;屮和右闸得蒂權与硝酸战化的过駄曲阻間液反逼•穆^14305曲色观金 谓岡答* 1(悄中3神无素是 _________ (用元素挣号表加)◎肚宾与比反应的化学片程式尼 __________________________________________[3JX 中-种尤我对应的单匮,可与足童的屉落襪反应谓到(斗打马川厦 反应的化学方程式;破考点 【考点集训】考点一 氯、溴、碘及其化合物1.(2019届浙江宁波镇海中学高一单元测试 ,6)下列离子方程式正确的是( )① 氯气与水反应:Cl 2+H — 2H ++CI+CI0-; ② 氯气与氢氧化钠溶液反应:Cl 2+2OHCl -+CIO+HO;■o itfflX'F 暂評屯虜.■ Q 長鸣儿耳TvK 乂匚兀。
为认 KCH*丄乂虫T.飆』o 檢心當点I, 物庫曲址的肖誥计卑 ♦甜LR 其去突此合输的性虜❷能力要求卄显时踪合论他力、力利恢 1受新知训及扶临有恢偵嵐繼力的考畫. @解题思路⑴根谣①和M 综合拆斷十135诅和木反 应生廣0E mnl SI 和n.H2 rnJ K 〔Hi ・曲*厂 <\ II II.-I^KIJ ■…. .|-I II : wl- ''ll| ] Z \ i' 恻 EX 刑ClgUU ind K ?9 肿iud+A5,脚叔”I flfil niDixlJad :由”化含辆、祁种元議 ffljR'W t 览合將中可舐飭扛元竄咸耙 元札Hff 9UK^AM«元轧K*廉的量为QDlnd*所口负为£00〔期L K 反应的化爭方程式为血H.U = 2K0H+Kd«(3)1CL+H J1O= 2IKI +CLO , 2Xd.CO J +2UU^^2\.^i j+2XdllU). HlhliW 2O S +2N^C0^M 3O=^!NJ1C0J +4 2\da+u,o "❹易信谆示勉引问屮色输35解液足ht.姑訴 月星式蜡写肖2“尹制屮1%^=1珂f +4 2Xd (J+< 1J ).❺答案(1M <X 0aiK/304^ ----------- BKOfbKi I(3)2N^C01+2O 1+H 1Q^-€l ]p4lNflH(:O.+2Nut3❺规律总结 几柑"瘪礼曲:牡徳闌息凰略_ (龙族Hi 实益議探中晡冇息山及魁] 谭赵卜T 估£1-什小时乩忡珀样屮附 e\~^救辿,衍nt W>5 p $疋逍L .2•「172.-5 于 4 I'' I'- I'f . 样丈霽直班叩Vr 域的愛邑*所毎辆 甩冷:咛F ;屮吋詁I <t-r i i(t<.- 址吐枠冷一馭Fhi.EL 4 n 餐盜CT * 山Z'.M iq, Bfi 册 厲、抻立M 豪.大IHfltt,金ID# ^iirffiriio (Viwn 跡 质的无盍,期股的化学KlUJtAOi f7'.>ntt'":详式△③浓盐酸与二氧化锰共热:MnC2+4HCI(浓)Mn2++2CI+Cl2 f +2H0;④漂白粉溶液中通入少量的二氧化碳气体:Ca2++2CIO +HO+C — CaCO J +2HCIQA. ①③B.②④C.②③D.①④答案B2. (2019届浙江温州瑞安中学单元检测,3)下列与含氯化合物有关的说法正确的是()A. HCIO是弱酸,所以NaCIO是弱电解质B. 向沸水中逐滴加入少量饱和FeCb溶液,可制得Fe(OH)3胶体C. HCI溶液和NaCI溶液均通过离子导电,所以HCI和NaCI均是离子化合物D. 电解NaCI溶液得到22.4 L H 2(标准状况),理论上需要转移N A个电子(N A表示阿伏加德罗常数)答案B3. (2018浙江武义一中高一期末,12)已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图所示装置进行氯、溴、碘的性质实验。





第2课时从海水中提取镁从海带中提取碘课后篇素养形成合格考达标练1.碘元素在下列物质中以单质存在的是( )A.碘酒B.海带C.含碘食盐D.人工降雨剂,A符合题目要求;海带中碘元素以化合态的形式存在,B不符合题目要求;含碘食盐中碘元素以碘酸钾的形式存在,C不符合题目要求;人工降雨剂中碘元素以碘化银的形式存在,D不符合题目要求。
2.现有三组溶液:①汽油和氯化钠溶液②碘的CCl4溶液③氯化钠和单质溴的水溶液,分离以上各混合物的正确方法依次是( )A.萃取、蒸发、分液B.分液、蒸馏、萃取C.分液、萃取、蒸馏D.蒸馏、萃取、分液,可用分液的方法分离。
②分离碘的CCl4溶液可利用溶质与溶剂的沸点不同,用蒸馏的方法分离。
③溴单质在水中溶解度小,而在有机溶剂如苯、汽油中溶解度大,有机溶剂与水互不相溶,分离氯化钠水溶液中的单质溴,可以向其中加入苯或汽油萃取,然后分液。
故分离以上各混合液的正确方法依次是分液、蒸馏、萃取,B正确。
3.实验室用水浸取干海带制取纯碘主要包含的步骤有:①通氯气氧化②用CCl4萃取分液③在碘的CCl4溶液中加入NaOH溶液反萃取(转化为NaI 和NaIO3)并分液④水相用硫酸酸化分离出粗碘⑤干燥后加适量KI固体(将IBr和ICl转化为I2、KBr及KCl)混匀加热得纯碘等。
选择下列装置进行实验:下列说法错误的是( )A.步骤①可利用甲装置氧化I-B.步骤②③分液操作时可用乙装置:先放出有机相,再放出水相C.步骤④可用丙装置将碘与母液分离D.步骤⑤可用丁装置升华法提纯碘I-,A项正确;步骤②③为分液操作,有机相在下层,先放出有机相,再从上口倒出水相,B项错误;④水相用硫酸酸化后生成碘单质,可利用过滤法分离出粗碘,C项正确;步骤⑤可用丁装置升华提纯碘,D项正确。
4.某课外小组将灼烧海带产生的灰烬浸泡后过滤,得到澄清的滤液。
他们设计了如下几个方案,你认为能证明海带灼烧后的灰烬中含有碘元素的是( )A.取适量滤液,蒸干,观察是否有紫色固体生成B.取适量滤液,加入苯,振荡,静置,苯层无色,证明不含碘元素C.取适量滤液,向其中加入淀粉溶液,无明显现象,证明不含碘元素D.取适量滤液,加入酸化的H2O2溶液,再加入淀粉溶液,溶液呈蓝色证明含有碘元素5.在盛有碘水的试管中,加入少量CCl4后振荡,静置片刻后( )A.整个溶液变紫色B.上层为无色,下层为紫红色C.整个溶液变为棕黄色D.下层无色,上层紫红色CCl4,碘单质从水中转移到CCl4中,由于CCl4密度大于水,故试管中出现分层,且CCl4在下层为紫红色,上层为无色,B正确。

一、选择题1.从铝土矿中提取铝的工艺流程图如下:下列叙述正确的是A .过程①应用了氧化铝具有碱性氧化物的性质B .过程②中生成氢氧化铝和碳酸氢钠C .过程③发生的反应类型属于氧化还原反应D .过程④也可以用热还原法代替电解法冶炼铝2.铅的冶炼大致过程如下:①富集:将方铅矿(PbS)进行浮选;②焙烧:2PbS+3O 2焙烧2PbO+2SO 2;③制粗铅:PbO+ C ΔPb+CO↑;PbO+CO ΔPb+CO 2。
下列说法错误的是A .浮选法富集方铅矿的过程,属于物理变化B .将l molPbS 冶炼成Pb ,理论上至少需要6 g 碳C .方铅矿焙烧反应中,PbS 是还原剂,还原产物只有PbOD .焙烧过程中,每生成l molPbO 转移6 mol 电子3.中华传统文化中蕴藏丰富的化学知识。
下列说法正确的是A .“高奴县石脂水,水腻,浮上如漆,采以膏车及燃灯极明”中的“石脂水”为油脂B .“凡石灰经火焚……风中久自吹化成粉”中的“粉”为氧化钙C .“盖此矾色绿味酸,烧之则赤……”中“矾”为五水硫酸铜D .“土鼎者……入砂于鼎中,用阴阳火候飞伏之”中“土鼎”的主要成分为硅酸盐4.“绿色化学”提倡,设计制备物质的方案时,要从经济、环保和技术等方面考虑,以下由铜制取硝酸铜的四种方案中,比较符合“绿色化学”概念且可行的方案是A .Cu → Cu(NO 3)2B .Cu → CuO →Cu(NO 3)2C .Cu → CuCl 2 →Cu(NO 3)2D .Cu → CuSO 4 →Cu(NO 3)25.下列冶炼金属的原理中,属于热还原法的是( )A .Fe+CuSO 4= FeSO 4+CuB .MgCl 2(熔融)电解Mg+Cl 2↑C .2Ag 2O Δ4Ag+O 2↑D .Fe 2O 3+3CO 高温2Fe+3CO 26.塑料、合成橡胶和合成纤维这三大类合成材料,都主要是以石油、煤和天然气为原料生产的,下列有关说法错误的是A .天然气作为化工原料主要用于合成氨和生产甲醇B .煤可以直接液化,煤与氢气作用生成液体燃料C .乙烯、丙烯、甲烷等主要化工基本原料都可以由石油分馏得到D .聚乙烯塑料的主要成分聚乙烯是由乙烯通过聚合反应制得的7.“共享单车”方便出行,低碳环保。



镁的提取及应用一、选择题1.海水是镁的主要来源之一。
从海水中提取镁可按如下步骤进行:①把贝壳制成石灰乳;②在引入的海水中加入石灰乳,沉降、洗涤、过滤沉淀物;③将沉淀物与盐酸反应,结晶、过滤、干燥产物;④电解得到产物。
下列关于提取镁的说法不正确的是( )A.此法的优点之一是原料取自大海B.进行①②③步骤的目的是富集MgCl2C.可用电解熔融氧化镁的方法制取镁D.电解冶炼镁要消耗大量电能解析:由于MgO的熔点高,不能使用电解熔融MgO的方法冶炼Mg。
答案:C2.某化合物为Mg2(OH)m RO3·n H2O(m、n均为常数),则R的化合价为( ) A.+4 B.+(m+2)C.+(2m+2) D.+(4+m-2n)答案:B3.海水中含有氯化镁,是镁的重要来源之一。
下列从海水中提取镁涉及的化学方程式中,不正确的是( )A.制石灰乳:CaO+H2O===Ca(OH)2B.制Mg(OH)2:MgCl2+Ca(OH)2===Mg(OH)2↓+CaCl2C.制MgCl2:Mg(OH)2+2HCl===MgCl2+2H2OD.制Mg,在MgCl2溶液中加Na:MgCl2+2Na===2NaCl+Mg解析:氧化钙和水反应生成氢氧化钙,氢氧化钙溶解度小可以形成悬浊液,反应化学方程式为CaO+H2O===Ca(OH)2,A项正确;氯化镁和氢氧化钙反应生成更难溶的氢氧化镁沉淀:MgCl2+Ca(OH)2===Mg(OH)2↓+CaCl2,B项正确;用氢氧化镁和盐酸可以制取MgCl2:Mg(OH)2+2HCl===MgCl2+2H2O,C项正确;在MgCl2溶液中加Na,钠是活泼金属,在水溶液中和水剧烈反应生成氢氧化钠和氢气,氢氧化钠和氯化镁反应生成氢氧化镁沉淀,得不到金属镁,金属镁一般用电解熔融氯化镁得到,D项错误。
答案:D4.将相同质量的镁条分别放在①O 2;②N 2;③空气;④CO 2中燃烧,将燃烧后所得的固体产物按质量由小到大的顺序排列的是( ) A .②①③④ B .③②①④ C .④③②①D .②③①④解析:设1 mol 镁分别在①O 2;②N 2;③空气;④CO 2中燃烧,燃烧后所得的固体产物质量分别为40 g 、33.3 g 、大于33.3 g 但小于40 g 、46 g ,由小到大的顺序排列的是②③①④。

第5课时溴、碘的提取[学习目标定位]1。
了解从海水或海产品中提取溴、碘单质的基本原理和方法。
2.知道氯、溴、碘单质的性质及其差异。
3。
掌握Cl-、Br-、I-的检验方法。
一、氯、溴、碘的性质比较1.根据所熟悉的有关知识,填写下表:性质氯气(Cl2)溴(Br2)碘(I2)颜色黄绿色深红棕色紫黑色状态气体液体固体溶解性能溶于水,易溶于有机溶剂溴和碘在水中的溶解度很小,但易溶于酒精、四氯化碳等有机溶剂溶液颜色水中黄绿色,CCl4中黄绿色水中黄→橙,CCl4中橙→橙红水中棕→褐,CCl4中紫→紫红2.Cl2、Br2、I2的氧化性比较(1)NaBr溶液错误!溶液由无色变为橙色错误!溶液分层,下层液体呈橙红色。
化学方程式为2NaBr+Cl2===2NaCl+Br2。
结论:氧化性:Cl2>Br2。
(2)KI溶液错误!溶液由无色变为褐色错误!溶液分层,下层液体呈紫红色。
化学方程式为2KI+Cl2===2KCl+I2。
结论:氧化性:Cl2>I2.(3)KI溶液错误!溶液由无色变为褐色错误!溶液分层,下层液体呈紫红色。
化学方程式为2KI+Br2===2KBr+I2.结论:氧化性:Br2>I2。
3.将下列各实验中的现象填入下表:生成溶解(1)请写出实验中的化学方程式:①NaCl+AgNO3===AgCl↓+NaNO3;②NaBr+AgNO3===AgBr↓+NaNO3;③NaI+AgNO3===AgI↓+NaNO3。
(2)卤化银(AgCl、AgBr、AgI)沉淀的颜色不同,可用硝酸酸化的AgNO3溶液来检验卤素离子.1.Cl2、Br2、I2的性质比较卤素单质(Cl2、Br2、I2)的氧化性由强到弱的顺序是Cl2>Br2>I2;卤素离子(Cl-、Br-、I-)的还原性由强到弱的顺序是I->Br->Cl-。
2.卤素离子X-(Cl-、Br-、I-)的检验(1)AgNO3溶液—稀HNO3法(2)氯水-CCl4法(3)氯水—淀粉法溶液错误!溶液变蓝色…I-1.甲、乙、丙三种溶液中各含有一种X-(X-为Cl-、Br-或I-),往甲中加入淀粉溶液和氯水,则溶液变为橙色,再往此溶液中加入丙溶液,颜色无明显变化。
高一化学“从海水中获得的化学物质”单元测试2无锡智学堂教育备课组一、单选题1.B说明:Na与泡沫中的水及二氧化碳会反应。
2.A说明:+1价的氯表现出强氧化性而漂白。
3.C4.B说明:自来水中的氯气对亚铁离子有氧化作用。
5.C说明:氧化剂的氧化性强于氧化产物。
①中BrO3-强于ClO3-,②中Cl2强于HIO3。
点评氧化还原反应是高考的“传统题”,本题是根据2004年高考题结合教学进度改编的。
这类题今后还会经常出现,有关氧化还原反应的具体内容随学习内容的推进将不断更新、深化和拓展。
二、多选题6.D说明:硫从+2到+3价被氧化。
7.B说明:IBr发生反应后,化合价没有变化,不是氧化还原反应。
8.D9.C说明:以相等的镁反应,在氧气中只生成氧化镁,在空气中还生成氮化镁,在二氧化碳中除生成氧化镁为固体外还有炭。
10.BD说明:A中是强电解质,应拆分成离子,C中醋酸是弱电解质不能拆分。
11.B说明:有铁剩余说明,铜离子完全被置换,固此一定有铜单质。
12.AD说明:氧化剂是指含有化合价能降低元素的物质。
不局限于得氧和失氧。
三、填空题13.HCO 3- + H + = H 2O+ CO 2 ↑,CO 2 + 2OH - = H 2O+ CO 32- ,H 2O+ CO 32- + CO 2=2 HCO 3- 14.IO 3-+5I -+6H +=3I 2+3H 2O15.(l )甲厂污水中含有的4种离子是 Na +、Cl -、SO 42-、OH -; (2)乙厂污水中含有的4种离子是 Ag +、Fe 3+、Ba 2+、NO 3-16.①(CN )2+KOH==KCN+KCNO+H 2O ② 2KSCN +(CN )2==2KCN +(SCN )217.(1)A :Na B :Al C :Fe F :FeCl 2 H :Fe (OH )3 乙:Cl 2(2)反应①:2Na + 2H 2O == 2NaOH + H 2↑反应⑤:2FeCl 2 + Cl 2 == 2FeCl 3 反应⑥:FeCl 3+ 3NaOH == Fe (OH )3↓+ 3NaCl18.(1)刺激性 有毒(2)使空气中Cl 2的溶解于水,防止Cl 2的大范围的扩散;Cl 2 +2OH -=== Cl -+ ClO -+ H 2 O(3)用湿手巾捂住口鼻,并马上离开现场,尽可能走到地势较高的地方去 (或其它合理的答案)19.(1)0.2 mol Cl 2mol(2)漂白粉质量为25.4克20.解:(1)煮沸是为了除去溶液中溶解的O 2,避免维生素C 被O 2氧化,冷却是为了减缓滴定过程中维生素C 与液面上空气接触时被氧化的速度。
北京中国传媒大学附属中学 2022年高二化学期末试题含解析一、单选题(本大题共15个小题,每小题4分。
在每小题给出的四个选项中,只有一项符合题目要求,共60分。
)1. 许多国家十分重视海水资源的综合利用不需要化学变化就能从海水中获得的物质是A.氯、溴、碘 B.钠、镁、铝 C.烧碱、氢气 D.食盐、淡水参考答案:D2. 一定条件下,在体积为5 L的密闭容器中,0.5 mol X和0.5 mol Y进行反应:2X(g)+Y(g)Z(g),经60 s达到平衡,生成0.15 mol Z,下列说法正确的是A.将容器体积变为10 L,Z的平衡浓度变为原来的1/2B.以X浓度变化表示的反应速率为0.001 mol/(L·s)C.若升高温度Y的转化率减小,则正反应为吸热反应D.达到平衡时,X与Y 的浓度相等参考答案:B3. 下图是某同学做完Zn—Cu原电池实验后所做的读书卡片记录,其中描述合理的组合是A.①②③ B.②③④ C.③④⑤ D.④⑤⑥参考答案:C略4. 草酸是二元中强酸,草酸氢钠溶液显酸性。
常温下,向10 mL 0.01 mol·L-1 NaHC2O4溶液中滴加0.01 mol·L-1 NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是( )A.V(NaOH) = 0时,c(H+) = 1×10-2 mol·L-1B.V(NaOH)<10 mL时,不可能存在c(Na+) = 2c(C2O42-)+c(HC2O4- )C.V(NaOH) = 10 mL时,c(H+) = 1×10-7 mol·L-1D.V(NaOH)>10 mL时,c(Na+)>c(C2O42-)>c(HC2O4- )参考答案:D略5. 下图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容,据此,下列说法正确的是()A、该硫酸的物质的量浓度为9.2 mol?L-1B、配制200 mL 4.6 mol?L-1的稀硫酸需取该硫酸25 mLC、该硫酸与等体积的水混合后所得溶液浓度为9.2 mol?L-1D、该硫酸与等体积水混合后质量分数大于49%参考答案:C略6. 室温下,NaHSO3溶液的pH<7,NaHCO3溶液的pH>7,下列说法错误的是( )①NaHSO3和NaHCO3都能水解②NaHSO3和NaHCO3都会抑制水的电离③NaHSO3溶液中水电离出的c(H+)<10-7 mlo/L④NaHCO3溶液中水电离出的c(HO-)<10-7 mlo/LA.①④ B.①③ C.②③ D.②④参考答案:B7. 在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:3SnCl2+12Cl-+a H3AsO3+b H+=a As+3SnCl62-+c M。
一、选择题1.抗疫居家期间,同学们在参与家务劳动的过程中体会到化学知识无处不在。
下列劳动与所涉及的化学知识不相符的是选项家务劳动化学知识A餐后将洗净的铁锅擦干铁在潮湿环境中易生锈B使用白醋除去水壶中的水垢白醋可溶解碳酸钙等沉淀C使用含NaClO的84消毒液拖地NaClO具有还原性D用温热的纯碱溶液擦拭有油污的灶台油脂在碱性条件下发生水解反应A.A B.B C.C D.D及泥沙,得到纯净的NaCl,可将粗盐溶于水,然2.为了除去粗盐中的Ca2+,Mg2+,SO24后在下列操作中选取必要的步骤和正确的操作顺序是①加适量盐酸;②加过量NaOH溶液;③过滤;④加过量Na2CO3溶液;⑤加过量BaCl2溶液A.④②⑤B.②⑤④③①C.④③②⑤①D.③④②⑤①3.化学与生活密切相关,下列说法中正确的是()A.瘦肉精可提高生猪的瘦肉量,我们应向养猪厂家大力推广B.推广使用一次性塑料袋和纸巾有利于节约资源C.化学家无法合成自然界中并不存在的新物质与新材料D.银器久置后表面变暗,是因为发生了化学反应4.海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。
下列说法正确的是A.步骤①是指蒸发结晶B.步骤⑤是先通CO2再通NH3C.在步骤②、③、④中,溴元素均被氧化D.制取NaHCO3的反应是利用其溶解度在常温下小于NaCl和NH4HCO35.工业冶炼金属镁可以采取的方法是A.加热分解氧化镁B.电解熔融氯化镁C.高温下发生铝热反应D.高温下用氢气还原6.如图为海水综合利用的部分过程。
下列有关说法正确的是A .过程①加入药品顺序为:Na 2CO 3溶液→NaOH 溶液→BaCl 2溶液B .过程②为电解熔融精盐C .工业上过程③加入的试剂:浓NaOH 溶液D .第⑥步反应的离子方程式可表示为:3Br 2+32-3CO =5 Br -+-3BrO +3CO 2↑7.利用海水提取溴和镁的过程如下,下列说法不正确的是A .工业溴中含少量Cl 2,可用NaOH 溶液除去B .工业上常利用电解熔融MgCl 2冶炼金属镁C .富集溴元素过程中,空气吹出法利用了溴易挥发的性质D .若提取1 mol Br 2,至少需要标准状况下44.8 L 的Cl 28.能源是国民经济和社会发展的重要物质基础,它的开发和利用应遵循社会可持续发展原则。
从海水中获得的化学物质(A卷)班级姓名学号得分可能需要的原子量:H-1 C-12 N-14 O-16 Ne-20 S-32 Cu-64Cl-35.5 Na-23 Mg-24 Al-27 Fe-56 Zn-65第一卷(选择题共43分)一、选择题(本题包括5小题,每小题3分,共15分,每小题只有一个选项符合题意)1.用自来水(用Cl2消毒)养金鱼时,将水注入鱼缸的前需在阳光下暴晒一段时间,目的是()A.使水的温度升高B.使水中HClO分解C.起到杀菌作用D.增加水中O2的含量2.当不慎有大量Cl2逸到周围空气里时,可用浸有一定浓度的下列物质溶液的毛巾捂住鼻子,该物质是( ) A.NaOH B.NaClC.H2O D.Na2CO33.钠在自然界中最主要的存在形式是()A.游离态B.氯化钠C.硫酸钠D.硝酸钠4.钠与水反应的现象和钠的下列性质无关的是()A.钠的熔点较低B.钠的密度小于水C.钠的硬度较小D.钠的还原性强5.工业上制造镁粉是将镁蒸气在气体中冷却。
可作为却气体的是()①空气②CO2③Ar ④H2⑤N2A.①②B.②③C.③④D.④⑤二、选择题(本题包括7小题,每题4分,共28分,每小题有一个或两个选项符合题意。
若正确答案包括一个选项,多选时,该题得0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且正确的给4分,但只要选错一个,该小题就为0分)6.下列说法不正确的是( ) A.H2在Cl2中燃烧会产生苍白色火焰B.氯水用于漂白表现了HClO的强氧化性C.漂粉精是混合物,其有效成分是次氯酸钠D.漂粉精放入稀酸中可以提高漂白速度7.下列反应能说明卤素非金属性活泼顺序是Cl>Br>I的是( )①2HClO4+Br2(气) =2HBrO4+Cl2②2NaBr+Cl2=2NaCl+Br2③2KI+Cl2=2KCl+I2④2KI+Br2=2KBr+I2A.①②③B.①②④C.②③④D.①②③④8.对于反应:TiCl4+4Na==4NaCl+Ti,下列说法正确的是()A.该反应说明钠是强还原剂,可用于冶炼金属B.该反应条件是TiCl4在熔融状态或水溶液中C.Ti是氧化产物D.TiCl4是还原剂9.新制氯水与久置的氯水相比较,下列结论不正确的是()A.颜色相同B.前者能使有色布条褪色C.都含有H+D.加AgNO3溶液都能生成白色沉淀10.下列各组溶液中离子,能在溶液中大量共存的是:()A.H+、Ca2+、NO3-、CO32-B.K+、Na+、Br-、NO3-C.Ag+、Na+、Cl-、K+D.NH4+、K+、NO3-、SO42-11.能正确表示下列化学反应的离子方程式是()A.氢氧化钡溶液与盐酸的反应OH-+H+=H2OB.澄清的石灰水与稀盐酸反应Ca(OH)2+2H+=Ca2++2H2OC.铜片插入硝酸银溶液中Cu+Ag+=Cu2++AgD.碳酸钙溶于稀盐酸中CaCO3+2H+=Ca2++H2O+CO2↑12.将一定质量的Mg、Zn、Al混合物与足量稀H2SO4反应,生成H20.125mol,原混合物的质量可能是()A.2g B.4g C.8g D.10g第二卷(非选择题共57分)三(本题包括6小题,共39分)13.(6分)下列物质:①水②醋酸③盐酸④烧碱⑤硝酸钾⑥酒精⑦汽油⑧蔗糖(用编号回答)其中属于弱电解质的有;属于强电解质的有;强电解质在水中电离。
14.(6分)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。
漂白粉是常用的消毒剂。
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为。
(2)漂白粉的有效成分是(填化学式)。
(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为。
(4)反应(1)和反应(3)中,属于氧化还原反应的是(填编号)。
15.(6分)根据反应(1)2P+5Br2+8H2O=2H3PO4+10HBr(2)Cl2+2HBr=2HCl+Br2(3)2KMn04+16HCl(浓) =2KCl+2MnCl2+5Cl2↑+8H2O 推断氧化性(氧化剂)由强到弱的顺序是。
还原性(还原剂)由强到弱的顺序是。
16.(9分)试判断下面每组反应能否用同一个离子方程式表示,若能,写出相应的离子方程式;若不能,简要说明理由。
(1)CaCO3、Na2CO3分别跟盐酸反应(2)CuO分别跟稀硫酸、稀盐酸反应(3)H2SO4、K2SO4溶液分别跟Ba(OH)2反应17.(6分)某学生设计了如下实验:回答下列问题:(1)该同学的实验目的是;(2)上图括号内的操作步骤均为;(3)按此实验方案得到的NaCl固体中肯定含有(填化学式)杂质;为了解决这个问题可以向过滤得到的滤液中加入适量的;(4)写出生成B的离子方程式:18.(6分)现有X、Y、Z三种元素,已知有如下情况:①X、Y、Z的单质在常温下均为气体。
② X的单质在Z的单质中燃烧,生成XZ,燃烧时火焰呈苍白色。
③ XZ极易溶于水,在水溶液中电离出X+和Z-。
XZ的水溶液可使石蕊试液变红。
④两分子X的单质可与一分子Y的单质化合生成两分子X2Y,X2Y常温下为液体。
⑤ Z的单质溶于X2Y中,所得溶液具有漂白作用。
请完成下列问题:(1)写出XZ和X2Y的化学式:XZ X2Y(2)Z的单质溶于X2Y后,溶液起漂白作用的物质是(写化学式)。
(3)写出X的单质在Z的单质中燃烧的化学方程式。
(4)Z的单质能否与氢氧化钠溶液发生反应:(填“能”或“否”),若能,请写出反应的化学方程式:。
(若不能反应,则此空不必填写)。
四、(本题包括2小题,共18分)19.(8分)从100ml某种待测浓度的Na2CO3溶液中取出50ml,加入含HCl0.4mol的盐酸溶液,恰好完全反应。
(1)生成CO2的物质的量是多少?(2)待测Na2CO3溶液的物质的量浓度是多少?20.(10分)用KMnO4氧化密度为1.19g/cm3,溶质质量为36.5%的HCl.反应方程式如下:2KMnO4 +16HCl =2KCl +2MnCl 2+5Cl 2↑+8H2O(1)15.8g KMnO4能使多少克HCl发生上述反应?有多少克HCl被氧化?(2)若Cl 2在标准状况下的密度为3.17g/L,则产生的Cl 2在标准状况下的体积为多少?从海水中获得的化学物质A卷1.B【说明】自来水(Cl2消毒)中发生Cl2+H2O=HCl+HClO,光照使2HClO=2HCl+O2↑2.A【说明】Cl2+2NaOH = NaCl+NaClO+H2O3.B4.C【说明】钠与水反应的现象与钠的硬度较小5.C【说明】镁与空气、CO2、N2均能反应。
6.C【说明】漂粉精是混合物,其有效成分是次氯酸钙7.D【说明】氧化还原反应中氧化性:氧化剂>氧化产物8.A【说明】对于反应:TiCl4+4Na==4NaCl+Ti,钠是强还原剂,TiCl4是氧化剂,NaCl是氧化产物,Ti是还原产物,又因为钠能与水反应,所以该反应条件只能是TiCl4在熔融状态下。
9.A【说明】新制氯水为黄绿色,且Cl2+H2O=HCl+HClO,HClO有漂白性,HCl电离生成H+和Cl-,加AgNO3溶液都能生成白色沉淀;而久置的氯水为稀盐酸。
10.BD【说明】A C项中Ca2+与CO32-、Ag+与Cl-不能共存。
11.AD【说明】B项中石灰水Ca(OH)2应该写成:Ca2+和OH-,C项中离子方程式两边应遵守电荷守恒。
12.BC 【说明】生成H 20.125mol 需Mg 、Zn 、Al 各3g 、8.125g 、2.25g 。
所以混合物混合物的质量可能是2.25g ~8.125g 之间。
13.①②;④⑤;完全(几乎完全;全部)。
14.(1)2Cl 2+2Ca(OH)2 = CaCl 2+Ca(ClO)2+2H 2O(2)Ca(ClO)2(3)Ca(ClO)2 + CO 2 + H 2O == CaCO 3↓+ 2 HClO(4) (1)15.(1)氧化性(氧化剂)KMnO 4>Cl 2>Br 2>H 3PO 4;(2)还原性(还原剂)P>HBr>HCl>MnCl 2。
16. (1)不能。
CaCO 3难溶应写化学式,其离子方程式为:CaCO 3+2H +=Ca 2++CO 2↑+H 2O ;Na 2CO 3易溶于水,在溶液中以Na +和CO 32-存在,其离子方程式为:CO 32-+2H +=CO 2↑+H 2O(2)可以,CuO+2H +=Cu 2++H 2O(3)不能,H 2SO 4跟Ba(OH)2反应除生成BaSO 4外,还有难电离水生成;K 2SO 4跟Ba(OH)2反应只生成难溶的BaSO 4。
17.(1)分离CaCl 2和NaCl 两种固体混合物;(2)蒸发(3)Na 2CO 3 稀盐酸(4)Ca 2++CO 32-=CaCO 3↓18.(1)HCl H 2O (2)HClO (3) H 2+Cl 2点燃=== 2HCl(4)能 Cl 2+2NaOH =NaCl +NaClO +H 2O19.(1)0.2mol (2) 4mol/L【全解】(1)2HCl ~ CO 2 ~ Na 2CO 32mol 1mol 1mol0.4mol n(CO 2 ) n(Na 2CO 3 )n(CO 2 )=0.2mol n(Na 2CO 3 ) =0.2mol(2) 待测Na 2CO 3溶液的物质的量浓度= 0.2mol×(100ml÷50ml)÷0.1L=4mol/L答:(1)生成CO 2的物质的量是0.2mol 。
(2)待测Na 2CO 3溶液的物质的量浓度是4mol/L 。
20.(1)29.2g, 18.25g (2)5.6 L【全解】(1)n(KMnO 4) =15.8g÷158g/mol=0.1mol2KMnO 4 ~ 16HCl2mol 16×36.5g0.1mol m(HCl)m(HCl) = 29.2g被氧化的HCl = 29.2g×1610 = 18.25g (2) Vm = 71g/mol÷3.17g/L=22.4L /mol2KMnO 4 ~ 5Cl 2↑2mol 5mol×22.4L/mol 0.1mol v (Cl 2)v (Cl 2)= 5.6 L答:(1)15.8g KMnO 4能使29.2克HCl 发生上述反应有18.25克HCl 被氧化(2)则产生的Cl 2在标准状况下的体积为5.6L 。