铜原子半径
- 格式:docx
- 大小:10.28 KB
- 文档页数:1

铜的相互化的化学式-概述说明以及解释1.引言1.1 概述铜是一种非常重要的金属元素,也是人类历史上最早使用的金属之一。
它的化学性质丰富多样,广泛应用于各个领域。
铜的化学式为Cu,原子序数为29,原子量为63.55。
铜具有良好的导电和导热性能,同时还具有良好的韧性和可塑性,使其成为制造电线、电器设备以及管道等的重要材料。
本文将重点介绍铜的相互化学性质,包括其原子结构、电子配置以及化学反应。
通过对铜的原子结构的了解,我们可以更好地理解铜在化学反应中的行为。
同时,铜的氧化反应也是本文的重要内容,我们将深入探讨铜在不同氧化态下的反应行为,并详细介绍铜的氧化反应方程式以及氧化物的形成过程。
铜的配位化合物也是本文的重点内容,我们将介绍铜的配位数、配位反应以及配位化合物的性质。
通过对铜的化学性质的研究,我们可以更好地理解和应用铜在实际生活和工业生产中的作用。
希望通过本文的阐述,能够使读者对铜的相互化学式有一个更深入的了解,同时也能够在实际应用中取得更好的效果。
1.2文章结构文章结构是指文章的组织框架和内容安排。
在本文中,将围绕着铜的相互化的化学式展开讨论。
文章结构如下所示:1. 引言1.1 概述在本部分,将简要介绍铜是一种重要的化学元素,并概述铜的一些重要性质和应用领域。
1.2 文章结构本部分将详细介绍铜的化学性质,包括原子结构、电子配置和化学反应;铜的氧化反应,包括氧化态、氧化反应方程式和氧化物的形成过程;以及铜的配位化合物,包括配位数、配位反应和配位化合物的性质。
1.3 目的本部分将说明本文的目的,即探讨铜的相互化的化学式以及与之相关的化学性质和反应机制。
2. 正文2.1 铜的化学性质2.1.1 原子结构这一小节将介绍铜的原子结构,包括原子核、电子壳层和电子排布等。
2.1.2 电子配置这一小节将详细讨论铜的电子配置,包括外层电子数和填充规则等。
2.1.3 化学反应这一小节将探讨铜在不同条件下的化学反应,包括与氧、酸、碱等物质的反应性质。

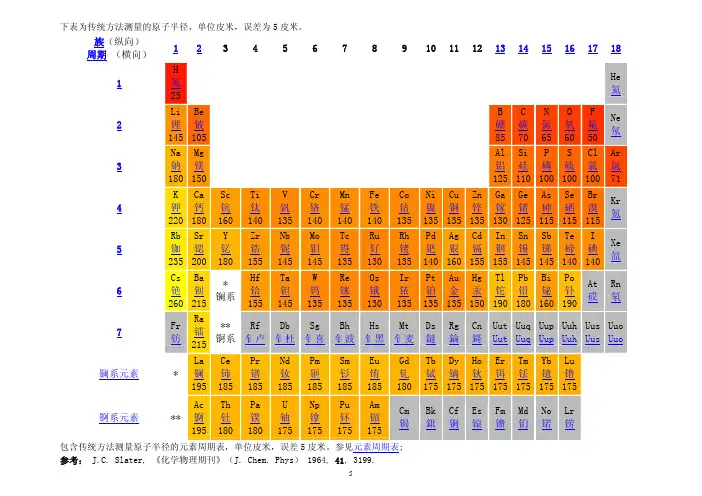
原子半径图表原子半径与电离能数值密不可分。
电离能是核外电子挣脱原子核引力,到达原子外成为自由电子所需要的能量。
一种原子有多少个电子,就有多少个数值大小不同的电离能。
以下是原子的电离能:(单位电子伏)氢13.6氦54.42 ,24.59锂122.5 ,75.64 ;;5.392铍217.7 ,153.9 ;;18.21 ,9.323硼340.2 ,259.4 ;;37.93 ,25.15 ,8.298碳490.0 ,392.1 ;;64.49 ,47.89 ,24.38 ,11.26氮666.9 ,552.1 ;;97.89 ,77.47 ,47.45 ,29.60 ,14.53氧871.0 ,739.3 ;;138.1 ,113.9 ,77.41 ,54.94 ,35.12 ,13.62氟1102 ,953.6 ;;185.2 ,157.2 ,114.2 ,87.14 ,62.71 ,34.97 ,17.42氖1361 ,1194 ;;239.5 ,207.3 ,157.9 ,126.2 ,97.12 ,63.45 ,40.96 ,21.56 钠1647,1464 ;;292.1,264.3, 208.5, 172.2, 138.4, 98.91,71.62,47.29,’ 5.139镁1960,1760;;368.4, 328.2,266.3,225, 186.8,141.3,109.3, 80.14;;15.o4, 7.464钾4913, 46o2;;1o44, 968.5, 861.5, 787, 715, 629.7, 565, 5o4;;175.9, 155, 117.6, 99.44, 82.69, 6o.94, 45.83, 31.64;;4.341钙5444,5108;;1160, 1086,979.4, 901.2, 820.0, 733.1, 660.0, 594.3;;215.6,188.7, 147.5, 127.2, 108.8, 84.50, 67.27, 50.91;;11.87, 6.113457.3, 392.4, 361.2, 331.o, 29o.3, 262.2, 223.7;;151.o, 125.o, 99.1o, 75.oo, 54.8o, 3o.64, 16.18, 7.9o2……这说明物理电子层中每层只有一个电子。

锂,钠,铜的金属性质和应用知识点:锂、钠、铜的金属性质和应用一、锂(Li)1.锂是第一周期第ⅠA族元素,具有最小的原子半径和最高的电负性。
2.锂的密度较低,为0.534g/cm³,硬度较小,熔点为180.54℃。
3.锂在自然界中主要以锂辉石、锂云母等矿物形式存在。
4.锂的还原性较强,可与氯气反应生成氯化锂,与氧气反应生成氧化锂。
5.锂的盐类在生活中广泛应用,如碳酸锂、氢氧化锂等。
6.锂离子电池是现代电动汽车和移动设备的主要电源。
二、钠(Na)1.钠是第三周期第ⅠA族元素,具有较大的原子半径和较低的电负性。
2.钠的密度为0.97g/cm³,硬度较小,熔点为97.81℃。
3.钠在自然界中主要以氯化钠(食盐)的形式存在,也有少量以矿石形式存在。
4.钠的还原性很强,可与氯气反应生成氯化钠,与氧气反应生成氧化钠。
5.钠的化合物在工业和日常生活中有广泛应用,如氢氧化钠、碳酸钠等。
6.钠离子电池是一种重要的储能材料,但能量密度较低。
三、铜(Cu)1.铜是第四周期第ⅠB族元素,具有较大的原子半径和较低的电负性。
2.铜的密度为8.96g/cm³,硬度适中,熔点为1083.4℃。
3.铜在自然界中主要以硫化铜、氧化铜等矿物形式存在。
4.铜的还原性较弱,可与氯气反应生成氯化铜,与氧气反应生成氧化铜。
5.铜是重要的导体材料,广泛应用于电线、电缆、电器等。
6.铜的合金如青铜、黄铜等在机械制造、船舶、汽车等领域有重要应用。
7.铜化合物在医药、农药、化工等领域有广泛应用,如硫酸铜、氯化铜等。
总结:锂、钠、铜作为常见的金属元素,具有独特的性质和广泛的应用。
它们在自然界中存在,可通过化学反应制得,并在工业、日常生活和科学研究等领域发挥重要作用。
习题及方法:1.习题:锂、钠、铜在元素周期表中的位置分别是什么?方法:根据元素周期表,我们可以知道锂位于第一周期第ⅠA族,钠位于第三周期第ⅠA族,铜位于第四周期第ⅠB族。

区别金属原子半径、离子半径、共价半径和范德华半径依照量子力学,核外电子运动没有固定轨道,没有明确的界限,只有概率密度的散布。
通常把核到最外层电子的平均距离概念为原子半径。
现代的科学技术还无法精准测定一个单独原子的半径,只能用实验方式,如X射线衍射法,测定出中相同间距离,或用同核双原子分子,被2相除得出。
不同元素原子有不同的存在形式,确实是同一元素的原子也可能形成不同的分子和晶体。
因此不同元素的原子半径可能表现形式不同,确实是同一元素的原子半径也可能有不同形式。
依照测定方式的不同,通常有3种原子半径:①半径:中相邻两金属原子核间距离的一半,称做该元素原子的金属半径,如的金属半径r=。
②共价半径:同种元素的两原子以结合时,其共价键键长的一半称做该元素原子的共价半径,符号表示为pm 或Å,其数值与几重键结合有关,如原子的共价半径r共,单键时为77pm,双键时为67pm,三键时为60pm。
金属元素原子在必然条件下也可形成共价的双原子分子,金属元素原子也有共价半径,如铜的共价半径r共为117pm。
由于形成共价键时,总会发生重叠,通常同一金属元素的金属半径比其单键共价半径要大10%~15%。
同周期元素的单键共价半径的转变规律为从左至右慢慢缩小,能够为是原子查对电子引力增大的缘故③范氏半径:(范德华氏半径的简称) 元素和有些金属元素所形成的分子间或单原子分子间靠(范德华力) 彼此吸引,其不同分子中两个相同原子核间距离的一半,称做该元素原子的范氏半径,如原子的范氏半径r范为181pm。
如左图所示,表示了氯原子的共价半径和范氏半径。
原子半径数据只有相对的、近似的意义,而且同一元素的不同半径,数值不同(r范>r金>r 共),而且相差较大。
利历时不要同时用不同半径的数据。
在一样的资料里,金属元素有金属半径和共价半径的数据,非金属元素那么有共价半径和范氏半径的数据,稀有气体只有范氏半径的数据。
而离子半径是表示离子大小的一个物理量。

原子半径比较口诀三句话
1. 同周期原子半径逐渐减小呀,就像跑步比赛,越往后的选手位置越靠前,比如钠原子半径就比镁原子半径大哟!
2. 同族原子半径逐渐增大呢,这就好比排队,越往下排人就越多,原子半径也就越大,像氟原子半径就比氯原子半径小嘛!
3. 具有相同电子层结构的离子,核电荷数越大半径越小哇,这不就像举重,力气大的能举起更重的东西,原子半径就小,比如钠离子半径小于镁离子半径呀!
4. 原子半径大小有规律,同周期从左往右减呀,就像爬山,越往上路越窄,像铝原子半径就小于硅原子半径呢!
5. 同主族从上往下增呀,如同下楼,越往下楼层越多,原子半径越大,碘原子半径就比溴原子半径大很多嘛!
6. 电子层越多半径越大呗,这就好像房子,层数越多空间越大,原子半径也就大,钾原子就比钠原子半径大不少呀!
7. 原子半径比较别发愁,记住这些就不愁呀,好比记单词有技巧,轻松就能掌握,像碳和硅的原子半径比较就很明显嘛!
8. 原子半径的秘密在这里,三句话让你搞清楚呀,就像找到了解题的钥匙,一下子就明白了,比如氮和磷的原子半径差异就很清楚啦!
9. 简单口诀记心间,原子半径不再难呀,好像有了导航,再也不会迷
路,像氧和硫的原子半径比较就很简单嘛!
10. 原子半径比较很有趣,三句话让你爱上它呀,就像喜欢一个游戏,越玩越上瘾,比如铁和铜的原子半径比较也能轻松搞定呢!
我的观点结论:通过这三句话的口诀,能够比较轻松地掌握原子半径的大小规律,真的很实用呀!。

原子半径通常概述原子半径是描述原子大小的物理量,通常用来衡量原子的外层电子云的边界范围。
它是研究原子结构、化学键和晶体结构等领域中的重要参数。
本文将介绍原子半径的定义、测量方法、影响因素以及一些典型元素的原子半径数值。
定义原子半径是指从原子核到其外层电子云边界距离的一半。
由于电子云没有明确的边界,因此确定原子半径并不是一个精确的测量值,而是一个近似值。
根据不同的测量方法和定义,可以得到不同元素的原子半径数值。
测量方法X射线衍射法X射线衍射法是测量晶体结构中原子间距离最常用的方法之一。
通过测量X射线在晶体中经过散射后形成衍射图样,在分析衍射图样时可以得到晶胞参数和晶格常数,进而计算出相邻原子之间的距离。
共振散射法共振散射法利用原子核或电子的共振能级,通过测量散射光的能量和角度来确定原子半径。
这种方法适用于特定元素和特定能级的测量。
光学法光学法是通过测量原子吸收、散射或发射光的性质来确定原子半径。
常用的方法包括原子吸收光谱法、拉曼散射法等。
计算方法除了实验方法外,还可以利用理论计算来估算原子半径。
例如,基于密度泛函理论(DFT)的计算方法可以预测不同元素的原子半径。
影响因素原子半径受到多种因素的影响,包括:电荷数一般情况下,原子核带正电荷,而外层电子带负电荷。
由于电荷之间存在静电斥力,使得外层电子云被压缩,导致原子半径变小。
原子序数随着元素周期表中的元素原子序数增加,一般情况下其原子半径也会增加。
这是因为随着电子层数增多,外层电子云离核更远,使得整个原子变大。
原子结构原子的外层电子排布也会影响其半径。
例如,对于相同的原子序数,带有更多外层电子的元素往往比带有较少外层电子的元素半径更大。
化学键在形成化学键时,原子之间会发生相互作用,这种相互作用也会影响原子半径。
例如,在共价键中,两个原子之间共享电子对,使得原子间距离变小。
典型元素的原子半径下表列举了一些典型元素的原子半径数值(单位:皮米):元素原子半径氢25碳70氮65氧60铁125铜135锌135需要注意的是,这些数值只是一个近似值,在不同文献和实验条件下可能会有所差异。

金属阳离子半径大小比较金属阳离子的大小是指金属元素失去一个或多个电子后形成的带正电的离子的半径大小。
金属阳离子的大小与其原子半径、价电子数、电子层数等因素有关。
本文将对不同金属阳离子的大小进行比较,以便更好地理解金属阳离子的特性和性质。
我们来比较一些常见金属阳离子的大小。
钠离子(Na+)的半径约为95皮米,镁离子(Mg2+)的半径约为65皮米,铝离子(Al3+)的半径约为50皮米。
可以看出,随着正电荷数的增加,金属阳离子的半径变小。
这是因为当金属原子失去电子后,带正电的离子核吸引周围的电子云,使得离子整体变小。
接下来,我们比较一些过渡金属阳离子的大小。
钛离子(Ti2+)的半径约为60皮米,铁离子(Fe2+)的半径约为55皮米,镍离子(Ni2+)的半径约为60皮米。
可以看出,过渡金属阳离子的半径大小与其原子半径相比较小。
这是因为过渡金属元素的原子结构较为复杂,外层电子的排布复杂,因此失去电子后形成的阳离子较小。
我们还可以比较一些具有不同电子层数的金属阳离子的大小。
比如,铜离子(Cu+)的半径约为80皮米,银离子(Ag+)的半径约为115皮米,金离子(Au+)的半径约为135皮米。
可以看出,金属阳离子的半径大小与其电子层数也有关系。
电子层数越多,金属阳离子的半径越大。
金属阳离子的半径大小还会受到其配位数和配位体的影响。
当金属离子与多个配位体形成配合物时,其半径大小可能会发生变化。
例如,亚铁离子(Fe3+)在水合状态下的半径约为63皮米,而在配合物中的半径可能会有所增加或减小。
金属阳离子的大小与其原子半径、价电子数、电子层数以及配位数等因素有关。
通过比较不同金属阳离子的大小,我们可以更好地理解金属离子的特性和性质。
这对于理解金属化合物的结构和性质,以及研究金属离子在催化、电子传输等方面的应用具有重要意义。
希望本文对读者对金属阳离子的大小比较有所帮助。

金属离子氧化性顺序:探究与分析一、金属离子氧化性顺序的概念金属离子氧化性顺序是一种描述金属离子在氧化过程中被氧化的程度的概念,它可以帮助我们了解金属离子在不同氧化状态下的性质。
该概念是根据金属离子在氧化过程中被氧化程度的大小来排列的,其中,被氧化程度越大,金属离子的氧化性就越强。
例如,铜离子的氧化性比铁离子的氧化性强,而钠离子的氧化性则比铁离子的氧化性弱。
金属离子氧化性顺序的概念可以用来帮助我们预测金属离子在不同氧化状态下的性质。
例如,我们可以预测,铁离子的氧化性比镁离子的氧化性强,而铜离子的氧化性则比铁离子的氧化性弱。
此外,金属离子氧化性顺序也可以用来解释金属离子在实际应用中的性质,例如,由于铜离子的氧化性比铁离子的氧化性强,因此铜离子可以用于制造防腐蚀性能更强的金属材料。
总之,金属离子氧化性顺序是一种描述金属离子在氧化过程中被氧化的程度的概念,它可以帮助我们预测金属离子在不同氧化状态下的性质,从而为我们的实际应用提供指导。
二、金属离子氧化性顺序的影响因素金属离子氧化性顺序的影响因素多种多样,它们在不同的情况下会产生不同的结果。
其中最重要的因素有:原子半径、电子配置、电负性、电子捕获能力以及质子数量。
首先,原子半径会影响金属离子氧化性顺序。
原子半径越小,金属离子的氧化性越强。
例如,钾的原子半径只有0.133nm,而铜的原子半径为0.128nm,因此钾的氧化性比铜强。
其次,电子配置也会影响金属离子氧化性顺序。
电子配置越复杂,金属离子的氧化性越弱。
例如,铝具有3s2 3p1的电子配置,而钠具有3s1的电子配置,因此铝的氧化性比钠弱。
此外,电负性也会影响金属离子氧化性顺序。
电负性越大,金属离子的氧化性越弱。
例如,镁具有最大的电负性,而钾具有最小的电负性,因此镁的氧化性比钾弱。
再者,电子捕获能力也会影响金属离子氧化性顺序。
电子捕获能力越强,金属离子的氧化性越强。
例如,钴具有最强的电子捕获能力,而铜具有最弱的电子捕获能力,因此钴的氧化性比铜强。

面心立方的原子半径嘿,大家好,今天咱们聊聊面心立方的原子半径。
别看这名字有点高深,其实它的意思也不复杂。
简单来说,面心立方就是一种晶体结构,它的原子排布得像是“立方体里面有个大宝藏”,大宝藏就是这些原子啦。
先别着急,它又不是魔法阵,咱们一块儿细说。
想象一下,你家里有一个大大的盒子,里面放着一些小球,这些小球每个都很整齐地排着,形成了一个立方体的结构。
这些小球之间的间距,就是我们要讨论的“原子半径”。
原子半径,顾名思义,就是原子的“大小”。
你看,这个“小家伙”虽然很小,但它又是组成万千物质的基础。
原子半径其实也不固定的,跟它所处的环境、压力、温度等等都有关。
在面心立方结构里,每个原子都处在一个特别的“位置”。
为什么说特别呢?因为这些原子不仅自己成排,还跟它们的邻居有着特别亲密的关系——它们会通过“面”互相接触。
换句话说,原子们就像是开了个“群聊”,时刻保持着亲密接触。
你可能会问了,为什么我们要关注这个面心立方的原子半径呢?嗯,这事儿其实跟咱们的日常生活有关系。
比如说,金属的导电性、导热性,甚至它们的硬度和延展性,都跟这种结构以及原子之间的排列方式有很大的关系。
如果你能理解了这些原子怎么“挤在一起”,你就能明白为什么不同的金属表现得完全不一样了。
拿金属铜举个例子。
铜是面心立方结构的典型代表,它的原子半径差不多是0.128纳米(纳米啊,就是亿分之一米,别说你已经算不清这数字了,我都替你头疼)。
好啦,这个数值看起来可能有点抽象,没关系,我们不拘泥于这些细节。
重要的是,这个“原子半径”是决定铜的许多特性的重要因素。
想想看,铜的导电性能好,常常用在电缆里。
这个特点,跟它的原子如何排列紧密,密不可分。
讲到这里,你可能又想问了,什么叫“紧密排列”呢?简单来说,面心立方的结构可以理解为“每个角落都有一个原子,中心也有一个原子,而每个面上都有原子,大家像是一群人站在一起,挤得满满当当,几乎没有空隙”。
这种排列方式就是高度紧密的,所以原子间的“亲密接触”就让它们表现出了超强的稳定性和各种特别的物理性质。

铜的第二电离能大于锌的原因
铜和锌作为二价元素,其第一电离能都为855.8以费米(eV)记;而第二电离能的强弱却出现了反差,显然铜的第二电离能要比锌的第二电离能大,电离能大小是来自原子内部电子的总能量跃迁所决定的,而电子的总能量取决于原子的电子结构,原子半径与电子结构也就会影响电离能的大小,让我们一步一步来分析吧。
首先,根据元素周期表所示,铜与锌均属于第四周期,所以它们都有完整的4s和4p 子层,因此第一电离能相同;
其次,在第二电离能上,铜与锌的原子半径表现出了显著的差异,以实测值计算,新物理化学第二版中显示出,铜的原子半径比锌的原子半径大约是80pm,无论是用真空含能计算,还是实验测量,这个值都会相差不大,说明原子半径有明显规律性;
再之后,考虑到电子结构,有一个重要概念叫做电子“填充原则”,这是一种理论假定,这个假定主要是指原子电子可以按低能量层次在电子层进行,以充分利用电子靠近原子核的能量效应以及此核已产生的屏蔽作用,在第一电离能的排列上,铜的4s电子排布于4p电子之前,而锌的4s电子排布于4p电子之后,那么根据填充原理,显然铜的第二电离能会比锌的第二电离能大;
最后,考虑到同粒子受电场作用的叠加性,由于铜的原子半径比锌大,因此铜电子受同粒子电场作用会比锌电子大,也增加了更容易电离出去的能量,即铜的第二电离能会比锌的第二电离能高;
综上所述,铜的第二电离能大于锌的原因主要不是由于它们原子素不同所致,而是因为其中的原子电子结构存在差异,以及原子半径存在差异,这又归结于原子核的大小与其所处的周期层次影响的结果,电子的总能量在这个过程中受到了影响,从而影响到了电离能的大小。
四水合铜离子结构式四水合铜离子结构式,是指由一个正铜离子(Cu2+)和四个水分子组成的结构。
这种结构可以在液体和固体中发现,并可以通过X射线衍射或元素分析来检测。
此外,它也是一种非常重要的化学物质,可以用于生产铜管、铜线等金属结构。
四水合铜离子结构式是一个三维的立方体结构,其中铜离子位于立方体的中心,而四个水分子则位于每个角落。
铜离子与四个水分子之间的最短距离约为2.25Å(原子半径),这是一种密集的结构,使得铜离子和水分子之间形成了强烈的相互作用。
四水合铜离子结构式在物理和化学上都有重要意义。
在物理方面,它可以用来预测铜离子的性质,例如溶解度、活性、吸附性等。
在化学方面,它可以帮助我们更好地理解铜离子如何与其他物质相互作用,从而更好地利用铜离子的特性和性质。
四水合铜离子结构式可以用来识别许多有机和无机物质,特别是铜的各种混合物。
它也可以用来鉴定铜离子的含量,以及它们在液体中的相对活性。
此外,它还可以帮助研究人员更好地理解蛋白质和其他有机物质如何与铜离子结合,从而有效地促进化学反应。
四水合铜离子结构式也可以用来检测铜的含量,这是一种非常重要的用途。
它可以用来检测食物和饮料中的铜含量,以及人体内铜的含量。
这样做可以有效发现铜缺乏症,并帮助消除铜缺乏症的症状,从而改善人们的健康状况。
四水合铜离子结构式对工业也有重要意义。
它可以用来检测不同型号的铜管、铜线和其他金属结构,以确保它们具有良好的电气性能和耐久性。
此外,它还可以用来测量某些金属表面的光泽度和抗腐蚀性,以确保它们能够承受极端环境条件。
总之,四水合铜离子结构式是一种非常重要的结构,它可以用来检测和识别许多有机和无机物质,并可用于检测和分析某些金属结构,这有助于我们更好地理解和利用铜离子的特性和性质。
铜离子核外电子排布式铜(Cu)是一种金属元素,在自然界中具有重要的地位和影响。
因此,了解其原子核外电子排布式(atomic orbital arrangement)是理解铜的相关特性的关键。
本文将介绍铜原子核外电子排布的特点以及如何描述这种排布。
铜元素共有29个电子,根据结构规则,这些电子组成2s2 2p6 3s2 3p6 3d10 4s2 4p2层次结构,其中s、p、d三种原子轨道类型分别由2个,6个,10个电子组成。
因此,铜元素的原子核外电子排布可以简单地用填充示意图表示。
在此填充示意图中,金属离子和焰色电子之间的关系可以更清楚地反映出来:由于铜元素的3d电子层次未填满,因此它具有阳离子的特征,拥有具有某些官能团的焰色性质(例如羰基以及羧基官能团),而其他电子类型的舍入现象可以使铜在某些情况下具有共价性质。
同时,铜的原子核外电子排布可以由极坐标方程描述。
极坐标方程是数学概念,它可以用来描述一个圆卷积(convolutional spiral),即沿着一个球坐标轴来描述一个电子气体的形状,由此可以更好地理解铜离子核外电子排布情况及其特点。
最后,铜元素的原子核外电子排布可以通过它的原子质量和原子半径来描述。
铜元素的原子半径为128pm,比氢原子半径大出约1.1倍,而其原子质量则是63.55u。
这些数据与其原子核外电子的排布有着直接的关系,比如一个具有更多的外电子的原子半径更大,这是因为外层原子离子的半径会大大增加,使整个原子变得更大;而原子质量也会随着原子核外电子数量增加而增加,这也是因为原子质量不仅取决于核质量,还取决于原子核外电子的数量,每个电子的质量都占有一部分。
总的来说,铜元素的原子核外电子排布可以从填充示意图,极坐标方程以及从原子质量和原子半径三个方面进行描述。
其中,填充示意图反映出铜的阳离子性质以及其具备焰色性质的可能;极坐标方程则描述了铜离子核外电子排布的形状和结构;而原子质量和原子半径则反映出铜离子核外电子数量的大小。
铜镍固溶体生成条件铜和镍形成固溶体需要满足以下条件:1. 原子尺寸相似:铜和镍的原子半径相近,为 1.28 和 1.25 埃。
这种相似性允许镍原子在铜晶格中取代铜原子,形成固溶体。
2. 电负性差异小:铜和镍的电负性差异不大,分别为 1.9 和1.8。
电负性差异小的元素更容易形成固溶体,因为它们之间的键合力相似。
3. 晶体结构相同:铜和镍都具有面心立方 (FCC) 晶体结构。
相同晶体结构的元素更容易形成固溶体,因为它们具有相同的原子排列方式。
4. 混合焓为负:形成固溶体需要能量投入,称为混合焓。
对于铜和镍固溶体,混合焓为负,这意味着形成固溶体比将两种金属单独分开时能量更低。
5. 相图存在固溶体相区:铜和镍的相图显示了一个固溶体相区。
这个相区表示在特定温度和组成范围内,存在一个单一的固溶体相。
6. 温度和成分范围:铜和镍固溶体的形成受到温度和成分范围的影响。
一般来说,更高的温度和更接近等原子比的组成有利于固溶体的形成。
固溶体的特性铜镍固溶体具有以下特性:- 同质:固溶体在宏观上是均匀的,具有单一的晶体结构和均匀的组成。
- 机械性能:铜镍固溶体的机械性能取决于镍的含量。
随着镍含量的增加,强度和硬度增加,而延展性降低。
- 电导率:铜镍固溶体的电导率低于纯铜,但仍比许多其他金属高。
- 耐腐蚀性:镍的添加提高了铜的耐腐蚀性,尤其是在还原性环境中。
- 磁性:当镍含量高于约 30 wt% 时,铜镍固溶体表现出磁性。
应用铜镍固溶体广泛用于各种应用中,包括:- 硬币:许多硬币,如美国五分镍,由铜镍固溶体制成。
- 电气部件:铜镍固溶体用于电阻器、连接器和其他电气部件,因为它具有良好的电导率和耐腐蚀性。
- 海洋应用:铜镍固溶体用于船体和海洋结构,因为它具有耐腐蚀性、强度和良好的焊接能力。
- 耐腐蚀合金:铜镍固溶体与其他元素结合使用,形成耐腐蚀合金,用于化工、石油和造纸等行业。
- 磁性材料:高镍含量的铜镍固溶体用于磁性材料,如电磁铁和变压器。
o的原子半径原子半径有一个重要的数据,这就是它们的原子半径。
下面让我们看看几种主要元素的原子半径。
一、最基本的原子,那就是C,所以先来看看它的原子半径吧。
原子半径: 3。
8m (1。
068u)二、然后是Na、 K、 Ca、 Sr、 Ba、P。
它们的原子半径分别为: 1。
044、 1。
046、 1。
049、 1。
022、1。
035、 1。
048、 1。
020、 1。
026、 1。
010、 1。
011、 1。
009、 1。
008、 1。
008、 1。
008。
1。
006。
原子半径: 1。
065三、最后是Na、 K、 Ca、 Sr、 Ba、 P。
它们的原子半径分别为:1。
059、 1。
058、 1。
056、 1。
054、 1。
055、 1。
045、 1。
054、 1。
043、 1。
042、 1。
041、 1。
040、 1。
040、 1。
049、1。
049、 1。
049。
(1)O分子式为,属于分子晶体。
(2)N的原子半径与其结构有关。
分析表明,氮原子中N的价电子处于第四周期中第Ⅰ和第Ⅱ族,氮原子的电子构型为。
由于氮原子是以sp杂化轨道形成三重键,氮原子半径较大,而且几乎不含氧原子。
它的原子半径为。
(用公式N的原子半径为r的单位是厘米)。
4、 O的外层电子只能接受电子对,与氯离子不同。
因此常态下不容易发生取代反应。
O具有还原性,遇有机物可发生反应生成卤素单质。
常见氧化物:一氧化碳二氧化碳二氧化硫一氧化碳,还有水(不属于非金属氧化物)。
(如碳酸氢钠)常见还原物:硫、氧气、臭氧等一些物质。
(如氧化铜、三氧化铬)。
(但不包括还原物如碳、碘、铝、镁等)5、 H、 F、 Cl、 Br。
5、 O分子在稀硫酸中稳定。
稀硫酸是强酸,会使金属钝化,也会使某些非金属溶解。
(这时金属离子或铵根离子就没有电离的电子了,电子会留给H原子和SO2分子的氢核,所以它们就不再显电离的电子,变得钝化了)6、氢、 H2、 H2O、 H2SO4、 H2SO3、 H2Cl4、 H2SO2、H2ClO5、 H4O2、 H2O4、 H4O等都有还原性。
铜的综述第七章铜⾦属铜(copper,Cu),原⼦序数29,价电⼦层结构为3d104s1,原⼦量63.54,相对体积质量8.92,熔点1083℃,原⼦半径127.8pm。
纯铜呈浅玫瑰⾊或淡红⾊。
氧化态有+1、+2。
铜的热导率和电导率都很⾼,化学稳定性强,抗张强度⼤,易熔接,具有抗蚀性、可塑性、延展性。
能与锌、锡、铅、锰、钴、镍、铝、铁等⾦属形成合⾦,形成的合⾦主要有三类:黄铜是铜锌合⾦,青铜是铜锡合⾦,⽩铜是铜钴镍合⾦。
铜加热产⽣⿊⾊的氧化铜,长时间存放在潮湿的环境中,铜的表⾯会产⽣⼀层铜绿。
铜易溶于硝酸、热浓硫酸,可缓慢溶于稀盐酸和硫酸,也能与浓盐酸在加热情况下反应。
铜是与⼈类关系⾮常密切的有⾊⾦属,被⼴泛地应⽤于电⽓、轻⼯、机械制造、建筑⼯业、国防⼯业等领域,各企业铜消费的⽐例为:电⼦(包括通讯)48%、建筑24%、⼀般⼯程12%、交通7%、其他9%。
第⼀节铜在环境中的分布⼀、空⽓中的铜美国空⽓中的铜浓度为10~570ng/m3,南极空⽓中平均铜浓度是0.036ng /m3。
⼆、⽔中的铜地球上的⽔体是铜存在和迁移的场所之⼀。
铜随着岩⽯风化、⽔⼟流失、降⾬和⽣物迁移进⼊江河湖海。
天然淡⽔中浓度中铜的含量很低,平均仅为3µg /L。
在⼤⽓降⽔中的铜主要以⽔溶性铜(占总量80%)降落到陆地表⾯。
北美(北纬40°~50°)的⼤陆降⽔铜浓度为21.0pg/L,俄罗斯平原(北纬50°~70°)的⼤陆降⽔铜浓度为4.0pg/L,⼤西洋(北纬35°~40°)的海洋降⽔(⾬⽔)铜浓度为2.6pg/L,南极沿岸地带的海洋降⽔(雪)铜浓度为0.9pg/L。
铜在海⽔中的浓度为30pg/L。
江河湖⽔中的铜含量⼀般不⾼,⼤约3µg/L。
但天然⽔源多受铜的污染,使⽔源铜含量增加。
例如⽢肃省监测的13个⽔库中,铜超标率33.3%。
黄河⽔在有些城市河段铜超标,长江⽔中的铜在靠近⼀些城市的江段也有超标,例如安徽的芜湖段超标31.11%。