酯自身缩合反应机理
- 格式:ppt
- 大小:675.50 KB
- 文档页数:20
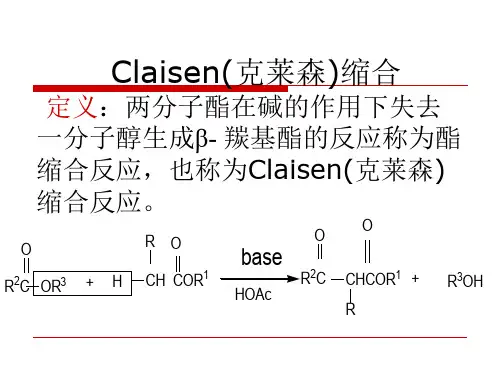
Claisen(克莱森)酯缩合反应
一、定义
含有α-氢的酯在醇钠等碱性缩合剂作用下发生缩合作用,失去一分子醇得到β-酮酸酯的反应称为酯缩合反应,也称为Claisen(克莱森)缩合反应。
二、机理(Mechanism)
通式如下:
R O
OR1R2OR3
O base
R2OR1
O O
R3OH
反应机理如下:
1
B
-H+
1
3
1R
2OR1
O O
机理解读:
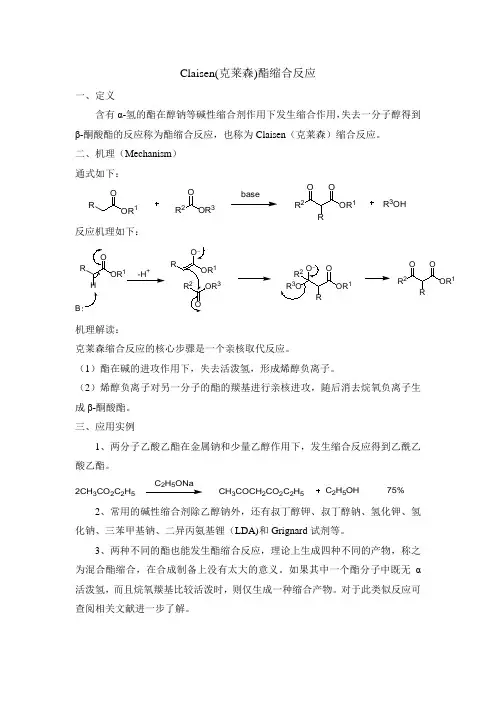
克莱森缩合反应的核心步骤是一个亲核取代反应。
(1)酯在碱的进攻作用下,失去活泼氢,形成烯醇负离子。
(2)烯醇负离子对另一分子的酯的羰基进行亲核进攻,随后消去烷氧负离子生成β-酮酸酯。
三、应用实例
1、两分子乙酸乙酯在金属钠和少量乙醇作用下,发生缩合反应得到乙酰乙酸乙酯。
2CH3CO2C2H5C2H5ONa
CH3COCH2CO2C2H575%
C2H5OH
2、常用的碱性缩合剂除乙醇钠外,还有叔丁醇钾、叔丁醇钠、氢化钾、氢化钠、三苯甲基钠、二异丙氨基锂(LDA)和Grignard试剂等。
3、两种不同的酯也能发生酯缩合反应,理论上生成四种不同的产物,称之为混合酯缩合,在合成制备上没有太大的意义。
如果其中一个酯分子中既无α活泼氢,而且烷氧羰基比较活泼时,则仅生成一种缩合产物。
对于此类似反应可查阅相关文献进一步了解。

claisen缩合反应一、Claisen缩合反应的概念和原理Claisen缩合反应是一种重要的有机化学反应,其基本原理是通过两个酯或一个酯和一个醛/酮之间的羰基加成,形成β-羰基酯。
这种反应常用于有机合成中,可以制备出许多重要的有机化合物。
二、Claisen缩合反应的分类1. Claisen酯缩合反应:两个不同的酯在碱性条件下发生缩合反应,生成β-羰基酯。
2. Claisen内酯缩合反应:一种环状的β-羰基酮在碱性条件下发生内部环化,生成环状的β-内酯。
3. Dieckmann环化反应:两个相同的β-羰基酸酯在碱性条件下发生内部环化,生成环状的β-内酯。
三、Claisen缩合反应机理1. 首先,在碱性条件下,一个羰基亲核试剂(如乙氧根离子)攻击一个羧基碳上的电子不稳定位点,形成一个临时的α-羟基负离子中间体。
2. 然后,在第二个羰基试剂的作用下,这个中间体的负电荷被转移到第二个羰基碳上,形成一个新的负离子中间体。
3. 最后,经过质子化和消除水分子,生成β-羰基酯产物。
四、Claisen缩合反应的影响因素1. 碱催化剂:碱催化剂可以促进反应进行,并且影响反应速率和产物选择性。
2. 温度:温度对反应速率和产物选择性都有影响。
通常,较高温度可以加快反应速率,但也可能导致产生不良产物。
3. 反应物浓度:较高浓度的反应物可以加快反应速率,但也可能导致不良产物的生成。
4. 反应时间:反应时间也会影响反应速率和产物选择性。
通常,较长的反应时间可以增加产量和纯度。
五、Claisen缩合反应在有机合成中的应用1. 制备β-羰基酸酯:Claisen缩合反应是制备β-羰基酸酯的重要方法。
这些化合物在医药、香料和杀虫剂等领域都有广泛的用途。
2. 制备环状化合物:Claisen内酯缩合反应和Dieckmann环化反应是制备环状化合物的常用方法。
这些化合物在药物、农药和天然产物的合成中具有重要作用。
3. 制备α,β-不饱和羰基化合物:通过Claisen缩合反应可以制备出α,β-不饱和羰基化合物,这些化合物在有机光电子学、涂料和高分子材料等领域具有广泛的用途。


克莱森酯缩合反应机理克莱森酯缩合反应是一种重要的有机合成反应,被广泛应用于生物化学、有机合成和药物合成等领域。
这种反应的基本原理是以β-酰基联合物(如乙酰乙酸和苯酚)为底物,经过酸催化下的水解和缩合反应,生成新的酰化产物。
本文将从反应机理以及主要反应步骤两个方面详细介绍克莱森酯缩合反应。
一、反应机理克莱森酯缩合反应的机理较复杂,主要可分为三个步骤:酸催化水解、质子转移和羰基加成。
(1)酸催化水解首先,β-酰基联合物在酸的作用下发生水解反应,生成相应的酸和醇。
例如:乙酰乙酸与苯酚可以在硫酸的作用下水解成苯基丙酮和水。
(2)质子转移随着底物的水解,产生的苯基丙酮分子中的一个羰基带有正电荷,另一个羰基则带有负电荷。
为达到中性,α碳上的氢离子会向带负电荷的羰基迁移,形成稳定的偶电子共轭结构。
质子转移反应是本反应中最重要的步骤。
(3)羰基加成最后,由于酮与酯基序列相连,可能发生Ⅰ型加成,形成的β-酰羰基联合物是反应产物的主要组成部分。
二、主要反应步骤1、准备反应底物首先需要准备出乙酰乙酸和苯酚这两种反应底物。
其中,乙酰乙酸是一种有机酸,常为无色无臭的液体,可以通过将醋酸称为之后脱水得到。
苯酚则是一种无色透明的液体,可通过苯的氢氧化反应制得。
2、加入催化剂将乙酰乙酸和苯酚按照一定的比例混合,加入适量的硫酸作为催化剂,用磁力搅拌器搅拌至混合均匀。
3、反应将混合物放置在用于加热的反应器中,加热至适宜的温度继续搅拌,持续反应1-2小时。
反应结束后,用硫酸中和反应产物酸,然后用冰水洗涤,干燥后得到产物。
综上所述,克莱森酯缩合反应具有较高的化学反应性和广泛的应用前景,是有机合成和化学生物学领域不可或缺的重要反应之一。

酯基成环反应酯基成环反应是有机化学中一种常见的反应类型,也被称为酯内环化反应。
它是指酯分子中的羰基和羟基之间发生缩合反应,生成环状的化合物。
这种反应通常需要催化剂的存在,如酸或碱等。
下面将详细介绍酯基成环反应的机理、影响因素和应用。
一、机理酯基成环反应的机理可以分为两个步骤:首先是羟基与羰基发生加成反应,生成一个临时中间体;然后是临时中间体内部亲核攻击,形成环状产物。
具体来说,在催化剂(如硫酸)存在下,羟基会先与羰基发生加成反应,形成一个稳定的过渡态。
在这个过渡态中,羟基上带有一个负电荷,而羰基上带有一个正电荷。
接着,在这个过渡态内部,负电荷会被邻近的羰基吸引,并向其移动。
这样就形成了一个稳定的临时中间体。
在这个临时中间体中,由于负电荷已经转移到了邻近的羰基上,因此原来带有负电荷的羟基就变成了一个亲核物。
这个亲核物会攻击临时中间体中的羰基,形成环状产物,并释放出一个催化剂分子。
二、影响因素酯基成环反应的影响因素主要包括以下几个方面:1. 催化剂:不同的催化剂对反应速率和选择性都有很大影响。
常用的催化剂有硫酸、氢氧化钠等。
2. 反应条件:包括反应温度、反应时间、溶剂等。
通常情况下,较高的温度和较长的反应时间可以促进反应进行,但也可能导致产物分解或杂质生成。
3. 底物结构:不同结构的酯分子对反应速率和选择性都有影响。
一般来说,含有较活泼羟基或较易形成稳定临时中间体的酯分子更容易进行酯基成环反应。
4. 其他因素:如溶液pH值、浓度等也会对反应产率和选择性产生影响。
三、应用酯基成环反应在有机合成中具有广泛的应用。
一些常见的例子包括:1. 合成环状化合物:酯基成环反应是制备环状化合物的重要方法之一。
例如,可以用这种反应来合成内酯、内酰胺等化合物。
2. 合成药物:许多药物分子中都含有环状结构,因此酯基成环反应可以用于制备药物前体或中间体。
例如,一些抗癌药物和抗生素就是通过这种反应合成的。
3. 合成天然产物:许多天然产物也含有环状结构,因此酯基成环反应也被广泛用于天然产物的全合成。


有机化学基础知识点整理酯的反应机理酯的反应机理酯是有机化合物的一种重要类别,广泛存在于生物和化学领域中。
它们具有丰富的化学反应性质,可以通过各种方式进行合成和转化。
本文将整理酯的反应机理,旨在帮助读者更好地理解和应用有机化学基础知识。
一、酯的形成酯的形成主要是通过酸催化下的醇和羧酸(或酸酐)的缩合反应实现的。
该反应通常在常温下进行,生成酯与水。
反应机理如下:1. 酸性催化剂(一般为无水无矿酸)提供质子(H+)。
2. 质子攻击羧酸(R1-COOH)中的羟基(-OH),形成氧化羫离子(R1-CO+H2O)。
3. 氧化羫离子进一步与醇(R2-OH)发生缩合反应,生成过渡态(R2-O-CO-R1)。
4. 过渡态失去质子,生成酯(R2-O-CO-R1)。
总的反应方程式如下:R1-COOH + R2-OH → R1-COOR2 + H2O二、酯的水解酯的水解是指酯与水在碱性或酸性环境中发生反应,将酯分解为羧酸和醇。
酯水解在生物体内广泛存在,是一种重要的代谢途径。
1. 酸性条件下的水解当酯与较强的酸(如浓硫酸或盐酸)反应时,水分子先离解为质子(H+)和水合氢离子(H3O+)。
质子攻击酯中的羧基(-COOR),生成对应的酸酐。
通过这个步骤,酯可以转化为羧酸和醇。
反应机理如下:1. 水分子离解为质子(H+)和水合氢离子(H3O+)。
2. 质子攻击羧酸酯(R-COOR),生成酸酐(R-CO-OH2+)。
3. 酸酐发生水解,脱去酯中的羟基,生成羧酸(R-COOH)。
总的反应方程式如下:R-COOR + H+ → R-COOH2+ + ROHR-COOH2+ + H2O → R-COOH + H3O+2. 碱性条件下的水解酯在碱性条件下水解主要经历乌尔曼水解反应。
在碱性介质中,羧酸酯先与羟氧化钠(NaOH)反应生成羟基钠盐和酸酐。
接着,经过水分子的进一步攻击,酸酐转化为羧酸和相应的醇。
反应机理如下:1. 羧酸酯与碱反应生成羟基钠盐和酸酐。

有机化学基础知识点整理羧酸的酯化和酯解反应有机化学基础知识点整理:羧酸的酯化和酯解反应在有机化学领域中,羧酸的酯化和酯解反应是常见的有机合成反应。
本文将对羧酸的酯化和酯解反应进行简要介绍和整理。
一、羧酸的酯化反应在有机化学中,酯化反应是指羧酸与醇(或醇类化合物)在酸性条件下发生酯键的形成。
这种反应是一种酸催化反应,通过羧酸中的羧基与醇分子中的羟基之间的缩合反应来实现。
酯化反应通常需要一定的时间和适宜的反应条件才能得到较好的产率。
酯化反应的机理:酯化反应的机理主要包括三个步骤:质子化、缩合和消去。
1. 质子化:质子(H+)与羧酸分子中的羧基发生反应,形成羧酸中间体 -OH2+,同时释放出水。
2. 缩合:质子化的羧酸中间体与醇中的羟基发生缩合反应,形成酯单质子 -C-O-R+。
3. 消去:通过酸催化,产生的酯单质子中的羟基脱去质子,生成酯。
酯化反应的影响因素:1. 酯化反应的速率通常取决于羧酸和醇的反应物浓度。
2. 酯化反应通常在酸性条件下进行,选择适宜的催化剂可以提高反应速率和产率。
3. 温度的选择也会影响酯化反应的进行,通常较低的反应温度有助于提高产率。
二、酯解反应酯解反应是指酯化反应的逆过程,即酯键被水或醇断裂,形成羟基或醇基和羧酸的反应。
酯解反应通常在碱性条件下进行,其中碱催化酯解是最常见的类型。
酯解反应的机理:酯解反应主要包括两个步骤:质子化和断裂。
1. 质子化:碱对酯化反应中形成的酯进行质子化。
2. 断裂:质子化后的酯发生断裂反应,形成碱金属盐、醇和羧酸。
酯解反应的影响因素:1. 酯解反应通常在碱性条件下进行,选择合适的碱催化剂可以提高反应速率和产率。
2. 温度的选择同样对酯解反应有一定影响。
3. 酯解反应的速率也受到反应物浓度的影响。
结论:羧酸的酯化和酯解反应是有机合成中常见的反应类型。
酯化反应是通过羧酸和醇在酸性条件下发生酯键的形成,而酯解反应则是酯化反应的逆过程。
这两种反应都受到多种因素的影响,如反应物浓度、催化剂的选择、温度等。

claisen酯缩合条件克莱森(酯)缩合反应是含有α-活泼氢的酯类在醇钠、三苯甲基钠等碱性试剂的作用下,发生缩合反应形成B-酮酸酯类化合物。
反应可在不同的酯之间进行,称为交叉酯缩合;也可将本反应用于二元皎酸酯的分子内环化反应,这时反应又称为迪克曼反应(DieCknIannreaction)o反应条件是α碳上有氢原子的酯发生反应。
克莱森(酯)缩合反应是一种有机化学反应,通常在碱催化下进行,涉及两个或多个酯分子之间的缩合。
这种反应条件温和,操作简便,因此在实际合成中得到了广泛应用。
在克莱森缩合反应中,酯分子中的碳原子上的氢原子被亲核试剂(如醇钠、三苯甲基钠等)所取代,形成新的碳-碳键。
这种反应可以用于合成具有特定结构的化合物,例如B-酮酸酯类化合物,具有广泛的生物活性和药理作用。
此外,克莱森缩合反应还可应用于其他类型的合成反应中,如交叉酯缩合和分子内环化反应等。
这些反应条件下的克莱森缩合反应具有较高的选择性,能够生成结构特定的化合物,因此在有机化学、药物合成和材料科学等领域中具有重要的应用价值。
在克莱森(酯)缩合反应中,反应条件的选择对于生成目标产物至关重要。
通常,强碱如醇钠或三苯甲基钠等被用作催化剂。
这些碱试剂能够有效地与酯分子中的皴基发生反应,形成负碳离子,进一步与另一分子酯的城基发生亲核加成反应。
在反应过程中,碳原子上的氢原子被取代,形成新的碳-碳键。
除了催化剂的选择外,反应温度、溶剂和反应时间也是影响克莱森(酯)缩合反应的重要因素。
通常,反应在温和的条件下进行,如室温或稍微加热的条件下。
选择适当的溶剂对于反应的进行也是至关重要的,通常会选择非极性或极性较低的溶剂,如乙醛、苯或四氢吠喃等。
反应时间则根据具体情况而定,通常需要数小时或更长时间才能完成。
此外,克莱森(酯)缩合反应在实际应用中还有一些技巧和注意事项。
例如,在反应过程中保持干燥、避免水分的侵入以及使用纯度较高的试剂等。
这些细节的处理能够确保反应的顺利进行并提高产物的纯度和收率。

dcc缩合机理酯化反应DCC缩合机理酯化反应概述:DCC缩合机理酯化反应是一种常用的有机合成方法,可用于酯化反应和肽链合成中的缩合反应。
本文将详细介绍DCC缩合机理酯化反应的原理、应用及相关实验方法。
一、原理:DCC(dicyclohexylcarbodiimide)是一种常用的缩合试剂,它能够催化酸和醇之间的酯化反应。
在DCC催化下,醇和酸发生缩合反应生成酯,并释放出二氧化碳。
DCC通过与酸反应形成活化的酯化中间体,然后与醇发生酯化反应,最终生成酯。
二、应用:DCC缩合机理酯化反应在有机合成中具有广泛的应用。
首先,它可用于合成酯类化合物,酯是一类重要的有机化合物,广泛应用于医药、香料、染料等领域。
其次,DCC缩合机理酯化反应还可用于合成肽链。
在肽链合成中,DCC可作为缩合试剂催化氨基酸和肽之间的缩合反应。
此外,DCC还可用于合成其他有机化合物,如酮、醚等。
三、实验方法:1. 准备反应体系:将DCC溶解在无水有机溶剂中,如二氯甲烷、二甲基甲酰胺等。
2. 加入反应物:将酸和醇依次加入反应体系中,控制摩尔比例。
3. 反应条件:在室温下搅拌反应体系,反应时间一般为数小时至数天。
4. 反应结束:反应结束后,通过过滤或萃取等方法分离出目标产物。
5. 纯化和鉴定:通过结晶、重结晶等方法纯化产物,并使用质谱、红外光谱等技术鉴定产物的结构。
四、注意事项:1. DCC是一种具有刺激性和毒性的化学试剂,操作时需佩戴防护手套和眼镜,并在通风橱内进行。
2. 实验中需控制反应物的摩尔比例,以提高反应的选择性和收率。
3. 反应温度和时间的选择应根据具体实验要求进行调整。
4. 在纯化和鉴定过程中,需注意选择合适的分离和分析方法,以确保产物的纯度和结构的准确性。
总结:DCC缩合机理酯化反应是一种重要的有机合成方法,可用于合成酯类化合物和肽链。
通过合理控制反应条件和选择适当的实验方法,可以高效地合成目标化合物。
在实验操作过程中,需注意安全操作,并进行合适的纯化和鉴定步骤,以确保产物的质量和结构准确性。
克莱森缩合反应是一种重要的有机化学反应,也称为克莱森缩合、克莱森酯化反应或克莱森缩合酯化反应。
它是一种缩合反应,可以将两个分子通过酯化反应形成一个更大的分子。
克莱森缩合反应的机理如下:
1. 首先,反应物中的一个醇和一个酸在适当的条件下(如加热、酸性催化剂等)发生酯化反应,生成一个酯和水。
2. 然后,这个酯与另一个醇发生克莱森缩合反应,生成一个更大的酯和一个小分子醇。
3. 这个小分子醇可以再次参与反应,与另一个酸发生酯化反应,生成一个更大的分子。
4. 这个过程可以重复进行,形成一个连续的酯化反应链。
克莱森缩合反应的机理可以用以下反应式来表示:
醇1 + 酸1 →酯1 + 水
酯1 + 醇2 →更大的酯+ 小分子醇
小分子醇+ 酸2 →酯2 + 水
酯2 + 醇3 →更大的酯+ 小分子醇
这个反应可以一直重复下去,形成一个连续的酯化反应链。
克莱森缩合反应的机理可以用分子轨道理论来解释。
在酯化反应中,醇中的羟基和酸中的羰基形成了一个共价键。
在克莱森缩合反应中,这个共价键被打破,形成了一个新的酯键。
这个过程中,分子中的电子云发生了变化,导致了反应的发生。
总的来说,克莱森缩合反应是一种重要的有机化学反应,可以将两个分子通过酯化反应形成一个更大的分子。
它的机理可以用酯化反应和分子轨道理论来解释。
第七章 缩合第一节 概述一、缩合反应的定义及分类方法 1. 定义:★凡两个或多个有机化合物分子通过反应释出小分子而形成一个新的较大分子的反应;或同一个分子发生分子内的反应形成新分子都可称为缩合反应。
释出的简单分子可以是水、醇、卤化氢、氨等。
也有些是加成缩合,不脱去任何小分子。
2. 分类:就化学键的形成而言,缩合反应包括碳-碳键和碳-杂键的形成反应。
二、缩合反应的重要性缩合反应是形成分子骨架的重要反应类型之一。
广泛地用于生产香料、医药、农药、染料等化工产品中。
如重要有机中间体乙酰乙酸乙酯的合成:EtoNaH+CH 32H 5CH 3CCH 22H 5C 2H 5OHO O O1)2)+2镇静催眠药物中间体2-甲基-2-戊烯醛的合成:CH 3CH 2CHO3CH 3CH 2CH=C-CHO240℃,15min(89%)第二节 羟醛缩合★醛或酮在一定条件下可发生缩合反应。
缩合反应分两种情况:一种是相同的醛或酮分子间的缩合,称为自身缩合;另一种是不同的醛或酮分子间的缩合,称为交叉缩合。
★一、羟醛缩合H3C HOCH 3CHOH C H 2C OHCH 3CHH C OHC 提供羰基 提供活泼α-H β-羟基醛 α、β-不饱和醛 含有活泼α-H 的醛或酮在碱或酸催化作用下经亲核加成反应先生成β-羟基醛(酮),再脱水发生消除反应便成α、β-不饱和醛或酮。
该类型的反应称为羟醛缩合反应。
它包括醛醛缩合、酮酮缩合和醛酮交叉缩合三种反应类型。
1.醛醛缩合反应醛醛缩合反应可分为醛的自身缩合和不同醛间的交叉缩合反应两类。
醛醛缩合后可得到β-羟基醛,β-羟基醛经脱水后得到α、β-不饱和醛。
★(1)醛的自身缩合反应醛的自身缩合是指在碱的催化下,两分于相同的含α-H 的醛发生自身缩合反应,得到β-羟基醛,经脱水后最终得到α、β-不饱和醛的反应。
在碱的催化下,乙醛的自身缩合反应式如下式所示:CH 3CHOCH 3CHCH 2CHOOHCH 3CH=CHCHOCH 3CH=CHCHOCH 3CH 2CH 2CHOCH3CH 2CH 2CH 2OHCH 3CH=CHCH 2OH其反应历程为亲核取代反应。
酯缩合反应机理酯缩合反应是一种重要的有机合成反应,其机理比较复杂,下面将从以下几个方面进行介绍:酯缩合反应是由两个酯分子通过缩合反应形成一个酯分子和一个醇分子的反应。
反应过程通常是在酯基还原剂的作用下进行,生成的酯反应产物可以被用作溶剂和反应中间体,所以酯缩合反应是一种十分重要的有机反应。
在反应过程中,最初的步骤是通过酶催化来加速反应。
首先,一个酯分子的羰基碳原子上的氧原子与另一个酯分子羟基下的氧原子之间发生核磁作用。
然后,它们之间的C-O键断裂,形成一个酯分子的羧基和另一个酯分子的羟基。
接着,羧基和羟基之间发生缩合反应,生成一个新的酯分子和一个醇分子,并释放一分子水。
二、催化剂酶被认为是酯缩合反应的理想催化剂,因为它们能够显著降低反应的能垒和提高反应速率。
然而,酶在实验室中的使用受到一些限制,如酶的稳定性和成本。
因此,有很多研究致力于开发新的催化剂,如有机催化剂和金属催化剂等,以代替酶催化的酯缩合反应。
三、反应特性酯缩合反应具有一定的特性。
例如,它是一种非常优美的反应,通常也是一种可控的反应。
此外,它可以通过多种不同的机制实现,例如Lewis酸催化、酸碱催化和金属催化等。
因此,它在化学反应中占据了非常重要的地位。
四、应用酯缩合反应具有广泛的应用场景,例如能够用于生产食品添加剂和精细化工品、化学药品等。
此外,酯分子也可以作为醇和脂肪的来源。
同样,酯缩合反应也可以用于发展新型催化剂、剂型设计和绿色化工等领域。
五、总结酯缩合反应是一种重要的有机反应,其机理比较复杂。
酶是理想的催化剂,但受到一些限制。
它具有优美的反应特性和广泛的应用场景,在化学反应中具有重要的地位。
不断拓展其应用领域和提高反应效率,是当前研究的重点。