高中化学 专题5 电化学问题研究整合课件 苏教版选修6
- 格式:ppt
- 大小:824.00 KB
- 文档页数:11


专题五电化学成绩研讨1.以下安装中,电流计G中有电流经过的是()2.有人设计出利用CH4和O2的反应,用铂电极在KOH溶液中构成原电池。
电池的总反应类似于CH4在O2中燃烧,则以下说法正确的是()①在标准形状下,每耗费5.6L CH4可以向外电路提供2mole-②经过甲烷电极的电极反应式为:CH4+10OH --8e-=CO32-+7H2O③经过甲烷的电极为电池的正极,经过氧气的电极为负极④电池放电后,溶液pH不断降低A.①② B.①③ C.①④ D.③④3.以下叙说不正确的是()A.电镀时,应把镀件置于电解槽的阴极,电镀液应含有镀层金属的阳离子B.中国第1艘液化自然气船“大鹏昊”船底镶嵌锌块,锌作负极,可以防止船体被腐蚀C.电解水的过程中,阴极区附近的溶液的pH会降低D.将钢铁与电源的负极相连可以起到保护钢铁的作用4.把一小块镁铝合金放入6 mol·L-1的氢氧化钠溶液中,可以构成微型电池,则该电池负极的电极反应为()A.Mg Mg2++2e-AlO+4H2O+6e-B.2Al+8OH-22C.4OH-2H2O+O2↑+4e-D.2H2O+2e-2OH-+H2↑5.原电池中,正极是()A.发生氧化反应的电极 B.电子流出的电极C.发生还原反应的电极 D.与负极比拟较,金属性较活泼的一极6.以下组合构成原电池安装,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是以下各组中的哪一组()A.A是锌,B是铜,C为稀H2SO4B.A是铜,B是锌,C为稀H2SO4C.A是铁,B是银,C为AgNO3溶液D.A是Ag,B是铁,C为AgNO3溶液7.有A、B、C、D四种金属,当A、B组成原电池时,电子流动方向A B;当A、D组成原电池时,A为正极;B与C构成原电池时,电极反应式为C2++2e-=C,B-2e-=B2+,则A、B、C、D金属性由强到弱的按次为( )。
A.A>B>C>DB.A>B>D>CC.D >A >B >CD.D >C >A >B8.如图是铅蓄电池充、放电时的工作表示图,已知放电时电池反应为:PbO 2+Pb+4H ++2S=2PbSO 4+2H 2O 。



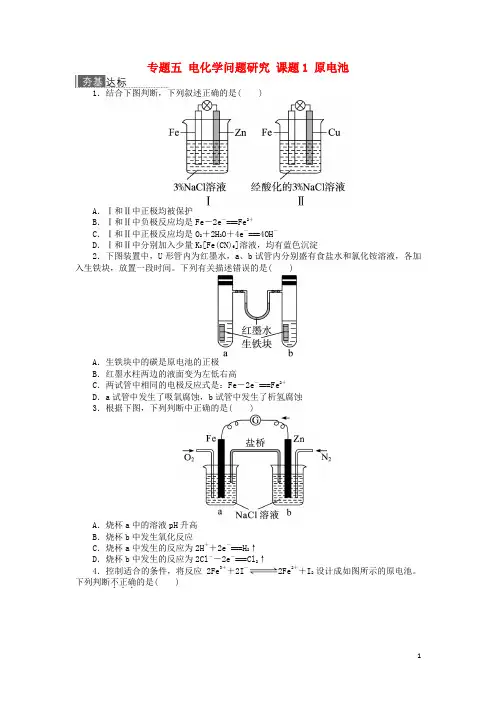
专题五电化学问题研究课题1 原电池1.结合下图判断,下列叙述正确的是( )A.Ⅰ和Ⅱ中正极均被保护B.Ⅰ和Ⅱ中负极反应均是Fe-2e-===Fe2+C.Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e-===4OH-D.Ⅰ和Ⅱ中分别加入少量K3[Fe(CN)6]溶液,均有蓝色沉淀2.下图装置中,U形管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液,各加入生铁块,放置一段时间。
下列有关描述错误的是( )A.生铁块中的碳是原电池的正极B.红墨水柱两边的液面变为左低右高C.两试管中相同的电极反应式是:Fe-2e-===Fe2+D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀3.根据下图,下列判断中正确的是( )A.烧杯a中的溶液pH升高B.烧杯b中发生氧化反应C.烧杯a中发生的反应为2H++2e-===H2↑D.烧杯b中发生的反应为2Cl--2e-===Cl2↑4.控制适合的条件,将反应2Fe3++2I-2Fe2++I2设计成如图所示的原电池。
下列判断不正确...的是( )A.反应开始时,乙中石墨电极上发生氧化反应B.反应开始时,甲中石墨电极上Fe3+被还原C.电流计读数为零时,反应达到化学平衡状态D.电流计读数为零后,在甲中溶入FeCl2固体,乙中的石墨电极为负极5.如图所示,下列叙述正确的是( )A.Y为阴极,发生还原反应B.X为正极,发生氧化反应C.Y与滤纸接触处有氧气生成D.X与滤纸接触处变红6.(1)今有反应2H2+O22H2O,可构成燃料电池,则负极通的应是________,正极通的应是________,电极反应式分别为:______________、______________。
(2)如把KOH改为稀硫酸作导电物质,则电极反应式为________、________,(1)和(2)的电解液不同,反应进行后,其溶液的pH各有何变化?(3)如把H2改为甲烷,KOH做导电物质,则电极反应式为________________________________________________________________________。


课题2 电解与电镀一、判断电解过程中的电极产物判断电解过程中电极产物的依据是:电极材料和离子放电顺序。
阴离子失去电子和阳离子得到电子的过程叫放电。
放电顺序取决于离子本身的性质,也与离子浓度及电极材料有关。
电解时所使用的电极分为两类:一类为惰性电极,只起导体的作用(如铂、石墨等),并不参与反应;另一类为活性电极(除铂、金以及在电解时很易钝化的铅、铬以外的金属),活性电极若作阴极,只起导体的作用;若为阳极,发生氧化反应的往往是电极本身。
电极上物质的变化情况以及电子的转移情况用电极反应式来表明。
当电解质溶液中存在多种阳离子或者多种阴离子时,电解质溶液中各种离子在两极上得失电子是有一定顺序的,称之为放电顺序。
放电顺序涉及多种因素,在中学阶段只要求掌握:阳极——①若为惰性电极,则阴离子放电(失电子,发生氧化反应),放电顺序为: S 2->I ->Br ->Cl ->OH ->含氧酸根离子>F -②若为活性电极,则电极本身失去电子而放电,电极溶解。
因为活性电极的还原性几乎大于一切的阴离子。
阴极——无论是惰性电极,还是活性电极,阴极总是受到保护,不会参与电极反应,始终为阳离子放电(得电子,发生还原反应),放电顺序为:Ag +>Hg 2+>Fe 3+>Cu 2+>H +(酸)>Pb 2+>Sn 2+>Fe 2+>Zn 2+>H +(H 2O)>Al 3+>Mg 2+>Na +>Ca 2+>K +因此,判断电解过程中电极产物的步骤可以概括为:①分析电解质溶液的组成,找全离子(包括水电离出的H +及OH -)并分为阴、阳两组;②分析离子的放电顺序;③确定电极,写出电极反应式。
【例1】某同学按下图所示的装置进行电解实验。
下列说法正确的是( )A .电解过程中,铜电极上不会有H 2产生B .电解初期,主反应方程式为Cu +H 2SO 4=====通电CuSO 4+H 2↑ C .电解一定时间后,石墨电极上不会有铜析出D .整个电解过程中,H +的浓度不断增大解析:从装置图可以看出铜接电源正极作阳极,石墨作阴极,应在阴极区产生H 2,且H +浓度应逐渐减小,故A 、D 错。


课题2 电解与电镀一、判断电解过程中的电极产物判断电解过程中电极产物的依据是:电极材料和离子放电顺序。
阴离子失去电子和阳离子得到电子的过程叫放电。
放电顺序取决于离子本身的性质,也与离子浓度及电极材料有关。
电解时所使用的电极分为两类:一类为惰性电极,只起导体的作用(如铂、石墨等),并不参与反应;另一类为活性电极(除铂、金以及在电解时很易钝化的铅、铬以外的金属),活性电极若作阴极,只起导体的作用;若为阳极,发生氧化反应的往往是电极本身。
电极上物质的变化情况以及电子的转移情况用电极反应式来表明。
当电解质溶液中存在多种阳离子或者多种阴离子时,电解质溶液中各种离子在两极上得失电子是有一定顺序的,称之为放电顺序。
放电顺序涉及多种因素,在中学阶段只要求掌握:阳极——①若为惰性电极,则阴离子放电(失电子,发生氧化反应),放电顺序为: S 2->I ->Br ->Cl ->OH ->含氧酸根离子>F -②若为活性电极,则电极本身失去电子而放电,电极溶解。
因为活性电极的还原性几乎大于一切的阴离子。
阴极——无论是惰性电极,还是活性电极,阴极总是受到保护,不会参与电极反应,始终为阳离子放电(得电子,发生还原反应),放电顺序为:Ag +>Hg 2+>Fe 3+>Cu 2+>H +(酸)>Pb 2+>Sn 2+>Fe 2+>Zn 2+>H +(H 2O)>Al 3+>Mg 2+>Na +>Ca 2+>K +因此,判断电解过程中电极产物的步骤可以概括为:①分析电解质溶液的组成,找全离子(包括水电离出的H +及OH -)并分为阴、阳两组;②分析离子的放电顺序;③确定电极,写出电极反应式。
【例1】某同学按下图所示的装置进行电解实验。
下列说法正确的是( )A .电解过程中,铜电极上不会有H 2产生B .电解初期,主反应方程式为Cu +H 2SO 4=====通电CuSO 4+H 2↑ C .电解一定时间后,石墨电极上不会有铜析出D .整个电解过程中,H +的浓度不断增大解析:从装置图可以看出铜接电源正极作阳极,石墨作阴极,应在阴极区产生H 2,且H +浓度应逐渐减小,故A 、D 错。
课题1 原电池一、原电池工作原理1.原理图示2.原电池的判断方法(1)先分析有无外接电源,有外接电源的为电解池,无外接电源的可能为原电池,然后依据原电池的形成条件分析判断,主要是“四看”:看电极——两极为导体且存在活泼性差异(燃料电池的电极一般为惰性电极);看溶液——两极插入溶液中;看回路——形成闭合回路或两极直接接触;看本质——有无氧化还原反应发生。
(2)多池相连,但无外接电源时,两极活泼性差异最大的一池为原电池,其他各池可看作电解池。
【例1】在盛有稀硫酸的烧杯中放入用导线连接的锌片和铜片,下列叙述正确的是( )A.正极附近的SO2-4浓度逐渐增大B.电子通过导线由铜片流向锌片C.正极有O2逸出D.铜片上有H2逸出解析:本题符合铜锌原电池的形成条件,原电池工作时,电子由负极(锌)经外电路(导线)流向正极(铜)。
负极锌片:Zn-2e-===Zn2+;正极铜片:2H++2e-===H2↑;总反应为:Zn+2H+===Zn2++H2↑。
原电池中没有产生O2。
SO2-4向负极移动。
答案:D1-1下列装置中明显有电流产生的是( )二、原电池正负极的判断与电极反应式的书写1.正负极的判断在书写原电池的电极反应式时,首先应正确判断原电池的两个电极哪一个是正极,哪一(1)书写电极反应式时,按照负极发生氧化反应,正极发生还原反应,首先正确判断出电极反应产物,然后结合反应物及转移电子数量写出反应式,再结合质量守恒、电荷守恒配平各电极反应式。
(2)注意负极反应生成的阳离子与电解质溶液中的阴离子是否共存。
若不共存,则该电解质溶液中的阴离子应写入负极反应式;若正极上的反应物质是O2,且电解质溶液为中性或碱性,则H2O必须写入正极反应式中,且O2生成OH-;若电解质溶液为酸性,则H+必须写入正极反应式中,且O2生成H2O;若在熔融盐电解质中反应,则O2可能得电子变成O2-。
(3)正负电极反应式相加得到电池反应的总方程式,若能写出已知电池反应的总方程式,可以减去较易写出的电极反应式,从而得到较难写出的电极反应式。