微生物限度检验原始记录
- 格式:doc
- 大小:44.00 KB
- 文档页数:2
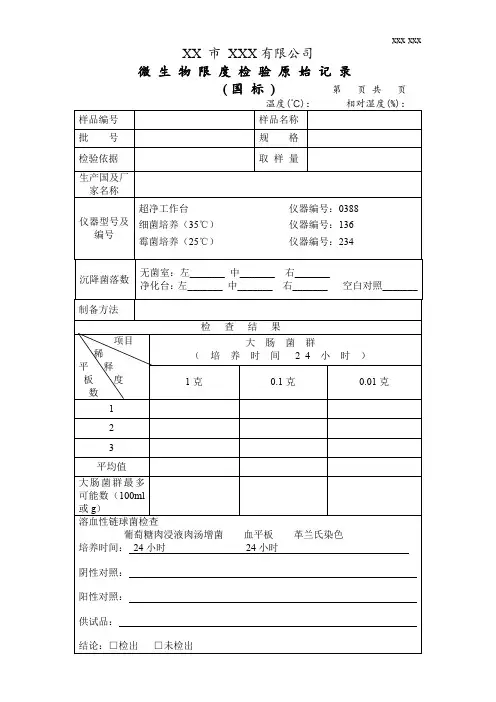

菌落总数与大肠菌群检验原始记录
主检:年月日校核:年月日
菌落总数和大肠菌群检测原始记录
主检:年月日校核:年月日
水质微生物检验原始记录
主检:年月日校核:年月日
乳酸菌与大肠菌群检测记录
主检:年月日校核:年月日
致病菌检验原始记录
主检:年月日校核:年月日
XXXX检测有限公司
霉菌和酵母菌检验原始记录
菌落计数:
培养温度:28±1℃培养时间:年月日时--- 年月日时
主检:年月日校核:年月日
XXXX检测有限公司
商业无菌检验原始记录
共页第页
主检:日期:校核:日期:。

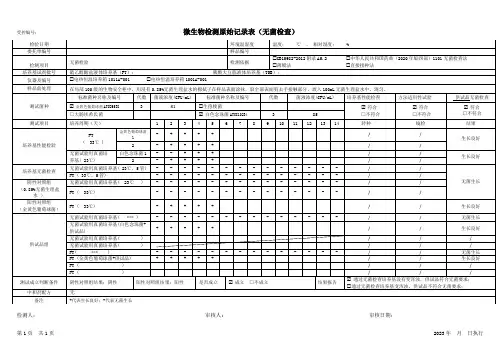

微生物检测原始记录一、目的本文档旨在规定微生物检测的原始记录格式和内容,以确保检测过程和结果的准确性和可追溯性。
二、记录格式1、记录纸张:使用A4纸,横向排列,页边距至少留有2cm。
2、记录标题:在页面顶部居中书写“微生物检测原始记录”。
3、日期和实验室名称:在页面右下角书写检测日期和实验室名称。
4、检测样品信息:在页面中部或适当位置填写样品信息,包括样品名称、编号、来源、处理方式等。
5、检测项目和指标:在页面中部或适当位置列出检测项目和指标,如菌落总数、大肠杆菌、沙门氏菌等。
6、检测方法和仪器:在页面中部或适当位置描述检测所采用的方法和使用的仪器设备。
7、检测结果记录:在页面中部或适当位置详细记录每个检测项目的实验数据,并确保数据准确、清晰、可追溯。
8、结论和建议:在页面底部或适当位置总结检测结果,并给出相应建议或处理意见。
9、检测人员签名:在页面右下角或适当位置由检测人员签名,以示负责。
10、备注:根据需要添加其他相关信息,如样品异常情况说明、引用标准、注意事项等。
三、记录内容1、样品信息:样品名称、编号、来源(如生产批次、产地等)、处理方式(如取样、前处理等)。
2、检测项目和指标:根据实际需要确定检测项目和指标,如菌落总数、大肠杆菌、沙门氏菌等微生物指标,以及可能的化学指标等。
3、检测方法:描述微生物检测所采用的方法,如国标法、第三方检测方法等。
同时应注明所用方法的版本号和发布机构。
4、仪器设备:列出在检测过程中使用的所有仪器设备的名称、型号、编号和使用状态等信息。
5、实验数据记录:详细记录每个检测项目的实验数据,包括观察结果、计数结果、吸光度值等。
数据应准确、清晰、可追溯,并附上必要的图表和曲线图。
6、结论和建议:根据检测结果给出相应的结论和建议,如是否符合标准要求,是否需要进一步处理或跟进等。
7、其他信息:根据需要添加其他相关信息,如样品异常情况说明、引用标准、注意事项等。
8、检测人员签名:由检测人员签名,以示负责。
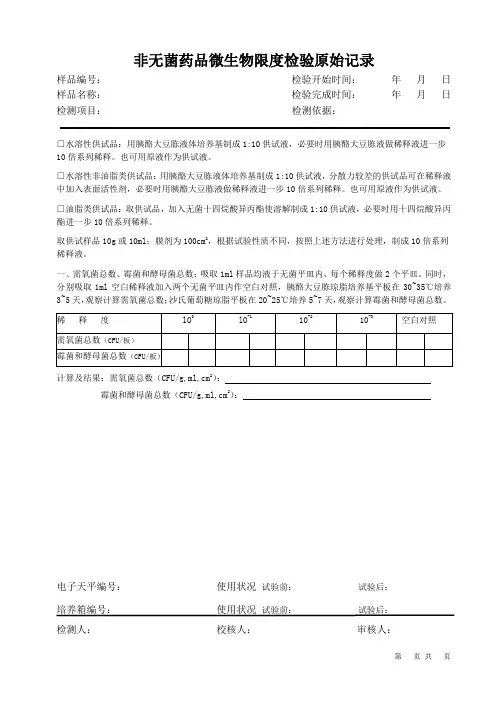
非无菌药品微生物限度检验原始记录样品编号:检验开始时间:年月日样品名称:检验完成时间:年月日检测项目:检测依据:□水溶性供试品:用胰酪大豆胨液体培养基制成1:10供试液,必要时用胰酪大豆胨液做稀释液进一步10倍系列稀释。
也可用原液作为供试液。
□水溶性非油脂类供试品:用胰酪大豆胨液体培养基制成1:10供试液,分散力较差的供试品可在稀释液中加入表面活性剂,必要时用胰酪大豆胨液做稀释液进一步10倍系列稀释。
也可用原液作为供试液。
□油脂类供试品:取供试品,加入无菌十四烷酸异丙酯使溶解制成1:10供试液,必要时用十四烷酸异丙酯进一步10倍系列稀释。
取供试样品10g或10ml;膜剂为100cm2,根据试验性质不同,按照上述方法进行处理,制成10倍系列稀释液。
一、需氧菌总数、霉菌和酵母菌总数:吸取1ml样品均液于无菌平皿内,每个稀释度做2个平皿。
同时,分别吸取1ml空白稀释液加入两个无菌平皿内作空白对照,胰酪大豆胨琼脂培养基平板在30~35℃培养3~5天,观察计算需氧菌总数;沙氏葡萄糖琼脂平板在20~25℃培养5~7天,观察计算霉菌和酵母菌总数。
计算及结果:需氧菌总数(CFU/g,ml,cm2):霉菌和酵母菌总数(CFU/g,ml,cm2):电子天平编号:使用状况试验前:试验后:培养箱编号:使用状况试验前:试验后:检测人:校核人:审核人:样品编号:二、注:+生长或有可疑菌落;-未生长或无可疑菌落。
电子天平编号:使用状况试验前:试验后:培养箱编号:使用状况试验前:试验后:检测人:校核人:审核人:抗生素残留量检查原始记录样品编号:检验开始时间:年月日样品名称:检验完成时间:年月日检测项目:检测依据:取直径8cm的培养皿,注入融化的抗生素II号培养基15~20ml,使在碟底内均匀摊布,放置水平台上使凝固,作为底层。
取抗生素II号培养基15~20ml置于1支50℃水浴预热的试管中,加入0.5%~1.5%(ml/ml)的菌悬液300μm混匀,取适量注入已铺至底层的培养皿中,放置水平台上,冷却后,在每个培养皿上等距离均匀放置钢管,于钢管中依次滴加供试品溶液、阴性对照溶液(磷酸盐缓冲液)及对照品溶液,培养皿置于37℃培养18~22h,进行结果判定。
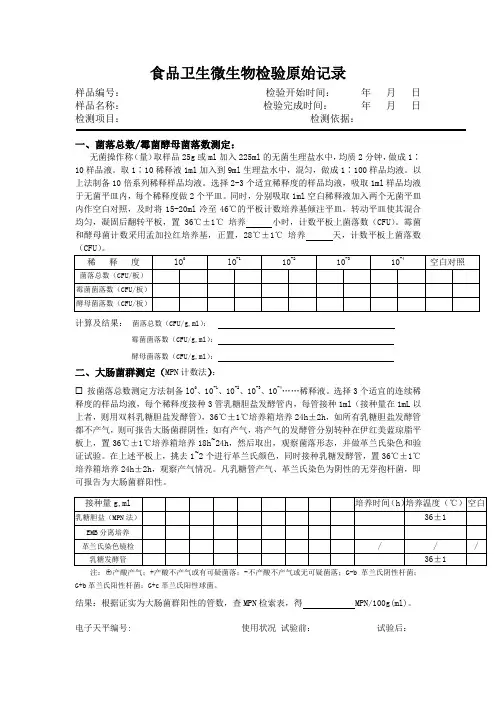
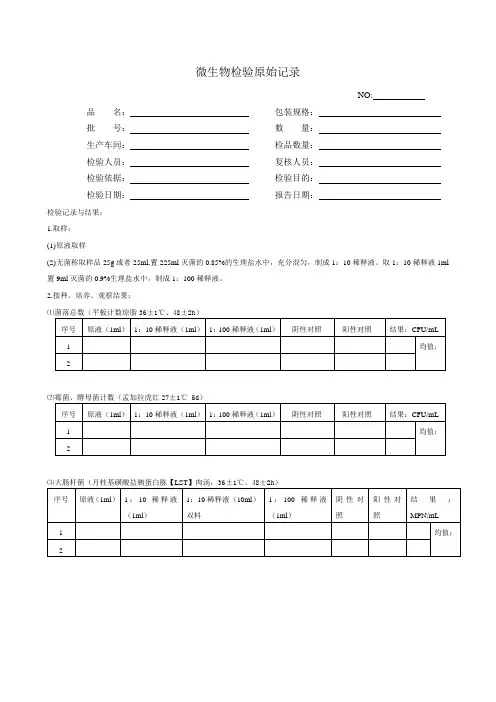
食品卫生微生物检验原始记录样品编号:检验开始时间:年月日样品名称:检验完成时间:年月日检测项目:检测依据:一、菌落总数/霉菌酵母菌落数测定:无菌操作称(量)取样品25g或ml加入225ml的无菌生理盐水中,均质2分钟,做成1∶10样品液。
取1∶10稀释液1ml加入到9ml生理盐水中,混匀,做成1∶100样品均液。
以上法制备10倍系列稀释样品均液。
选择2-3个适宜稀释度的样品均液,吸取1ml样品均液于无菌平皿内,每个稀释度做2个平皿。
同时,分别吸取1ml空白稀释液加入两个无菌平皿内作空白对照,及时将15-20ml冷至46℃的平板计数培养基倾注平皿,转动平皿使其混合均匀,凝固后翻转平板,置 36℃±1℃培养小时,计数平板上菌落数(CFU)。
霉菌和酵母菌计数采用孟加拉红培养基,正置,28℃±1℃培养天,计数平板上菌落数(CFU)。
计算及结果:菌落总数(CFU/g,ml):霉菌菌落数(CFU/g,ml):酵母菌落数(CFU/g,ml):二、大肠菌群测定(MPN计数法):按菌落总数测定方法制备lO0、10-1、10-2、10-3、10-4……稀释液。
选择3个适宜的连续稀释度的样品均液,每个稀释度接种3管乳糖胆盐发酵管内,每管接种1ml(接种量在1mL以上者,则用双料乳糖胆盐发酵管),36℃±1℃培养箱培养24h±2h,如所有乳糖胆盐发酵管都不产气,则可报告大肠菌群阴性;如有产气,将产气的发酵管分别转种在伊红美蓝琼脂平板上,置36℃±1℃培养箱培养18h~24h,然后取出,观察菌落形态,并做革兰氏染色和验证试验。
在上述平板上,挑去1~2个进行革兰氏颜色,同时接种乳糖发酵管,置36℃±1℃培养箱培养24h±2h,观察产气情况。
凡乳糖管产气、革兰氏染色为阴性的无芽孢杆菌,即可报告为大肠菌群阳性。
注:○+产酸产气;+产酸不产气或有可疑菌落;-不产酸不产气或无可疑菌落;G-b革兰氏阴性杆菌;G+b革兰氏阳性杆菌;G+c革兰氏阳性球菌。
规 格 检验日期结论:活螨检验:供试品 用直接检查法, 活螨结论:产品名称 产品批号产品名称产品批号 控制菌检查 阳性对照菌 取沙门菌 新鲜营养肉汤(配制批号:)培养物1ml, 9ml0.9%无菌NaCI 溶液10倍递增稀释取供试品10g 直接接种至300ml 的营养肉汤(配制批号: )中,混匀,培养18〜24小时。
取上述培养物1ml ,接种于10ml 四硫磺酸钠亮绿培养基(配制批号:)中,培养18〜24小时后,分别划线接种于胆盐硫乳琼脂培养基 (或沙门、志贺菌属琼脂培养基) 和麦康凯琼脂培养基(配制批号:)(或曙红亚甲蓝琼脂培养基)的平板上,培养18〜24小时(必要时可延长至 40-48小时)。
若平板上生长的菌落与下表所列的菌落形态特征相符或疑似,用接种针挑选 2-3个菌落分别于三糖铁琼脂培养基高层斜面上进行斜面和高层穿刺接种,培养18〜24小时。
阳性对照试验 阳性对照试验方法同供试品的检查,对照菌加菌量为 10-100cfu 。
阴性对照试验 取稀释液10ml 照控制菌检查法检查。
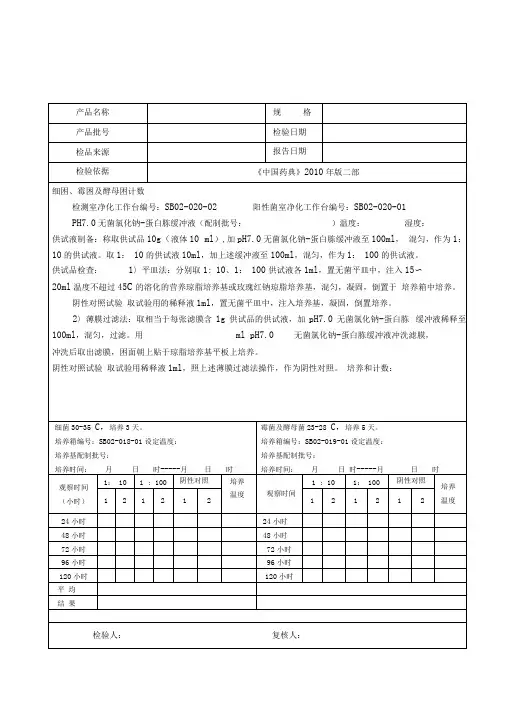
结论:规 格 检验日期检测室净化工作台编号:SB02-020-02 阳性菌室净化工作台编号:SB02-020-01供试液制备:取本品用开孔面积为20cm2的消毒过的金属模板压在内层面上,将无菌棉签用0. 9%无菌氯化钠溶液,稍沾湿,在板孔范围内擦抹5次,换1支棉签再擦抹5次,每个位置用2支棉签共擦抹10次,共擦抹5个位置100cmt每支棉签抹完后立即剪断(或烧断),投入盛有30ml 0.9 %无菌氯化钠溶液的锥型瓶(或大试管)中。
全部擦抹棉签投入瓶中后,将瓶迅速摇晃1分钟,即得供试液。
供试品检查:平皿法:分别取100cm:30 ml、100cm:300 ml供试液各1ml,置无菌平皿中,注入15〜20ml温度不超过45C的溶化的营养琼脂培养基或玫瑰红钠琼脂培养基,混匀,凝固,倒置于培养箱中培养。
阴性对照试验取试验用的稀释液1ml,置无菌平皿中,注入培养基,凝固,倒置培养。

委托检验协议书
(甲方)委托方:阳江市人民医院
(乙方)受委托方:阳江市检测检验中心
由于甲方有部分制剂检验项目尚未能检验,为了保证制剂质量和临床用药安全,甲方特委托乙方对甲方生产的制剂进行以下项目检验:
1.中药制剂成品的薄层色谱法鉴别检查;
2.中药制剂成品的微生物限度检测;
乙方对每批送检品的检验完成周期为10个工作日,每批检品数量为4瓶,并参照国家发改委和财政部[2003]213号收费标准收取药品检验费用(具体价格见附件1),乙方出具的检验报告书仅对甲方送检的样品负责,双方按照委托合同条款执行,时间从2016年9月1日起至2018年9月1日止。
此合同一式二份,双方各执一份。
(甲方)委托方:阳江市人民医院(乙方)受委托方:阳江市检测检验中心负责人:负责人:
年月日年月日。

样品名称:主要成分(处方):样品来源:样品规格:批号:样品前处理方法:取 g(ml)加(乳化剂) g(ml),加pH7.0无菌氯化钠-蛋白胨缓冲液(pH6.8无菌磷酸盐缓冲液) ml验证用菌种:枯草芽孢杆菌CMCC(B)63501、金黄色葡萄球菌CMCC(B)26003、大肠埃希菌 CMCC(B)44102、白色念珠菌 CMCC(F)98001、黑曲霉 CMCC(F)98003。
菌液制备:大肠埃希菌肉汤培养物1ml,加9ml生理盐水,10倍稀释至,备用。
金黄色葡萄球菌肉汤培养物1ml,加9ml生理盐水,10倍稀释至,备用。
枯草芽孢杆菌肉汤培养物1ml,加9ml生理盐水,10倍稀释至,备用。
白色念珠菌改良马丁培养物1ml,加9ml生理盐水,10倍稀释至,备用。
黑曲霉菌斜面的新鲜培养物接种至改良马丁琼脂斜面培养基上,25.5±2.5℃培养5~7d,使大量的孢子成熟。
取经25℃培养7d的黑曲霉真菌斜面培养物,加入生理盐水 ml洗下孢子,吸出转移至空试管作为原液,稀释至,备用。
菌液计数:分别取上述5种细菌菌液适量加入培养皿,每种菌液做平行2皿。
大肠埃希菌、金黄色葡萄球菌、枯草芽孢杆菌注入营养琼脂培养基约15~20ml,30~35℃培养;白色念珠菌注入改良马丁琼脂培养基、黑曲霉注入玫瑰红钠琼脂培养基约15~20ml,23~28℃培养。
表1 细菌数计数结果表2 霉菌数计数结果回收率测定:(常规法)(1)试验组:分别取供试液1 ml和各试验菌液同时加入平皿中,立即倾注营养琼脂培养基(白色念珠菌用改良马丁琼脂培养基,黑曲霉用玫瑰红钠琼脂培养基),待凝固后,置规定温度培养24~72小时观察结果。
(2)供试品对照组:除不加菌液外,其他同试验组。
(3)稀释剂对照组:除不加供试液,余下同试验组。
回收率测定结果结果:(1)枯草芽孢杆菌回收率 70%金黄色葡萄球菌回收率 70%大肠埃希菌回收率 70%常规法□适合□不适合该品种细菌计数方法(2)白色念珠菌回收率 70%黑曲霉菌回收率 70%常规法□适合□不适合该品种霉菌及酵母菌计数方法回收率测定:(培养基稀释法) ml/皿(1)试验组:分别取供试液 1 ml,分置个平皿,每皿加入试验菌液,立即倾注营养琼脂培养基(白色念珠菌用改良马丁琼脂培养基,黑曲霉用玫瑰红钠琼脂培养基),待凝固后,置规定温度培养24~72小时观察结果。
微生物限度检查方法验证原始记录(平皿法)
验证类别:□初次验证□周期性再验证
样品来源:□研发中试产品□研发试生产产品□正式生产产品
验证药品名称:规格:
验证起止时间:年月日~年月日
一、计数方法验证
1、实验条件
样品名称:批号:
培养基:营养肉汤培养基批号:配制日期:
营养琼脂培养基批号:配制日期:
改良马丁液体培养基批号:配制日期:
改良马丁琼脂培养基批号:配制日期:
玫瑰红钠琼脂培养基批号:配制日期:
胆盐乳糖培养基批号:配制日期:
MUG培养基批号:配制日期:
蛋白胨批号:配制日期:
稀释剂:0.9%无菌氯化钠-蛋白胨缓冲液配制日期:
培养箱:□设备型号:SPX-150培养温度:30~35℃
□设备型号:LRH-150B培养温度:23~28℃
2、环境测试
测试时间:年月日操作人:复核人:沉降菌菌落数:
无菌室:左中右
净化台:左中右空白对照
3、菌种
大肠埃希菌(Escherichia coli)〔CMCC(B)44102〕编号:
金黄色葡萄球菌(Staphylococcus aureus)〔CMCC(B)26003〕编号:
枯草芽孢杆菌(Bacillus subtilis)〔CMCC(B)63501〕编号:
白色念珠菌(Candida albicans)〔CMCC(F)98001〕编号:
黑曲霉(Aspergillus niger)〔CMCC(F)98003编号:
(1)微生物生长检查记录(1)样品名称:样品批号:。