2.1.2-钠的几种化合物
- 格式:ppt
- 大小:2.17 MB
- 文档页数:3


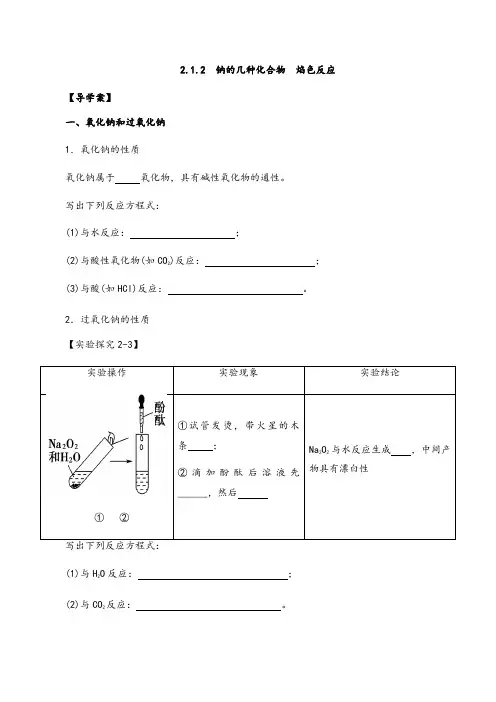
2.1.2 钠的几种化合物焰色反应【导学案】一、氧化钠和过氧化钠1.氧化钠的性质氧化钠属于氧化物,具有碱性氧化物的通性。
写出下列反应方程式:(1)与水反应:;)反应:;(2)与酸性氧化物(如CO2(3)与酸(如HCl)反应:。
2.过氧化钠的性质【实验探究2-3】①②(1)与HO反应:;2反应:。
(2)与CO2【核心素养提升】【思考1】有的同学认为Na2O与Na2O2都是碱性氧化物,你同意这种观点吗?【思考2】结合Na2O2的性质思考实验室中应该如何保存Na2O2?【思考3】现有两包淡黄色粉末。
分别是硫粉和过氧化钠,请思考用怎样的方法可将二者鉴别?3.过氧化钠的用途:供氧剂、漂白剂【重点知识突破】1.过氧化钠的性质(1)Na2O2不是碱性氧化物,因其与酸(盐酸、稀硫酸等)反应时除生成盐和水外,还生成O2,不符合碱性氧化物的概念。
(2)Na2O2具有强氧化性,能氧化S2-、SO2、SO2-3、Fe2+、酸碱指示剂等。
(3)Na2O2的水溶液具有漂白性,因此Na2O2的水溶液能氧化有色物质而使之褪色,能漂白品红溶液、酸碱指示剂、有色布条等。
2.Na2O2与H2O、CO2的反应(1)物质的量的关系无论是CO2或H2O的单一物质还是二者的混合物,通过足量的Na2O2时,CO2或H2O与放出O2的物质的量之比均为2∶1。
(2)固体质量的关系相当于固体(Na2O2)只吸收了CO2中的“CO”、H2O中的“H2”;可以看作发生相应的反应Na2O2+CO===Na2CO3,Na2O2+H2===2NaOH(实际上该反应不能发生)。
3.氧化钠和过氧化钠的比较二、碳酸钠和碳酸氢钠1.Na2CO3、NaHCO3的溶解性、溶液的酸碱性【实验探究2-4】2.Na2CO3、NaHCO3的热稳定性【实验探究2-5】3.Na2CO3、NaHCO3与酸、碱的反应(1)与酸(足量盐酸)反应(写出相应的离子方程式)①Na2CO3:__________________________。

第二章海水中的重要元素——钠和氯第一节钠及其化合物第2课时钠的几种化合物1.下列叙述正确的是()①Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物②Na2O与CO2发生化合反应生成Na2CO3,Na2O2与CO2发生置换反应生成O2③Na2O是淡黄色物质,Na2O2是白色物质④Na2O2可作供氧剂,而Na2O不可⑤Na2O2和Na2O焰色反应均为黄色A.都正确B.②③④⑤C.②③⑤D.④⑤2.下列说法中正确的是()A.非金属单质燃烧时火焰均为无色B.NaCl与Na2CO3灼烧时火焰颜色相同C.焰色反应均应透过蓝色钴玻璃观察D.只有金属单质灼烧时火焰才有颜色3.有两份质量相同的NaHCO3,向第一份中加入盐酸使其充分反应;将第二份加热使其完全分解,冷却至原温度再加入相同浓度的盐酸充分反应,则它们所耗用的盐酸的体积比为()A.2∶1 B.1∶1 C.1∶2 D.4∶14.用光洁的铂丝蘸取某无色溶液在无色火焰上灼烧,直接观察到火焰呈黄色,下列各判断正确的是()A.只含有Na+B.一定含有Na+,可能含有K+C.既含有Na+,又含有K+D.可能含有Na+,可能还含有K+5.下列物质既能与盐酸反应,又能与NaOH反应的是()A.Na2CO3B.NaHSO4C.NaHCO3D.Na2SO46.78 g过氧化钠与168 g碳酸氢钠固体混合后,在密闭容器中加热充分反应,排尽气体后冷却,残留的固体物质是()A.Na2CO3B.Na2O2、Na2CO3C.NaOH、Na2CO3D.Na2O2、NaOH、Na2CO37.下列判断正确的是()A.可用水来确定某Na2O粉末中是否含有Na2O2B.可用CO2来确定某Na2O粉末中是否含有Na2O2C.Na2O比Na2O2稳定D.将足量的Na2O2、Na2O分别加到酚酞溶液中,最终溶液均为红色8.可以用来断定碳酸氢钠粉末中是否混有碳酸钠的实验方法是()A.加热时有无气体放出B.滴加盐酸时有无气泡放出C.溶于水后,滴加稀的氯化钙溶液看有无白色沉淀生成D.溶于水后,滴加澄清石灰水,看有无白色沉淀生成9.把Na2O2投入下列各物质的稀溶液中,充分反应后不可能有浑浊产生的是()A.Ba(HCO3)2B.Na2CO3C.NaHCO3D.CuSO410.在一定温度下,向饱和的烧碱溶液中加入一定量的过氧化钠,充分反应后恢复到原来温度,下列说法正确的是()A.溶液中Na+浓度增大,有O2放出B.溶液碱性不变,有H2放出C.溶液中Na+数目减少,有O2放出D.溶液碱性增强,有O2放出11.A、B、C、D、E五种物质的焰色反应都显黄色,A、B与水反应都有气体放出,A与水的反应放出的气体具有还原性,同时都生成溶液C,C与适量的CO2反应生成D,D溶液与过量的CO2反应生成E,E加热能变成D。

钠的几种化合物的知识点钠(化学符号Na)是一种常见的金属元素,属于第一周期第一族元素。
它的原子序数为11,原子量为22.99。
钠是一种非常活泼的金属,常以离子的形式存在,与其他元素形成各种化合物。
钠的化合物可以分为氯化物、硫酸盐、碳酸盐和亚硝酸盐等几个主要类别。
下面将逐步介绍钠的几种主要化合物及其特点。
1.氯化钠(NaCl):氯化钠是钠最常见的化合物,也是我们日常生活中所熟知的食盐。
它以无色晶体的形式存在,可溶于水。
氯化钠是一种离子化合物,由一个钠离子(Na+)和一个氯离子(Cl-)组成。
由于氯化钠的晶体结构稳定,它具有很高的熔点和沸点。
氯化钠在食品加工、调味和防腐等方面有广泛的应用。
2.硫酸钠(Na2SO4):硫酸钠是一种无色结晶体,也是一种重要的无机化合物。
它可以通过钠与硫酸反应得到。
硫酸钠在化学工业中具有许多用途,例如用作纤维素、皮革和纸张的漂白剂,还可以用于制备其他钠化合物。
3.碳酸钠(Na2CO3):碳酸钠,俗称苏打粉,是一种白色结晶体。
它可以通过钠与二氧化碳反应得到。
碳酸钠在许多领域都有广泛应用,例如制造玻璃、肥皂和洗涤剂,还可用作调节水体的pH值。
4.亚硝酸钠(NaNO2):亚硝酸钠是一种白色结晶体,可溶于水。
它是一种常见的食品添加剂,用作防腐剂和抗氧化剂。
亚硝酸钠也可用于制备其他亚硝酸盐和一些有机化合物。
除了以上几种化合物,钠还可以与许多其他元素形成化合物,例如氧化钠(Na2O)、氢氧化钠(NaOH)等。
这些化合物在工业生产和日常生活中都有重要的应用。
总结:钠是一种活泼的金属元素,与其他元素形成多种化合物。
氯化钠、硫酸钠、碳酸钠和亚硝酸钠是钠的几种主要化合物,它们在食品加工、化学工业和其他领域有广泛应用。
了解钠的化合物对我们理解钠的性质和应用具有重要意义。




第二章《海水中的重要元素—钠和氯》教学设计第一节钠及其化合物第二课时钠的几种化合物焰色试验【回顾1】氧化物的定义:由两种元素组成,其中一种是氧元素的化合物。
氧化物可分为碱性氧化物、酸性氧化物和两性氧化物等。
【回顾2】Na2O 属于碱性氧化物(填“酸性”或“碱性”)能和水、酸、酸性氧化物等物质反应。
化学方程式分别为:【板书】Na2O+H2O=2NaOH、Na2O+2HCl=2NaCl+H2O、CaO+CO2=Na2CO3。
【回顾3】NaOH是一种强碱,俗称火碱、烧碱、苛性碱,在空气中易吸收水分而发生潮解。
能和酸、酸性氧化物、盐等物质反应。
【预习1】而过氧化钠是特殊氧化物。
氧化钠和过氧化钠均能与水的反应,其化学方程式分别为:【板书】Na2O+H2O===2NaOH 、2Na2O2+2H2O===4NaOH+O2↑ ;它们与CO2反应的化学方程式分别为:【板书】Na2O+CO2===Na2CO3 、2Na2O2+2CO2===2Na2CO3+O2.。
【预习2】按照组成元素分类,碳酸钠和碳酸氢钠属于钠或碳酸盐,碳酸钠具有稳定性,而碳酸氢钠受热易分解。
化学方程式为:【板书】2NaHCO3Na2CO3+H2O+CO2↑ 。
【导入】趣味实验“滴水生火”。
把少量淡黄色粉末平铺在脱脂棉上,用玻璃棒轻轻压拨,使粉末进入脱脂棉中,用胶头滴管滴加蒸馏水,观察棉花会燃烧。
这是为什么呢?【学生1】①组成元素一样、均为金属氧化物;因此,可能能与水、二氧化碳、盐酸等物质反应。
【教师】强调实验安全及注意事项、投影表格。
【学生】分小组完成实验:过氧化钠与水的反应。
填写表格内容。
实验操作将1①2 mL水滴入盛有1~2 g过氧化钠固体的试管中立即把带火星的木条伸入试管中,检验生成的气体;用手轻轻触摸试管外壁,感受有什么变化;用PH试纸检验溶液的酸碱性,观察有何现象。
实验现象①滴入水后试管中有大量气泡产生,生成的气体能使带火星的木条复燃。


第2课时钠的几种化合物教学目标1. 通过钠的化合物——氧化钠和过氧化钠的性质对比学习,掌握钠的两种氧化物性质的异同。
2. 通过学习碳酸钠和碳酸氢钠的性质异同及二者之间的相互转化,对学生进行唯物主义教育,培养学生的思维能力和综合分析能力,培养学生证据推理与模型认知、科学探究与创新意识的化学核心素养。
教学重难点重点:1. 氧化钠和过氧化钠的性质对比。
2. 碳酸钠和碳酸氢钠性质异同及相互转化。
3. 焰色试验。
难点:1. 过氧化钠的化学性质。
2. 碳酸钠和碳酸氢钠的转化和鉴别。
教学过程一、导入新课“吹气生火”,请一位学生对着蘸有Na2O2的脱脂棉轻轻地吹口气,脱脂棉剧烈燃烧。
二、新课讲授一、氧化钠和过氧化钠【师】1. 过氧化钠与水反应【实验2-3】向试管中加入过氧化钠固体,再向其中滴加1~2 mL的蒸馏水,将带火星的木条伸入试管中。
用手轻轻触摸试管外壁,有什么感觉?最后用pH试纸检验溶液的酸碱性。
【实验现象】反应放热,有气体生成,带火星的木条复燃,溶液为碱性。
反应原理:2Na2O2 + 2H2O === 4NaOH + O2↑【师】在实际生产生活中,用碳、一氧化碳、氢气等还原剂与金属氧化物在高温下发生还原反应,从而获得金属单质,即金属的冶炼。
【师】2. 过氧化钠与二氧化碳反应反应原理:2Na2O2 + 2CO2 === 2Na2CO3 + O2【总结】【过渡】PPT展示“呼吸面具”的种类和苏打水。
苏打水是碳酸氢钠的水溶液,可以天然形成或者用弱碱泡腾片、苏打泡腾片以及机器人工生成。
苏打水含有弱碱性,医学上外用可消毒杀菌。
天然苏打水除含有碳酸氢钠外,还含有多种微量元素成分,因此是上好的饮品。
世界上只有法、俄、德等少数国家出产天然苏打水,我国部分地区(四川乐山、黑龙江)亦有出产天然苏打水。
基本特点1.苏打水属于弱碱性水,可以天然形成,也可以通过机器或者用弱碱泡腾片、苏打泡腾片快速溶解而成。
2.苏打水有利于养胃,因为苏打弱碱水能中和胃酸。
新教材2020-2021学年化学人教版(2019)必修第一册学案:第二章第一节第2课时钠的几种化合物焰色试验含解析第2课时钠的几种化合物焰色试验1.氧化钠和过氧化钠(1)物理性质氧化钠是白色固体,过氧化钠是淡黄色固体。
(2)化学性质①过氧化钠与水反应的实验。
2.碳酸钠与碳酸氢钠(1)物理性质(2)化学性质(3)用途①碳酸钠:在玻璃、肥皂、合成洗涤剂、造纸、纺织、石油等方面有广泛的应用。
②碳酸氢钠:是发酵粉的主要成分,可以作治疗胃酸过多的药剂。
3.焰色试验(1)定义很多金属或它们的化合物在灼烧时都会使火焰呈现特殊的颜色。
(2)操作(3)几种金属的焰色钠:黄色,钾:紫色(观察时要透过蓝色钴玻璃)。
知识点一:氧化钠、过氧化钠结构、性质对比知识点二:Na2CO3和NaHCO3的鉴别、除杂与转化(1)鉴别(2)除杂混合物(括号内为杂质)除杂方法或试剂Na2CO3固体(NaHCO3)加热NaHCO3溶液(Na2CO3)通入足量CO2气体Na2CO3溶液(NaHCO3)加入适量NaOH溶液题组一过氧化钠的性质1.下列关于Na2O2的叙述中正确的是(D)A.Na2O2是淡黄色固体,久置于空气中变成Na2OB.Na2O2与水的反应中,Na2O2只作氧化剂C.用Na2O2漂白过的织物、麦秆等日久又渐渐变成黄色D.Na2O2放入饱和NaOH溶液中,放出大量的O2,并有白色固体析出解析:Na2O2久置于空气中变成Na2CO3;Na2O2与水反应时,Na2O2既是氧化剂又是还原剂;利用Na2O2的强氧化性漂白织物,这种漂白是永久性的;Na2O2与H2O反应消耗饱和NaOH溶液中的水,同时生成NaOH和O2,故有NaOH固体析出.2.“二氧化碳是否在有水存在时才能与过氧化钠反应?"这个问题可通过以下实验加以证明。
(1)按图安装好装置,在干燥的试管Ⅲ中装入Na2O2后,通入CO2之前,应事先将弹簧夹K1、K2夹好,目的是以防试管Ⅲ内的过氧化钠和外界相通时发生吸潮现象.(2)试管Ⅰ内的试剂X是浓H2SO4时,打开弹簧夹K1、K2,加热试管Ⅲ约5 min后,将带火星的小木条放在试管Ⅱ的液面上方,可观察到带火星的小木条不能剧烈燃烧,且试管Ⅲ内淡黄色粉末未发生变化.则所得的结论是过氧化钠与干燥的CO2不反应。