化妆品检验原始记录
- 格式:docx
- 大小:37.04 KB
- 文档页数:4
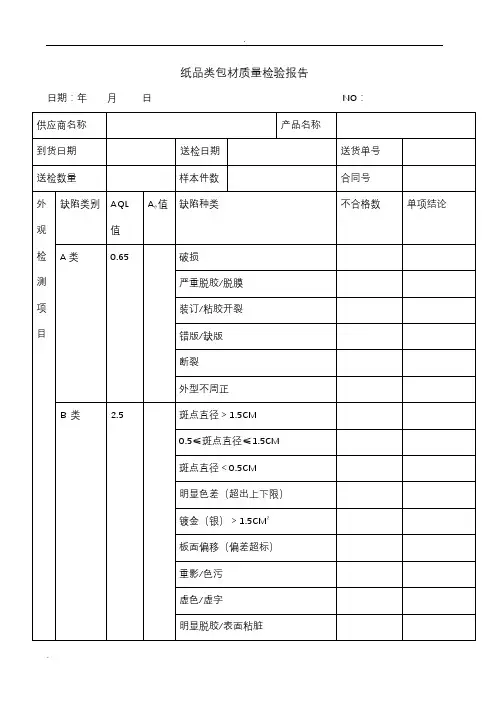
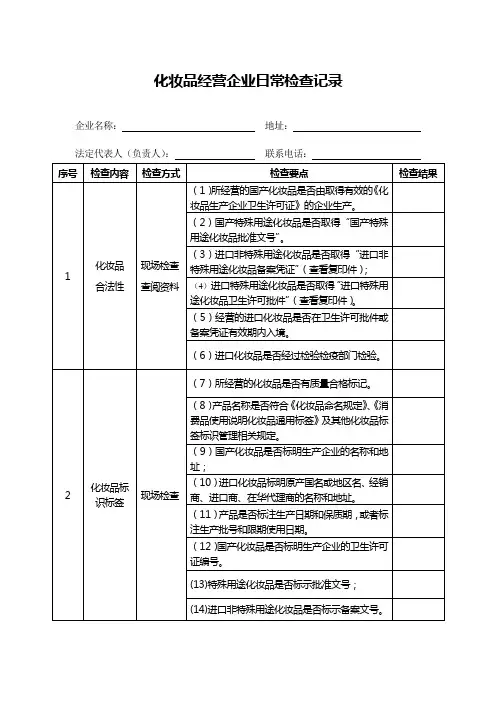
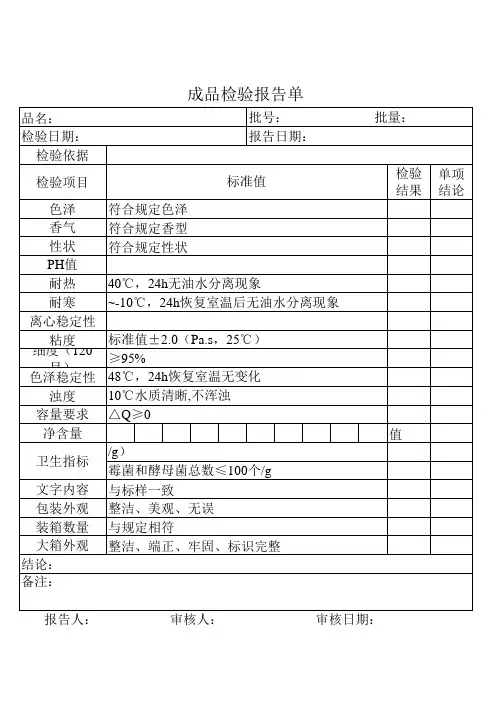
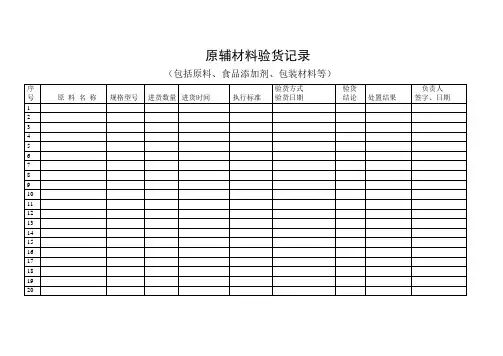
原辅材料验货记录(包括原料、食品添加剂、包装材料等)产品销售台帐原辅材料供方评价登记表(包括原材料、食品添加剂、营养增加剂包装材料等)原辅材料投料、使用记录(包括食品添加剂、营养强化剂使用情况)关键工艺、关键工序质量控制记录计量器具检定、使用台账生产设备管理台账消毒剂、清洗剂使用记录质量管理考核记录包装材料使用记录主要负责人员、工程技术人员一览表使用食品添加剂备案表填报单位(盖章):填报时间:年月日原料记录表生产记录表产品销售记录表原料信息记录表注:1、企业应如实全数填写报表;2、上报时应附上相关供应商、生产厂家的资质证书复印件、产品检验报告书复印件(均需加盖公章);3、发生增减品种时应及时上报,以便更新数据库有关内容。
不合格原料通知单检验员:复核:检验时间:不合格产品评审处置表质量工作会议记录醒发工序记录烘烤工序记录不合格项纠正记录培训记录设备维修(保养)记录检修人:日期:(部门负责人)确认:日期:消毒剂入库、领用记录设备、设施及地面卫生清洗消毒记录消毒剂名称:消毒方法:A浸泡、B喷洒、C擦洗消毒液配制记录消毒剂名称:工作服消毒记录记录人:审核人:年月日抽样单抽样单抽样单生产过程产品感官检验记录成品卫生检验原始记录净含量及感官检验原始记录配料记录采购验证记录采购验证记录出厂检验报告单干燥失重(水分)检验原始记录g干燥失重(水分)检验原始记录g物资采购计划单物资采购计划单成品出库记录细菌总数检测原始记录总大肠菌群检测证实试验记录。


化妆品成品检验报告
报告编号:2024-001
报告日期:2024年1月1日
报告单位:ABC化妆品检验中心
一、样品信息
样品名称:牌美白乳液
样品生产日期:2024年12月15日
样品产地:国
样品规格:100ml/瓶
二、检验目的
本次检验的目的是对牌美白乳液的产品质量进行评估,确认产品是否符合相关国家和行业标准的要求。
三、检验方法
本次检验采用了以下测试项目和方法:
1.外观:目测法
2.pH值:玻璃电极法
3.稳定性:振荡振幅法
4.大肠菌群:平板计数法
5.铅(以Pb计):原子吸收法
6.汞(以Hg计):气相色谱法
四、检验结果
1.外观:乳白色液体,无悬浮物和沉淀,符合要求。
2.pH值:6.5,符合要求(要求范围为5.5-7.5)。
3.稳定性:经振荡测试,无明显变化,符合要求。
4.大肠菌群:未检出大肠菌群,符合要求(要求为未检出)。
5.铅:未检出铅,符合要求(要求为未检出)。
6.汞:未检出汞,符合要求(要求为未检出)。
五、结论
根据对样品的多项指标检验结果判断,牌美白乳液在外观、pH值、
稳定性、大肠菌群、铅和汞的含量方面均符合相关国家和行业标准的要求。
可以认定该批次的样品合格,可以正常投放市场销售和使用。
六、备注
ABC化妆品检验中心。


化妆品检验报告1. 检验目的本次化妆品检验旨在对产品进行质量、安全性及合规性方面的评估,确保产品符合相关法规和标准的要求。
2. 检验方法采用以下检验方法对化妆品进行检测:- 外观检验:对产品的外观进行观察,包括包装完整性、标签清晰度等方面。
- 成分分析:采用化学分析方法,对化妆品中的主要成分进行定性和定量分析。
- 安全性评估:通过对产品中可能存在的有害物质进行检测,评估其对人体的安全性。
- 功能性评估:对产品的功能性进行评估,如保湿效果、抗皱效果等。
- 微生物检验:对产品进行微生物检测,评估其是否符合微生物限制标准。
3. 检验结果根据以上检验方法,对所检化妆品进行了全面评估和检测,得出以下结果:- 化妆品外观:产品包装完整无损,标签清晰可读。
- 成分分析:产品成分中主要包含水、甘油、植物提取物等,符合相关法规和标准的要求。
- 安全性评估:经有害物质检测,化妆品中未检出任何有害物质,符合人体安全性要求。
- 功能性评估:产品保湿效果良好,抗皱效果稍有提升。
- 微生物检验:化妆品微生物检测结果符合微生物限制标准,未发现任何异常。
4. 检验结论根据本次化妆品检验的结果,可以得出以下结论:本化妆品产品在质量、安全性及合规性方面均符合相关法规和标准的要求。
产品外观完好,成分安全无害,功能良好,并且微生物检测结果正常。
5. 建议和改进措施鉴于本次化妆品检验结果良好,建议继续保持产品的质量和安全性,并注意产品功能的改进和创新。
以上为本次化妆品检验报告。
如有任何疑问或需要进一步了解,请及时与我们联系。
谢谢!。

化妆品质检化验批记录
化妆品质检化验批记录
记录日期:__________________
化验员:__________________
化妆品名称:__________________
生产批号:__________________
抽样日期:__________________
样品数量:__________________
外观检查结果:
1. 包装完好无损。
2. 标签信息准确无误。
3. 外观无明显缺陷或污染。
物理性质检验结果:
1. 检查样品的颜色、气味、触感等外观特性。
2. 测定样品的稠度、粘度、pH值等物理性质,符合规定要求。
化学成分检验结果:
1. 使用相应仪器检测样品中的化学成分。
2. 比对化学成分与产品配方的合理性,符合规定要求。
3. 检测样品中的添加剂或污染物,符合规定要求。
微生物检验结果:
1. 通过取样分析检测样品中的细菌、霉菌等微生物。
2. 样品不得含有致病菌或超标微生物数量。
稳定性检验结果:
1. 针对样品的贮存条件,进行稳定性测试。
2. 检测样品在一定时间范围内的性能变化情况。
3. 样品的稳定性符合规定要求。
其他备注:
1. 记录其他需要特别说明的情况或异常。
2. 如有对样品进行其他特殊测试,需在此进行记录。
质检结论:
1. 合格:样品通过所有质检项目,符合规定要求。
2. 不合格:样品未通过一项或多项质检项目,不符合规定要求。
质检员签名:__________________。
化妆品生产原始记录填写操作规程
目的:规范车间生产原始记录的填写,特制定此操作规程。
范围:本操作规程适用于乳化车间生产原始记录填写过程。
职责:半成品部部长、车间班长、操作人员对本操作规程的实施负责。
内容
1. 乳化车间
1.1按照工艺单记录表如实填写工艺单的产品名称、生产数
量、编号、生产锅组、环境温度、操作人姓名及生产日期。
1.2按照记录表格要求如实记录每一步实际操作的相关项
目。
1.3特殊情况必须如实填写在记录表下方备注栏里。
1.4所有原始记录数据不得更改,如因个人失误填写错误,
须在数据旁边签上修改人名字或经由班长同意方可修
改,且原数据只能以双斜线划掉,不得以其他方式涂抹更改。
1.5在生产过程遇到的异常情况除了在记录表格上进行填写
外,还应及时汇报相关人员。
1.6每批生产后的记录表格,核实无误后统一交到班长处1.7生产监控人要核实记录人记录数据,确认无误后在监控
栏签名。
1.8领料出库单中的原料批次需由原料仓管如实填写,配料
人员复核。
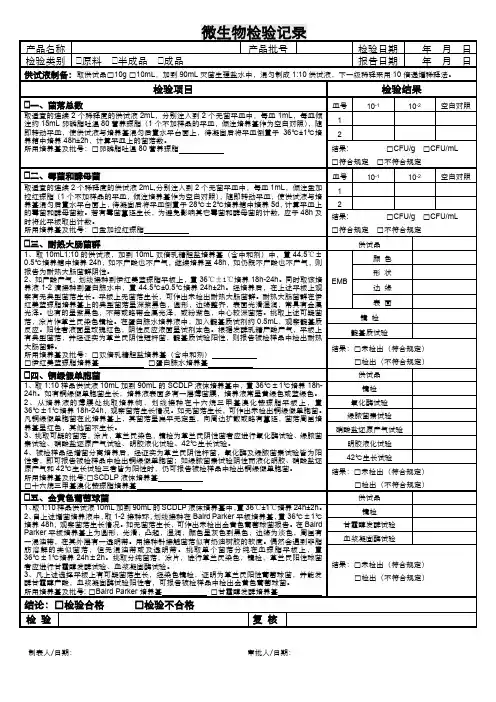
化妆品微生物检验原始记录样品编号:检验开始时间:年月日样品名称:检验完成时间:年月日检测项目:检测依据:一、供检样品的制备:液体样品:1.水溶性的液体样品:灭菌吸管吸取10ml加到90ml灭菌生理盐水中,混匀后,制成1∶10检液;2.油性液体样品:取样品10g,依次加入5ml灭菌液体石蜡和10ml灭菌吐温80,在℃水浴中振荡混合10min,加入灭菌的生理盐水75ml,在℃水浴中乳化,制成1∶10检液;膏、霜、乳剂半固体状样品:1.亲水性的样品:称取10g加入装有玻璃珠的90ml灭菌生理盐水三角瓶中,充分震荡混匀,静置15min,取其上清液作为1∶10检液;2.疏水性样品:称取10g置于灭菌的研钵中,加10ml灭菌液体石蜡,研磨成粘稠状,再加入10ml灭菌吐温80,研磨待溶解后,加70ml灭菌生理盐水,在℃水浴中充分混匀,制成1∶10检液;固体样品:称取10g,加到90ml灭菌生理盐水中,充分震荡混匀,使其分散混悬,静置后,取其上清液作为1∶10检液;二、菌落总数测定:无菌操作吸取1∶10稀释的检液1ml加入到9ml的无菌生理盐水中,混匀,做成1∶100的稀释液。
以上法制备10-3、10-4……稀释液。
选择合适的稀释度,吸取1ml加入到无菌平皿中,每一稀释度做2个平皿同时,分别吸取1ml空白稀释液加入两个无菌平皿内作空白对照。
加入冷至46±1℃的无菌卵磷脂吐温-80营养琼脂约15ml,混匀,凝固后,翻转平板,置 36±1℃培养小时,计数平板上菌落数(CFU)。
霉菌和酵母菌计数采用虎红培养基,置28±1℃培养天,计数平板上菌落数(CFU)。
结果计算:细菌菌落数(CFU/g,ml):霉菌和酵母菌落数(CFU/g,ml):电子天平编号:使用状况试验前:试验后:培养箱编号:使用状况试验前:试验后:检测人:校核人:审核人:样品编号:三、粪/耐热大肠菌群检验:注:○+产酸产气;+产酸不产气或有典型菌落或靛基质试验阳性;-不产酸不产气或无典型菌落或靛基质试验阴性;G-b革兰氏阴性杆菌;G+b革兰氏阳性杆菌; G+c革兰氏阳性球菌四、致病菌检验:注:+生长或有可疑菌落;-未生长或无可疑菌落;G-b革兰氏阴性杆菌;G+b革兰氏阳性杆菌;G+c革兰氏阳性球菌电子天平编号:使用状况试验前:试验后:培养箱编号:使用状况试验前:试验后:检测人:校核人:审核人:样品编号:注:+生长或有可疑菌落;-未生长或无可疑菌落;G-b革兰氏阴性杆菌;G+b革兰氏阳性杆菌;G+c革兰氏阳性球菌电子天平编号:使用状况试验前:试验后:培养箱编号:使用状况试验前:试验后:检测人:校核人:审核人:样品编号:注:+生长或有可疑菌落;-未生长或无可疑菌落;G-b革兰氏阴性杆菌;G+b革兰氏阳性杆菌;G+c革兰氏阳性球菌电子天平编号:使用状况试验前:试验后:培养箱编号:使用状况试验前:试验后:检测人:校核人:审核人:样品编号:注:+生长或有可疑菌落;-未生长或无可疑菌落;G-b革兰氏阴性杆菌;G+b革兰氏阳性杆菌;G+c革兰氏阳性球菌电子天平编号:使用状况试验前:试验后:培养箱编号:使用状况试验前:试验后:检测人:校核人:审核人:样品编号:注:+生长或有可疑菌落;-未生长或无可疑菌落;G-b革兰氏阴性杆菌;G+b革兰氏阳性杆菌;G+c革兰氏阳性球菌电子天平编号:使用状况试验前:试验后:培养箱编号:使用状况试验前:试验后:检测人:校核人:审核人样品编号:五、需氧嗜温性细菌:无菌操作加入1ml初悬液和样品稀释液倒入15ml~20ml琼脂培养基(保存在不超过48℃的水浴中)小心旋转或倾注平板使初悬液和样品稀释液与培养基充分混合,室温下将培养皿放置在水平面上使平皿中的混合物凝固。
化妆品检验原始记录
检验原始记录编号:产品名称:生产批号:生产日期:规格:取样日期:样品数量:
检验依据:根据2015年版的化妆品安全技术规范进行检验。
检验时间:报告时间。
检测环境:温度(T):℃;相对湿度(RH):%
检验仪器:单人操作净化台、电热恒温干燥箱、高压蒸汽灭菌锅、恒温器、恒温培养箱、天平。
1、取样与稀释:
无菌称取检样10g(ml),加到装有玻璃珠的90ml灭菌生理盐水的三角瓶中,充分混匀,制成1:10的匀液。
吸取1:10的匀液1ml至9ml灭菌生理盐水中,制成1:100
的匀液。
每个稀释度吸取2ml,分别注入到两个灭菌平皿内,
每皿1ml。
将45℃-50℃的卵磷脂吐温80营养琼脂培养基加入平皿,每皿约15ml,混匀,待凝固后,翻转平皿于36℃±1℃培养
48h±2h。
同时做空白对照。
2、无菌吸取检样10g(ml),加入灭菌液体石蜡10ml混匀,振荡,在加10ml灭菌吐温80,溶解后,最后加入70ml灭菌
生理盐水,在40℃-45℃水浴中充分混合。
制成1:10的匀液,吸取1:10的匀液1ml至9ml灭菌生理
盐水中,制成1:100的匀液。
每个稀释度吸取2ml,分别注入
到两个灭菌平皿内,每皿1ml。
将45℃-50℃的卵磷脂吐温80营养琼脂培养基加入平皿,每皿约15ml,混匀,待凝固后,翻转平皿于36℃±1℃培养
48h±2h。
同时做空白对照。
菌落总数(卵磷脂吐温80营养琼脂,36℃±1℃,
48h±2h)。
稀释度1:101:100空白对照。
检验结果标准值:CFU/ g。
单项判定:平皿1、平皿2≤1000(眼、唇部、儿童用品≤500)。
感官、理化指标:
检验依据:根据相关标准进行检验。
检验时间:报告时间。
项目:外观、色泽、香气、耐热、耐寒。
指标:无异物、符合规定色泽、符合规定香型、
(40±1)℃保持24h,恢复至室温后无分离现象,-5℃—-10℃保持24h,恢复至室温后无分离析水现象。
PH值测定:
检验依据:GB/T.1.
检验时间:报告时间。
样品处理:各取一定量的样品,加入一定量的蒸馏水,加热至40℃不断搅拌,冷却到测试温度,测定。
净含量(g):
检验员:审核。
标识(g/mL)。
次数、总重(g)、净含量(g)、平均净含量(g)。