总胆固醇(TC)测定试剂(盒)(CHOD—PAP法)产品技术要求新产业
- 格式:docx
- 大小:16.96 KB
- 文档页数:3

胆固醇测定试剂盒(CHOD-PAP法)适用范围:本试剂盒用于体外定量测定人血清中胆固醇浓度。
1、规格试剂:1×40ml、试剂:1×80ml、试剂:2×60ml、试剂:3×40ml试剂:4×80ml、试剂:5×60ml、试剂:2×100ml试剂:2×95ml;试剂:2×5ml、试剂:10×60ml2.1 外观试剂为无色至浅黄或浅红色澄清液体。
2.2 净含量试剂净含量不少于标称装量。
2.3 试剂空白吸光度用生理盐水作为样本加入试剂测试时,在37℃、波长505nm、1cm光径条件下,试剂空白吸光度应不大于0.100。
2.4 分析灵敏度CHO含量为5.17mmol/L时,测定吸光度差值的绝对值应>0.100(△A)。
2.5 线性区间试剂(盒)线性在[0.1,12.9]mmol/L区间内:2.5.1 线性相关系数(r)应不小于0.9900;2.5.2 [0.1,1.5]mmol/L区间内,线性绝对偏差不超过±0.2mmol/L;(1.5,12.9]mmol/L区间内,线性相对偏差不超过±10%。
2.6 精密度2.6.1 重复性批内精密度应不大于4.0%。
2.6.2 批间差批间差应不大于6.0%。
2.7 准确度用国家标准物质(编号:GBW09178b)进行测试,实测值与标示值的相对偏差应在±10.0%内。
2.8 稳定性试剂盒于2℃~8℃避光环境中密封保存至有效期末进行检验,检验结果应符合2.1、2.3、2.4、2.5、2.6.1、2.7的要求。

胆固醇测定试剂盒(CHOD-PAP法)适用范围:本试剂用于体外定量测定人血清或血浆中胆固醇的含量。
1.1 产品型号/规格1×25 ml;1×50 ml;2×50 ml;4×50 ml;8×50 ml;2×100 ml;6×100 ml 4×70 ml;9×70 ml;6×50 ml;2×125 ml;4×125 ml;5×50 ml;8×22.4 ml 1.2 划分说明GOOD’s缓冲液(PH6.7) 50 mmol/L苯酚5 mmol/L4-氨基安替比林 0.3 mmol/L胆固醇酯酶 >200 U/L胆固醇氧化酶 >100U/L过氧化物酶 >3 KU/L2.1 外观和性状2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;中文包装标签应清晰、准确、牢固。
2.1.2 试剂应为无色至淡粉红色澄清液体。
2.2 净含量不少于标示值。
2.3 试剂空白吸光度在光径1 cm、主波长546 nm下,以蒸馏水为检测样本时,吸光度应不大于0.1。
2.4 分析灵敏度CHO含量为5.17 mmol/L时,测定吸光度差值(△A)应在0.591 ~1.098 范围内。
2.5 线性范围CHO试剂在线性范围(0~19.39] mmol/L内:(a)回归系数r应不小于0.990;(b)在(0~3.00 ] mmol/L范围内,线性绝对偏差应不大于±0.30 mmol/L;(c)在(3.00~19.39] mmol/L范围内,线性相对偏差应不大于±10%。
2.6 测量精密度2.6.1 重复性变异系数(CV)均应不大于4%。
2.6.2 批间差相对偏差(R)应不大于6%。
2.7 准确度采用GBW09180a标准物质对试剂盒进行测试,相对偏差应不超过±10%。
胆固醇(CHO)测定试剂盒(CHOD-PAP法)适用范围:用于体外定量测定人体血清中胆固醇的含量。
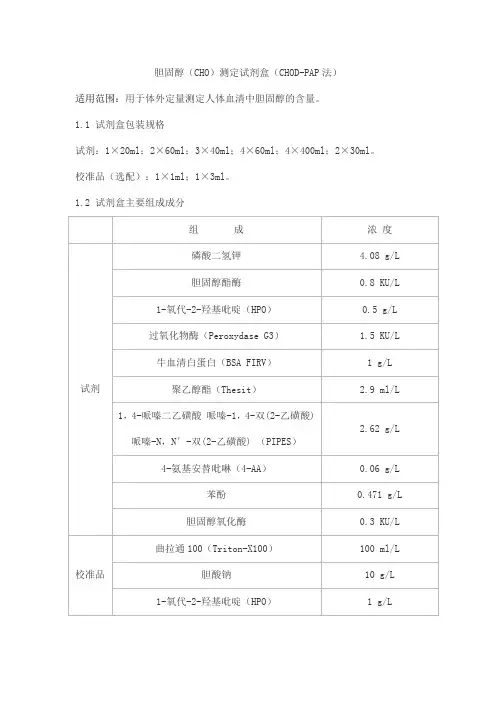
1.1 试剂盒包装规格试剂:1×20ml;2×60ml;3×40ml;4×60ml;4×400ml;2×30ml。
校准品(选配):1×1ml;1×3ml。
1.2 试剂盒主要组成成分2.1 外观试剂:浅粉红色澄清液体。
校准品:无色至淡黄色澄清液体。
2.2 净含量液体试剂的净含量不得低于标示体积。
2.3 试剂空白吸光度在37℃、505nm波长、1cm光径条件下,试剂空白吸光度应不大于0.1。
2.4 分析灵敏度测定浓度为5.17mmol/L样本时,吸光度变化值(ΔA)应在(0.10,0.45)范围内。
2.5 线性范围在(0.5,19.3)mmol/L线性范围内,线性相关系数r不小于0.996。
在[5,19.3)mmol/L范围内的线性相对偏差应不大于±10%;测定结果(0.5,5)mmol/L 时线性绝对偏差应不大于±0.50mmol/L。
2.6 重复性重复测试两份高低浓度的样本,所得结果的变异系数(CV%)应不大于4%。
2.7 批间差不同批号试剂测试同一份样本,测定结果的批间相对极差应不大于5%。
2.8 准确度相对偏差:相对偏差应不超过±10%。
2.9 校准品溯源性依据GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,校准品溯源至NIST生产的有证参考物质(SRM909)。
2.10 稳定性效期稳定性:试剂盒在2℃~8℃下有效期为12个月,取失效期的试剂盒进行检测,试验结果应满足2.1、2.3、2.4、2.5、2.6、2.8要求。

总胆固醇(CHO)测定试剂盒(CHOD-PAP法)适用范围:该试剂盒用于体外定量测定人血清中总胆固醇的浓度。
1.1 产品规格1.2 组成成分该试剂盒由试剂1(R1)和校准品(选配)组成。
1.2.1试剂组成试剂1: MOPSO 缓冲液≥50.0mmol/L对羟基苯甲酸钠≥5.0mmol/L4-氨基安替比林≥0.3mmol/L胆固醇脂酶(CE)≥0.2KU/L胆固醇氧化酶(CO)≥0.1KU/L过氧化物酶(POD)≥0.5KU/L1.2.2校准品组成胆固醇目标浓度:5.20mmol/L 该校准品为水基质液体校准品2.1 外观a) R1应为无色至淡红色溶液,无混浊,无未溶解物。
b) 校准品应为无色至暗黄色溶液,无混浊,无未溶解物2.2 净含量液体组分不少于标示值。
2.3 试剂空白2.3.1试剂空白吸光度应不大于0.100。
2.4 分析灵敏度CHO试剂盒测定浓度5.00mmol/L的被测物时,吸光度差值(ΔA)应不小于0.150。
2.5 准确度测试参考物质,相对偏差应不超过±10%。
2.6 精密度2.6.1重复性变异系数应不大于4%。
2.6.2批间差批间相对极差(R)应不大于6%。
2.7 线性在(0,19.30]mmol/L范围内,CHO试剂盒的线性相关系数r应不低于0.9900;在(0,5.00]范围内绝对偏差应不超过0.50mmol/L,在(5.00,19.30]范围内相对偏差应不超过±10%。
2.8 校准品溯源性依据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品控制物质赋值的计量学溯源性》及有关规定提供总胆固醇校准品的来源、赋值过程以及测量不确定度等内容。
校准品溯源至国家标准物质GBW09178。
2.9稳定性原包装的CHO试剂盒在2℃~8℃避光保存,有效期为18个月。
试剂在规定的条件下保存到有效期末,产品的性能应符合2.3、2.4、2.5、2.6.1和2.7的要求。

总胆固醇(CHOL)测定试剂盒
2、性能指标
2.1外观和性状
外观和性状应符合表2要求。
表2 试剂盒内各组分的外观性状
2.2试剂空白吸光度
试剂以蒸馏水为空白时,在波长500~550 nm,光径1.0 cm,温度37℃条件下,吸光度≤0.080。
2.3分析灵敏度
试剂盒测试0.5 mmol/L被测物时,吸光度变化值≥0.002。
2.4线性范围
2.4.1试剂盒在0.5~19.6mmol/L区间(范围)内,其回归系数r≥0.990。
2.4.2相对偏差或绝对偏差应符合表3 要求。
表3 相对偏差或绝对偏差
2.5精密度
2.5.1试剂盒批内精密度CV 值应≤4.0%。
2.5.2试剂盒批间相对极差(R)应≤6.0%。
2.6准确度
使用具有溯源性的标准品进行测定,实测值与标示值的相对偏差应在±10.0% 内。
2.7液体装量
试剂盒不同规格的净含量应不少于其标示量。

(本试剂盒仅供体外研究使用,不用于临床诊断!)Elabscience®总胆固醇(TC)比色法测试盒(单试剂COD-PAP法)Total Cholesterol (TC) Colorimetric Assay Kit (Single Reagent, COD-PAP Method)产品货号:E-BC-K109-M产品规格:48T(44 samples)/96T(92 samples)检测仪器:酶标仪(495-525 nm)使用前请仔细阅读说明书。
如果有任何问题,请通过以下方式联系我们:销售部电话************,************技术部电话131****6790具体保质期请见试剂盒外包装标签。
请在保质期内使用试剂盒。
联系时请提供产品批号(见试剂盒标签),以便我们更高效地为您服务。
用途本试剂盒适用于检测血清(浆)、组织的总胆固醇含量。
检测原理总胆固醇(Total Cholesterol,TC)包括游离胆固醇和胆固醇酯。
胆固醇酯可被胆固醇酯酶(cholesterol esterase,CE)水解成胆固醇和游离脂肪酸,胆固醇在胆固醇氧化酶(cholesterol oxidase,CO)的氧化作用下生成△4-胆甾烯酮和过氧化氢。
过氧化氢在4-氨基安替吡啉和酚存在时,经过氧化物酶(peroxidase,POD)催化,反应生成苯醌亚胺非那腙的红色醌类化合物,其颜色深浅与TC含量成正比。
其检测原理如下图:提供试剂和物品说明:试剂严格按上表中的保存条件保存,不同测试盒中的试剂不能混用。
对于体积较少的试剂,使用前请先离心,以免量取不到足够量的试剂。
所需自备物品仪器:酶标仪(495-525 nm)、微量移液器(1000 μL,200 μL,100 μL,10 μL)、恒温箱、离心机。
耗材:枪头(1000 μL、200 μL、2.5 μL)、EP管(2 mL)。
试剂:双蒸水、生理盐水(0.9% NaCl)或PBS(0.01 M,pH 7.4)、无水乙醇。

胆固醇测定试剂盒(CHOD-PAP法)适用范围:本产品用于体外定量测定人血清中总胆固醇的浓度。
1.1包装规格干粉型试剂1(R1):10mL×10,试剂2(R2):100mL×1,校准品:1mL×1;试剂1(R1):50mL×4,试剂2(R2):100mL×2,校准品:1mL×1。
1.2主要组成成分试剂1(R1)干粉:胆固醇酯酶(CEH)≥1140U/L胆固醇氧化酶(CHOD)≥800U/L过氧化物酶(POD)≥6000U/L试剂2(R2)液体:酚 3.5mmol/L4-氨基安替吡啉 0.5mmol/L校准品液体:牛血清基质(1个浓度)胆固醇校准品定值范围150mg/dL~230mg/dL(每批定值,详见值单)2.1 外观试剂盒中各组件的外观应满足:2.1.1试剂1(R1)应为白色干粉,外包装完整无破损。
2.1.2试剂2(R2)应为无色透明溶液,无杂质、无絮状物,外包装完整无破损。
2.1.3校准品应为浅黄色溶液,无杂质、无絮状物,外包装完整无破损。
2.2 净含量液体试剂净含量应不少于标示值。
2.3 试剂空白吸光度在波长505nm(480nm~550nm)(光径1cm)处,试剂空白吸光度(A)应≤0.080。
2.4准确度测定GBW09138a,其测定结果的相对偏差应不超过±10%。
2.5分析灵敏度对应于浓度为5.17mmol/L的CHO所产生的吸光度差值(△A)应在0.380~0.680范围内。
2.6批内瓶间差)应≤3%。
批内瓶间差的变异系数(CV瓶间2.7批间差测试同一样本,批间差(R)应≤5%。
2.8线性范围在[1.29,12.93]mmol/L范围内,线性相关系数(r)应≥0.990,线性相对偏差应不超过±10%。
2.9试剂稳定性2.9.1效期稳定性原包装的试剂在2℃~8℃避光贮存,有效期为36个月。
试剂盒有效期满后3个月以内,试剂性能应符合2.1、2.3、2.4、2.5、2.6、2.8的要求。

总胆固醇测定试剂盒(CHOD-PAP法)适用范围:本品用于体外定量测定人血清中总胆固醇的含量。
1.1规格规格1: (试剂1:20mL;试剂2: 5mL);规格2: (试剂1:40mL;试剂2:10mL);规格3: (试剂1:80mL;试剂2:20mL);校准品:(选配)规格1(0.3mL×1;1水平);规格2(0.5mL×1;1水平);规格3(1.0mL×1;1水平);质控品:(选配)规格1(0.5mL×2;2水平);规格2(1.0mL×2;2水平)。
1.2组成试剂盒组成见表1表1胆固醇测定试剂盒组成注:校准品及质控品赋值具有批特异性,每批次浓度详见标签。
2.1试剂2.1.1外观试剂盒外观应整洁,文字符号标识清晰;组分齐全,液体无漏液;试剂1为无色透明液体,不得有沉淀和絮状物;试剂2为淡黄色透明液体,不得有沉淀和絮状物.2.1.2装量每瓶不少于标示值。
2.1.3试剂空白吸光度用指定的空白样品测试试剂(盒),在光径1cm下,在A500nm处测定试剂空白吸光度A≤0.08。
2.1.4分析灵敏度测定6.5 mmol/L范围内的样本,吸光度变化≥0.03A。
2.1.5线性范围2.1.5.1在[1.2,20.0] mmol/L内,相关系数R≥0.990。
2.1.5.2在[1.2,4.0] mmol/L内,线性绝对偏差不超过±0.4mmol/L;(4.0,20.0] mmol/L内,线性相对偏差不超过±10%。
2.1.6重复性重复测试(4.0±0.8) mmol/L和(16.0±3.2)mmol/L样本,所得结果的变异系数(CV%)应不大于4%。
2.1.7批间差测定(4.0±0.8) mmol/L和(16.0±3.2)mmol/L样本,所得结果的批间相对极差(R)应不大于6%。
2.1.8准确度用国家标准物质GBW09178a检测,实测值与标示值的相对偏差在±10%内。

总胆固醇(TCHO)测定试剂盒(CHOD-POD法)适用范围:本产品用于体外定量测定人血清中总胆固醇的含量。
1.1规格:试剂(R)5×80mL ;7×60mL ;5×40mL ;2×100mL;3×400mL;1×20mL;624T:208.8mL。
校准品(选配):1×3mL。
1.2组成1.2.1试剂组成表1 试剂组成1.2.2校准品的组成:单个水平的液体校准品,在水基质缓冲液中添加胆固醇,稳定剂<0.1%;定值范围:(4.0-6.0)mmol/L。
2.1 外观液体单试剂:浅粉色澄清液体。
校准品:无色至淡黄色液体。
2.2 净含量液体试剂的净含量不得低于标示体积。
2.3 空白吸光度在37℃、(546nm±10%范围内的)波长、1cm光径条件下,用去离子水或(生理盐水)作为样品加入试剂测试时,试剂空白吸光度<0.08 ABS。
2.4 分析灵敏度浓度为5.17mmol/L时,吸光度变化范围为(0.15-0.27)。
2.5 线性范围在[0.1-19.3]mmol/L线性范围内,线性相关系数r2≥0.996。
在(5.0-19.3]mmol/L范围内的相对偏差≤10%;测定结果[0.1-5]mmol/L 时绝对偏差≤0.50mmol/L。
2.6 精密度试剂盒测试项目精密度CV< 4 %。
2.7 批间差不同批号之间测定结果的相对极差应< 5 %。
2.8 准确度相对偏差:用参考物质作为样本进行检测,测量结果与参考物质靶值的相对偏差应不超过±10%。
2.9 稳定性原包装试剂(含校准品),在(2-8)℃下有效期为18个月,取失效期的试剂盒检测其外观、空白吸光度、分析灵敏度、线性范围、精密度、准确度应分别符合2.1、2.3、2.4、2.5、2.6、2.8的要求。
2.10校准品的溯源性参见附录A。

总胆固醇测定试剂盒(CHOD-PAP法)适用范围:本试剂盒用于体外定量测定人血清中胆固醇的含量。
1.1包装规格:试剂1:10ml×10(干粉复溶后的体积);试剂2:100ml×1。
1.2组成成份:试剂1:胆固醇酯酶(CE)≥400U/L,胆固醇氧化酶(CO)≥500U/L,过氧化物酶(POD)≥200U/L,4-氨基安替吡啉(4-AAP) 1mmol/L;试剂2:磷酸盐缓冲液0.1mol/L。
2.1 外观:试剂 1为干燥粉末,试剂 2为澄清溶液,外包装完整。
2.2 净含量:不少于标示值。
2.3 试剂空白吸光度:A≤0.08(波长500nm~550nm,光径10mm)。
2.4 分析灵敏度:浓度为5.17mmol/L时,吸光度变化△A≥0.20。
2.5 线性区间2.5.1线性相关系数:[2.585,15.5]mmol/L范围内,线性相关系数r≥ 0.9900。
2.5.2线性偏差:[2.585,5.17] mmol/L时,绝对偏差不超过±0.517mmol/L;(5.17, 15.5] mmol/L时,相对偏差不超过±10%。
2.6 精密度2.6.1 重复性:重复测定高、低两个水平浓度的质控血清,变异系数(CV)≤4.0%。
2.6.2批内瓶间差:用高、低两个水平浓度的质控血清重复测试同一批号及同一瓶试剂,CV≤5.0%。
2.6.3批间差:用同一质控血清测试3个不同批号的试剂,相对极差≤6.0%。
2.7 准确度:测定国家标准物质,相对偏差应不超过±10%。
2.8 稳定性2.8.1效期稳定性:试剂盒在2℃~8℃贮存,有效期为24个月。
保存至有效期末进行测定,试验结果满足2.1、2.3、2.4、2.5、2.6.1、2.6.2、2.7的要求。
2.8.2复溶稳定性:工作液18℃~25℃可稳定8小时,2℃~8℃可稳定7天。
试验结果满足2.5、2.7的要求。
胆固醇测定试剂盒(CHOD-PAP法)适用范围:本产品用于体外定量测定人血清中胆固醇的浓度。
1.1包装规格试剂的包装规格见表1的规定。
表1 包装规格1.2主要组成成分试剂盒由单一液体试剂组成,主要的组成成分见表2。
表2试剂盒组成成分2. 1外观试剂为淡红色溶液,透明、无沉淀及絮状悬浮物,外包装完整无破损。
2. 2 净含量试剂的净含量应不少于标示值。
2. 3 试剂空白吸光度在500nm的波长测试时,1cm光径下测定吸光度值应不大于0.100。
2. 4 分析灵敏度测试0.008mmol/L的总胆固醇引起的吸光度变化值应≥0.0001。
2.5 线性范围本产品的线性范围是[18.75,1000]mg/dl或[0.5,25.8]mmol/L,线性相关系数r 应不小于0.990。
在[18.75,192]mg/dL或[0.5,5]mmol/L范围内的绝对偏差应不超过±19.2mg/dL 或0.5mmol/L,在(192,1000]mg/dL或(5,25.8]mmol/L 范围内的相对偏差应不超过±10%。
2.6 精密度2.6.1批内精密度批内精密度应不大于4.0%。
2.6.2批间差批间差应不大于6.0%。
2.7准确度测试标准物质(编号及来源:GBW09178a、GBW09179卫生部临床检验中心),所得准确度偏差应不超过±10%。
2.8 稳定性:试剂盒贮存在2℃~8℃条件下,有效期为24个月。
产品在有效期末测试2.1、2.3、2.4、2.5、2.6.1、2.7,结果符合各项要求。
胆固醇测定试剂盒(CHOD-PAP法)适用范围:用于体外定量测定人血清中胆固醇的浓度。
1.1包装规格a) 试剂1:8×60ml,试剂2:2×60ml;b)试剂1:4×60ml,试剂2:4×15ml;c) 试剂1:2×80ml,试剂2:2×20ml;d) 试剂1:2×40ml,试剂2:2×10ml;e) 试剂1:2×400ml,试剂2:2×100ml;f) 试剂1:1×40ml,试剂2:1×10ml;g) 试剂1:12×16ml,试剂2:12×4ml。
1.2.试剂主要组成成分试剂1主要组成成分PIPES缓冲液 50mmol/LHBA 16mmol/L过氧化物酶(POD) 0.5KU/L4-氨基安替比林(4-AAP) 0.5mmol/L试剂2主要组成成分磷酸缓冲液 50mmol/L CHE 5.0KU/ COD 1.8KU/L 2.1外观和性状2.1.1试剂盒各组分应齐全、完整、液体无渗漏;外包装完好、无破损,标签完好、字迹清晰。
2.1.2试剂1:无色或淡黄色透明溶液;试剂2:无色或淡黄色透明溶液。
2.2净含量应不低于试剂瓶标示装量。
2.3试剂空白吸光度测定试剂空白吸光度,应<0.08;2.4分析灵敏度测试15 mmol/L 的被测物时,吸光度变化(ΔA)应不低于0.2。
2.5准确度测定值与靶值相对偏差不超过±10%。
2.6精密度2.6.1批内精密度变异系数(CV)应不超过4%。
2.6.2批间差批间差应不大于6%。
2.7线性区间2.7.1在(1,17.5)mmol/L区间内,线性回归的相关系数(r)应不低于0.990;2.7.2在(4,17.5)mmol/L区间内,相对偏差不超过±15%;2.7.3在(1,4]mmol/L区间内,绝对偏差不超过±0.5mmol/L。
胆固醇测定试剂盒(CHOD-PAP法)
适用范围:用于体外定量测定人血清中胆固醇的含量。
1.1 规格
2×60mL;4×45mL;6×60mL;2×40mL;1×5L;1×20L。
1.2主要组成成分
试剂主要组分:
2.1 净含量
应不低于试剂瓶标示装量。
2.2 外观
试剂:为浅粉色或淡红色液体。
外包装完好、无破损,标签完好、字迹清晰。
2.3 试剂空白
在505nm(500nm~550nm)波长下,试剂空白吸光度应不大于0.100。
2.4 分析灵敏度
测试5.0mmol/L的被测物时,吸光度变化(ΔA)应不低于0.0060。
2.5 准确度
用参考物质(GBW09179)对试剂(盒)进行测试,实测值与标示值的相对偏差应在±10%内。
2.6 重复性
变异系数(CV)应不大于4%。
2.7 线性
2.7.1在[0.5,15]mmol/L区间内,线性相关系数r应不低于0.9900;
2.7.2 [0.5,1.5)mmol/L区间内绝对偏差应不超过±0.15mmol/L;[1.5,
15]mmol/L区间内相对偏差应不超过±10%。
2.8 批间差
相对极差应不大于6.0%。
2.9 稳定性
取在2℃~8℃条件下贮存达到12个月后的试剂进行检测,检测结果应符合2.2、2.3、2.4、2.5、2.6、2.7的要求。
总胆固醇测定试剂盒(CHOD-PAP法)
适用范围:用于体外定量测定人血清中总胆固醇的含量。
1.1包装规格
a) 单一试剂:4×40mL;
b) 单一试剂:5×60mL;
c) 单一试剂:2×100mL。
1.2主要组成成分
2.1 外观
单一试剂:无色至浅粉红色澄清液体。
2.2 试剂装量
应不低于试剂瓶标示装量。
2.3 试剂空白吸光度
在520nm波长处测定试剂空白吸光度,应≤0.1。
2.4 分析灵敏度
测定TC含量为1mmol/L样本时,其△A应为0.0413~0.0504。
2.5线性范围
2.5.1 在[1,13] mmol/L范围内,线性回归的相关系数应不低于0.990;
2.5.2 测试浓度在[1,2] mmol/L范围内线性绝对偏差不超过±0.5mmol/L;
测试浓度在(2,13] mmol/L范围内线性相对偏差应不超过±10%。
2.6 测量精密度
2.6.1 重复性:用两个水平质控血清重复测试其变异系数(CV)应不超过4%。
2.6.2 批间差:抽取3个不同批号的试剂,对同一份样本进行重复测定,相对极差≤6%。
2.7 准确度
以国家标准物质为检测样本时,测定结果相对偏差不超过±10%。
2.8 稳定性
取在2℃~8℃条件下贮存达到18个月的试剂进行检测,应符合2.1、2.3、2.4、2.5、2.6.1、2.7的要求。
总胆固醇(TC )含量检测试剂盒说明书微量法货号:BC1985规格:100T/96S产品组成:使用前请认真核对试剂体积与瓶内体积是否一致,有疑问请及时联系索莱宝工作人员。
试剂名称规格保存条件提取液液体100 mL×1瓶(自备)4℃保存试剂一液体30 mL×1瓶4℃保存试剂二液体200 μL×1支4℃保存试剂三液体30 μL×1支4℃保存标准品粉剂×1支4℃保存溶液的配制:1、提取液:自备异丙醇,4℃保存。
2、标准品:10 mg 胆固醇,临用前加入517 μL 提取液,振荡溶解,即为50 μmol/mL 的胆固醇标准溶液。
3、试剂三:液体置于试剂瓶内EP 管中。
4、工作液的配制:将试剂一:试剂二:试剂三按3 mL :20 μL :3 μL 的比例配制工作液,现用现配。
产品说明:总胆固醇(Total Cholesterol ,TC )是指所有脂蛋白所含胆固醇的总和,包括游离胆固醇和胆固醇酯。
利用酯酶催化胆固醇酯水解生成游离胆固醇(FC )和游离脂肪酸(FFA ),从而把胆固醇酯转化为FC ;进一步利用胆固醇氧化酶催化FC 氧化,生成4-胆甾烯酮和H 2O 2;最后利用过氧化物酶催化H 2O 2氧化4-氨基安替比林和酚,生成红色醌类化合物,其在500nm 有特征吸收峰,其颜色深浅与TC 含量成正比。
技术指标:最低检出限:0.143 μmol/mL 线性范围:0.156-5 μmol/mL注意:实验之前建议选择2-3个预期差异大的样本做预实验。
如果样本吸光值不在测量范围内建议稀释或者增加样本量进行检测。
需自备的仪器和用品:可见分光光度计/酶标仪、天平、低温台式离心机、微量玻璃比色皿/96孔板、可调式移液枪、EP 管、蒸馏水、异丙醇。
操作步骤:一、样本处理(可适当调整待测样本量,具体比例可以参考文献)1.组织:按照组织质量(g ):提取液体积(mL )为1:5~10的比例(建议称取约0.1g 组织,加入1mL 提取液)进行冰浴匀浆。
医疗器械产品技术要求编号:
总胆固醇(TC)测定试剂(盒)(CHOD-PAP 法)
2.性能指标
2.1外观
试剂应为清澈透明的液体,无沉淀、悬浮物和絮状物。
2.2装量
试剂装量的装量应按表1,液体装量的最大允许负偏差应为5%。
2.3试剂空白吸光度
试剂(盒)测试空白样本,在37 ℃±0.1℃ ,505 nm 波长、1 cm 光径条件下,试剂空白吸光度应≤0.050 Abs。
2.4分析灵敏度
试剂(盒)测试4.07 mmol/L 的被测物时,吸光度变化(ΔA)应≥0.320 Abs。
2.5线性区间
试剂(盒)线性在(0.00,22.00] mmol/L 区间内,应符合如下要求:
a)线性相关系数r≥0.990;
b) (0.00,2.00] mmol/L 区间内,线性绝对偏差在±0.20 mmol/L 范围内;(2.00,22.00] mmol/L
区间内,线性相对偏差在±10%范围内。
2.6精密度
2.6.1重复性
试剂(盒)测试浓度在(4.08±0.54)mmol/L 和(7.53±0.98)mmol/L 范围内的样本时,变异系数CV≤3.0%。
2.6.2批间差
试剂(盒)测试浓度在(4.08±0.54)mmol/L 和(7.53±0.98)mmol/L 范围内的样本时,
相对极差R≤5.0%。
2.7准确度
测可溯源至有证参考物质的校准品,相对偏差 B 在±10%范围内。