二氧化碳(CO2)测定试剂盒(酶法)产品技术要求mairui
- 格式:docx
- 大小:15.44 KB
- 文档页数:2

二氧化碳测定试剂盒(PEPC酶法)适用范围:该产品用于体外定量测定人血清中的二氧化碳(CO2)的含量。
1.1包装规格序号规格1 试剂1:2×20ml ;校准品:1×3ml。
2 试剂1:2×40ml ;校准品:1×3ml。
3 试剂1:2×60ml ;校准品:1×3ml。
4 试剂1:2×80ml ;校准品:1×3ml。
5 试剂1:2×100ml ;校准品:1×3ml。
6 试剂1:1×1000ml ;校准品:1×3ml。
7 试剂1:5×24ml ;校准品:1×3ml。
8 试剂1:5L。
1.2主要组成成分本试剂由试剂1(R1)和校准品(STD)组成试剂1(R1):磷酸盐缓冲液25mmol/LPEP 6.3mmol/LNADH 0.45mmol/LPEPC 200U/LMG 8.0mmol/LMDH ﹥600U/L校准品:CO溶液(基质:水溶液;浓度:25mmol/L)22.1 外观试剂盒外观应整洁,文字符号标识清晰;R1为无色至淡黄色澄清液体,校准品为无色透明液体。
液体试剂不得有沉淀和絮状物。
2.2 装量试剂瓶内液体装量应不少于标示值。
2.3 空白吸光度以生理盐水为样品,在37℃、405nm波长、1cm光径条件下,吸光度≥0.7。
2.4 分析灵敏度浓度为25mmol/L的样本,吸光度差值△A>0.2。
2.5 准确性用参考物质(GBW(E)060023c)对试剂盒进行测试,相对偏差不超过±10%。
2.6 重复性用浓度(25±3)mmol/L的样本进行检测,重复检测10次,其批内变异系数(CV)应不超过5%。
2.7 线性2.7.1在(2,50)mmol/L范围内,线性相关系数r应不低于0.990;2.7.2 在(2,10]mmol/L范围内绝对偏差不超过±1.0mmol/L;(10,50) mmol/L 范围内相对偏差不超过±10%。
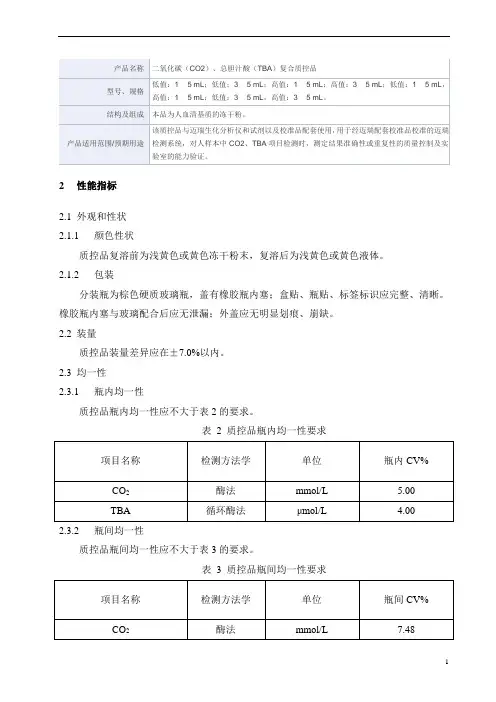
2性能指标
2.1外观和性状
2.1.1颜色性状
质控品复溶前为浅黄色或黄色冻干粉末,复溶后为浅黄色或黄色液体。
2.1.2包装
分装瓶为棕色硬质玻璃瓶,盖有橡胶瓶内塞;盒贴、瓶贴、标签标识应完整、清晰。
橡胶瓶内塞与玻璃配合后应无泄漏;外盖应无明显划痕、崩缺。
2.2装量
质控品装量差异应在±7.0%以内。
2.3均一性
2.3.1瓶内均一性
质控品瓶内均一性应不大于表2的要求。
表 2 质控品瓶内均一性要求
2.3.2瓶间均一性
质控品瓶间均一性应不大于表3的要求。
表 3 质控品瓶间均一性要求
1
2.4参考值及参考范围
每批质控品均应提供本批产品的参考值表。
经迈瑞校准品校准的适用仪器及配套试剂对质控品进行测定,测定结果应在给定的参考范围内。
2.5生物安全性
质控品使用国家权威管理机构认可的、且不低于我国法定用于血源筛查体外诊断试剂灵敏度的检测试剂,乙型肝炎病毒表面抗原(HBsAg)、人类免疫缺陷病毒(HIV)抗体、丙型肝炎病毒(HCV)抗体、梅毒螺旋体(TP)抗体检测应为阴性。
2。

二氧化碳测定试剂盒(PEPC酶法) 适用范围:用于体外定量测定人血清中二氧化碳的浓度。
1.1规格a) 试剂1:2×45ml,试剂2:2×15ml;b) 试剂1:4×45ml,试剂2:4×15ml;c) 试剂1:2×60ml,试剂2:2×20ml;d) 试剂1:2×300ml,试剂2:2×100ml;e) 试剂1:12×16.8ml,试剂2:12×5.6ml;f) 试剂1:1×30ml,试剂2:1×10ml;g) 试剂1:2×54ml,试剂2:2×18ml。
1.2 组成试剂主要组分见表1:表1 试剂主要组分2.1 外观试剂1应为无色透明溶液;试剂2应为淡黄色透明溶液。
2.2 净含量应不低于试剂瓶标示装量。
2.3 试剂空白2.3.1试剂空白吸光度测定试剂空白吸光度,应≥0.5。
2.3.2试剂空白吸光度变化率试剂空白吸光度变化率△A/min应≤0.02。
2.4 分析灵敏度测定浓度为40mmol/L的样品,吸光度变化率△A/min应不低于0.015。
2.5 线性2.5.1在[1,50]mmol/L范围内,线性回归的相关系数应不低于0.990;2.5.2测试浓度[20,50]mmol/L的样品,相对偏差应不超过±10%;测试浓度[1,20)mmol/L的样品,绝对偏差应不超过±2mmol/L。
2.6 重复性2.6.1 批内重复性变异系数(CV)应不超过5%。
2.6.2 批间差对同一份样品进行重复测定,相对极差(R)应不超过10%。
2.7 准确度用国家标准物质[GBW(E)060023、GBW(E)060315、GBW(E)060141任选一种]对试剂盒进行测试,测定值与标准物质标示值的相对偏差应不超过±10%。
2.8 稳定性取在2℃~8℃条件下贮存达到18个月但未超过24个月的试剂检测,应符合本技术要求2.1、2.3、2.4、2.5、2.6.1、2.7之规定。

二氧化碳测定试剂盒(PEPC酶法)适用范围:本试剂盒用于体外定量测定人体血清中二氧化碳的含量。
1.1产品规格1.2产品组成PEP 12.5mmol/L,NADH 0.6mmol/L,MDH>4100U/L,PEPC>400U/L。
2.1 外观试剂无色或略带黄色透明溶液;试剂盒各组分齐全、完整,液体无渗漏,包装标签文字符号清晰牢固不易脱落,外包装完整无破损。
2.2 装量液体试剂的净含量应不少于标示量。
2.3 试剂空白2.3.1试剂空白吸光度在405nm波长、1cm光径条件下,试剂空白吸光度应不小于0.70。
2.3.2 试剂空白吸光度变化率在405nm波长、1cm光径条件下,用生理盐水作为样品加入试剂测试时,试剂空白波光度变化率(ΔA/min)应不大于 0.005/min。
2.4分析灵敏度测定30mmol/L二氧化碳时,吸光度变化率在(0.03±0.01)/min范围内。
2.5 准确度采用比对试验,相关系数r≥0.98;[1,10]mmol/L区间内,线性绝对偏差不超过±1.5mmol/L;(10,40]mmol/L区间内,线性相对偏差不超过±15%。
2.6 精密度2.6.1 重复性用血清样品或质控样品重复测试所得的变异系数(CV)应不大于10.0%。
2.6.2 批间差试剂(盒)批间相对极差应不大于10.0%。
2.7 线性区间试剂线性在[1,40]mmol/L区间内:a) 线性相关系数|r|应不小于0.990;b) [1,10]mmol/L区间内,线性绝对偏差应不超过±1.5mmol/L;(10,40]mmol/L区间内,线性相对偏差应不超过±15%。
2.8稳定性原包装试剂2~8℃避光保存有效期12个月,到效期后的样品检测试剂空白、分析灵敏度、准确度、重复性、线性区间应符合2.3、2.4、2.5、2.6.1、2.7的要求。

二氧化碳测定试剂盒(PEPC酶法)产品技术要求zhongshengbeikong 二氧化碳测定试剂盒(PEPC酶法)适用范围:本产品用于体外定量测定人血清中二氧化碳的浓度。
1.1包装规格液体单剂型试剂(R):20mL×4,校准品:3mL×1;试剂(R):20mL×6,校准品:3mL×1。
1.2主要组成成分试剂(R)液体:磷酸烯醇式丙酮酸(PEP) 12.5mmol/L磷酸烯醇式丙酮酸羧化酶(PEPC) 400U/L) 8.0mmol/L氯化镁(MgCl2苹果酸脱氢酶(MDH) 4100U/L还原辅因子 0.6mmol/L校准品液体:水溶液基质(1个浓度)碳酸氢钠目标浓度25.0 mmol/L(每批定值,详见值单) 2.1 外观试剂盒中各组件的外观应满足:2.1.1试剂(R)应为浅黄绿色透明溶液,无杂质、无絮状物,外包装完整无破损。
2.1.2校准品应为无色透明溶液,无杂质、无絮状物,外包装完整无破损。
2.2 净含量液体试剂净含量应不少于标示值。
2.3 试剂空白吸光度在波长400nm~420nm(光径1cm)处,试剂空白吸光度(A)应≥0.600;试剂空白吸光度变化率(△A/min)应≤0.015。
2.4准确度测定GBW06101,测定结果的相对偏差应不超过±10%。
2.5分析灵敏度对应于浓度为 25mmol/L的二氧化碳所引起的吸光度变化率(△A/min)的绝对值应在0.010~0.080的范围内。
2.6重复性重复测试高、中、低浓度样本,变异系数(CV)应≤10%。
2.7批间差测试同一样本,批间差(R)应≤10%。
2.8线性范围在[3,60]mmol/L范围内,线性相关系数(r)应≥0.990;在(25,60]mmol/L范围内,线性相对偏差应不超过±10%;在[3 ,25]mmol/L范围内,线性绝对偏差应不超过±2.5mmol/L2.9试剂稳定性2.9.1效期稳定性原包装的试剂盒在2℃~8℃避光贮存,有效期为12个月。

二氧化碳(CO2)测定试剂盒(PEPC酶法)说明书【产品名称】二氧化碳(CO2)测定试剂盒(PEPC酶法)【包装规格】a)单一试剂:1×15mLb)单一试剂:2×40mLc)单一试剂:5×60mLd)单一试剂:2×100mL【预期用途】用于体外定量测定人血清中二氧化碳的含量。
血液中CO2含量对人体内酸碱平衡的调节起着重要的作用。
增高:代谢性碱中毒,如幽门梗阻、柯兴综合征等。
呼吸性酸中毒,如呼吸中枢抑制、呼吸机麻痹等。
降低:代谢性酸中毒,如严重腹泻、肾功能衰竭等。
慢性呼吸碱中毒[1]。
临床上测定二氧化碳代谢性与呼吸性酸、碱中毒的辅助诊断,通常与pH值同时进行。
【检验原理】样本中的碳酸氢根在磷酸烯醇式丙酮酸羧化酶(PEPC)催化下,与磷酸烯醇式丙酮酸(PEP)反应,生成草酰乙酸和磷酸;草酰乙酸在苹果酸脱氢酶(MDH)催化下,生成苹果酸,同时NADH被氧化成NAD+,NADH被氧化的程度与碳酸氢根的含量成正相关。
【主要组成成分】试剂主要组分三羟甲基氨基甲烷缓冲液250mmol/L磷酸烯醇式丙酮酸(PEP)10g/L磷酸烯醇式丙酮酸羧化酶(PEPC)10KU/L苹果酸脱氢酶(MDH)8KU/L还原型辅酶I(NADH) 2.2g/L表面活性剂及稳定剂适量注:不同批号试剂盒中各组分未经试验不可互换。
【储存条件及有效期】1.试剂原包装在2~8℃储存,有效期为12个月,生产日期、有效期见标签。
2.开口后的试剂在仪器仓中(2~8℃)可稳定30天。
【适用仪器】艾威德AS-420/AS-660/AS-1200;日立HITACHI7020型/7060型/7180型/7600型/LABOSPECT008AS型;贝克曼AU400/AU480/AU640/AU680/ AU2700/AU5400/AU5800/AU5811/AU5821;佳能TBA-FX8/TBA-120FR/ TBA-2000FR;罗氏cobas8000c702/cobas8000c701/cobas8000c502;西门子SIEMENS ADVIA1800/ADVIA2400;雅培ABBOTT ARCHITECT c8000/ARCHITECT c16000/ARCHITECT ci8200;西森美康SYSMEX BM6010/C;科华KHB卓越310/卓越330/卓越400/卓越450/ZY-1200/ ZY-1280;迪瑞CS-240/CS-T300/CS-300B/CS-380/CS-400A/CS-400B/ CS-600A/CS-600B/CS-800A/CS-800B/CS-1200/CS-1200ISE/CS-1300B/CS-14 00;迈瑞MINDRAY BS-220/BS-330/BS-350E/BS-380/BS-390/BS-400/BS-430/ BS-600/BS-800/BS-2000M;颐兰贝ES-200/ES-380/ES-480;赛诺迈德SUNMATIK-9050型;雷杜Chemray420;英诺华D280;特康TC6010L;锦瑞GS400;普康6066。
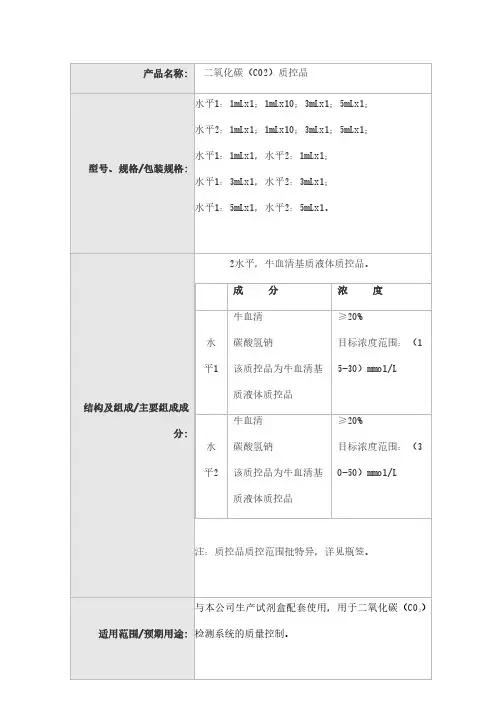
水平1:1mLx1;1mLx10;3mLx1;5mLx1;水平2:1mLx1;1mLx10;3mLx1;5mLx1;水平1:1mLx1,水平2:1mLx1;
水平1:3mLx1,水平2:3mLx1;
水平1:5mLx1,水平2:5mLx1。
1.2主要组成成分
2水平,牛血清基质液体质控品。
注:质控品质控范围批特异,详见瓶签。
2.1性状
质控品为无色至淡黄色液体。
2.2装量
液体质控品的装量不少于标示值。
2.3可接受区间
质控品测定值应在靶值范围内。
2.4瓶间均匀性
赋值结果的瓶间均匀性变异系数(CV)≤5%。
2.5稳定性
2.5.1效期稳定性
质控品原包装在2℃~8℃避光保存,有效期为18个月,在稳定期内赋值结果的变化趋势不显著。
2.5.2开瓶稳定性
质控品开瓶后,在2℃~8℃下避光密封保存,可稳定14天,在稳定期内赋值结果的变化趋势不显著。

二氧化碳测定试剂盒(PEPC法)适用范围:本品用于体外定量测定人血清中二氧化碳的含量。
1.1规格规格1: (试剂1:30mL);规格2: (试剂1:60mL);规格3: (试剂1:90mL);规格4:(试剂1:120mL);校准品:(选配)规格1(0.3mL×1;1水平);规格2(0.5mL×1;1水平);规格3(1.0mL×1;1水平);质控品:(选配)规格1(0.5mL×2;2水平);规格2(1.0mL×2;2水平)。
1.2组成试剂盒组成见表1表1 二氧化碳测定试剂盒组成注:校准品及质控品赋值具有批特异性,每批次浓度详见标签。
2.1试剂2.1.1外观试剂盒外观应整洁,文字符号标识清晰;组分齐全,液体无漏液;试剂1为浅黄色透明液体,不得有沉淀和絮状物。
2.1.2装量每瓶不少于标示值。
2.1.3试剂空白吸光度用指定的空白样品测试试剂(盒),在光径1cm下,在A405nm处测定试剂空白吸光度A≥0.8。
2.1.4分析灵敏度测定在29 mmol/L范围内的样品,吸光度变化绝对值大于0.05A。
2.1.5线性范围2.1.5.1在[0.5,50] mmol/L内,相关系数R≥0.990。
2.1.5.2在[0.5,15] mmol/L内,线性绝对偏差不超过±1.5mmol/L;(15,50] mmol/L内,线性相对偏差不超过±10%。
2.1.6 重复性重复测试(18±3.6)mmol/L和(34±6.8)mmol/L样本,所得结果的变异系数(CV%)应不大于5%。
2.1.7批间差测定(18±3.6)mmol/L和(34±6.8)mmol/L样本,所得结果的批间相对极差(R)应不大于10%。
2.1.8准确度)中加入一定体积高于50 mmol/L的碳酸氢钠纯在正常浓度范围的临床样本(C品(Cs)或由纯品配制的标准溶液,回收率应在90%-110%范围内。

酶法二氧化碳测定试剂的临床应用评价【摘要】目的评价浙江伊利康生物技术有限公司生产的二氧化碳(CO2)测定试剂盒。
方法通过试剂的精密度、线性范围、回收率、干扰试验等进行系统评估。
结果低、高值质控日内精密度(用CV日内值表示)分别为2.94和1.52%,日间精密度(用CV日间值表示)分别为4.66%和4.15%。
与电极法相比,相关方程为Y = 0.9722X + 4.1861,相关系数r2 = 0.9897,测定结果显著相关(P<0.05)。
当甘油三酯(TG)浓度≤10mmol/L,血红蛋白(Hb)浓度≤5g/L,维生素C(Vc)浓度≤2540μmol/L,胆红素(BIL)浓度≤342μmol/L时对本法无显著性干扰。
结论该试剂完全符合临床应用要求,能适用于全自动化分析。
【关键词】二氧化碳;临床应用评价血清(浆)中的二氧化碳含量对人体内的酸碱平衡的调节起重要作用。
测定血清二氧化碳的方法有很多,目前临床实验室普遍采用的是电极法和酶法。
本文应用美国国家实验室标准委员会(NCCLS)的部分EP系列文件[1]对酶法试剂的精密度、准确度、线性范围、抗干扰性进行评价,并与电极法进行对比实验,评价结果报告如下。
1 材料与方法1.1样本我院住院及门诊病人当天空腹抗凝血浆标本,立即分离血浆后在1h内上机测定。
1.2试剂和仪器CO2测定试剂盒由浙江伊利康生物技术有限公司生产,批号:110201;仪器为HITACHI 7080全自动生化分析仪。
1.3方法均按试剂盒生产厂商提供测定参数、测定方法进行。
2 实验结果2.1精密度[2] 取低、高两个不同浓度的质控,连续测20次,再每天测1次,共测20天,CV日内分别为2.94和1.52%,CV日间分别为4.66和4.15%。
2.2回收试验取一份新鲜混合人血清,CO2的浓度26.5mmol/L,将其分成3份,每管0.9m1,分别加入CO2为8.1mmol/L、24.0mmol/L、38.2mmol/L的高、中、低血清0.1ml,混合后CO2浓度分别为24.66mmol/L、26.25mmol/L、27.67mmol/L共3个浓度的样品;用酶法试剂共测定5次,计算回收率分别为101.3%、99.6%、100.7%,平均为100.5%。

二氧化碳测定试剂盒(PEPC酶法)适用范围:用于体外定量测定人血清或血浆中二氧化碳的含量。
1.1 包装规格见表1表1 包装规格试剂:5×20mL试剂:6×80mL试剂:8×60mL试剂:1×100mL试剂:12×3.8mL试剂:10×10mL试剂:10×50mL试剂:1×20mL500测试/盒(试剂:5×20mL)600测试/盒(试剂:5×20mL)800测试/盒(试剂:5×20mL)校准品(液体,1水平):1×3mL1.2 主要组成成分见表2表2主要组成成分试剂成分浓度试剂:磷酸烯醇丙酮酸盐稳定化NADH变体苹果酸脱氢酶磷酸烯醇丙酮酸羧酶缓冲液,pH 7.5防腐剂12.5mmol/L 0.6mmol/L > 4100 U/L > 400 U/L校准品(液体):NaHCO3 20~30mmol/L2.1 外观试剂为黄色澄清液体,目测不得有任何沉淀及絮状悬浮物;校准品为无色澄清液体,目测不得有任何沉淀及絮状悬浮物;试剂盒标签标识清晰,外包装完整无损。
2.2 净含量试剂的净含量应不少于表1中的标称量。
2.3 测定项目2.3.1 试剂空白吸光度A405nm下测定空白吸光度应≥0.8000。
2.3.2 准确度用国家标准物质GBW(E)060023,对试剂盒进行测试,其测量结果的相对偏差应不超过±15%。
2.3.3 分析灵敏度样本浓度为16mmol/L时,其吸光度变化在0.0200~0.0600之间。
2.3.4 线性区间在[3,50]mmol/L区间内,线性相关系数r≥0.990,测定的线性相对偏差应不超过±10%。
2.3.5 测量精密度a) 重复性对高、低两个浓度的血清样本或质控品重复测定10次,其测定值的变异系数(CV%)应不大于10%。
b) 批间差随机抽取三批试剂盒的批间相对极差(R)应不大于10%。

二氧化碳(CO2)测定试剂盒(PEP-C法)适用范围:本产品用于体外定量测定人血清或血浆中总二氧化碳含量。
1.1包装规格试剂(R):2×80mL;试剂(R): 3×60mL;试剂(R) :2×40mL;试剂(R):2×100 mL;试剂(R):1×20mL;试剂(R):3×61mL;360测试/盒:【试剂(R):2×41mL】;校准品(选配):单水平1×3mL;质控品(选配):单水平1×3mL。
1.2主要组成成分1.2.1 试剂组成见表1:表1 试剂(R)组成1.2.2 校准品组成单水平液体校准品,在50mmol/L,pH=9.0 的Tris缓冲液中添加碳酸氢钠,定值范围:(20~40)mmol/L。
稳定剂<0.1%。
1.2.3 质控品组成:单水平的液体质控品,在50mmol/L,pH=9.0 的Tris缓冲液中添加碳酸氢钠,目标浓度范围在(20~40)mmol/L之间。
稳定剂<0.1%。
注:校准品和质控品浓度具有批特异性,具体浓度见标签。
2.1 外观R试剂:液体单试剂,浅黄色澄清液体。
校准品:无色透明液体。
质控品:无色透明液体。
2.2 净含量液体试剂净含量不得低于标示体积。
2.3 空白吸光度在37℃、405nm波长、1cm光径条件下,试剂空白吸光度应大于0.7ABS。
2.4 分析灵敏度浓度为25mmol/L时,吸光度差值的绝对值范围在(0.03~0.25)ABS之间。
2.5 线性在(0,50]mmol/L线性范围内,线性相关系数r应不小于0.995;在[15,50]mmol/L范围内的相对偏差应不超过±10%;测定浓度小于15 mmol/L时,绝对偏差应不超过±2 mmol/L。
2.6 重复性变异系数CV应小于5%。
2.7 批间差不同批号之间测定结果的相对极差应小于6%。
2.8 准确度用参考物质(GBW06101c)作为样本进行检测,其测量结果的相对偏差应不超过±10%。
二氧化碳测定试剂盒(PEPC酶法)适用范围:适用于体外定量测定人血清中二氧化碳的含量。
1. 产品型号/规格及其划分说明产品组成:试剂:缓冲液 pH=7.5(25℃) PEP 2.5mmol/LPEPC(微生物) >400U/L苹果酸脱氢酶>400U/LNADH 6mmol/L表面活性剂 0.3%防腐剂 1g/L校准品:碳酸盐,见标签。
2.1 外观2.1.1 试剂为淡黄色透明液体,无混浊,无未溶解物。
2.1.2 校准品为无色透明液体,无混浊,无未溶解物。
2.1.3 标签内容清晰,字迹牢固不易脱落。
2.2 试剂装量液体试剂的净含量不少于标示值。
2.3 试剂空白吸光度A≥0.8(光径1.0cm,410nm±20 nm波长)。
2.4 试剂空白吸光度变化率ΔA/min≤0.005。
2.5 准确度回收率在±10%范围内。
2.6 批内精密度变异系数CV≤5%。
2.7 批间精密度批间相对极差≤6%。
2.8 分析灵敏度样本与试剂比例为1:100,测定20mmol/L 被测物,吸光度变化在0.010/分~0.030/分区间内。
2.9 线性2.9.1 2.9 mmol/L~50 mmol/L。
在规定的线性区间内,测定值与样本浓度值的相关系数(r)应不低于0.9800。
2.9.2 2.9mmol/L~10mmol/L区间内,线性偏差应不超过±1mmol/L;10mmol/L~50mmol/L区间内,线性相对偏差应不超过±10%。
2.10 稳定性原装试剂盒2~8℃保存,有效期12个月,有效期满后两个月内测定结果应符合2.5和2.9要求。
二氧化碳(CO2)测定试剂盒(PEPC酶法)适用范围:用于体外定量测定人体血清中二氧化碳的含量。
1.1 试剂盒包装规格试剂:1×20ml;2×60ml;3×40ml;4×60ml;4×400ml;1×8L;2×30ml。
校准品(选配):1×1ml;1×3ml。
质控品(选配):1×1ml;1×3ml;2×3ml(单水平)。
1.2 试剂盒主要组成成分2.1 外观液体单试剂:浅黄色澄清液体。
校准品:无色至淡黄色澄清液体。
质控品:无色至浅黄色澄清液体。
2.2 净含量液体试剂的净含量不得低于标示体积。
2.3 试剂空白吸光度在37℃、405 nm波长、1cm光径条件下,试剂空白吸光度应不小于0.7。
2.4 分析灵敏度测定浓度为25mmol/L样本时,吸光度变化值(ΔA)应在(0.03,0.25)范围内。
2.5 线性范围在(5,50)mmol/L线性范围内,r不小于0.995。
在(20,50)mmol/L范围内线性相对偏差不大于±10%;在(5,20]mmol/L范围内线性绝对偏差不大于±2mmol/L。
2.6 重复性重复测试两份高低浓度的样本,所得结果的变异系数(CV%)应不大于5%。
2.7 批间差不同批号试剂测试同一份样本,测定结果的批间相对极差应不大于6%。
2.8 准确度相对偏差:相对偏差应不超过±10%。
2.9 质控品赋值有效性测定结果在靶值范围内。
2.10校准品溯源性依据GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,校准品溯源至中国计量科学研究院生产的国家标准物质碳酸钠(GBW(E)060023c)。
2.10稳定性效期稳定性:试剂盒在2℃~8℃下有效期为12个月,取失效期的试剂盒进行检测,试验结果满足2.3、2.4、2.5、2.6、2.8、2.9的要求。
二氧化碳检测试剂盒(PEPC法)适用范围:用于体外定量测定人血清中二氧化碳的含量。
1.1包装规格1)试剂1:60mL×102)试剂1:60mL×43)试剂1:45mL×64)试剂1:20m×45)试剂1:120mL×21.2 组成成分PEP 1.8 mmol/LMgSO4 10 mmol/LNADH 0.40 mmol/LMDH 1,250 U/LPEPC 200 U/L草酸钠 2.5 mmol/L缓冲液рH 7.02.性能指标2.1试剂装量应不低于瓶签标示装量。
2.2外观试剂:无色或淡黄色澄清液体。
2.3试剂空白吸光度测定温度:37℃;测定波长:405nm;比色杯光径:1.0cm;其空白吸光度为>1.0。
2.4准确度按试剂盒的说明书操作,测试国家标准物质GBW(E)080969,重复测定3次,取测试结果的均值,按公式计算检测结果与标准物质标示值的偏差,偏差应不超过±15%。
2.5精密度2.5.1重复性重复测定高、中、低三个浓度水平的血清样品或质控样品,其结果的变异系数(CV)应不超过10%。
2.5.2批间差重复测定血清样品或质控样品,其结果相对极差R不超过10%。
2.6线性在[5,50]mmol/L范围内,线性回归的相关系数应不低于0.99,[5,10]mmol/L浓度的线性绝对偏差不超过±3mmol/L,(10,50]mmol/L浓度的线性相对偏差应不超过±15%。
2.7分析灵敏度5mmol/L二氧化碳样本的吸光度差值为:0.001≤△A≤0.1。
2.8稳定性原包装试剂盒在2~8℃条件下贮存达到12个月,性能指标应符合2.2、2.3、2.4、2.5.1、2.6、2.7之规定。
二氧化碳测定试剂盒(PEPC酶法)适用范围:用于体外定量测定人血清中二氧化碳的含量。
1.1 包装规格a) 单一试剂:1×15mLb) 单一试剂:2×40mLc) 单一试剂:5×60mLd) 单一试剂:2×100mL1.2 主要组成成分三羟甲基氨基甲烷缓冲液250 mmol/L 磷酸烯醇式丙酮酸(PEP)10 g/L磷酸烯醇式丙酮酸羧化酶(PEPC)10 KU/L苹果酸脱氢酶(MDH)8 KU/L还原型辅酶I(NADH) 2.2 g/L表面活性剂及稳定剂适量2.1 外观试剂应为无色至浅黄色澄清液体。
2.2 试剂装量应不低于试剂瓶标示装量。
2.3 试剂空白2.3.1试剂空白吸光度在405nm波长处测定试剂空白吸光度,应≥0.4。
2.3.2试剂空白吸光度变化率在405nm波长处测定其空白吸光度变化率|△A/min|<0.01。
2.4 分析灵敏度含量为25 mmol/L样本时,其|△A/min|应≥0.005。
测定CO22.5 线性范围2.5.1在(5,50)mmol/L范围内,线性回归的确定系数应不低于0.990;2.5.2测试浓度在(5,10] mmol/L范围内,线性绝对偏差应不超过±1 mmol/L;测试浓度在(10,50)mmol/L范围内,线性相对偏差应不超过±10%。
2.6 测量精密度2.6.1重复性:用三个水平质控血清重复测试其变异系数(CV)应不超过10%。
2.6.2批间差:抽取3个不同批号试剂,对同一份样本进行重复测定,相对极差≤10%。
2.7 准确度以国家标准物质为检测样本时,测定结果相对偏差不超过±5%。
2.8 稳定性取在2℃~8℃条件下贮存达到12个月的试剂进行检测,应符合2.1、2.3、2.4、2.5、2.6.1、2.7的要求。
二氧化碳(CO2)测定试剂盒(PEPC酶法)适用范围:本试剂盒用于体外定量测定人血清中二氧化碳(CO)的浓度。
21.1包装规格1.2主要组成成分试剂主要组分:磷酸烯醇丙酮酸(PEP) 6.3mmol/L磷酸烯醇丙酮酸羧化酶(PEPC) ≥50U/L苹果酸脱氢酶(MDH) ≥100U/L还原型因子≥0.1mmol/L 校准品主要组分:水基质CO2 20-40mmol/L,批特异,具体浓度见瓶签质控品主要组分:水基质CO2 水平1:10-30mmol/L;水平2:20-50mmol/L,批特异,具体浓度见瓶签2.1外观2.1.1试剂应为无色到淡黄色透明溶液,无混浊,无未溶解物。
2.1.2校准品应为无色透明溶液,无混浊,无未溶解物。
2.1.3质控品应为无色透明溶液,无混浊,无未溶解物。
2.2装量液体试剂的净含量应不少于标示值。
2.3试剂空白CO2试剂盒在波长(395~415)nm处测定空白样品的吸光度值,应不小于0.7000。
2.4分析灵敏度试剂盒测试25mmol/L被测物时,吸光度差值(ΔA)应不小于0.0500。
2.5准确度测定国家标准物质GBW06101,相对偏差应不超过15%。
2.6精密度2.6.1重复性重复测试(15.0±3.0)mmol/L、(25.0±5.0)mmol/L和(36.0±6.0)mmol/L 的样本,所得结果的变异系数CV应不大于5%;2.6.2批间差测试(25.0±5.0)mmol/L的样本,所得结果的批间相对极差应不大于10%。
2.7线性范围CO2试剂盒在[3,50]mmol/L范围内,线性相关系数(r)应不小于0.990;在[3,20]mmol/L区间内,线性绝对偏差应不超过±2mmol/L;在(20,50]mmol/L区间内,线性相对偏差应不超过±10%。
2.8质控品赋值有效性重复测定质控品,测定结果应在质控范围内。
1 性能指标
2.1外观
试剂应为清澈透明的液体,无沉淀、悬浮物和絮状物;
2.2净含量
液体试剂的净含量应不少于标示值。
2.3试剂空白
2.3.1试剂空白吸光度
试剂以水为空白在37℃±1℃,405 nm 波长条件下,吸光度应大于0.3 A。
2.3.2试剂空白吸光度变化率
试剂以水为空白在37℃±1℃,405 nm 波长条件下,吸光度变化率应小于0.009 A/min。
2.4分析灵敏度
当样本浓度为25 mmol/L 时,吸光度变化率应不小于0.027 A/min。
2.5线性范围
试剂盒在(1.0~50.0)mmol/L 范围内:
a)线性相关系数r 应不小于0.9900;
b)当样本浓度不大于30.3 mmol/L 时,线性绝对偏差应不大于±3.03 mmol/L;当样本浓度大于30.3 mmol/L 时,线性相对偏差应不大于±10.0%。
2.6测量精密度
2.6.1重复性
变异系数:CV 应不大于 5.0%。
2.6.2批间差
相对偏差:R 应不大于 5.0%。
2.7准确度
测定校准品,测定结果与靶值的相对偏差应不大于±10.0%。
2.8分析特异性
血红蛋白浓度在800 mg/dL 内、抗坏血酸浓度在60 mg/dL 内、内源性酯浓度在1000
mg/dL 内、胆红素浓度在80 mg/dL 内,对试剂检测结果的偏差影响应在±10%以内。
2.9校准品均一性
试剂盒校准品的均一性:CV 应不大于 5.0%。
1。