化学元素的一些特殊性质
- 格式:doc
- 大小:28.50 KB
- 文档页数:2

元素周期表中的稀有元素与放射性元素元素周期表是化学领域中的一张重要图表,它将所有已知的化学元素按照原子序数和化学性质进行了分类和排列。
在这张表中,我们可以看到一些特殊的元素,如稀有元素和放射性元素。
本文将探讨这些元素的特性和应用。
稀有元素是指元素周期表中的18号族元素,也被称为稀有气体。
这些元素包括氦、氖、氩、氪、氙和氡。
它们在自然界中以单质的形式存在,具有稳定的电子结构和低反应性。
稀有气体在工业和科学领域有着广泛的应用。
例如,氦广泛用于气球和激光技术中,氖被用于霓虹灯和激光器,氩被用于气体保护焊和充电灯,氪和氙则被用于光学薄膜和激光器。
此外,稀有气体还被用于气象学研究、核磁共振成像和医学诊断。
除了稀有元素,元素周期表中还有一些放射性元素。
放射性元素是指具有放射性衰变性质的元素,它们的原子核不稳定,会自发地发射出粒子或电磁辐射以达到更稳定的状态。
放射性元素包括镭、铀、钚等。
放射性元素的放射性衰变可以用于放射治疗和核能发电。
例如,镭曾被用于治疗癌症,铀被用于核武器和核电站,钚则被用于核燃料和核爆炸装置。
然而,放射性元素也带来了一定的危险性。
放射性辐射对人体和环境都具有一定的伤害。
因此,在使用和处理放射性元素时,必须采取严格的安全措施。
核电站和核设施需要严格的安全监管,以防止辐射泄漏和核事故发生。
此外,核废料的处理和储存也是一个全球性的难题,需要找到安全可靠的方法来处理这些高放射性废料。
除了稀有元素和放射性元素,元素周期表中还有其他许多有趣的元素。
例如,金属铁是地球上最常见的元素之一,它在建筑、制造和能源领域有着广泛的应用。
碳是生命的基础,它存在于有机物中,如葡萄糖、脂肪和蛋白质。
硅是半导体材料,被广泛应用于电子器件和太阳能电池。
元素周期表中的每一个元素都有其独特的性质和应用。
通过研究这些元素,我们可以更好地理解物质的本质和化学反应的规律。
同时,我们也需要认识到元素的应用是需要谨慎和负责任的,特别是对于稀有元素和放射性元素。
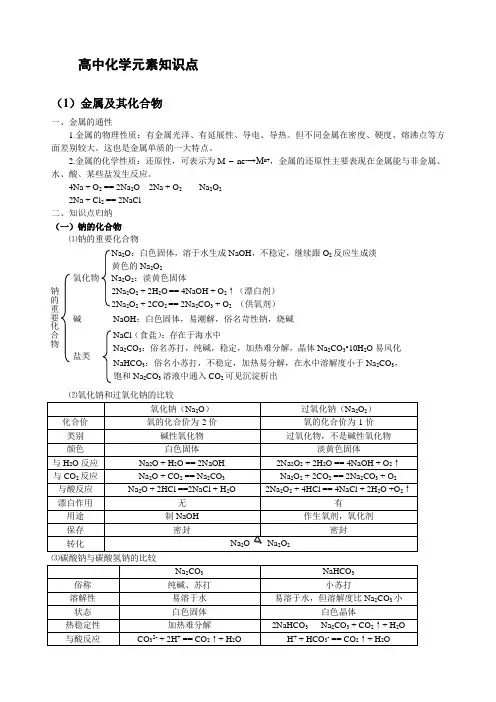
高中化学元素知识点(1)金属及其化合物一、金属的通性1.金属的物理性质:有金属光泽、有延展性、导电、导热。
但不同金属在密度、硬度、熔沸点等方面差别较大。
这也是金属单质的一大特点。
2.金属的化学性质:还原性,可表示为M – ne -→M n+,金属的还原性主要表现在金属能与非金属、水、酸、某些盐发生反应。
4Na + O 2 == 2Na 2O 2Na + O 2 Na 2O 2 2Na + Cl 2 == 2NaCl 二、知识点归纳 (一)钠的化合物 ⑴钠的重要化合物氧化钠(Na 2O ) 过氧化钠(Na 2O 2) 化合价 氧的化合价为-2价氧的化合价为-1价 类别 碱性氧化物 过氧化物,不是碱性氧化物颜色 白色固体 淡黄色固体与H 2O 反应 Na 2O + H 2O == 2NaOH 2Na 2O 2 + 2H 2O == 4NaOH + O 2↑ 与CO 2反应 Na 2O + CO 2 == Na 2CO 3 Na 2O 2 + 2CO 2 == 2Na 2CO 3 + O 2 与酸反应 Na 2O + 2HCl ==2NaCl + H 2O2Na 2O 2 + 4HCl == 4NaCl + 2H 2O +O 2↑漂白作用 无 有用途 制NaOH 作生氧剂,氧化剂保存 密封密封转化Na 2O → Na 2O 2Na 2CO 3 NaHCO 3 俗称 纯碱、苏打 小苏打溶解性 易溶于水 易溶于水,但溶解度比Na 2CO 3小状态 白色固体 白色晶体热稳定性 加热难分解2NaHCO 3 Na 2CO 3 + CO 2↑+ H 2O与酸反应CO 32- + 2H + == CO 2↑+ H 2OH + + HCO 3- == CO 2↑+ H 2O钠的重要化合物氧化物 Na 2O :白色固体,溶于水生成NaOH ,不稳定,继续跟O 2反应生成淡黄色的Na 2O 2Na 2O 2:淡黄色固体 2Na 2O 2 + 2H 2O == 4NaOH + O 2↑(漂白剂) 2Na 2O 2 + 2CO 2 == 2Na 2CO 3 + O 2 (供氧剂) 碱NaOH :白色固体,易潮解,俗名苛性钠,烧碱 盐类 NaCl (食盐):存在于海水中 Na 2CO 3:俗名苏打,纯碱,稳定,加热难分解,晶体Na 2CO 3•10H 2O 易风化NaHCO 3:俗名小苏打,不稳定,加热易分解,在水中溶解度小于Na 2CO 3,饱和Na 2CO 3溶液中通入CO 2可见沉淀析出与CaCl 2反应 Ca 2+ + CO 32- == CaCO 3↓不反应与NaOH 反应 不反应HCO 3- + OH - == CO 32- + H 2O 与Ca(OH)2反应Ca2++ CO 32- == CaCO 3↓2HCO 3-(过量)+ 2OH - + Ca 2+ == CO 32- +2H 2O + CaCO 3↓相互转化CO 32- + CO 2 + H 2O == 2HCO 3- NaHCO 3 + NaOH == Na 2CO 3 + H 2O 2NaHCO 3 Na 2CO 3 + CO 2↑+ H 2O(二) 铝及其重要化合物的性质⑴ 位置和原子结构示意图: 第3周期 第ⅢA 族。

元素化学及其特性元素是构成物质的基本单位,人类对元素的研究可以追溯到古代。
随着科学技术的发展,元素化学逐渐成为一门独立的学科。
本文将介绍元素化学的基本概念和一些常见元素的特性。
一、元素的定义和分类元素是由相同类型的原子组成的物质,无法通过化学方法进一步分解。
根据元素的性质和特点,科学家将元素分为金属元素、非金属元素和过渡金属元素三类。
金属元素具有导电性、热导性和延展性等特点,例如铁、铜、锌等。
非金属元素通常不能导电,化学性质较为活泼,如氧、氮、碳等。
过渡金属元素具有特殊的物理和化学性质,如铁、铬、铜等。
二、原子结构及元素周期表元素的构成单位是原子。
原子由核和电子组成,核中包含质子和中子,电子环绕在核外。
质子和电子的数量相等,原子整体电荷为中性。
元素周期表是元素化学的重要工具。
它是根据元素的原子序数(即原子核中质子的数量)将元素排列起来,使具有相似化学性质的元素在同一竖列。
元素周期表将元素分为周期和族,周期表示元素的电子层次,族表示元素的化学性质。
三、元素的性质元素的性质包括物理性质和化学性质。
1. 物理性质物理性质是指元素在不改变其化学组成的情况下所表现出来的特性。
其中包括颜色、密度、硬度、熔点和沸点等。
例如,金属元素常常具有金黄色、高密度、较高的硬度和熔点等特点;非金属元素通常呈现无色或淡黄色、较低的密度和硬度,熔点和沸点也较低。
2. 化学性质化学性质是指元素在化学反应中与其他物质发生的变化。
元素的化学性质包括氧化性、还原性、稳定性等。
例如,金属元素常常具有较强的氧化性,可以与氧气反应生成金属氧化物;非金属元素通常具有较强的还原性,可以与氧气反应生成氧化物。
四、常见元素的特性1. 氢(H)氢是宇宙中最常见的元素之一,具有无色、无味、无毒的性质。
它是一种非常活泼的元素,在常温下与氧、氮等元素可以反应生成化合物。
2. 氧(O)氧是地球上最常见的元素之一,也是生命体系中必不可少的元素。
它是一种无色、无味、无毒的气体,在可燃物质燃烧和许多氧化反应中起着重要的作用。

H 核内无中子;原子半径最小;在IA族中,但属非金属;唯一能形成裸露阳离子的非金属元素。
最外层电子数=电子总数=电子层数=周期数=主族序数。
H2为最轻的气体。
第ⅠA族中能形成共价化合物的元素;在化合物中其数目改变,质量分数变化不大;与O可生成两种液体(H2O、H2O2)。
He最外层电子数(2个)是电子层数的2倍,是最轻的稀有气体,一般不参加反应。
Li最轻的金属(密度最小的金属)。
最外层电子数=电子层数的一半(1/2)=次外层电子数的一半(1/2);次外层电子数=电子层数;周期数=主族序数的2倍。
唯一不能形成过氧化物的碱金属元素。
密保存于石蜡中。
Be相同质量情况下与酸反应放出H2最多的金属;最高价氧化物及其水化物既能与强酸反应又能与强碱反应。
最外层电子数=电子层数=次外层电子数=核外电子总数的一半(1/2);周期数=主族序数。
B最外层电子数比次外层电子数多1。
硼酸(H3BO3)可用于洗涤不小心溅在皮肤上的碱液的药品;硼砂(Na2B4O7•10H20)为制硼酸盐玻璃的材料。
C 12C作为相对原子质量的标准;气态氢化物含氢量最高;是形成化合物最多的元素;金刚石是天然矿物中最硬的物质;石墨是一种有金属光泽且能导电的混合晶体单质。
次外层电子数=电子层数=最外层电子数的一半(1/2);主族序数=周期数的2倍;最高正价=最低负价的绝对值。
CO2通入石灰水生成沉淀再消失;CO2灭火;CO2充汽水。
氧化物CO、CO2;简单氢化物CH4,正四面体结构,键角109°28′;最高价含氧酸H2CO3;N氮元素是植物所需的三大元素之一;气态氢化物水溶液呈碱性且溶解度最大;气态氢化物可以与其最高价氧化物对应水化物发生化合反应;液态时可以做致冷剂;其单质化学性质较稳定,可用于填充灯泡、储存粮食和焊接金属的保护气;HNO3为实验室中常备的三大强酸之一。
最外层电子数比次外层多3个;最高正价与负价绝对值之差为2。
氢化物NH3;氧化物形式最多(6种);含氧酸有HNO3,HNO2;气态氢化物水溶液唯一呈碱性;常见离子化合物NH4C1中含配位键;NH4+正四面体结构;HNO3与金属不产生氢气。

元素周期表中的过渡金属元素特性元素周期表是现代化学学科的基本工具之一,它将所有已知的化学元素组织成特定的顺序。
在这个表中,过渡金属元素占据了一整个区域,包括3d系列和4d系列的元素,它们具有特殊的化学和物理性质,对于我们理解和应用元素周期表是非常重要的。
本文将重点探讨过渡金属元素的特性。
一、原子结构过渡金属元素的共同特点是它们的原子结构中有一个或多个未填满的d轨道。
这意味着过渡金属元素的电子结构在外层电子的填充上有一些特殊规律。
以铁(Fe)为例,其电子结构为1s² 2s² 2p⁶ 3s² 3p⁶ 4s²3d⁶,其中未填满的3d轨道成为其特征。
二、物理性质过渡金属元素常常具有良好的导电性和热导率。
这是由于它们的原子结构中的未填满d轨道,能够容纳更多的电子和形成更复杂的电子结构,从而增强导电性能。
此外,过渡金属元素的硬度通常较高,且具有高熔点和高密度。
这些物理性质使得过渡金属元素在工业和科学研究中有广泛的应用。
三、化学性质1. 变价性:过渡金属元素通常具有多种变价态。
由于其未填满的d轨道,过渡金属元素可以通过失去或获得d轨道中的电子来形成不同的化合物。
这种多变价性使得过渡金属元素在催化剂、电池等领域有着重要的应用。
2. 形成配合物的能力:过渡金属元素具有形成配合物的能力,这是由于它们的d轨道可以接受配体的电子对并与之形成稳定的配合物。
这种能力使得过渡金属元素在生物学、医药化学和材料科学等领域具有广泛的应用。
3. 催化活性:由于其特殊的电子结构和变价性,过渡金属元素经常作为催化剂在化学反应中发挥着重要的作用。
例如,铂(Pt)常用来催化氢气和氧气的结合以产生水,铁(Fe)则在哈伯-博什过程中用作氨的合成催化剂。
四、应用领域过渡金属元素在许多领域都有着广泛的应用。
例如,铁、钴(Co)和镍(Ni)被广泛建筑和汽车制造业用作钢铁的合金成分。
铜(Cu)是一种重要的导电金属,广泛应用于电子、电力和通信行业。

10. 浓H2SO4是一种酸性干燥剂,一般可用于干燥中性和酸性气体,但不能干燥H2S、HBr、HI等具有还原性的酸性气体。
这是因为浓H2SO4能将其氧化。
H2SO4(浓)+ H2S === S↓ + SO2 + 2H2O、H2SO4(浓)+ 2HBr === Br2 + SO2↑ + 2H2O、H2SO4(浓)+ 2HI === I2 + SO2↑ + 2H2O11. 酸与酸之间一般不反应,但浓H2SO4和亚硫酸能分别和氢硫酸反应。
H2SO4(浓)+ H2S === S↓ + SO2↑+ 2H2O、H2SO3 + 2H2S === 3S↓ + 3H2O。
12. 酸性氧化物与酸一般不反应,但SO2与氢硫酸能够反应。
SO2 + 2H2S === 3S↓ + 2H2O13. 强酸与弱酸盐反应可以制弱酸,弱酸一般不能与强酸盐反应制强酸。
但有氢硫酸与CuSO4溶液反应可制的强酸。
CuSO4+ H2S === H2SO4 + CuS↓。
14. 在实验室用浓H2SO4与NaCl反应制取HCl,可以在强热的条件下进行反应生成Na2SO4;但用浓H2SO4与NaNO3反应制取HNO3时,却不能强热,只能微热生成NaHSO4。
H2SO4(浓)+ 2NaCl Na2SO4 + 2HCl↑H2SO4(浓)+ NaNO3NaHSO4 + HNO3↑。
15. 钡盐一般有毒,但BaSO4却无毒,可做“钡餐”。
16. 同素异形体之间的转化一般属于化学变化,如O2和O3、白磷与红磷、金刚石与石墨之间的转化等均属于化学变化;但斜方硫与单斜硫之间的转化(S8的组成及硫原子之间的化学键均未变化,只是S8分子大晶体里的排列方式不同)却属于物理变化。
、17. 活泼金属与稀H2SO4反应,一般速率很快;但活泼金属Ca、Ba与稀H2SO4反应时,由于生成CaSO4、BaSO4沉淀物附于金属表面,致使反应速率很慢。
18.在金属活动顺序表中,位于氢后面的金属与非氧化性酸一般不反应,但Cu与氢硫酸可以反应。


《化学元素知识》元素简介:铍大家好,我们接着来认识铍元素,铍是一种有毒的元素,会涉及医学和职业病相关方面的知识,希望大家喜欢,有什么问题可以和我交流。
铍是一种化学元素,符号为Be,原子序为4,原子量为9.012,属于碱土金属。
铍通常在宇宙射线与较重原子散裂过程中产生,是宇宙中较为稀有的元素之一。
在恒星核心内,铍会被聚变成更重的元素,几乎很少保留。
铍单质呈灰色,是一种坚硬、轻质、易碎的金属。
1. 特性①物理性质铍是一种呈灰色的坚硬金属,室温下易碎,晶体呈六方密排结构。
铍有着极高的刚性(杨氏模量为287GPa)及熔点。
铍的弹性模量大约比钢高50%,铍的密度较低,这导致铍的音速特别高,在标况下约为12.9km/s。
另外,由于铍的热容量(1925J/kg·K)和热导率(216W/m·K)都很高,铍是单位重量散热性最好的金属。
铍的线性热膨胀率(1.14×10⁻⁵K⁻¹)较低,因此铍在热负荷条件下有着特殊的稳定性。
②核物理性质除了由宇宙射线所致的痕量放射性同位素以外,天然铍几乎完全由核自旋为3/2的铍-9组成。
铍的高能中子截面较大,对能量高于10keV的中子截面约为6靶恩。
因此,铍是一种良好的中子反射体和中子减速剂,能使中子热能降至0.03eV以下。
铍对这些低能中子的截面比高能中子低至少一个数量级,其确切截面值取决于材料雏晶的纯度和大小。
铍-9会与中子能量高于1.9MeV的中子反应,产生铍-8和两个中子,铍-8又会立刻分裂成两个α粒子。
所以对于高能中子来说,铍是一种中子倍增剂,因为它释放的中子多于吸收的中子。
铍-9在吸收低能中子后,还会生成氚和氦核以及电子。
铍-9受高能α粒子撞击时也会释放中子,铍-9会与α粒子发生核反应生成碳-12和一个中子。
铍在氘核和质子的撞击下还会释放中子,所以在实验室中可用镭、钋和钚对铍进行辐射作为中子源。
大部分波长的X射线和γ射线都可以穿透铍金属,所以铍可以做X射线管等器材的窗口材料。

汞的物理化学性质汞是一种化学元素,原子序数为80,化学符号为Hg。
它是一种银白色的金属,在常温下为液态。
汞具有一系列独特的物理化学性质,以下将对其进行详细描述。
1. 密度和熔点:汞是一种相对密度很高的物质,其密度为13.5 g/cm³。
这使得汞在常温下呈液态,并且在大多数温度下都保持液态状态。
汞的熔点为-38.83°C,是一种相对较低的熔点。
2. 沸点和蒸气压:汞的沸点为357°C,远高于常温。
由于其高沸点和较低的蒸气压,汞在室温下几乎没有蒸发。
这使得它可以用于温度计等高温测量装置中,因为其不易挥发。
3. 导电性:汞是一种良好的导电体,具有良好的电导率。
这使得汞在电子设备和化学研究中有许多应用。
例如,汞开关和汞电极在电路中的应用十分广泛。
4. 自旋轨道偶合和自旋振荡:汞具有特殊的自旋轨道耦合效应,这导致其原子态在电子态上具有热不稳定性。
在汞原子中,由于自旋-轨道耦合和磁场效应的相互作用,底层(基态)的两个自旋型态(J=1/2和J=3/2)发生了一个小的交叉,这被称为自旋振荡。
这一性质对于在光谱学、原子物理学和化学反应动力学等领域的研究具有重要意义。
5. 反应性:汞是一种相对不活泼的金属,在大多数情况下不与其他元素发生反应。
但是,在高温和氧气存在的条件下,汞可以与氧气反应形成氧化物汞。
此外,汞还可与硝酸反应产生亚硝酸盐。
6. 溶解性:汞在常温下是不溶于水的,但可以溶于很多酸性和碱性溶液中。
在一些氧化性溶液中,汞也可以溶解。
汞的溶解性使其在实验室和工业生产中有着广泛的应用。
7. 毒性:汞是一种高度有毒的物质,对人体和环境都具有潜在的危害。
摄入或吸入过量的汞可能对中枢神经系统、肾脏和其他器官造成损害。
因此,在使用和处理汞时,必须遵循严格的安全操作和处置规定。
总结:汞作为一种物质,具有独特的物理化学性质。
它具有高密度和熔点、高沸点和低蒸气压、良好的导电性、自旋轨道偶合和自旋振荡、反应性和溶解性等特点。

化学元素的独特之处发现元素的特殊性质元素是构成物质的基本单位,化学元素的独特之处在于其特殊性质的发现。
通过科学家们的努力,我们逐渐认识到每个元素都具有各自独特的性质和特点。
本文将探讨一些常见元素的特殊性质的发现过程。
一、氢元素的独特之处氢元素是最简单的元素,它是宇宙中最丰富的元素之一。
科学家们通过实验观察发现,氢气具有轻质、难溶于水、易燃的特性。
不仅如此,氢元素还是唯一一种能够与氧元素反应生成水的元素,这种反应被称为氢氧化反应,也是生命活动中水的形成过程。
二、氧元素的独特之处氧元素是生命中不可或缺的元素,它存在于大气中并参与许多化学反应。
科学家们发现,氧气是一种无色、无臭、无味、不可燃的气体。
但同时,氧气又是一种极好的氧化剂,在许多燃烧反应中起着重要作用。
氧元素的发现对理解生命的起源和维持起着关键作用。
三、金元素的独特之处金元素是一种贵重金属,具有独特的物理和化学性质。
科学家们发现,金是一种黄色的金属,具有优异的导电性和导热性。
此外,金元素还能够在常温下保持稳定,不被空气中的氧化物腐蚀。
这使得金成为一种理想的储备价值的金属,被广泛应用于金融、珠宝等领域。
四、碳元素的独特之处碳元素是生命中最为关键的元素之一,它具有多样的形态和性质。
科学家们发现,碳元素可以形成无数种不同的化合物,包括有机物和无机物。
这些化合物的多样性使得碳成为生命的基石,它构成了大量的生物分子,如蛋白质、脂肪和碳水化合物等。
总结来说,化学元素的独特之处在于它们的特殊性质的发现。
通过科学家们的努力,我们逐渐认识到每个元素都具有各自独特的性质和特点。
从氢元素的轻质易燃到金元素的稳定贵重,再到碳元素的多样性,每个元素都有着不同的魅力和应用领域。
通过进一步的研究和探索,我们相信还会发现更多元素的特殊性质,为人类社会的发展做出更大的贡献。

神秘的稀有元素拥有特殊性质的化学元素在化学元素周期表中,存在着一些稀有元素,它们的特殊性质令人着迷。
这些元素具有独特的化学和物理特性,使它们在科学研究和现实应用中扮演着重要的角色。
本文将深入探讨一些神秘的稀有元素及其引人注目的性质。
1. 钋(Po)钋是一种放射性元素,含有84个质子和质量数为210。
它是地球上最稀有和最具毒性的元素之一。
尽管钋的存在量极为有限,但它的特性使其在科学研究和工业应用中有着广泛的用途。
钋的放射性特性使其成为一种理想的放射性同位素,被用于癌症治疗和核激发。
2. 铥(Tm)铥是一种稀有的地球金属,它的存在量非常有限。
铥的特殊之处在于它的磁性性质。
在极低温下,铥会表现出强烈的铁磁性,可以用于制造超导体和磁存储材料。
此外,铥还用于制造最强的永磁材料,被广泛应用于电动汽车和医疗设备等领域。
3. 铼(Re)铼是一种稀有的过渡金属,具有高熔点和高密度。
它在耐热合金的制备中有广泛的应用,可提高材料的强度和耐腐蚀性。
此外,铼还被用于制造光纤和电阻器等电子器件,以及催化剂和火箭喷嘴等高科技领域。
4. 錒(Ac)錒是一种放射性稀有金属,属于锕系元素。
它的原子序数为89,质量数为227。
錒是地球上最稀有的元素之一,主要通过人工合成获得。
由于錒的放射性特性和高能量密度,它在核能源和核武器研究中有着重要的应用。
5. 锿(Es)锿是一种人工合成的放射性元素,属于锕系元素。
它的原子序数为99,质量数为252。
锿是一种非常不稳定的元素,具有极短的半衰期。
尽管如此,锿的研究对于理解重元素的性质和核物理学的发展至关重要。
6. 锔(Cm)锔是一种人工合成的放射性元素,属于锕系元素。
它的原子序数为96,质量数为247。
锔是地球上最稀有的元素之一,主要通过人工核反应获得。
由于锔的高放射性,它在核能研究和核废料处理中起着关键的作用。
结语神秘的稀有元素拥有特殊性质,对科学研究和现实应用有着重要的影响。
钋、铥、铼、錒、锿和锔是一些令人着迷的稀有元素,它们的特殊性质在各个领域发挥着重要作用。
神奇的化学元素揭示它们的特殊化学性质化学元素构成了我们周围的一切事物,而其中的一些元素具有令人惊叹的特殊化学性质。
在本文中,我们将揭示一些神奇的化学元素及其独特的性质。
第一,让我们来探索氢元素。
氢是宇宙中最常见的元素之一,也是最简单的元素。
它具有许多令人惊叹的特性。
首先,氢是非常轻的元素,其原子质量仅为1.008,是所有元素中最轻的。
此外,氢可以在极低的温度下变为液态或固态,这使得它在航天工业和液体燃料中得到了广泛应用。
接下来,让我们来研究一下氧元素。
氧是地球大气中的第三多元素,也是生命的基本要素之一。
氧具有非常强大的氧化能力,它能与许多物质发生反应并使其燃烧。
此外,氧还是大多数生物体呼吸过程中不可或缺的元素。
我们身体中的细胞需要氧气来进行新陈代谢过程,释放能量并维持生命。
除了氧,还有一个神奇的元素是碳。
碳是一种非常独特的元素,它能形成无数种复杂的化合物。
这是因为碳原子能与其他碳原子或不同的元素原子形成共价键。
这种特性使得碳能够构建出多样性极高的有机物分子,这些有机分子构成了生物体的基础,包括蛋白质、脂肪和碳水化合物等。
酸碱性质在化学中起着至关重要的作用。
我们不可忽视的元素之一是氢离子(简称H+)。
氢离子是酸性溶液中的主要离子,它决定了溶液的酸性强度。
溶液中的pH值就是用来表示氢离子浓度的指标。
酸性溶液中的氢离子浓度高,pH值低于7。
能够产生氢离子的化合物被称为酸,包括我们常见的柠檬汁和醋等。
而碱性物质则是产生氢离子的反义词,其氢离子浓度低于酸性溶液。
最后,我们来探索一下金(Au)元素。
金是一种非常贵重和稳定的元素,具有耐腐蚀性。
这使得金在珠宝制作和货币制作等领域广泛应用。
此外,金具有优良的导电性,使其在电子行业中得到广泛应用。
在本文中,我们研究了一些神奇的化学元素及其特殊的化学性质。
从氢的轻巧和液态能力,到氧的强大氧化性和支持生命的重要性,再到碳的构建多样性和生物体的基础,这些元素都展示出了令人惊叹的特性。
神奇的溴了解溴元素的特殊性质神奇的溴---了解溴元素的特殊性质溴(化学符号:Br)是一种化学元素,属于卤素族。
与其他卤素元素相比,溴具有许多独特的性质和应用。
本文将深入探讨溴的特殊性质,帮助读者更好地了解这一神奇元素。
一、物理性质1.1 相态特性溴是室温下为液体状的元素,呈红棕色。
这使得溴在实验室和工业生产中的使用非常方便,可以直接应用于液态反应体系中。
1.2 密度和沸点溴具有较高的密度(约为 3.11 g/cm³),与水相比,溴的密度更大。
此外,溴的沸点较低(约为59℃),使其可在常温下迅速蒸发成为有毒的紫色气体。
二、化学性质2.1 强氧化性溴具有强烈的氧化能力,能与许多其它元素或化合物反应。
例如,溴可以和金属反应生成相应的溴化物,如溴化铁、溴化铜等。
2.2 漂白性溴是一种强力漂白剂,可用于去除有机物中的颜色。
溴水溶液常常被用于漂白纸浆、木材和纺织品等工业领域。
2.3 溴发反应溴与丁醇等物质反应后,会发生明显的溴发反应。
这是因为在反应中,溴分子发生了裂解,释放出紫色的溴气。
这一特性被广泛应用于有机化学实验中的溴试剂检验。
三、生物学应用3.1 溴消毒液溴被广泛应用于水处理领域,可用于消毒和消毒剂的生产。
溴消毒液可以灭活细菌、病毒和其他微生物,是一种高效可靠的消毒方式。
3.2 溴代替碘溴在医药领域具有广泛的应用,常被用作碘的替代物。
比如,溴化物(溴化钾、溴化银等)可用于治疗某些甲状腺疾病,并作为造影剂使用。
四、环境效应4.1 臭氧层的破坏溴化物被释放到大气中时,会对臭氧层产生负面影响。
溴化物会分解臭氧分子,从而引发臭氧层破坏的反应。
因此,为了保护环境,人们需控制溴化物的排放。
4.2 水体污染溴化物是水体中的常见污染物之一。
由于其毒性较高,过量的溴化物会对水生态系统产生负面影响,包括鱼类和其他水生生物的死亡。
五、总结综上所述,溴作为一种化学元素,具有多种特殊的性质。
其具有液态状态和较低沸点的特点,使其在实验室和工业应用中具备独特优势。
钕的性质及相关应用场景钕是一种化学元素,原子序数为60,化学符号为Nd。
它是一种银白色的金属,在常温常压下稳定。
钕具有一些特殊的性质,这些性质使得它在许多应用领域具有广泛的用途。
首先,钕具有较高的磁性。
它是一种强磁性材料,常常被用作制造永磁材料。
钕的永磁性能非常好,可以制造出高磁感应强度和高磁能积的磁体。
因此,钕永磁材料被广泛用于电动机、发电机、磁盘驱动器、磁体等等。
其次,钕是一种良好的光学材料。
它能够吸收和发射特定的光波长,对于激光器和光纤通信非常有用。
钕掺杂的激光晶体可以用于制造固体激光器,可广泛应用于医学、通信、测量和材料加工领域。
此外,钕也可以用来增强玻璃的抗紫外线性能,因此也常用于制作太阳镜和汽车窗玻璃。
另外,钕在核反应堆中有广泛的应用。
钕可以吸收中子,因此可以用来控制反应堆的中子流和反应速率。
钕还可以用来制造核燃料元件和热中子源。
此外,钕还有一些其他的应用。
钕可以合金化,使得合金具有较高的强度和耐磨性,因此在制造航空发动机等高温和高压应用设备时,常常会使用钕合金。
钕基合金还具有较好的耐腐蚀性和抗疲劳性能,因此也可用于制造海洋设备和化学设备等。
除了以上应用,钕在生物医学领域也有一些潜在的应用。
钕可以被用作一种对比剂,以提高核磁共振成像(MRI)的图像对比度。
此外,钕还可以被用作药物的载体,将药物传递到特定的部位。
总之,钕是一种具有特殊性质的化学元素,具有广泛的应用场景。
它被广泛应用于永磁材料、光学材料、核反应堆、合金制造和生物医学等领域。
未来随着科学技术的进步,钕的更多应用可能会被发现和开发出来。
铋元素金属中的独特存在铋元素是一种具有特殊性质的金属元素,它具有许多独特的存在方式。
在本文中,我们将探讨铋元素金属的晶体结构、化学性质以及它在工业和科学领域中的应用。
一、晶体结构铋元素以其独特的晶体结构而闻名。
晶体结构是指金属内部原子的排列方式。
铋元素的晶体结构为面心立方晶体结构,这意味着铋原子与周围的原子之间存在密集的接触。
这种紧密的结构赋予了铋元素一些非凡的性质。
二、化学性质铋元素金属在化学性质上也具有独特之处。
首先,铋元素是一种良好的导电体,具有较低的电阻率。
这使得铋元素在电子行业中得到广泛应用,比如半导体和光电子器件中使用铋元素作为基础材料。
其次,铋元素具有较低的熔点和较高的密度。
铋的熔点为271.4摄氏度,是常见金属中熔点最低的之一。
同时,铋的密度为9.8克/立方厘米,比许多金属都要高。
这使得铋元素在核能反应堆中的使用成为可能,因为铋可以用来吸收中子,从而起到调节反应速率的作用。
此外,铋元素还具有较强的化学反应性。
铋可以与氧气、硫和氮等元素形成化合物,如氧化铋、硫化铋和氮化铋等。
这些化合物在医药和材料科学中具有重要的应用价值。
三、工业应用铋元素在工业领域中有广泛的应用。
首先,铋元素广泛用于制备合金材料。
铋和其他金属元素的合金常用于制造耐蚀材料、电池和超导材料等。
其次,铋元素还被用于制备陶瓷材料。
铋化合物在陶瓷工业中起到重要的作用,可以增加陶瓷材料的硬度和耐磨性。
另外,铋元素也在医药领域中被广泛使用。
铋化合物具有抗菌和抗炎等特性,因此常被用于制备药物和外科器械。
四、科学应用铋元素还具有许多科学应用。
首先,铋元素在材料科学中被用于制备高温超导材料。
由于铋元素具有较低的电阻率和较高的密度,因此被认为是研究高温超导现象的重要材料。
其次,铋元素在能源科学领域具有重要的应用。
铋化合物可以作为催化剂用于水分解反应,产生氢气作为清洁能源。
此外,铋元素的独特晶体结构也在材料科学和凝聚态物理学的研究中起到关键作用。
..专心. 元素性质的“一般〞和特殊1.原子核一般是由质子和中子构成。
特殊:H 11只有质子而没有中子。
2.非金属性强的元素,其单质的活泼性一般也强。
特殊:N 元素的非金属性强于P ,但是氮气的性质比白磷、红磷的都要稳定。
原因是在氮分子中,氮原子间以共价三键结合,三键的键能大,形成的键很稳定,不易断裂,故常温下氮气的性质很稳定。
3.非金属元素的非金属性越强,其气态氢化物的热稳定性越强。
特殊:N 的非金属性强于C ,但CH 4的热稳定性比NH 3的强。
4.非金属元素的原子形成的简单离子一般是阴离子。
特殊:氢原子易失去电子形成阳离子〔H +〕。
5.金属单质一般可与酸反应,不能与碱反应。
特殊:金属Al 既能与酸反应,又能与碱反应,其反应的实质为:2Al+6H 2O==2Al(OH)3↓+3H 2↑,Al(OH)3+NaOH==NaAlO 2+2H 2O 。
6.非金属元素一般既可显正价,又可显负价。
特殊:氟的非金属性很强,与其他元素化合时只显负价。
7.活泼非金属单质一般可把不活泼非金属元素从其无氧酸盐的水溶液中置换出来。
特殊:氟除外,如F 2不能从KCl 溶液中将氯置换出来。
其原因是F 2的非金属性较强,与水充分接触时,优先与水发生反应:2Fe+2H 2O==4HF+O 2。
8.活泼金属一般可把不活泼金属元素从其盐的水溶液中置换出来。
特殊:碱金属除外,如钠与硫酸铜溶液混合,发生的反应为:2Na+2H 2O==2NaOH+H 2↑,CuSO 4+2NaOH==Cu(OH)2↓+Na 2SO 4。
原因是金属阳离子在水溶液中一般是以水合离子形式存在,钠接触的是水分子,而不是金属阳离子,故钠先与水反应。
9.碱金属的氢氧化物一般易溶于水,属强碱。
特殊:LiOH 微溶于水,属弱碱。
10.非金属元素除氢外,在形成化合物时,其原子一般满足最外层8电子的稳定结构。
特殊:硼的氢化物、卤化物中硼原子未达到最外层8电子的稳定结构,而是只有6个电子。
化学元素总结不同的化学元素在化学研究和生活中起着重要的作用。
化学元素按照原子序数顺序排列,从氢到奥氮根,共有118种已知元素。
每种元素都有独特的原子结构,化学性质和物理性质。
以下是对一些常见化学元素的总结。
氢是宇宙中最常见的元素之一,也是地球上最轻的元素。
它是一个非金属元素,具有低密度,易燃和可燃的特性。
氢在工业上被用作化学品的重要组成部分,也可以用作能源的来源。
同时,氢还可以用于氢燃料电池中,是一种清洁,可再生的能源。
氦是第二轻的元素,是其他元素中最稳定的元素之一。
它是一种惰性气体,在自然界中非常稀少。
由于其高热导性和低密度,氦广泛应用于气体充气,如氦气球和氦气球囊。
此外,氦还在实验室和工业上用于高温实验,例如,作为高温容器的冷却剂。
碳是一种非金属元素,是生命存在的基础。
碳在地球上广泛存在于有机物中,例如,石油,天然气和生物分子。
碳的特殊性质使它成为制造人造纤维,石墨和石墨烯等材料的重要原料。
此外,碳还可以形成无数种化合物,包括烷烃,烯烃和芳香化合物。
氧是地球上最常见的元素,大约占地壳质量的49.2%。
氧是一种非金属元素,具有高度的电负性和活性。
氧在空气中是一个重要的组成部分,支持人和其他动物的呼吸过程。
此外,氧在许多化学反应中起着至关重要的作用,例如燃烧和氧化反应。
硅是一种非金属元素,是地壳中第二丰富的元素,占地壳质量的27.7%。
它是一种半导体材料,被广泛应用于电子技术,如制造电路和太阳能电池。
硅还可以形成硅石和硅胶等材料,用于工业和医疗上。
另外,硅的化合物,如硅酸和硅烷,也在肥料和化妆品等领域中有用途。
氟是一种高度反应性的非金属元素。
它是自然界中最活跃的元素之一,可以与几乎所有其他元素形成化合物。
因为它的强大腐蚀性,氟被广泛应用于蛋白质合成工艺,消毒水和牙膏等产品中。
此外,氟化物也用于工业上的制铝过程。
钠是一种金属元素,具有低密度和低熔点。
钠在自然界中广泛分布于地球和宇宙中的许多化合物中。
化学元素的一些特殊性质
高中化学
2011-05-02 19:55
一.周期表中特殊位置的元素
①族序数等于周期数的元素H、Be、Al、Ge。
②族序数等于周期数2倍的元素C、S。
③族序数等于周期数3倍的元素O。
④周期数是族序数2倍的元素Li、Ca。
⑤周期数是族序数3倍的元素Na、Ba。
⑥最高正价与最低负价代数和为零的短周期元素C。
⑦最高正价是最低负价绝对值3倍的短周期元素S。
⑧除H外,原子半径最小的元素F。
⑨短周期中离子半径最大的元素P。
二.常见元素及其化合物的特性
①形成化合物种类最多的元素、单质是自然界中硬度最大的物质的元素或气态氢化物中氢的质量分数最大的元素C。
②空气中含量最多的元素或气态氢化物的水溶液呈碱性的元素N。
③地壳中含量最多的元素、气态氢化物沸点最高的元素或氢化物在通常情况下呈液态的元素O。
④最轻的单质的元素H ;最轻的金属单质的元素Li 。
⑤单质在常温下呈液态的非金属元素Br ;金属元素Hg 。
⑥最高价氧化物及其对应水化物既能与强酸反应,又能与强碱反应的元素Be、Al、Zn。
⑦元素的气态氢化物和它的最高价氧化物对应水化物能起化合反应的元素N;能起氧化还原反应的元素S。
⑧元素的气态氢化物能和它的氧化物在常温下反应生成该元素单质的元素S。
⑨元素的单质在常温下能与水反应放出气体的短周期元素Li、Na、F。
⑩常见的能形成同素异形体的元素C、P、O、S。
∙ (2011-04-30 20:09:45)
∙ (2011-04-30 20:04:35)
∙ (2011-04-29 09:58:50)
∙ (2011-04-07 17:33:15)
∙(2011-04-06 17:32:47)
∙ (2011-04-06 16:00:54)
∙ (2011-04-05 19:26:15)
∙ (2011-04-04 12:10:35)
∙ (2011-03-21 10:57:34)
∙ (2010-05-26 20:21:19)。