干细胞临床研究项目备案流程
- 格式:doc
- 大小:74.19 KB
- 文档页数:2

干细胞临床研究管理办法目录第一章总则 (2)第二章机构的条件与职责 (3)第三章研究的立项与备案 (6)第四章临床研究过程 (8)第五章研究报告制度 (10)第六章专家委员会职责 (12)第七章监督管理 (15)第八章附则 (18)第一章总则第一条为规范和促进干细胞临床研究,依照《中华人民共和国药品管理法》、《医疗机构管理条例》等法律法规,制定本办法。
第二条本办法适用于在医疗机构开展的干细胞临床研究。
干细胞临床研究指应用人自体或异体来源的干细胞经体外操作后输入(或植入)人体,用于疾病预防或治疗的临床研究。
体外操作包括干细胞在体外的分离、纯化、培养、扩增、诱导分化、冻存及复苏等。
第三条干细胞临床研究必须遵循科学、规范、公开、符合伦理、充分保护受试者权益的原则。
第四条开展干细胞临床研究的医疗机构(以下简称机构)是干细胞制剂和临床研究质量管理的责任主体。
机构应当对干细胞临床研究项目进行立项审查、登记备案和过程监管,并对干细胞制剂制备和临床研究全过程进行质量管理和风险管控。
第五条国家卫生健康委与国家食品药品监管总局负责干细胞临床研究政策制定和宏观管理,组织制定和发布干细胞临床研究相关规定、技术指南和规范,协调督导、检查机构干细胞制剂和临床研究管理体制机制建设和风险管控措施,促进干细胞临床研究健康、有序发展;共同组建干细胞临床研究专家委员会和伦理专家委员会,为干细胞临床研究规范管理提供技术支撑和伦理指导。
省级卫健行政部门与省级食品药品监管部门负责行政区域内干细胞临床研究的日常监督管理,对机构干细胞制剂和临床研究质量以及风险管控情况进行检查,发现问题和存在风险时及时督促机构采取有效处理措施;根据工作需要共同组建干细胞临床研究专家委员会和伦理专家委员会。
第六条机构不得向受试者收取干细胞临床研究相关费用,不得发布或变相发布干细胞临床研究广告。
第二章机构的条件与职责第七条干细胞临床研究机构应当具备以下条件:(一)三级甲等医院,具有与所开展干细胞临床研究相应的诊疗科目。

干细胞临床研究项目备案流程干细胞临床研究项目备案流程一、申请备案1.1 申请备案的资格要求:●主研人员须具有相关学术背景和研究经验;●研究团队要具备必要的设备和场所,以保证研究的进行;●临床试验方案要经过伦理委员会审批。
1.2 申请备案的程序:●申请者向相关部门提交申请备案的申请表和临床试验方案;●申请材料要包括研究背景、目的、方法、预期结果等详细信息;●相关部门对申请材料进行评审,并进行初步审核;●审核通过后,申请者需缴纳备案费用,并提交完整的备案材料。
二、备案审批2.1 材料审核:●相关部门根据法律法规和相关政策,对申请材料进行审核;●审核内容包括实验设计的合理性、伦理道德审查、安全保障等方面;●相关部门可要求申请者提供补充材料或进行补充说明;2.2 专家评审:●相关部门组织专家对备案申请进行评审;●评审内容包括实验方案的技术可行性、科学合理性等;●评审结果将作为备案审批的依据。
2.3 决策:●相关部门根据材料审核和专家评审结果,进行备案审批决策;●决策结果通知申请者,并说明决策理由;●如果备案申请未获得批准,申请者可在一定时间内提出复议。
三、备案登记3.1 登记手续:●备案批准后,申请者需向相关部门办理备案登记手续;●登记手续包括填写相应表格、提交备案材料的副本等;●相关部门核对登记信息,并签发备案证书。
3.2 监督检查:●备案完成后,相关部门将对研究项目进行定期监督检查;●监督检查的内容包括实验进展、合规性等方面;●如有不符合要求的情况,相关部门将采取相应的处罚措施。
附件:1.申请备案表格;3.专家评审标准;4.监督检查记录表。
法律名词及注释:-备案:指将临床试验项目的相关信息备案并获得批准的过程。
-备案费用:指备案申请人需要缴纳的费用。
-伦理委员会:负责审查和监督人体相关试验的机构。
-专家评审:由相关领域的专家对备案申请的科学性、可行性等进行评审。
-备案证书:备案批准后,相关部门向申请者签发的证明备案成功的证书。

附件1干细胞临床试验研究管理办法(试行)(征求意见稿)第一章总则第一条为保证干细胞临床试验研究过程规范,结果科学可靠,保护受试者的权益并保障其安全,根据《中华人民共和国药品管理法》、《医疗机构管理条例》和《药物临床试验质量管理规范》等相关法律法规,制定本办法。
第二条本办法所指干细胞是一类具有不同分化潜能,并在非分化状态下自我更新的细胞。
干细胞临床试验研究,是指在临床前研究基础上,应用人自体或异体来源的干细胞经体外操作后回输(或植入)人体,用于疾病预防和治疗的临床试验研究。
这种体外操作包括干细胞在体外的分离、纯化、培养、扩增、修饰、干细胞(系)的建立、诱导分化、冻存及冻存后的复苏等过程。
用于干细胞治疗的干细胞主要包括成体干细胞、胚胎干细胞以及诱导的多能性干细胞。
成体干细胞包括自体或异体、胎儿或成人不同分化组织,以及发育相伴随的组织(如脐带、羊膜、胎盘等)来源的造血干细胞、间充质干细胞、各种类型的祖细胞或前体细胞等。
第三条干细胞临床试验研究必须具备充分的科学依据,其预防和治疗疾病的预期优于现有的手段,或用于尚无有效干预措施的疾病,优先考虑威胁生命和严重影响生存质量的重大疾病,以及重大医疗卫生需求。
第四条干细胞临床试验研究必须在干细胞临床研究基地进行,干细胞临床试验研究基地由卫生部和国家食品药品监督管理局组织进行遴选和确定。
第五条干细胞临床试验研究基地(法人单位)是干细胞临床试验研究的责任主体。
申报单位对干细胞制剂质量及相关研究活动负责。
第六条干细胞临床试验研究应当按照《药物临床试验质量管理规范》要求,遵守以下原则:(一)符合临床试验研究伦理原则,保护受试者、捐献者生命健康权益;(二)符合技术安全性、有效性原则,即风险最小化;(三)符合干细胞制剂质量要求的原则;(四)认真履行有效知情同意的原则;(五)有益于促进公众健康的原则;(六)干细胞临床试验研究透明化原则;(七)保护个人隐私的原则。
第七条开展干细胞临床试验研究,不得向受试者收取费用,不得市场化运作,不得发布干细胞治疗广告。

干细胞临床研究项目备案流程一、申报备案1.准备材料:根据相关管理部门的要求,准备项目申请书、研究方案、研究团队成员的资质证明、机构批准文件等一系列申报材料。
2.填写备案表格:在相关管理部门的官方网站或指定平台上,按要求填写项目备案表格,并上传准备好的申报材料。
二、审查1.初审:相关管理部门对已提交的备案材料进行初步审查,检查材料的完整性和合规性。
如发现不符合要求的情况,要求补齐材料或进行必要的修改。
2.专家评审:相关管理部门邀请相关领域的专家组成评审团队,对项目备案材料进行评审,包括研究方案的科学性和可行性、研究团队的资质和能力等方面。
3.专家意见反馈:评审团队提交评审意见以及建议,根据评审意见和建议,相关管理部门决定是否通过备案。
若不通过,要求项目申请人进行修改并重新提交。
三、立项1.通过备案:相关管理部门根据专家评审意见和建议,对项目进行审核,并最终决定是否通过备案。
如果通过备案,相关管理部门将下发备案函给项目申请人,确认项目已经获得备案资格。
2.公示和投诉期:相关管理部门将备案项目公示一定时间,接受公众的监督和投诉,保证备案决策的透明公正。
四、执行1.项目推进:备案通过后,项目申请人可以按照备案内容和要求开展科学研究活动,但必须严格遵守相关法律法规和管理规定。
2.监督检查:相关管理部门将对备案项目进行定期或不定期的监督检查,确保项目的合法合规进行。
如发现违规行为,相关管理部门将依法予以处理。
3.结果报告:项目完成后,项目申请人需要向相关管理部门提交项目的最终结果报告和研究成果,并接受相关评估和审核。
总结起来,干细胞临床研究项目备案流程主要包括申报备案、审查、立项和执行四个阶段。
在整个流程中,项目申请人需要准备申报材料并填写备案表格,提交审核,经过初审和专家评审后,最终决定是否通过备案。
通过备案后,项目申请人可以开展研究活动,但必须遵守相关法律法规和管理规定,接受监督检查。
项目完成后,需要提交最终结果报告和研究成果,并接受相关评估。

干细胞临床研究管理办法(试行)第一章总则第一条为规范和促进干细胞临床研究,依照《中华人民共和国药品管理法》、《医疗机构管理条例》等法律法规,制定本办法。
第二条本办法适用于在医疗机构开展的干细胞临床研究.干细胞临床研究指应用人自体或异体来源的干细胞经体外操作后输入(或植入)人体,用于疾病预防或治疗的临床研究。
体外操作包括干细胞在体外的分离、纯化、培养、扩增、诱导分化、冻存及复苏等.第三条干细胞临床研究必须遵循科学、规范、公开、符合伦理、充分保护受试者权益的原则。
第四条开展干细胞临床研究的医疗机构(以下简称机构)是干细胞制剂和临床研究质量管理的责任主体.机构应当对干细胞临床研究项目进行立项审查、登记备案和过程监管,并对干细胞制剂制备和临床研究全过程进行质量管理和风险管控。
第五条国家卫生计生委与国家食品药品监管总局负责干细胞临床研究政策制定和宏观管理,组织制定和发布干细胞临床研究相关规定、技术指南和规范,协调督导、检查机构干细胞制剂和临床研究管理体制机制建设和风险管控措施,促进干细胞临床研究健康、有序发展;共同组建干细胞临床研究专家委员会和伦理专家委员会,为干细胞临床研究规范管理提供技术支撑和伦理指导.省级卫生计生行政部门与省级食品药品监管部门负责行政区域内干细胞临床研究的日常监督管理,对机构干细胞制剂和临床研究质量以及风险管控情况进行检查,发现问题和存在风险时及时督促机构采取有效处理措施;根据工作需要共同组建干细胞临床研究专家委员会和伦理专家委员会.第六条机构不得向受试者收取干细胞临床研究相关费用,不得发布或变相发布干细胞临床研究广告。
第二章机构的条件与职责第七条干细胞临床研究机构应当具备以下条件:(一)三级甲等医院,具有与所开展干细胞临床研究相应的诊疗科目。
(二)依法获得相关专业的药物临床试验机构资格。
(三)具有较强的医疗、教学和科研综合能力,承担干细胞研究领域重大研究项目,且具有来源合法,相对稳定、充分的项目研究经费支持。

医疗机构申报干细胞临床研究项目的流程1.医疗机构首先需要确定要申报的干细胞临床研究项目的具体内容和目的。
Medical institutions need to first determine the specific content and goals of the stem cell clinical research project to be reported.2.接着,医疗机构需要对申报的干细胞临床研究项目进行立项申请。
Next, the medical institution needs to apply for the establishment of the stem cell clinical research project.3.申请需要包括研究项目的背景、意义、目标、方法、预期效果等详细资料。
The application should include detailed information on the background, significance, objectives, methods, expected effects, and other aspects of the research project.4.申请材料需要经过医疗机构内部的审核和评审程序。
The application materials need to go through the internal review and evaluation process of the medical institution.5.通过内部审核和评审后,医疗机构将向相关监管部门提交申报材料。
After the internal review and evaluation, the medical institution will submit the application materials to the relevant regulatory authorities.6.监管部门将对申报材料进行审查,包括科学性、合规性及伦理性等方面。

干细胞临床研究管理办法(试行)第一章总则第一条为规范和促进干细胞临床研究,依照《中华人民共和国药品管理法》、《医疗机构管理条例》等法律法规,制定本办法.第二条本办法适用于在医疗机构开展的干细胞临床研究。
干细胞临床研究指应用人自体或异体来源的干细胞经体外操作后输入(或植入)人体,用于疾病预防或治疗的临床研究。
体外操作包括干细胞在体外的分离、纯化、培养、扩增、诱导分化、冻存及复苏等。
第三条干细胞临床研究必须遵循科学、规范、公开、符合伦理、充分保护受试者权益的原则。
第四条开展干细胞临床研究的医疗机构(以下简称机构)是干细胞制剂和临床研究质量管理的责任主体.机构应当对干细胞临床研究项目进行立项审查、登记备案和过程监管,并对干细胞制剂制备和临床研究全过程进行质量管理和风险管控。
第五条国家卫生计生委与国家食品药品监管总局负责干细胞临床研究政策制定和宏观管理,组织制定和发布干细胞临床研究相关规定、技术指南和规范,协调督导、检查机构干细胞制剂和临床研究管理体制机制建设和风险管控措施,促进干细胞临床研究健康、有序发展;共同组建干细胞临床研究专家委员会和伦理专家委员会,为干细胞临床研究规范管理提供技术支撑和伦理指导。
省级卫生计生行政部门与省级食品药品监管部门负责行政区域内干细胞临床研究的日常监督管理,对机构干细胞制剂和临床研究质量以及风险管控情况进行检查,发现问题和存在风险时及时督促机构采取有效处理措施;根据工作需要共同组建干细胞临床研究专家委员会和伦理专家委员会.第六条机构不得向受试者收取干细胞临床研究相关费用,不得发布或变相发布干细胞临床研究广告.第二章机构的条件与职责第七条干细胞临床研究机构应当具备以下条件:(一)三级甲等医院,具有与所开展干细胞临床研究相应的诊疗科目.(二)依法获得相关专业的药物临床试验机构资格。
(三)具有较强的医疗、教学和科研综合能力,承担干细胞研究领域重大研究项目,且具有来源合法,相对稳定、充分的项目研究经费支持。

干细胞临床研究管理办法(试行)第一章总则第一条为规范和促进干细胞临床研究,依照《中华人民共和国药品管理法》、《医疗机构管理条例》等法律法规,制定本办法。
第二条本办法适用于在医疗机构开展的干细胞临床研究。
干细胞临床研究指应用人自体或异体来源的干细胞经体外操作后输入(或植入)人体,用于疾病预防或治疗的临床研究.体外操作包括干细胞在体外的分离、纯化、培养、扩增、诱导分化、冻存及复苏等.第三条干细胞临床研究必须遵循科学、规范、公开、符合伦理、充分保护受试者权益的原则.第四条开展干细胞临床研究的医疗机构(以下简称机构)是干细胞制剂和临床研究质量管理的责任主体.机构应当对干细胞临床研究项目进行立项审查、登记备案和过程监管,并对干细胞制剂制备和临床研究全过程进行质量管理和风险管控。
第五条国家卫生计生委与国家食品药品监管总局负责干细胞临床研究政策制定和宏观管理,组织制定和发布干细胞临床研究相关规定、技术指南和规范,协调督导、检查机构干细胞制剂和临床研究管理体制机制建设和风险管控措施,促进干细胞临床研究健康、有序发展;共同组建干细胞临床研究专家委员会和伦理专家委员会,为干细胞临床研究规范管理提供技术支撑和伦理指导。
省级卫生计生行政部门与省级食品药品监管部门负责行政区域内干细胞临床研究的日常监督管理,对机构干细胞制剂和临床研究质量以及风险管控情况进行检查,发现问题和存在风险时及时督促机构采取有效处理措施;根据工作需要共同组建干细胞临床研究专家委员会和伦理专家委员会。
第六条机构不得向受试者收取干细胞临床研究相关费用,不得发布或变相发布干细胞临床研究广告。
第二章机构的条件与职责第七条干细胞临床研究机构应当具备以下条件:(一)三级甲等医院,具有与所开展干细胞临床研究相应的诊疗科目.(二)依法获得相关专业的药物临床试验机构资格。
(三)具有较强的医疗、教学和科研综合能力,承担干细胞研究领域重大研究项目,且具有来源合法,相对稳定、充分的项目研究经费支持。
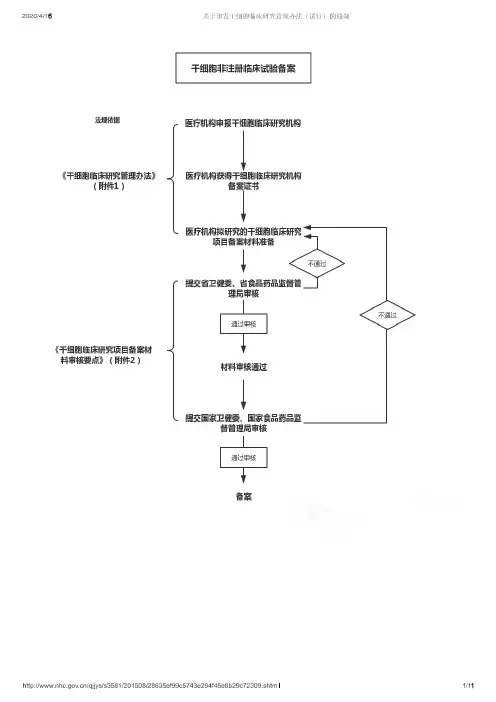

干细胞临床试验备案相关流程法规一、干细胞临床试验备案流程:2.专家评审:申请备案的干细胞临床试验项目将由相关的专家委员会进行评审,对试验的科学性、合理性、伦理性进行评估,并提出修改意见。
3.伦理委员会审查:干细胞临床试验备案申请还需要提交给相关的伦理委员会进行审查,以评估试验的伦理合规性,包括样本采集、试验方案、知情同意等事项。
4.监管部门审批:待专家评审和伦理委员会审查通过后,监管部门会对备案申请进行审批,评估试验的风险、安全性和科学意义等方面,决定是否批准备案。
5.具体操作:备案申请获得批准后,研究机构或企业可以开始组织具体操作,包括样本采集、治疗或观察过程、信息记录和统计分析等。
6.监督和评估:在试验过程中,监管部门将进行监督和评估,确保试验符合法规要求,并能保障患者的权益和安全。
二、干细胞临床试验备案的法规:1.国家药品监督管理局发布的《药物临床试验管理办法》:该办法规定了药物临床试验的各个环节,包括备案、伦理审查、监管要求等,作为干细胞临床试验备案的基本法规之一2.国家食品药品监督管理总局发布的《干细胞(非成体细胞)临床研究管理办法》:该办法对干细胞临床试验的备案、评审、审查和监管等进行了详细规定,以确保试验的合法性和安全性。
3.伦理委员会的相关规定:干细胞临床试验备案申请需要通过伦理委员会的审查,伦理委员会的相关规定对试验的伦理合规性进行了规范,包括试验对象的知情同意、权益保障、数据保密等方面。
以上是干细胞临床试验备案相关的流程和法规的总体概述,具体的流程和法规内容可能因国家和地区的不同而有所区别。
做好备案工作,制定科学的试验方案和严格的监管措施,将有助于保障试验的安全性和可靠性,推动干细胞临床研究的发展。

干细胞临床研究项目备案流程干细胞临床研究项目备案是指将干细胞的临床研究项目计划进行备案登记的过程。
干细胞临床研究备案的目的是确保临床研究方案的合理性、科学性和安全性,保护研究对象和研究人员的安全权益,提高干细胞临床研究的质量和可控性。
下面详细介绍干细胞临床研究项目备案流程。
一、备案申请材料准备1.临床研究单位应提交临床研究项目备案申请书,包括研究项目的基本信息、研究背景和目的、研究方案和方法等;2.提供实施临床研究的人员资质证明,包括医生执业证、药学(临床药学)专业资格证书等;3.提供相关伦理委员会批准文件,包括伦理审查委员会的审批文件和研究计划的伦理评审报告等;二、备案申请提交将备案申请材料提交至国家相关部门,如国家药品监管部门或国家卫生计生委等,根据不同国家的法律法规和规定,备案申请可由相关部门进行审查、审批。
三、备案审查四、备案结果通知备案审查结束后,相关部门将向临床研究单位发出备案结果通知,通知内容包括备案通过与否、备案编号、备案有效期等。
五、备案验收备案通过后,临床研究项目可以进行正式实施,但在实施过程中需要按照备案要求进行监督和管理。
备案机构会对临床研究项目进行定期的或不定期的监督和检查,以确保临床研究的规范进行。
六、备案更新备案通常有一定的有效期限,在有效期届满前,临床研究单位需要向备案机构提交备案更新申请。
备案更新主要是对研究项目的进展情况进行汇报,包括研究进展报告、伦理委员会审批文件更新等。
七、备案取消如果临床研究项目存在重大违规行为或安全风险,备案机构有权决定取消该项目的备案。
备案取消后,临床研究项目将不能继续进行。
总结干细胞临床研究项目备案流程包括备案申请材料准备、备案申请提交、备案审查、备案结果通知、备案验收、备案更新和备案取消等环节。
备案流程的目的是确保干细胞临床研究的科学性、伦理合规性和安全性,保护研究对象和研究人员的权益,提高研究的规范性和质量。
干细胞临床研究项目备案流程干细胞临床研究项目备案流程一、项目基本信息1、项目名称:2、项目负责人:3、所属单位:4、研究目的:5、研究内容:6、研究方法:7、预期成果:二、项目备案申请1、申请材料准备:a:申请表格b:研究方案c:相关承诺书d:研究团队成员名单及简历e:其他必要材料2、申请材料提交:a:提交备案申请材料至相关部门b:等待备案审批三、备案审批流程1、初步审批:a:相关部门初步审核备案申请材料b:如有需要,要求补充材料或做进一步调查2、专家评审:a:邀请相关领域专家进行评审b:评审结果作为备案决策的重要依据3、部门审批:a:相关部门根据评审结果作出备案决策b:完成备案审批手续四、备案结果通知1、通知备案申请人:a:书面通知备案申请人备案结果b:如获批准,告知后续操作事项2、公示:a:对批准的项目进行公示b:公示期间,接受公众意见和建议五、项目执行与监管1、项目执行:a:根据备案结果,启动项目实施b:按照研究方案进行实验和数据收集2、监管与评估:a:相关部门对项目进行监督和评估b:定期报告项目进展六、项目总结与结案1、结案报告:a:完成项目后,编写结案报告b:报告内容包括项目实施过程、结果及对未来工作的建议2、结案审查:a:相关部门对结案报告进行审查b:根据审查结果做出结案决定附件:1、申请表格2、研究方案3、相关承诺书4、研究团队成员名单及简历5、其他材料法律名词及注释:1、干细胞:一种具有自我更新和分化能力的细胞,可以分化成多种不同类型的细胞。
2、临床研究:在人类身上进行的科学研究,旨在评估新药物、治疗方法等的安全性和有效性。
3、备案:根据法律法规规定,对特定项目进行申请、审批和登记的过程。
4、项目负责人:研究项目的主要负责人,负责项目的组织和管理。
附件1干细胞临床试验研究管理办法(试行)(征求意见稿)第一章总则第一条为保证干细胞临床试验研究过程规范,结果科学可靠,保护受试者的权益并保障其安全,根据《中华人民共和国药品管理法》、《医疗机构管理条例》和《药物临床试验质量管理规范》等相关法律法规,制定本办法。
第二条本办法所指干细胞是一类具有不同分化潜能,并在非分化状态下自我更新的细胞。
干细胞临床试验研究,是指在临床前研究基础上,应用人自体或异体来源的干细胞经体外操作后回输(或植入)人体,用于疾病预防和治疗的临床试验研究。
这种体外操作包括干细胞在体外的分离、纯化、培养、扩增、修饰、干细胞(系)的建立、诱导分化、冻存及冻存后的复苏等过程。
用于干细胞治疗的干细胞主要包括成体干细胞、胚胎干细胞以及诱导的多能性干细胞。
成体干细胞包括自体或异体、胎儿或成人不同分化组织,以及发育相伴随的组织(如脐带、羊膜、胎盘等)来源的造血干细胞、间充质干细胞、各种类型的祖细胞或前体细胞等。
第三条干细胞临床试验研究必须具备充分的科学依据,其预防和治疗疾病的预期优于现有的手段,或用于尚无有效干预措施的疾病,优先考虑威胁生命和严重影响生存质量的重大疾病,以及重大医疗卫生需求。
第四条干细胞临床试验研究必须在干细胞临床研究基地进行,干细胞临床试验研究基地由卫生部和国家食品药品监督管理局组织进行遴选和确定。
第五条干细胞临床试验研究基地(法人单位)是干细胞临床试验研究的责任主体。
申报单位对干细胞制剂质量及相关研究活动负责。
第六条干细胞临床试验研究应当按照《药物临床试验质量管理规范》要求,遵守以下原则:(一)符合临床试验研究伦理原则,保护受试者、捐献者生命健康权益;(二)符合技术安全性、有效性原则,即风险最小化;(三)符合干细胞制剂质量要求的原则;(四)认真履行有效知情同意的原则;(五)有益于促进公众健康的原则;(六)干细胞临床试验研究透明化原则;(七)保护个人隐私的原则。
第七条开展干细胞临床试验研究,不得向受试者收取费用,不得市场化运作,不得发布干细胞治疗广告。
临床研究(非干细胞)项目备案操作说明(本说明仅限于临床医学备案系统的操作步骤)一、写在前面的话目前本系统(医学研究登记备案系统;http://114.255.123.14)主要满足医学研究机构的伦理委员会、干细胞项目和临床研究(非干细胞)项目的在线备案工作。
建议医院或其他研究机构,首先委派科技处人员来系统进行注册,注册的账号即为机构管理员账号。
然后,管理员账号创建本机构的子账号(机构内账号),把子账号分配给伦理委员会秘书或项目秘书,伦理委员会秘书或项目秘书用分配给自己的账号登录系统,填写备案信息。
最后,管理员对填写的信息进行审核,通过后,备案信息上报到省或国家卫健委进行再次审核,通过后,备案信息在本网站上进行信息公开,能够被查询和浏览,备案完成。
由伦理委员会秘书或项目秘书注册的机构管理员账号,建议移交给本机构科技处人员,进行统一管理。
每个机构仅限于一个管理员账号,已经有重复注册的机构,与本系统管理员(微信:liguangllin1978)联系,进行调整。
伦理委员会审核周期在5个工作日;项目审核周期在10个工作日。
二、整体流程非机构人员操作:省或国家卫健委对备案信息进行审核三、操作步骤注册:首次登录系统,点击“注册”按钮,进行机构基本信息注册。
注册时填写的用户名即是机构管理员账号,用此账号管理本机构备案相关工作。
★提示1:一个机构仅限于注册一次。
请不要重复注册。
★提示2:如果提示机构名称已经被占用,请与管理员(微信:liguangllin1978)取得联系。
创建机构 子用户 分配账号给项目秘书并登陆系统 填报项目信息 机构管理员审核 省管理员审核 注册 (生成机构管理员账号) 委管理员审核并信息公开机构管理员操作:一般由医院科技处人员负责,管理本院基础信息填写和备案信息审核等工作机构子用户操作:分配给本院项目秘书,负责本伦理委员备案信息填写创建机构子账号:机构管理员登录,选中“用户管理”菜单,点击“新增用户”按钮,创建机构子账号。
机构伦理委员会备案操作说明(本说明仅限于临床医学备案系统的操作步骤)一、前言目前本系统(医学研究登记备案系统;http://114.255.123.14)主要满足医学研究机构的伦理委员会、干细胞项目和临床研究(非干细胞)项目的在线备案工作。
建议医院或其他研究机构,首先委派科技处人员来系统进行注册,注册的账号即为机构管理员账号。
然后,管理员账号创建本机构的子账号(机构内账号),把子账号分配给伦理委员会秘书或项目秘书,伦理委员会秘书或项目秘书用分配给自己的账号登录系统,填写备案信息。
最后,管理员对填写的信息进行审核,通过后,备案信息上报到省或国家卫健委进行再次审核,通过后,备案信息在本网站上进行信息公开,能够被查询和浏览,备案完成。
由伦理委员会秘书或项目秘书注册的机构管理员账号,建议移交给本机构科技处人员,进行统一管理。
每个机构仅限于一个管理员账号,已经有重复注册的机构,与本系统管理员(微信:liguangllin1978)联系,进行调整。
伦理委员会审核周期在5个工作日;项目审核周期在10个工作日。
系统管理员联系方式:李老师(微信:liguangllin1978)二、整体流程非机构人员操作:省或国家卫健委对备案信息进行审核三、操作步骤注册:首次登录系统,点击“注册”按钮,进行机构基本信息注册。
注册时填写的机构名称即是机构管理员账号,用此账号管理本机构备案相关工作。
★提示1:一个机构仅限于注册一次。
请不要重复注册。
★提示2:如果提示机构名称已经被占用,请与管理员(微信:liguangllin1978)取得联系。
机构管理员登录 创建机构子用户 分配账号给伦理委员会秘书 伦理委员会秘书登录 填写伦理委员会信息 机构管理员登录并审核 注册 (生成机构管理员账号) 委管理员审核并信息公开机构管理员操作:一般由医院技术处人员负责,管理本院基础信息填写和备案信息审核等工作机构子用户操作:分配给本院伦理委员会秘书,负责本伦理委员备案信息填写创建机构子用户:机构管理员登录,选中“用户管理”菜单,点击“新增用户”按钮,创建机构子用户,此用户分配给伦理委员会秘书。
《干细胞临床研究管理办法(试行)》2015年关于印发干细胞临床研究管理办法(试行)的通知国卫科教发〔2015〕48号各省、自治区、直辖市卫生计生委、食品药品监管局,新疆生产建设兵团卫生局、食品药品监管局,国家卫生计生委直属有关单位,食品药品监管总局直属有关单位:为规范并促进我国干细胞临床研究,国家卫生计生委与食品药品监管总局共同组织制定了《干细胞临床研究管理办法(试行)》(可从国家卫生计生委、食品药品监管总局网站下载)。
现印发给你们,请遵照执行。
国家卫生计生委食品药品监管总局2015年7月20日干细胞临床研究管理办法(试行)第一章总则第一条为规范和促进干细胞临床研究,依照《中华人民共和国药品管理法》、《医疗机构管理条例》等法律法规,制定本办法。
第二条本办法适用于在医疗机构开展的干细胞临床研究。
干细胞临床研究指应用人自体或异体来源的干细胞经体外操作后输入(或植入)人体,用于疾病预防或治疗的临床研究。
体外操作包括干细胞在体外的分离、纯化、培养、扩增、诱导分化、冻存及复苏等。
第三条干细胞临床研究必须遵循科学、规范、公开、符合伦理、充分保护受试者权益的原则。
第四条开展干细胞临床研究的医疗机构(以下简称机构)是干细胞制剂和临床研究质量管理的责任主体。
机构应当对干细胞临床研究项目进行立项审查、登记备案和过程监管,并对干细胞制剂制备和临床研究全过程进行质量管理和风险管控。
第五条国家卫生计生委与国家食品药品监管总局负责干细胞临床研究政策制定和宏观管理,组织制定和发布干细胞临床研究相关规定、技术指南和规范,协调督导、检查机构干细胞制剂和临床研究管理体制机制建设和风险管控措施,促进干细胞临床研究健康、有序发展;共同组建干细胞临床研究专家委员会和伦理专家委员会,为干细胞临床研究规范管理提供技术支撑和伦理指导。
省级卫生计生行政部门与省级食品药品监管部门负责行政区域内干细胞临床研究的日常监督管理,对机构干细胞制剂和临床研究质量以及风险管控情况进行检查,发现问题和存在风险时及时督促机构采取有效处理措施;根据工作需要共同组建干细胞临床研究专家委员会和伦理专家委员会。