格林-巴利综合征的鉴别诊断
- 格式:doc
- 大小:23.00 KB
- 文档页数:1

格林巴利综合症是一种神经系统退化性疾病,其类型包括亚急性联合变性(Subacute Combined Degeneration,SCD)和亚急性坏死性脊髓病(Subacute Necrotizing Myelopathy,SNM)。
以下是格林巴利综合症在磁共振成像(MRI)中可能的表现:
1. 脊髓萎缩:MRI可以显示患者脊髓的萎缩情况。
脊髓在病变区域呈现明显的变细。
2. 白质病变:格林巴利综合症患者的大脑白质可能存在异常信号。
这些信号改变通常位于脊髓后、脊髓侧索和脑干的各个部位。
3. 脊髓后侧索受累:磁共振成像可能显示脊髓后侧索区域的异常信号,这是格林巴利综合症的典型特征之一。
这种信号改变可能表现为高信号或低信号,取决于病变的阶段和严重程度。
4. 脊髓增粗:在某些情况下,MRI显示脊髓的横截面积增大。
这是由于病变引起的脊髓组织水肿或萎缩周围组织的代偿性增生。
5. 脊髓脱髓鞘:MRI可能显示脊髓部分或完全失去髓鞘覆盖,这意味着神经纤维受到了严重的损害。
需要注意的是,磁共振成像结果可能因患者的病情和病变阶段而有所差异。
因此,对于确诊格林巴利综合症,医生通常会综合病史、临床症状和其他相关检查结果进行综合分析。
如果你或你认识的人有类似的症状,请及时就医咨询专业医生。

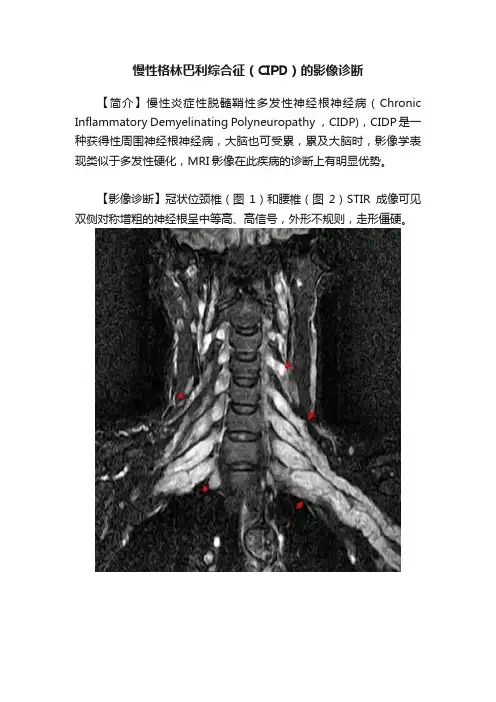
慢性格林巴利综合征(CIPD)的影像诊断
【简介】慢性炎症性脱髓鞘性多发性神经根神经病(Chronic Inflammatory Demyelinating Polyneuropathy ,CIDP),CIDP是一种获得性周围神经根神经病,大脑也可受累,累及大脑时,影像学表现类似于多发性硬化,MRI影像在此疾病的诊断上有明显优势。
【影像诊断】冠状位颈椎(图1)和腰椎(图2)STIR成像可见双侧对称增粗的神经根呈中等高、高信号,外形不规则,走形僵硬。
矢状位 (图 3)、水平位(图 4)MRI FLAIR示侧脑室周围白质信号异常呈小片、斑片状中等高信号,界面不清。
【临床表现】对称性运动症状重于感觉症状;运动障碍,肢体远端重于近端。
CIDP可累及任何年龄的人群,但以老年男性最为常见。
【发病机理】很可能是免疫介导的,多发性。
【诊断要点及治疗】神经根和周围神经增粗;累及大脑时,影像学表现类似于 MS。
主要以免疫疗法为主。
【鉴别诊断】神经根增粗的疾病:淋巴瘤、结节病、神经纤维瘤病 1型;MS及其他传染病和炎症性疾病。

吉兰-巴雷综合征_Ji Lan - Ba Lei Zong HeZheng一概述吉兰-巴雷综合征(GBS)又称格林巴利综合征,是以四周神经和神经根的脱髓鞘病变及小血管炎性细胞浸润为病理特点的自身免疫性四周神经病,经典型的GBS称为急性炎症性脱髓鞘性多发性神经病(AIDP),临床表现为急性对称性弛缓性肢体瘫痪。
二病因病因尚未充分阐明。
约70%的GBS患者发病前8周内有前驱感染史,通常见于病前1~2周,少数患者有手术史或疫苗接种史。
空肠弯曲菌(CJ)感染最常见,约占30%,腹泻为前驱症状的GBS患者CJ感染率高达85%,常与急性运动轴索型神经病(AMAN)有关。
CJ感染埋伏期为24~72小时,腹泻初为水样便,以后消失脓血便,高峰期24~48小时,1周左右恢复。
患者常在腹泻停止后发病,约50%的CJ肠炎患者腹泻2周后就不能分别出细菌。
巨细胞病毒(CMV)感染与严峻感觉型GBS有关,多数患者较年轻,发病症状严峻,常消失呼吸肌麻痹,脑神经及感觉受累多见,与GM2抗体关系亲密,抗CMV的IgM抗体和冷凝集抗体滴度增高,观看发觉CMV感染的GBS有群发觉象。
发生于传染性单核细胞增多症发病前后的GBS常伴EB病毒(EBV)感染。
肺炎支原体(MP)感染的GBS患者年龄较轻。
乙型肝炎病毒(HBV)感染患者GBS发生率显著高于非HBV感染组。
另外亦有人类免疫缺陷病毒(HIV)及Lyme病的报道。
三临床表现多数患者起病前1~4周可有胃肠道或呼吸道感染症状或疫苗接种史。
急性或亚急性起病;首发症状为肌无力,多于数日至2周进展至高峰,常见类型为上升性麻痹,首先消失对称性两腿无力,典型者在数小时或短短数天后无力从下肢上升至躯干、上肢或累及脑神经。
下肢较上肢更易受累,肢体呈弛缓性瘫痪,腱反射降低或消逝,通常在发病早期数天内患者即消失腱反射消逝,部分患者轻度肌萎缩,长期卧床可消失废用性肌萎缩。
除极少数复发病例,全部类型AIDP患者均呈单相病程,多在发病4周时肌无力开头恢复。


格林:巴利综合征的鉴别诊断格林-巴利综合征(GBS)是一种急性的、自身免疫性的神经系统疾病,主要表现为对周围神经及其周围结构的炎症反应,导致肌无力和感觉障碍等症状。
然而,有一些其他疾病也可能表现出类似的症状,使得鉴别诊断变得至关重要。
病史首先,对于可能患有GBS的患者,详细了解其病史是至关重要的。
重点关注患者是否有感染史,特别是前些日子是否有感冒、腹泻或其他病毒感染的表现。
此外,还需要了解患者是否有接种过疫苗,是否有食物中毒的经历等。
临床症状患有GBS的患者常常出现对称性的四肢无力、麻木、疼痛、肌肉酸痛等症状。
在严重的情况下,患者可能会出现呼吸困难等并发症。
然而,这些症状也可能出现在其他神经系统疾病中,如重症肌无力、急性炎性脱髓鞘性多发性神经病等。
实验室检查进行一系列实验室检查也是进行鉴别诊断的重要方法之一。
包括血液检查、脑脊液检查等。
在GBS中,脑脊液检查中的蛋白含量常常升高,而细胞数并不明显增高。
有时候,还会进行肌电图检查,查看神经传导情况以帮助鉴别。
神经肌肉电生理学通过对神经肌肉电生理学的检查,可以确定病变是在周围神经部位还是在肌肉部位发生了变化。
这能代表性地帮助我们进行鉴别诊断,从而更好地确定是GBS还是其他神经系统疾病。
影像学检查有时候,CT或MRI等影像学检查也能在鉴别诊断中发挥重要作用。
通过影像学检查,可以发现患者的神经系统是否出现异常,有无受累部位等信息。
诊断标准最后,根据国际GBS诊断标准,将上述各项信息进行综合分析,再结合患者的临床表现,最后做出正确的诊断。
综上所述,格林-巴利综合征是一种临床表现多样的疾病,需要进行全面的鉴别诊断才能准确确定其诊断。
只有通过仔细的病史询问、详细的临床症状观察、实验室检查、神经肌肉电生理学和影像学检查,且结合GBS的诊断标准,我们才能准确诊断患者是否患有格林-巴利综合征。

-巴利综合征)诊治指南中国吉兰-巴雷综合征(格林(中华神经科杂志2010年8月第43卷第8期 Chin J Neurol, August 2010, Vol43,No.8)中华医学会神经病学分会神经肌肉病学组中华医学会神经病学分会肌电图及临床神经电生理学组中华医学会神经病学分会神经免疫学组-吉兰-巴雷综合征(Guillain-Barre syndrome, GBS)是一类免疫介导的急性炎性周围神经病。
临床特征为急性起病,临床症状多在2周左右达到高峰,表现为多发神经根及周围神经损害,常有脑脊液蛋白-细胞分离现象,多呈单时相自限性病程,静脉注射免疫球蛋白(intravenous immunoglobulin,IVIg)和血浆交换(PE)治疗有效。
该病还包括急性炎性脱髓鞘性多发神经根神经病(acute inflammatory demyelinating polyneuropathies,AIDP)、急性运动轴索性神经病(acute motor axonal neuropathy,AMAN)、急性运动感觉轴索性神经病(acute motor-sensory axonal neuropathy,AMSAN)、Miller Fisher综合征(Miller Fisher syndrome,MFS)、急性泛自主神经病(acute sensory neuropathy,ASN)等亚型。
一、诊断(一)AIDPAIDP是GBS中最常见的类型,也称经典型GBS,主要病变为多发神经根和周围神经节段性脱髓鞘。
1)任何年龄、任何季节均可发病。
(21、临床特点)前驱事件:(上呼吸道[1-3][3-4]:常见有腹泻和感染,包括空肠弯曲菌、巨细胞病毒、肺炎支原体或其他病原菌感染,疫苗接种,手术,器官移植等。
(3)急性起病,病情多在2周左右达到高峰。
(4)弛缓性肢体肌肉无力是AIDP的核心症状。
多数患者肌无力从双下肢向上肢发展,数日内逐渐加重,少数患者病初呈非对称性;肌张力可正常或降低,腱反射减低或消失,而且经常在肌力仍保留较好的情况下,腱反射已明显减低或消失,无病理反射。


格林-巴利综合征格林-巴利综合征(GBS)是急性弛缓性瘫痪常见的病因,以四肢对称性无力、反射减退或消失为特征,病情常在4周内达到高峰(图1)。
感觉症状如感觉减退或麻木,常起始于远端肢体,呈对称性表现。
GBS最常见的亚型为急性炎性脱髓鞘多神经根神经病变(AIDP)和急性运动性轴索神经病(AMAN);其次为Miller Fisher 综合征(MFS)。
总体来说,GBS的临床病程、严重程度和结局具有高度各异性。
Nature Reviews Neurology 杂志发表综述总结了GBS的免疫病理机制和临床特征、描述了GBS现行的诊断标准、讨论脑脊液检查和神经传导检查的诊断价值、治疗的选择和预后(包括GBS患者新型的预测模型)。
图 1.GBS的病程进展(蓝色)。
多数 GBS患者在肢体无力出现之前报告有前驱感染(红色);常可测及抗神经节苷脂抗体(绿色),但其水平随时间而降低;渐进性肢体无力在4周内达到高峰(常在2周内),恢复期可持续数周、数月甚至数年。
流行病学GBS是一种罕见病,发病率为 0.81-1.89 /10万人 /年,男性多见于女性(比率 3:2)。
GBS的儿童发病率(0.34-1.34/10万人 /年)低于成人,发病率随着年龄增加而增高。
此外,由于不同地区个体和人群的基因多样性差异,基因易感性也各异。
上述差异不仅与特殊类型GBS亚型相关,而且与疾病的病程和严重程度有关;需要进行大量人群遗传学研究来探讨。
发病机制GBS为感染后病变,2/3的患者在GBS发病前有呼吸系统或胃肠道感染症状。
近半数GBS患者可发现存有某种特异性前驱感染,而1/3的感染由空肠弯曲杆菌引起。
其它可引起GBS相关前驱感染的病原体有:巨细胞病毒、EB病毒、肺炎支原体、流感嗜血杆菌和A型流感病毒。
GBS发生机制的重要环节为空肠弯曲杆菌感染后,产生抗体与特异性神经节苷脂交互反应,而这一抗体在非复杂性空肠弯曲杆菌性胃肠炎时并不产生。
但交互反应性抗体只在易感个体中产生。

格林巴利综合症的诊断方法格林巴利综合症有一个标准的诊断方法,格林巴利综合症是一种很少见的疾病,在诊断格林巴利综合症的时候要注意不要过于疲劳,以下就是神经内科治疗专家介绍的格林巴利综合症的诊断方法。
1.格林巴利综合症的电生理检查:病后可出现神经传导速度明显减慢,F波反映近端神经干传导减慢。
2.格林巴利综合症的起病迅速,病情呈进行性加重,常在数天至1-2周达高峰,到4周停止发展,稳定进入恢复期。
3.格林巴利综合症病前1-6周约半数有呼吸道、水痘、带状疱疹、肠道感染、不明原因发热、受凉、支原体、疟疾、腮腺炎、淋雨、疲劳、创伤、手术等。
4.感觉障碍主诉较多,客观检查相对较轻,可呈手套、袜子样感觉异常或无明显感觉障碍,少数有感觉过敏,神经干压痛。
5.格林巴利综合症病后2-4周进入恢复期,也可迟延至数月才开始恢复。
6.格林巴利综合症的脑脊液检查:WBL<10×106/L,1-2周,蛋白可升高,呈蛋白-细胞分离(如细胞超过10×106/L,以多核为主,则需排除其它疾病),细胞学分类以淋巴单核细胞为主,也可出现大量吞噬细胞。
7.格林巴利综合症的可合并植物神经功能障碍,如低血压、血管运动障碍、心动过速、高血压、出汗多,可有一时性排尿困难。
8.颅神经以迷走、舌咽、舌下神经受累多见,其他颅神经也可受损,但视、听神经几乎不受累。
9.格林巴利综合症在发病时,腱反射减弱,甚至消失,尤其是远端常以消失为主。
10.进行性肢体力弱,基本对称,少数也可不对称。
轻则下肢无力,重则四肢瘫,包括球麻痹、躯体瘫痪、面肌以至眼外肌麻痹,最严重的是呼吸肌麻痹。
以上就是格林巴利综合症的诊断方法,神经内科治疗专家提示:格林巴利综合症任何年龄和男女均可得病,但以男性青壮年为多见。
患者在治疗时要注意听从医生的安排,按时吃药,在生活中可以适当的锻炼身体。

格林-巴利综合征(Guillian-Barre Syndrome)格林-巴利综合征(Guillian-Barre Syndrome)是常见的脊神经和周围神经的脱髓鞘疾病。
1916年由Guillian和Barre两位学者报告而得名。
又称急性特发性多神经炎或对称性多神经根炎。
临床上表现为进行性上升性对称性麻痹、四肢软瘫,以及不同程度的感觉障碍。
病人成急性或亚急性临床经过,多数可完全恢复,少数严重者可引起致死性呼吸麻痹和双侧面瘫。
脑脊液检查,出现典型的蛋白质增加而细胞数正常,又称蛋白细胞分离现象。
病因多数患者发病前有诸如巨细胞病毒、EB病毒或支原体感染,但少数病例的病因不明。
Guillian-Barre综合征(Trichrome染色):髓鞘染成红色,胶原纤维染成青色。
可见髓鞘缺失、崩解本病性质尚不清楚,可能与免疫损伤有关。
以患者血清注射于动物神经可产生静脉周围脱髓鞘病变。
此外,患者神经组织中有C3b及免疫球蛋白C主要是(IgG或IgM)存在。
以上事实提示,本病可能是与体液免疫有关。
但至今尚未能从患者血液中提出髓鞘蛋白的抗体。
病理变化病变累及运动和感觉神经根、后根神经节及周围神经干。
以近端,尤其是神经根和神经丛改变明显。
也可累及颅神经。
主要表现为:①神经节和神经内膜水肿及炎细胞浸润,以淋巴细胞,巨噬细胞为主;②节段性脱髓鞘,崩解,髓鞘被巨噬细胞吞噬;③在严重病例,轴索可发生肿胀和断裂,严重时,相关肌群可发生去神经性萎缩。
在反复发作的病例中,阶段性脱髓鞘和受累神经纤维的修复过程反复进行,病变处神经髓鞘细胞突起与胶原纤维作同心圆状层层包绕,成为洋葱球形成。
格林巴利综合症格林巴利综合症(Guillain-Barre Snydrome,GBS)是常见病,多发病。
它指一种急性起病,一组神经系统自身免疫性疾病。
以神经根、外周神经损害为主,伴有脑脊液中蛋白-细胞分离为特征的综合征。
又称格林巴利综合征。
任何年龄和男女均可得病,但以男性青壮年为多见。
根据起病形式和病程,GBS又可分为急性型、慢性复发型和慢性进行型。
急性格林巴利综合征又名急性感染性多发性神经根神经炎或急性感染性脱髓鞘性多发性神经根神经病(AIDP)。
约半数以上病人在发病前数日到数周内常有感染史,如喉痛、鼻塞、发热等上呼吸道感染以及腹泻、呕吐等消化道症状,另外还可有带状疱疹、流感、水痘、腮腺炎、和病毒性肝炎等。
多起病急,症状逐渐加重,在1-2周内达到高峰。
80%以上病人首先出现双下肢无力,继之瘫痪逐渐上升加重。
严重者出现四肢瘫痪、呼吸麻痹而危及生命。
多数在2~4周开始恢复,程度和快慢各病人差异较大。
约1/3病人可遗留有后遗症状。
如双下肢或/和双上肢无力或肌肉萎缩、肌肉酸痛,足下垂。
患肢有主观感觉异常,如麻木、蚁走感、针刺感和烧灼感,检查可见四肢远端"手套-短袜"型感觉减退或缺失。
部分病人遗留有面瘫,或吞咽困难、构音障碍、呛咳和咳痰不能。
一些病人植物神经功能障碍可见手足少汗或多汗,肢端皮肤干燥,或有大小便潴留或失禁。
慢性格林巴利综合征又名慢性感染性脱髓鞘性多发性神经根神经病(CIDP)。
与AIDP相似而又有所不同。
CIDP病程缓慢易复发,症状以肌无力和感觉障碍为主。
肌无力症状常是对称性的,主要表现肩、上臂和大腿无力,也可合并前臂、小腿、手和足的无力,肢体无力常较躯干无力更为常见。
下肢无力常表现为行走蹒跚,易踩空,不能持久站立,上下楼梯费力和起坐困难。
上肢无力则表现应用钥匙开锁、握笔、解钮扣、梳头有困难。
肌肉大多有萎缩。
有相当一部分患者临床表现为急进性病情发展恶化,自四肢远端肌肉萎缩无力进行性向近端发展,甚至累及胸背部、颈部肌群,造成全身肌肉萎缩;更有甚者,迅速导致呼吸肌萎缩,临床表现为呼吸困难,病人因呼吸衰竭、心力衰竭而危及生命。
格林-巴利综合征的鉴别诊断作者:王殿华来源:《中国社区医师》2010年第38期脊髓灰质炎脊髓灰质炎是由脊髓灰质炎病毒引起的急性传染病。
临床特点为发热、咽痛、肢体疼痛,少数病例出现肢体弛缓性瘫痪。
因本病多发于小儿,故称小儿麻痹症。
潜伏期一般为7~14天,偶尔可较长。
发病多有发热,剧烈头痛,颈背僵硬,深部肌肉疼痛,有时有感觉过敏和感觉异常,在急性期出现尿潴留和肌肉痉挛深腱反射消失,可不再进一步进展,但也可能出现深腱反射消失,不对称性肌群无力或瘫痪,这主要取决于脊髓或延髓损害的部位。
呼吸衰弱可能由于脊髓受累使呼吸肌麻痹,也可能是由于呼吸中枢本身受病毒损伤所致。
吞咽困难、鼻反流、发声时带鼻音是延髓受侵犯的早期体征。
脑病体征偶尔比较突出。
脑脊液糖正常,蛋白轻度升高,细胞计数10~300个/μl(淋巴细胞占优势)。
外周血白细胞计数正常或轻度升高。
脊髓灰质炎多为单侧肢体发病,呈节段性分布,肌肉萎缩严重,多留有后遗症。
卟啉病伴多发性神经病卟啉病系由先天性卟啉代谢紊乱,卟啉前体或叶啉在体内聚积所致,常有遗传因素。
起病可急可缓,呈间隙性发作,临床表现有腹痛、神经精神症状、光感性皮肤损害等。
神经系统的症状多种多样,如四肢神经痛、痛觉减退或麻木,痛觉消失的较少见。
可有单肢肌无力直至四肢松弛性瘫痪,在瘫痪出现前或同时可有肌肉剧痛,特别是小腿肌。
腱反射常常减低或消失。
腹部、肋间或膈肌无力可导致呼吸麻痹而危及生命。
还可出现视神经萎缩、眼肌麻痹、面神经瘫痪、吞咽困难和声带麻痹等症状。
轻者数周恢复,不留后遗症。
腹痛是最主要和突出的症状,发作性绞痛有时虽极轻,但大多较严重,甚至难以忍受。
疼痛部位可以是局限的,也可波及整个腹部,或放射至背部或腰部,可伴有恶心、呕吐,常有顽固性便秘,检查时,腹部大多没有明显压痛,除略有胀气外,很少有阳性发现。
实验室检查偶有蛋白及细胞数略增高,尿中卟胆原阳性,尿经日光照射呈紫红色,电生理检查神经传导速度减慢,可见广泛慢波。
格林-巴利综合征诊断治疗指南定义:格林-巴利综合征(Guillain-Barré syndrome, GBS)系一类急性免疫介导的炎性周围神经病,其临床特征为发病前常有前驱感染史,呈急性或亚急性起病;主要累及周围神经,常有脑脊液蛋白细胞分离;临床症状多在2-4周内达到高峰,呈单时相自限性病程;IVIg和血浆交换治疗有效。
疾病本质上是一种针对周围神经的自身免疫性炎性损伤和修复过程,病理主要为脱髓鞘,但也可有神经轴索的损害,以运动神经受累为主,少数伴有或以感觉神经或植物神经受累为主。
以运动受累为主的GBS有急性炎性脱髓鞘性多发神经病(acute inflammatory demyelinating polyneuropathies,AIDP)、急性运动轴索性神经病(acute motor axonal neuropathy,AMAN)和急性运动感觉轴索性神经病((acute motor-sensory axonal neuropathy,AMSAN);以非运动受累为主的GBS有Fisher 综合征((Miller Fisher syndrome,MFS)、急性全植物神经功能不全(Acute panautonomic neuropathy)和急性感觉神经病(acute sensory neuropathy,ASN)。
一、GBS的诊断(一)AIDP:其是GBS中最常见的类型,也称经典型GBS,疾病的本质是免疫介导性周围神经神经损伤,以比较广泛的神经根和周围神经髓鞘破坏和修复为主。
1.临床特点(1)任何年龄、任何季节均有发病。
(2)前驱事件:常见有上呼吸道感染和腹泻,尤其空肠弯曲菌和巨细胞病毒、肺炎支原体感染;其他还有EB病毒、HIV、A型肝炎病毒感染;疫苗接种:破伤风、流感、可能脊灰糖丸,狂犬病;分娩、手术、移植等。
(3)急性起病,病情多在2周内达到高峰,绝大多数在4周内达到高峰。
(4)最常见的首发症状是双下肢无力,常伴有下背部和下肢疼痛或酸痛,部分患者伴有四肢远端麻木。
吉兰巴雷鉴别诊断
吉兰巴雷即格林-巴利综合征,其鉴别诊断如下:
1.脊髓灰质炎。
起病时多有发热,肌肉瘫痪多呈节段性,且不对称,无感觉障碍,脑脊液白细胞计数常增多。
2.急性脊髓炎。
虽然急性期也呈弛缓性瘫痪,但常有锥体束征及横贯性感觉障碍,且括约肌功能障碍较明显。
脑脊液蛋白和细胞均有轻度增高或正常。
3.周期性瘫痪(周期性麻痹)。
发病急,可呈四肢对称性弛缓性瘫痪,少数病例也可有呼吸肌麻痹,但常有血清钾含量降低及低钾心电图改变,病程短,补钾后可迅速恢复,多在数小时至3-4天自愈。
此外,还需要与铅、砷所致的急性中毒性多发性周围神经病及癌性多发周围神经病相鉴别。
如有不适,请务必咨询医生。
格林-巴利综合征的鉴别诊断
本病需与以下疾病鉴别
1.脊髓灰质炎:发热数日后, 体温未完全恢复正常时出现瘫痪,常累及一侧下肢,无感觉障碍和脑神经受累。
病后3周可见CSF细胞蛋白分离, 注意鉴别。
2.低血钾性麻痹:GBS多有病前感染史和自身免疫反应,低血钾型周期性瘫痪则有低血钾、甲亢病史。
前者急性或亚急性起病, 进展不超过4周,四肢瘫常自双下肢开始,近端较明显,后者起病快(数小时~1天),恢复快(2~3天,) 四肢弛缓性瘫。
GBS可有呼吸肌麻痹、脑神经受损、感觉障碍(末梢型)及疼痛,低血钾型周期性瘫痪无。
GBS脑脊液蛋白细胞分离,电生理检查早期F波或H反射延迟,运动NCV减慢,低血钾型周期性瘫痪正常,电生理检查EMG电位幅度降低,电刺激可无反应。
GBS血钾正常,低血钾型周期性瘫痪血钾低, 补钾有效。
3.功能性瘫痪:根据神经体征不固定、腱反射活跃和精神诱因等鉴别。