第 31 讲5.5.3 影响晶态聚合物熔点的因素
- 格式:doc
- 大小:311.50 KB
- 文档页数:8

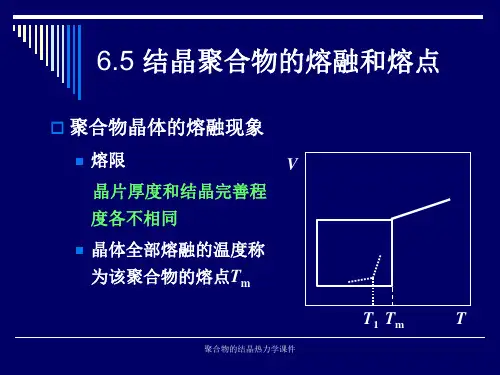
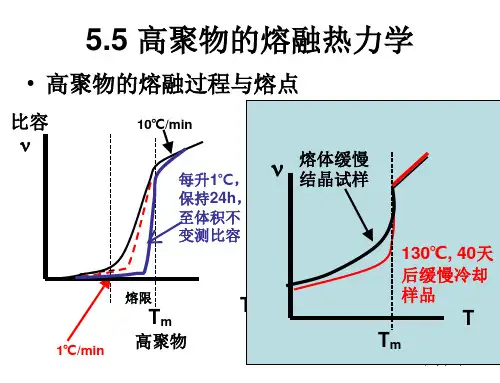
第五节聚合物的结晶热力学一、结晶聚合物的熔融特点结晶聚合物的熔融过程与小分子晶体的异同:相同点:都是一个相转变的过程。
不同点:小分子晶体在熔融过程,体系的热力学函数随温度的变化范围很窄,一般只有℃左右,可名符其实地称之为熔点。
结晶聚合物的熔融过程,呈现一个较宽的熔融温度范围,即存在一个“熔限”。
一般将其最后完全熔融时的温度称为熔点。
二、分子结构对熔点的影响聚合物的熔融过程,从热力学上来说,它是一个平衡过程,因而可用以下的热力学函数关系来描述:在平衡时,,则有凡是分子结构有利于增加分子间或链段间的相互作用力的,则在熔融过程中增加,而使熔点升高。
增加高分子链内旋转的阻力,使高分子链比较僵硬,则在熔融过程中构象变化较小,即较小,也使熔点升高。
(一)分子间作用力通过在主链或在侧链上引入极性基团或形成氢键,则可使增大,熔点提高。
例如,主链基团可以是酰胺。
酰亚胺。
氨基甲酸酯。
脲,这些基团都易在分子间形成氢键,从而使分子间的作用力大幅度增加,熔点明显提高。
分子链取代基的极性也对分子间的作用力有显著影响。
例如,在聚乙烯(℃)分子链上取代了(等规聚丙烯,℃)、(聚氯乙烯,=℃)和(聚丙烯晴,℃),随取代基的极性增加,熔点呈递升的趋势。
(二)分子链的刚性增加分子链的刚性,可以使分子链的构象在熔融前后变化较小,即变化较小,故使熔点提高。
一般在主链上引入环状结构,共轭双键或在侧链上引入庞大的刚性取代基均能达到提高熔点的追求。
(三)分子链的对称性和规整性具有分子链对称性和规整性的聚合物,在熔融过程所发生的变化相对地较小,故具有较高的熔点。
例如,聚对苯二甲酸乙二酯的为℃,而聚间苯二甲酸乙二酯的仅为℃。
聚对苯二甲酰对苯二胺()的为℃,而聚间苯二甲酰间苯二胺的仅为℃。
通常反式聚合物比相应的顺式聚合物的熔点高一些,如反式聚异戊二烯(杜仲胶)为℃,而顺式聚异戊二烯的为℃。
等规聚丙烯的分子链在晶格中呈螺旋状构象,在熔融状态时仍能保持这种构象,因而熔融熵较小,故熔点较高。


东华大学《高分子物理》各章选择判断题第一章高分子链的结构二、多项选择题:1.氯乙烯聚合时存在头―尾、头―头或尾―尾键接方式,它们被称为:(a)旋光异构体(b)顺序异构体(c)几何异构体(d)无规立构体2.1,4―丁二烯聚合可以形成顺式和反式两种构型,它们被称为:(a)光学异构体(b)几何异构体(c)异构体(d)无规立体异构体3下列哪些因素会增加聚合物的柔韧性:(a)结晶(b)交联(c)主链上引入孤立双键(d)形成分子间氢键4.下列哪个物理量不能描述聚合物分子链的柔性:(a)极限特征比(b)均方端距(c)段长(d)熔体指数5.5聚合物中旋转阻碍度增加,其均方端距:(a)增加(b)减小(c)不变(d)不能确定6.如果不考虑键合顺序,线性聚异戊二烯的异构体数量为:(a)6(b)7(c)8(d)97.比较聚丙烯(pp)、聚乙烯(pe)、聚丙烯腈(pan)和聚氯乙烯(pvc)柔性的大小,正确的顺序是:(a) pe>pp>pan>pvc(b)pe>pp>pvc>pan(c)pp>pe>pvc>pan(d)pp>pe>pan>pvc8。
对于相同的聚合物样品,以下哪一个计算值最大:(a)自由结合链的均方末端距(b)自由旋转链的均方末端距(c)等效自由结合链的均方末端距(d)一样大9.对于聚合度为1000、键长为0.154nm的PE,其自由结合链的均方端距为:(a)23.7nm2(b)47.4nm2(c)71.1nm2(d)94.8nm210.如果PE的聚合度增加10倍,则其自由结合链的均方端距离扩大:(a)10倍(b)20倍(c)50倍(d)100倍11.如果无PE键合链的均方根末端距离扩大10倍,则聚合度需要扩大:(a)10倍(b)100倍(c)50倍(d)20倍三、判断题:1.与其他物质一样,聚合物以固态、液态和气态存在。
2.无规线圈是线性聚合物在溶液和熔体中的主要形式。

熔点影响因素熔点是指物质从固态向液态转变时所需的温度,这个过程是相变过程中的一个重要特征。
熔点是物质的物理性质之一,不同物质的熔点也不同。
熔点影响因素复杂,包括以下几个方面:1.化学元素和化学结构:不同的化学元素和化学结构会影响物质的分子间相互作用力,从而影响分子之间的结合能和相对稳定性,进而影响物质的熔点。
例如,由于碳原子之间的键结构不同,金刚石和石墨熔点差别很大,分别为3820℃和3652℃。
2.构成物质的原子量和原子半径:原子量和原子半径的大小将影响原子之间的相互作用力大小。
原子间的离子键结构和共价键结构的性质不同,从而影响物质的熔点。
例如,NaCl的熔点比氢氧化钠高,是由于NaCl的离子键结构比氢氧化钠的共价键结构更稳定。
3.物质的晶体结构:晶体结构对熔点的影响十分显著。
晶体结构的密排程度和组成原子的排列方式都会影响固体的熔点。
例如,钻石是一种具有紧密堆积的晶体结构,相应的熔点也比较高。
4.外界环境:外界环境包括气压、湿度、温度、光照等因素。
当温度升高时,常温下为固态的物质会转化成液态,从而熔化。
环境因素的变化可能使得物质的熔点发生变化。
例如,水的熔点在常温下是0℃,而在高压下则可升高到约200℃。
5.杂质和晶体缺陷:杂质和晶体缺陷的存在可能影响晶体的结构和化学反应,因此也会影响物质的熔点。
例如,纯净的水可在0℃以下冰冻,但是加入了盐之后,水的冰点降低,需更低温才能冰冻。
总体来讲,物质的熔点是由多个因素共同作用的结果。
在工业生产和科学研究中,这些因素所带来的影响都需要得到考虑。
在研究物质的相变规律时,我们需要综合考虑这些因素的作用,深入探究物质熔点的本质、规律和应用。

一、结晶聚合物的熔融特点结晶聚合物的熔融过程与小分子晶体的异同:相同点:都是一个相转变的过程;不同点:小分子晶体在熔融过程,体系的热力学函数随温度的变化范围很窄,一般只有0.2 C左右,可名符其实地称之为熔点。
结晶聚合物的熔融过程,呈现一个较宽的熔融温度范围,即存在一个熔限” 一般将其最后完全熔融时的温度称为熔点T m。
二、分子结构对熔点的影响聚合物的熔融过程,从热力学上来说,它是一个平衡过程,因而可用以下的热力学函数关系来描述:_LR_在平衡时,AF=0凡是分子结构有利于增加分子间或链段间的相互作用力的,则在熔融过程中—「增加,而使熔点升高;增加高分子链内旋转的阻力,使高分子链比较僵硬,则在熔融过程中构象变化较小,即较小,也使熔点升高。
(一)分子间作用力通过在主链或在侧链上引入极性基团或形成氢键,则可使—「增大,熔点提高。
例如,主链基团可以是酰胺-CONH-酰亚胺-CONCQ-氨基甲酸酯-NHCOQ- 脲-NH-CO-NH-这些基团都易在分子间形成氢键,从而使分子间的作用力大幅度增加,熔点明显提高。
分子链取代基的极性也对分子间的作用力有显著影响。
例如,在聚乙烯(T m=138.7C)分子链上取代了-CH(等规聚丙烯,T=176C )、-Cl(聚氯乙烯,T m= 212C)和-CN(聚丙烯晴,6=3170),随取代基的极性增加,熔点呈递升的趋势。
(二)分子链的刚性增加分子链的刚性,可以使分子链的构象在熔融前后变化较小,即一「变化较小,故使熔点提高。
一般在主链上引入环状结构,共轭双键或在侧链上引入庞大的刚性取代基均能达到提高熔点的目的。
(三)分子链的对称性和规整性具有分子链对称性和规整性的聚合物,在熔融过程所发生的变化相对地较小,故具有较高的熔点。
例如,聚对苯二甲酸乙二酯的T m为2670,而聚间苯二甲酸乙二酯的T m 仅为2400;聚对苯二甲酰对苯二胺(Kevlar)的T m为5000,而聚间苯二甲酰间苯二胺的T m 仅为4300。

熔融状态温度的影响因素
熔融状态温度是指物质从固态转变为液态所需的温度。
影响熔融状态温度的因素有很多,包括但不限于以下几点:
1. 分子或原子间的相互作用力,分子或原子间的相互作用力越强,需要克服的相互作用力就越大,因此熔融温度就越高。
例如,离子晶体通常具有较高的熔点,因为其中的正负离子之间的电荷作用力很强。
2. 分子或原子的大小和形状,分子或原子的大小和形状也会影响熔融温度。
通常来说,分子或原子越大,其熔点也会越高,因为需要克服的分子间相互作用力更大。
此外,分子的形状也会影响其熔点,比如分子之间的空间构型对相互作用力的影响。
3. 外界压力,压力对熔融温度也有影响。
一般情况下,增加压力会使熔融温度升高,减小压力则会使熔融温度降低。
这是因为增加压力会使分子或原子更加紧密地排列,从而增加相互作用力。
4. 杂质,杂质的存在通常会降低物质的熔点。
这是因为杂质会干扰晶体的结构,使得分子或原子难以按照规律排列,从而降低了
熔化所需的能量。
5. 结晶度,结晶度是指物质分子或原子排列的有序程度。
结晶度越高,熔点通常越高,因为有序排列的分子或原子间的相互作用力更强。
总的来说,熔融状态温度受到多种因素的影响,这些因素相互作用,共同决定了物质的熔点。
对于不同的物质来说,其熔点受影响的因素可能会有所不同。

影响熔点的因素作者:洪安生教学参考资料来源:《热现象》点击数:4523 更新时间:2004-11-22熔点,实质上是该物质固、液两相可以共存并处于平衡的温度,以冰熔化成水为例,在一个大气压下冰的熔点是0℃,而温度为0℃时,冰和水可以共存,如果与外界没有热交换,冰和水共存的状态可以长期保持稳定.物质的熔点并不是固定不变的,有两个因素对熔点影响很大.(1)压强。
平时所说的物质的熔点,通常是指一个大气压时的情况;如果压强变化,熔点也要发生变化。
熔点随压强的变化有两种不同的情况.对于大多数物质,熔化过程是体积变大的过程,当压强增大时,这些物质的熔点要升高;对于像水这样的物质,与大多数物质不同,冰熔化成水的过程体积要缩小(金属铋、锑等也是如此),当压强增大时冰的熔点要降低。
如下两图中OL称为固液两相平衡曲线,又称为熔化曲线.该曲线的左方表示固相稳定存在的区域,右方一定的区域是液相稳定存在的区域,而线上的任一点,都代表固液两相平衡共存的状态。
OL线表示了该物质的熔点随压强变化的规律。
两图中OL线的斜率都很陡,说明物质的熔点随压强的变化很小,例如冰的熔点,每增加一个大气压,熔点才下降0.007 5℃,而要使冰的熔点下降1℃,则必须使压强增加1.75X107Pa,约为大气压的170倍。
两个图的斜率的正或负,反映了两类物质随压强的增大,熔点升高或降低的规律。
(2)溶有杂质。
以上讨论的都是纯净的液态物质,如果液体中溶有少量其他物质,或称为杂质,即使数量很少,物质的熔点也会有很大的变化,例如水中溶有盐,熔点就会明显下降,海水就是溶有盐的水,海水冬天结冰的温度比河水低,就是这个原因.饱和食盐水的熔点可下降到约-220℃,北方的城市在冬天下大雪时,常常往公路的积雪上撒盐,只要这时的温度高于-22℃,足够的盐总可以使冰雪熔化.合金又称为固态溶液,因为合金在液态时也可以看做是一种金属溶于另一种金属之中的溶液,因此合金的熔点比单质低属熔点要低,而且比组成合金的每一种金属的熔点都低.例如锡的熔点是232℃,铅的熔点是327℃,按一定比例组成的铅锡合金的熔点则只有170℃,而由铋、锡、铅、镉组成的合金的熔点可降低到70℃,常应用来制作保险丝、焊丝等。

第五节聚合物的结晶热力学一、结晶聚合物的熔融特点结晶聚合物的熔融过程与小分子晶体的异同:相同点:都是一个相转变的过程;不同点:小分子晶体在熔融过程,体系的热力学函数随温度的变化范围很窄,一般只有0.2℃左右,可名符其实地称之为熔点。
结晶聚合物的熔融过程,呈现一个较宽的熔融温度范围,即存在一个“熔限”;一般将其最后完全熔融时的温度称为熔点T m。
二、分子结构对熔点的影响聚合物的熔融过程,从热力学上来说,它是一个平衡过程,因而可用以下的热力学函数关系来描述:在平衡时,,则有凡是分子结构有利于增加分子间或链段间的相互作用力的,则在熔融过程中增加,而使熔点升高;增加高分子链内旋转的阻力,使高分子链比较僵硬,则在熔融过程中构象变化较小,即较小,也使熔点升高。
(一)分子间作用力通过在主链或在侧链上引入极性基团或形成氢键,则可使增大,熔点提高。
例如,主链基团可以是酰胺-CONH;-酰亚胺-CONCO;-氨基甲酸酯-NHCOO;-脲-NH-CO-NH-,这些基团都易在分子间形成氢键,从而使分子间的作用力大幅度增加,熔点明显提高。
分子链取代基的极性也对分子间的作用力有显著影响。
例如,在聚乙烯(T m=138.7℃)分子链上取代了-CH3(等规聚丙烯,T m=176℃)、-Cl(聚氯乙烯,T m=212℃)和-CN(聚丙烯晴,T m=317℃),随取代基的极性增加,熔点呈递升的趋势。
(二)分子链的刚性增加分子链的刚性,可以使分子链的构象在熔融前后变化较小,即变化较小,故使熔点提高。
一般在主链上引入环状结构,共轭双键或在侧链上引入庞大的刚性取代基均能达到提高熔点的目的。
(三)分子链的对称性和规整性具有分子链对称性和规整性的聚合物,在熔融过程所发生的变化相对地较小,故具有较高的熔点。
例如,聚对苯二甲酸乙二酯的T m为267℃,而聚间苯二甲酸乙二酯的T m 仅为240℃;聚对苯二甲酰对苯二胺(Kevlar)的T m为500℃,而聚间苯二甲酰间苯二胺的T m仅为430℃。

熔点影响因素一、介绍熔点是物质从固态转化为液态的温度,不同物质的熔点因其分子或原子间的相互作用力而异。
本文将探讨影响熔点的各种因素,包括物质种类、分子或原子结构、外部压力等。
二、物质种类不同物质的熔点差异较大,主要取决于其分子或原子组成。
常见的无机物如金属、盐类和硫化物通常具有较高的熔点,而有机物如醇类和酮类则具有较低的熔点。
1. 金属金属通常以晶格结构排列,其熔点较高。
金属结构中的金属键由金属离子形成。
金属离子以它们的价电子在晶格中自由移动,形成金属的特殊性质。
2. 盐类盐类由阳离子和阴离子组成,它们以离子键相互结合。
盐类的熔点通常较高,因为离子键具有很强的电荷吸引作用和相对较大的电荷。
3. 有机物有机物通常由碳、氢和氧等元素组成。
由于分子间的相对较低的相互作用力,有机物的熔点通常较低。
三、分子或原子结构物质的分子或原子结构对熔点有重要影响。
以下是与分子或原子结构相关的因素。
1. 极性分子的极性是指分子中正负电荷之间的不对称分布程度。
极性分子由于极性吸引力较强,更容易形成较稳定的晶格结构,因此其熔点较高。
2. 分子大小分子的大小会影响分子间的范德华力的大小。
较大的分子通常有更大的分子间接触面积,从而会有更大的范德华力相互作用,导致较高的熔点。
3. 分子形状分子形状也会影响分子间的相互作用力。
若分子呈线性排列,由于分子间距较远,相互作用力较弱,因此熔点较低。
而若分子呈三维结构,分子间距较近,相互作用力较强,熔点较高。
4. 氢键氢键是由氢原子与电负性较高的原子(如氮、氧和氟)形成的强相互作用力。
具有氢键的物质通常具有较高的熔点,因为氢键可以增强物质的稳定性。
四、杂质和晶格缺陷杂质和晶格缺陷可以降低物质的熔点。
1. 杂质杂质是指在晶体中存在的相同化学组成但原子或离子不同的物质。
杂质的存在会引入晶体结构中的不规则性,从而降低晶体的稳定性,使熔点降低。
2. 晶格缺陷晶格缺陷是指晶体中的原子位置或序列的缺失、置换或错位。
《塑料成型加工基础》单元电子教材高分子的特征温度——熔点一、熔点晶态高聚物的熔点是在平衡状态下晶体完全消失的温度。
一般用T m表示。
对于晶态高聚物的塑料和纤维来说,T m是它们的最高使用温度,又是它们的耐热温度,还是这类高聚物成型加工的最低温度。
低分子晶体的熔融过程晶态高聚物的熔融过程晶态高聚物熔融的特点:(1)晶态高聚物熔融时比容-温度关系是边熔融边升温,突变不明显。
(2)存在熔限,即较宽的熔融温度范围的3~4K。
高分子结晶熔融过程中熔限的宽窄同高分子结晶的形成条件密切相关。
晶态聚合物边熔融边升温的主要原因主要是由于结晶聚合物中含有完善程度不同的晶体的缘故。
结晶时随着温度的下降,黏度上升,分子链活动能力减小,还来不及作充分的位置调整,这样各个不同阶段结晶状态同时并存,当熔化不完善的晶体(分子链堆不紧密)将在较低的温度下熔融,而完善的晶体则在较高温度下才能熔融,所以在通常升温条件下便出现较宽的熔融温度范围。
二、影响熔点的因素因为熔点是结晶高聚物的最高使用温度,所以熔点越高,对使用越有利。
因此,我们通过分析影响熔点的因素,找到合适的途径提高熔点。
在平衡熔点时,高聚物的晶相与非晶相达到热力学平衡,△F=0,即△F=△H-T△S=0所以其熔点为:T m=△H/△S式中,△H——1摩尔重复结构单元的熔化热;△S——1摩尔重复结构单元的熔化熵。
由此可知,△H越大或△S越小,则高聚物物的熔点越高。
△H与分子间作用力的强弱有关,若在高分子主链中或侧基上引入极性基团,或在大分子间形成氢键,均能增大分子间的作用力,进而,提高△H。
△S与晶体熔化后分子的混乱程度有关,进而与分子链的柔性有关。
柔性越好,晶体熔化后分子链的混乱程度就越大,因此其熔点就越低。
当主链引入苯环时,则柔性下降,刚性增加,因此使熔点升高。
另外一种工业上常用的方法,对结晶性高聚物进行高度拉伸,以使结晶完全,进而提高熔点。
三、熔点的测定方法熔点的测定方法基本上与玻璃化温度的测定方法相同。
第31 讲5.5.3 影响晶态聚合物熔点的因素熔点是结晶聚合物使用的上限温度,是晶态聚合物材料最重要的耐热性指标。
1)大分子链的化学结构是决定晶态聚合物熔点高低的最重要因素。
而结晶条件和材料的加工过程也对熔点产生一定影响。
晶态聚合物转变为液态(粘流态)的过程属于热力学相变过程,达到平衡时体系的自由能增量应为:△G=△H m –T m0 △S m=0式中:△H m 和△S分别是晶态聚合物的熔融热和熔融熵;设聚合物的熔融热和熔融熵分别由不与相对分子质量相关的“基础值”H0和S0和大分子链每一个结构单元在晶体熔化前后的增量(△H m) u和(△S m) u组成,则:由此可见,大分子链中结构单元的熔融热增量(△H m) u愈大,或熔融熵增量(△S m) u愈小,则晶态聚合物的熔化热也就愈高。
聚合物结构单元的熔融热增量与分子间的作用力强弱有关,而结构单元的熔融熵增量则与晶体熔化以后分子的混乱程度有关。
表5-15 一些结晶聚合物的相关热力学数据归纳影响晶态聚合物熔点的一般规律:①刚性分子链的晶态聚合物的熔点高于柔性链聚合物的熔点,如聚苯撑的熔点高达530℃;②极性分子链的晶态聚合物的熔点高于非极性链聚合物的熔点,如聚丙烯腈熔点高达317℃;③分子主链含可生成氢键的O、N 原子的晶态聚合物的熔点很高,如尼龙的熔点都在260℃以上;④分子主链上的亚甲基(CH2)数目愈多则大分子的柔顺性愈高,聚合物晶体的熔点愈低,如聚己二酸己二酯的熔点只有65℃;⑤凡是能够增加分子链柔顺性的因素都使熔点降低,如天然橡胶和聚氧化乙烯的熔点都很低。
不过需要注意的是:必须综合考虑影响晶态聚合物熔点的各种因素,才能对晶态聚合物的熔点作出正确的判断,有时单从大分子链的结构很难准确判断聚合物的熔点高低。
熔值的影响因素
熔值是材料在一定条件下从固态转变为液态的温度。
影响熔值的因素主要包括以下几个方面:
1. 材料的分子结构:分子之间的相互作用力是影响熔值的关键因素。
分子间的强相互作用力会增加熔值,而分子间的弱相互作用力会降低熔值。
2. 分子大小和形状:分子较大且形状复杂的物质,分子间的相互作用力较强,其熔值较高。
3. 材料的晶体结构:晶体化合物的熔值与其晶体结构有关。
具有有序结构的晶体通常具有较高的熔值,而无序结构的非晶体通常具有较低的熔值。
4. 材料的纯度:杂质的存在会影响熔值。
纯度较高的材料通常具有较高的熔值,因为杂质可能干扰分子间的相互作用力。
5. 外界条件:温度、压力以及其他环境因素都可以影响熔值。
通常情况下,提高温度可以增加材料的熔值,而增加压力则会降低熔值。
综上所述,熔值的影响因素是多方面的,包括分子结构、分子大小和形状、晶体结构、材料纯度以及外界条件等。
不同材料的熔值会受到这些因素的相互影响而
有所不同。
熔点差异的原因熔点(meltingpoint)指物质在热力作用下,由固态到液态发生变化的温度点。
不同物质的熔点也会存在差异,而这种差异取决于物质的结构、相互作用力、熔解所需的能量以及其它因素。
在物理和化学上,熔点具有重要意义,因为它能帮助我们正确地认识和描述特定物质的性质,以及有助于我们介绍和表征它们之间的相互关系。
以水为例,在常温下,它的熔点是0摄氏度,这意味着当温度降至0摄氏度时,水就从固态变成液态。
而其他物质却可能具有比水低或比水高的熔点,比如金属,它们介于几百摄氏度到几千摄氏度之间,这是因为它们拥有不同的结构、电子结构和相互作用力,这些因素在不同程度上影响着它们的熔点。
首先,结构是影响熔点差异最主要的因素,基本上可以概括为分子内部(分子内)和分子外部(分子间)之间的结构。
分子内部结构反映着分子内部键的结构,如共价键和极性键的强度,以及分子的大小、形状及相互作用力(如氢键),它们都会影响物质的熔点。
其次,熔解过程涉及物质在固态和液态之间的相互转变,这种转变所需要的能量是根据熔融物质的电子结构和相互作用力而定的,而电子结构和相互作用力又取决于物质的分子构型。
例如,有的物质有较强的疏氢键,它们的熔点会比没有疏氢键的物质要高,因为它们需要更多的能量才能消除疏氢键,以完成融化过程。
此外,熔点差异还受到物质的分子大小和分子表面积的影响。
通常情况下,分子越大,熔点越高,而分子表面积越大,熔点越低。
这是因为分子表面积越大,熔解过程时所需要的能量就会减少,从而降低熔点。
最后,熔点差异也可能受到其它温度因素的影响,因为除了正常温度外,高温环境或低温环境也会对熔点有影响。
对不同物质而言,它们在高温条件下的熔点可能会更高,而在低温条件下的熔点可能会更低,这是因为它们受到环境温度的影响而发生变化。
综上所述,熔点是指物质在热力作用下,由固态到液态发生变化的温度点,而它的差异取决于物质的结构、电子结构和相互作用力,以及其他因素,比如分子大小、分子表面积以及温度等。
第 31 讲5.5.3 影响晶态聚合物熔点的因素熔点是结晶聚合物使用的上限温度,是晶态聚合物材料最重要的耐热性指标。
1)大分子链的化学结构 是决定晶态聚合物熔点高低的最重要因素。
而结晶条件和材料的加工过程也对熔点产生一定影响。
晶态聚合物转变为液态(粘流态)的过程属于热力学相变过程,达到平衡时体系的自由能增量应为: △G = △H m – T m0 △S m = 0式中:△H m 和△S 分别是晶态聚合物的熔融热和熔融熵;设聚合物的熔融热和熔融熵分别由不与相对分子质量相关的“基础值”H 0和S 0和大分子链每一个结构单元在晶体熔化前后的增量(△H m) u 和(△S m) u 组成,则:由此可见,大分子链中结构单元的熔融热增量(△H m) u 愈大,或熔融熵增量(△S m) u 愈小,则晶态聚合物的熔化热也就愈高。
聚合物结构单元的熔融热增量与分子间的作用力强弱有关,而结构单元的熔融熵增量则与晶体熔化以后分子的混乱程度有关。
表5-15 一些结晶聚合物的相关热力学数据 归纳影响晶态聚合物熔点的一般规律:①刚性分子链的晶态聚合物的熔点高于柔性链聚合物的熔点,如聚苯撑的熔点高达530℃; ②极性分子链的晶态聚合物的熔点高于非极性链聚合物的熔点,如聚丙烯腈熔点高达317℃;③分子主链含可生成氢键的 O 、N 原子的晶态聚合物的熔点很高,如尼龙的熔点都在260℃以上;④分子主链上的亚甲基(CH2)数目愈多则大分子的柔顺性愈高,聚合物晶体的熔点愈低,如聚己二 酸己二酯的熔点只有65℃;⑤凡是能够增加分子链柔顺性的因素都使熔点降低,如天然橡胶和聚氧化乙烯的熔点都很低。
不过需要注意的是:必须综合考虑影响晶态聚合物熔点的各种因素,才能对晶态聚合物的熔点作出正确的判断,有时单从大分子链的结构很难准确判断聚合物的熔点高低。
2)影响熔点的其他因素①片晶厚度和结晶缺陷 对所有种类聚合物晶体熔点都有影响。
片晶厚度越薄,结晶缺陷越多,熔点越低,如图5-24聚三氟氯乙烯片晶厚度与熔点的关系曲线 所示。
②结晶温度的影响由片晶理论厚度与温度的关系公式:第二:结晶温度越低,则晶体熔化的温度范围即熔限也越宽。
右图5-25为天然橡胶的熔化温度与结晶温度的关系。
原因:熔点和熔限对结晶温度的依赖性完全产生于大分子的长链结构。
较低结晶温度下,体系粘度较高,分子链的活动能力较低生成片晶的厚度较小,且晶体内部的缺陷也较多,所以熔点较低,熔限较宽。
反之,在较高的结晶温度下,熔点较高熔限较窄。
在熔点附近温度经长时间的缓慢结晶 ,所得结晶的熔限范围将很小,甚至完全消失。
③ 添加剂的影响稀释剂→增塑剂、稳定剂→可溶性物质(助剂)填充剂→无机颜料、填料→不溶性物质(助剂)增塑剂的加入可以明显改善聚合物制品的脆性并提高其韧性,但是却使熔点降低。
当稀释剂的用量足够低时,可以用下式计算其对熔点降低的程度:式中T m 0和T m 分别是纯聚合物和加入稀释剂以后的熔点(K );x b 是稀释剂的摩尔分率,R 是摩尔气体常数。
(上)图5-26 两种共聚物的熔点与共聚物组成的关系 图5-27增塑和共聚对熔点和玻璃化温度的影响T m0==△H m △S m==H 0S 0++n (△H m )u n (△S m )u == (△S m )u (△H m )u()()cm u m m f T T H T -∆=02σ片晶的理论厚度()u m b mm H Rx T T ∆=-0115—26图a.两种单体的均聚物具有相同的结晶形态,熔点随组成平滑变化。
b.两种单体的均聚物具有不同的结晶形态,随第二单体(少组分)含量增加,共聚物晶体变小,熔点降低。
5—27图a、加增塑剂聚合物的熔点;b、共聚物的熔点;c、加增塑剂聚合物的玻璃化温度;d、共聚物的玻璃化温度。
可看出:采用共聚或加入增塑剂的方法都能够同时降低结晶聚合物的熔点和玻璃化温度。
而共聚的方法作用更加显著。
④外应力的影响拉伸有利于结晶过程并减小晶体结构缺陷,所以有利于提高结晶聚合物的熔点。
应力越大,Tm越高。
表5-16 外界条件对结晶聚合物熔点的影响序号影响因素影响结果1 片晶厚度片晶厚度越厚,晶体熔限越宽2 结晶温度结晶温度愈低,晶体开始熔化的温度愈低,熔限也越宽3 添加剂稀释剂使熔点降低;增塑和共聚可使玻璃化温度和熔点均降低4 外应力拉伸应力有利于结晶完全,使晶态聚合物熔点升高第32 讲5.5.4 晶态聚合物熔点与结构的相关性5.5.5 聚合物玻璃化温度与熔点的关系5.5.4 晶态聚合物熔点与结构的相关性①聚乙烯和天然橡胶都属于柔顺性高的分子,而它们的熔点却分别为141.4℃和28℃。
原因是天然橡胶分子链结构单元的熔融熵增量(△S m)u远大于聚乙烯分子链结构单元的熔融熵增量。
换言之,天然橡胶的低熔点主要产生与它在熔化过程中的高熵变值。
②聚氧化乙烯结构单元熔融热增量(△H m) u是聚乙烯的两倍。
然而前者分子链柔顺性好,其结构单元的熔融熵增量(△S m)u比聚乙烯高得多。
因此同样由于熔化过程中高熵变值的原因,使它的熔点要比聚乙烯低得多。
③聚甲醛的螺旋状晶体结构比聚氧化乙烯的螺旋晶体结构紧密得多,堆砌更为致密,所以聚甲醛分子链的刚性和熔点都比聚氧化乙烯高得多;④虽然红外光谱分析结果表明,即使熔化以后聚酰胺分子链之间的氢键仍然存在,但是由于酰胺键在液态或粘流态时的共振倾向高于处于晶体中的共振倾向,氢键僵硬降低了熔化过程熵的增加值。
换言之,聚酰胺的高熔点主要产生于熔化过程,因氢键僵硬而导致的熔化熵增量(△S m)u的降低。
⑤聚酰胺的熔点与分子主链上酰胺键之间的碳原子数有关,如图5-28和5-29所示.图5-28 聚ω氨基酸熔点与单体碳原子数的关系(奇高偶低)图5-29 二元胺碳原子数与尼龙n10熔点的关系(偶高奇低)◆尼龙的熔点随单体碳原子数的增加而呈现锯齿形下降的趋势;以奇数碳原子的ω氨基酸(或内酰胺)合成尼龙的熔点均高于相邻偶数碳原子单体合成尼龙的熔点;◆不同碳原子数的二元胺与同一二元酸为单体,则偶数碳原子二元胺合成的尼龙的熔点高于相邻奇数碳原子二元胺合成的尼龙。
原因是:不同碳原子数的单体生成聚合物以后,大分子链之间形成氢键的概率和密度不同。
图5-30 几种聚合物的熔点与重复结构单元碳原子数的关系a 聚脲;b 聚酰胺;c 聚氨酯;d 聚乙烯此为总体趋势。
若区分奇偶数的变化,依然存在与上面两图相类似的锯齿形下降趋势。
⑥上述规律性也适用于其他能够生成氢键的缩聚物类型。
如脂肪族聚脲、聚酰胺和聚氨酯的分子主链上分别含有如下结构:—R—HN—CO—HN—R′——R—HN—CO—R′——R—HN—COO—R′—这些结构都可以在分子链间生成氢键,所以这些聚合物的熔点都很高。
⑦线型脂肪族聚酯的熔点都比聚乙烯的熔点低。
聚酯晶体融化所要克服的内聚能几乎完全来源于亚甲基产生的色散力。
由于单位链长聚酯所含有的亚甲基数目总是少于聚乙烯的亚甲基数,因此线型聚酯的熔点总是低于聚乙烯的熔点。
⑧涤纶分子链中含有的苯环使分子链的刚性大大增加,熔点高达280℃。
⑨聚四氟乙烯的熔点(327℃)大大高于聚乙烯,这是由于大量强极性的氟原子增加了分子链的刚性,从而使结构单元的熔化熵增量(△S m)u减小的缘故。
⑩全同结构的聚丙烯的熔点很高,也是由于全同构型的聚丙烯分子链在晶体或熔体中都呈现螺旋状构象,这就大大降低了结构单元的熔化熵增量(△S m)u,因此熔点很高。
大分子链结构对晶态聚合物平衡熔点的10点影响结果,归纳于下表:一般而言,晶态聚合物的熔点都明显高于同类非晶态聚合物的玻璃化温度。
例如,无规聚丙烯的玻璃化温度为-18℃,而晶态全同立构聚丙烯的熔点则高达176℃。
聚合物熔点和玻璃化温度的线性关系式:T m == K T g (K)Tmax≈0.8Tm(K)最高结晶温度Tmax=0.63T m+0.37T g-18.5式中K是与大分子链结构有关的常数,结构对称和非对称分子链的K值分别为2和1.5。
表5-18 一些聚合物的玻璃化温度和熔点第33讲5.5.4 晶态聚合物熔点与结构的相关性5.5.5 聚合物玻璃化温度与熔点的关系第34 讲第六章橡胶弹性6.1 橡胶态聚合物的特点6.2 形变类型及描述力学行为的基本物理量6.1 橡胶态聚合物的特点将处于玻璃化温度Tg之上,粘流温度Tf之下的非晶态聚合物的凝聚态称为橡胶态或高弹态。
1)弹性模量小,弹性形变大。
一般金属材料的弹性模量和弹性形变分别为1010~1011 Pa 和≤1%,而橡胶态弹性模量和弹性形变分别达到105~106 Pa和1000 %。
2)在绝热条件下快速拉伸橡胶态聚合物放热,回缩时吸热;而金属材料则恰恰相反——拉伸时吸热,回缩时放热。
3)橡胶态聚合物的高弹形变具有松弛特性,即形变与应力作用时间有关。
非晶态聚合物所具有的高弹性,是由其大分子链结构及链段运动特性所决定的。
Tg之上,由于σ键的内旋转能垒较低,即使很低的外力作用,亦能产生链段运动,从而导致构象的变化,大分子链的形态由卷曲逐渐变为舒展(小模量产生大形变);外力解除后,分子热运动使链段的构象回复到受力前比较稳定、熵值较大的卷曲状态,形变得以恢复,所以高弹形变属于可逆形变。
另一方面,由于链段的运动具有松弛特性,所以高弹形变亦具有松弛特性。
热力学上,长链处于卷曲状态时的熵值大,处于伸直状态时的熵值小。
所谓熵弹性,即橡胶的高弹性。
橡胶态聚合物处于卷曲状态的分子链的伸直过程是一个非自发的、受外力“强迫”、熵值减少的放热过程。
而伸直状态的分子链在外力解除以后的“回缩”过程则属于自发的、熵值增加的吸热过程。
从这个意义理解,常常又将处于橡胶态的非晶态聚合物所具有的高弹性叫做“熵弹性”。
6.2 形变类型及描述力学行为的基本物理量 1)形变类型物理的观点:基本形变:简单剪切 形状改变体积不变 本体压缩(或本体膨胀)体积改变形状不变 2)The concept of Strain and Stress当材料受到外力作用,而所处的条件却使其不能产生惯性位移时,材料的几何形状和尺寸将发生变化,这种变化就称为应变。
材料发生宏观变形时,其内部分子间及分子内各原子间的相对位置和距离发生变化,使原子间或分子间原有的引力平衡受到破坏,因而产生一种恢复平衡的力(即抵抗外力作用的力),此力简称附加内力。
达到平衡时,附加内力和外力相等,方向相反,单位面积上的附加内力(外力)称为应力。
Engineering stress 工程应力 True stress 真应力工程应变 真应变λ - 伸长率 拉伸模量——杨氏模量 模量 – 材料试样抵抗形变的性质柔量( Compliance )3)Shear 剪切(与截面相平行的力的作用)剪切应变 剪切应力(Shearing stress ) 剪切模量和剪切柔量简单剪切实验能把高聚物宏观力学性能与它们内部分子运动相联系,建立高聚物力学行为的分子理论。