浙江专用版高考化学一轮复习专题溶液中的离子反应盐类的水解苏教版
- 格式:pptx
- 大小:3.38 MB
- 文档页数:22

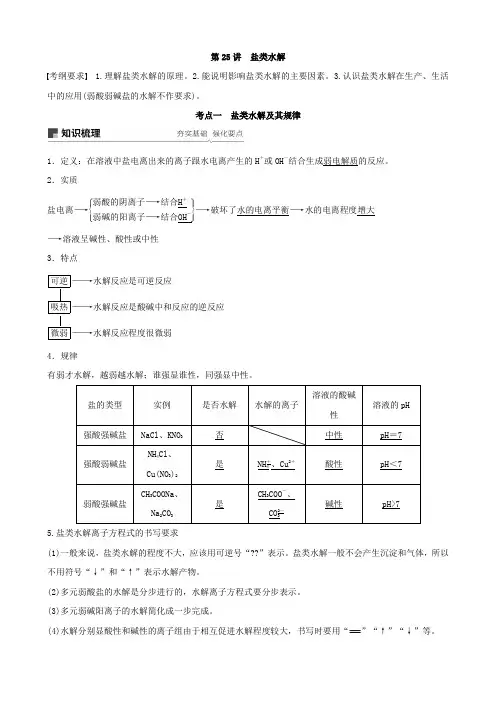
第25讲 盐类水解考纲要求 1.理解盐类水解的原理。
2.能说明影响盐类水解的主要因素。
3.认识盐类水解在生产、生活中的应用(弱酸弱碱盐的水解不作要求)。
考点一 盐类水解及其规律1.定义:在溶液中盐电离出来的离子跟水电离产生的H +或OH -结合生成弱电解质的反应。
2.实质盐电离―→⎩⎪⎨⎪⎧⎭⎪⎬⎪⎫弱酸的阴离子―→结合H +弱碱的阳离子―→结合OH -―→破坏了水的电离平衡―→水的电离程度增大 ―→溶液呈碱性、酸性或中性 3.特点可逆――→水解反应是可逆反应吸热――→水解反应是酸碱中和反应的逆反应 微弱――→水解反应程度很微弱 4.规律有弱才水解,越弱越水解;谁强显谁性,同强显中性。
5.盐类水解离子方程式的书写要求(1)一般来说,盐类水解的程度不大,应该用可逆号“??”表示。
盐类水解一般不会产生沉淀和气体,所以不用符号“↓”和“↑”表示水解产物。
(2)多元弱酸盐的水解是分步进行的,水解离子方程式要分步表示。
(3)多元弱碱阳离子的水解简化成一步完成。
(4)水解分别显酸性和碱性的离子组由于相互促进水解程度较大,书写时要用“===”“↑”“↓”等。
(1)溶液呈中性的盐一定是强酸、强碱生成的盐(×)(2)酸式盐溶液可能呈酸性,也可能呈碱性(√)(3)某盐溶液呈酸性,该盐一定发生了水解反应(×)(4)常温下,pH=10的CH3COONa溶液与pH=4的NH4Cl溶液,水的电离程度相同(√)(5)常温下,pH=11的CH3COONa溶液与pH=3的CH3COOH溶液,水的电离程度相同(×)(6)NaHCO3、NaHSO4都能促进水的电离(×)(7)向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成(×)(8)Na2CO3的水解:CO2-3+2H2O===H2CO3+2OH-(×)(9)FeCl3溶液与NaHCO3溶液混合:Fe3++3HCO-3===Fe(OH)3↓+3CO2↑(√)1.怎样用最简单的方法区别NaCl溶液、氯化铵溶液和碳酸钠溶液?答案三种溶液各取少许分别滴入紫色石蕊溶液,不变色的为NaCl溶液,变红色的为氯化铵溶液,变蓝色的为碳酸钠溶液。
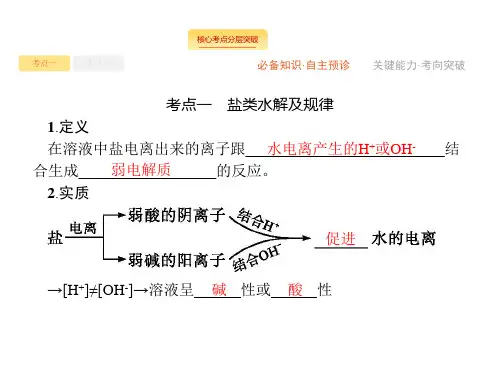


学习资料第26讲盐类的水解1.定义在溶液中盐电离出来的离子跟错误!水电离产生的H+或OH-结合生成错误!弱电解质的反应.2.实质3.特点4.规律有弱才水解,越弱越水解,谁强显谁性,同强显中性。
盐的类型实例是否水解水解的离子溶液的酸碱性常温下溶液的pH 强酸强碱盐NaCl、KNO3错误!否—错误!中性错误!pH=7 强酸弱碱盐NH4Cl、Cu(NO3)2错误!是错误!NH错误!、错误!Cu2+错误!酸性错误!pH<7 弱酸强碱盐CH3COONa、Na2CO3错误!是错误!CH3COO-、错误!CO错误!错误!碱性错误!pH〉75.离子方程式的书写(1)一般来说,盐类水解的程度不大,用可逆号“”表示。
盐类水解一般不会产生沉淀和气体,所以不用符号“↓”和“↑"表示水解产物。
如CuCl2、NH4Cl水解的离子方程式:□,01Cu2++2H2O Cu(OH)2+2H+;错误!NH错误!+H2O NH3·H2O+H+。
(2)多元弱酸盐的水解是分步进行的,水解离子方程式只写第一步。
如Na2S水解反应的离子方程式:错误!S2-+H2O HS-+OH-。
(3)多元弱碱阳离子的水解简化成一步完成,如FeCl3溶液中:错误!Fe3++3H2O Fe(OH)3+3H+。
(4)水解分别显酸性和碱性的离子组由于水解相互促进进行完全的,书写时要用“===”“↑”“↓"等,如NaAlO2与AlCl3混合溶液反应的离子方程式:Al3++3AlO错误!+6H2O===4Al(OH)3↓.6.影响盐类水解平衡的因素(1)内因:形成盐的酸或碱越弱,其盐就越易水解。
如水解程度:Na2CO3错误!>Na2SO3,Na2CO3错误!>NaHCO3。
(2)外因①温度:温度越高,水解程度错误!越大.②溶液的浓度:溶液越稀,水解程度错误!越大。
(3)外加酸碱错误!(4)加能水解的盐7.盐类水解的应用应用举例或原理解释判断溶液的酸碱性NH4Cl溶液显错误!酸性,原因是错误!NH错误!+H2O NH3·H2O+H+,与Mg反应可生成错误!H2比较溶液中离子浓度的大小如:Na2CO3溶液中离子浓度由大到小的顺序为错误!c(Na+)>c(CO 错误!)>c(OH-)〉c(HCO错误!)>c(H+)判断弱电解质的相对强弱如:物质的量浓度相同的三种盐溶液NaX、NaY、NaZ的pH依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序为错误!HX>HY〉HZ续表应用举例或原理解释证明某些电解质是弱酸或弱碱如:Na2CO3溶液能使酚酞试液变红,证明该溶液显碱性,证明H2CO3是弱酸判断盐溶液蒸干灼烧后的产物蒸干灼烧AlCl3溶液后的产物为错误!Al2O3,蒸干灼烧FeCl3溶液后的产物为错误!Fe2O3净水剂原理明矾用于净水,原理是错误!Al3++3H2O Al(OH)3(胶体)+3H+泡沫灭火器原理主要成分为NaHCO3与Al2(SO4)3,原理是错误!Al3++3HCO错误!===Al (OH)3↓+3CO2↑纯碱溶液去油污用热碱水洗油污的原理错误!CO 错误!+H2O HCO错误!+OH-胶体的制备将饱和FeCl3溶液滴入沸水中,制备Fe(OH)3胶体,原理是错误!Fe3++3H2O错误!Fe(OH)3(胶体)+3H+配制或贮存易水解的盐溶液配制FeCl3、SnCl2溶液时,常将它们先溶于较浓的盐酸,再稀释到所需浓度,目的是错误!抑制Fe3+或Sn2+的水解,配制FeSO4溶液时,需加入少量错误!铁粉和稀硫酸物质的提纯除去MgCl2溶液中的FeCl3,可加入□14Mg、MgO、Mg(OH)2或MgCO3,促使Fe3+水解完全,生成Fe(OH)3沉淀而除去1.判断正误,正确的画“√",错误的画“×",并指明错因.(1)酸式盐溶液一定呈酸性。





(浙江选考)2018高考化学大一轮复习专题8 溶液中的离子反应第3单元盐类的水解教师用书编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望((浙江选考)2018高考化学大一轮复习专题8 溶液中的离子反应第3单元盐类的水解教师用书)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为(浙江选考)2018高考化学大一轮复习专题8 溶液中的离子反应第3单元盐类的水解教师用书的全部内容。
第三单元盐类的水解浙江考试标准知识条目必考要求加试要求(1)盐类的水解原理,常见盐溶液的酸碱性的判断a b(2)盐类水解的简单应用b b(3)盐类水解的离子反应方程式b(4)多元弱酸盐的分步水解b(5)影响盐类水解的因素b(6)常见酸式盐溶液的酸碱性判断b考点1|盐类的水解及其应用[基础知识自查]1.盐类的水解(1)定义在水溶液中盐电离产生的离子跟水电离产生的H+或OH-结合生成弱电解质的反应.(2)实质―→c(H+)≠c(OH-)―→溶液呈碱性或酸性(3)特点2.盐类水解规律(1)强酸强碱盐不水解,溶液呈中性,如NaCl等.(2)弱酸强碱盐水解呈碱性,如Na2CO3等。
(3)强酸弱碱盐水解呈酸性,如Fe(NO3)3等。
3.盐类水解的简单应用应用举例判断溶液的酸碱性FeCl3显酸性,原因是Fe3++3H2O Fe(OH)3+3H+热的纯碱溶液洗油污升温促进Na2CO3水解,使溶液中c(OH-)增大配制或贮存易水解的盐溶液配制CuSO4溶液时,加入少量H2SO4,抑制Cu2+水解胶体的制取制取Fe(OH)3胶体的离子反应:Fe3++3H2O错误! Fe(OH)3(胶体)+3H+泡沫灭火器原理成分为NaHCO3与Al2(SO4)3,发生反应为Al3++3HCO错误!===Al(OH)3↓+3CO2↑作净水剂明矾可作净水剂,原理为Al3++3H2O Al(OH)3(胶体)+3H+化肥的使用铵态氮肥与草木灰不得混用,原因是CO错误!+H2O HCO错误!+OH-、NH错误!+OH-===NH3↑+H2O4(1)一般要求:盐类水解的程度不大,应用可逆号“”表示。
