元素化合物的转化关系网络图
- 格式:docx
- 大小:215.56 KB
- 文档页数:4
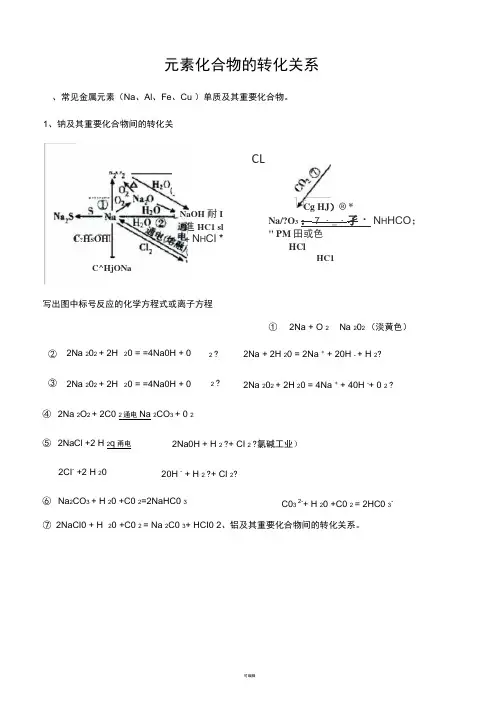
元素化合物的转化关系、常见金属元素(Na 、Al 、Fe 、Cu )单质及其重要化合物。
Cg HJ )® *Na/?O 3 : 7 ・_・孑・ N H HCO ; " PM 田或色HCl①2Na + O 2 Na 202 (淡黄色)② 2Na 202 + 2H 20 = =4Na0H + 0 2 ?③ 2Na 202 + 2H 20 = =4Na0H + 02 ?2Na + 2H 20 = 2Na + + 20H - + H 2? 2Na 202 + 2H 20 = 4Na + + 40H -+ 0 2 ?20 +C0 2 = Na 2C0 3+ HCI0 2、铝及其重要化合物间的转化关系。
④ 2Na 2O 2 + 2C0 2通电Na 2CO 3 + 0 2 ⑤ 2NaCl +2 H 2q 甬电 2CI - +2 H 20⑥ Na 2CO 3 + H 20 +C0 2=2NaHC0 32Na0H + H 2 ?+ CI 2 ?氯碱工业) 20H - + H 2 ?+ CI 2?C03 2-+ H 20 +C0 2 = 2HC0 3-CLHC1⑦ 2NaCI0 + H 1、钠及其重要化合物间的转化关系。
C ?H S OHC^HjONaNaOH 耐I 進HC1 sl + N H CI *写出图中标号反应的化学方程式或离子方程写出图中标号反应的化学方程式或离子方程式。
高温AI 3+ +3 AIO 2- +6H 2O = 4AI(OH) 3J 3、铁及其重要化合物间的转化关系。
4AI + 3O 22AI 2032AI + Fe 2O 3 2Fe + Al 2O 32AI + 2NaOH + 2H2O = 2NaAIO 2 + 3H2AI +20H - +2H 20 = 2AI0 2- +3H 2 f通电2AI 2O 34AI+3O 2 fAI 2O 3+6HCI = 2AICI 3+3H 2O AI 2O 3 + 6H + = 2AI 3+ + 3H 2OAI 2O 3 + 2NaOH = 2NaAIO 2 +H 2OAI 2O 3 + 2OH - = 2AIO 2- + H 2O AICI 3 +3NH 3 ・H O = AI(OH) 3 \|+ 3NH 4CIAI 3+ + 3 NH 3 •H O = AI(OH) 3“ 3NH 4+ AICI 3 +3 Na OH = AI(OH) 3 J+ 3 NaCIAI 3+ + 3OH - = AI(OH) 3 J AI(OH) 3 + NaOH =NaAIO2 +2 H 2OAI(OH) 3 + OH - = AIO 2- +2H 2O帥悄PiaAlO ;〜―*■或 N4A1(OH)J写出图中标号反应的高温学方程式或离子方程式。
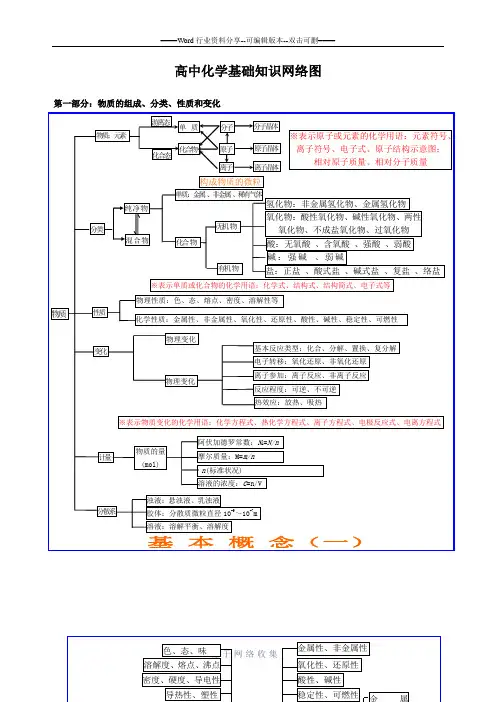
高中化学基础知识网络图第一部分:物质的组成、分类、性质和变化第二部分:基本理论(物质结构、化学反应速率、化学平衡、电解质溶液)源-于-网-络-收-集源-于-网-络-收-集第四部分:有机化学有机抓住官能团的性质烃烃的衍生物糖链烃(脂肪烃)环烃饱和链烃烷烃:C n H 2n+2(n ≥1)R —CH 3 不饱和链烃 烯烃:C n H 2n (n ≥2) R —CH=CH 2二烯烃:C n H 2n-2(n ≥4)R —CH=CH —CH=CH 2 炔烃:C n H 2n-2(n ≥2) R —C ≡CH环烷烃C n H 2n (n ≥3)芳香烃(苯和苯的同系物)C n H 2n-6(n ≥6)R卤代烃(官能团:—X ):饱和一卤代烃C n H 2n+1X(n ≥1)R —X 醇 (官能团:—OH ):饱和一元醇C n H 2n+1OH(n ≥1)R —OH 醚 C n H 2n+2O (n ≥2)R —O —R 酚(苯酚)(官能团:—OH )C n H 2n-6O (n ≥2)OH羧酸 (官能团:—COOH ):饱和一元羧酸 C n H 2n+1O 2 (n ≥1)R —COOH醛 (官能团:—CHO )C n H 2n O (n ≥1)R —CHO 酮 (官能团:—CO —)C n H 2n O (n ≥3)R —CO —R ’酯 (官能团:—COO —R ):饱和一元羧酸和饱和一元醇形成的酯 C n H 2n O 2 (n ≥2)R —COOR ’ 硝基化合物(官能团—NO 2)R —NO 2 胺(官能团—NH 2)R —NH 2单糖:葡萄糖、果糖C 6H 12O 6(互为同分异构) 二糖:蔗糖、麦芽糖C 12H 22O 11(互为同分异构)有机化合物源-于-网-络-收-集。
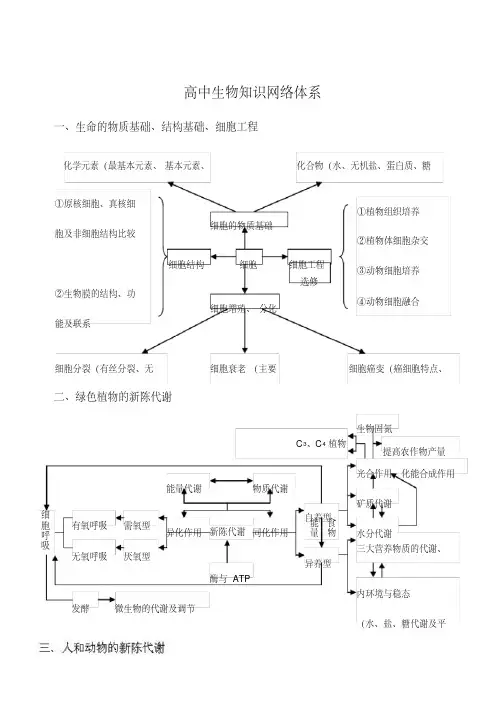
高中生物知识网络体系一、生命的物质基础、结构基础、细胞工程二、绿色植物的新陈代谢细胞细胞的物质基础细胞增殖、分化细胞工程细胞结构化学元素(最基本元素、基本元素、化合物(水、无机盐、蛋白质、糖①原核细胞、真核细胞及非细胞结构比较②生物膜的结构、功能及联系①植物组织培养②植物体细胞杂交③动物细胞培养④动物细胞融合细胞分裂(有丝分裂、无细胞癌变(癌细胞特点、细胞衰老(主要新陈代谢同化作用异化作用能量代谢物质代谢酶与ATP有氧呼吸无氧呼吸细胞呼吸需氧型厌氧型发酵微生物的代谢及调节自养型异养型能量食物水分代谢矿质代谢光合作用、化能合成作用提高农作物产量生物固氮C 3、C 4植物三大营养物质的代谢、内环境与稳态(水、盐、糖代谢及平选修四、生命中的能量知识网络:四、细胞的生命历程、生物的生殖和发育氨基转换成新的氨基酸生物的新陈代谢植物的新陈代谢光合作用光反应暗反应C 3植物与水分代谢矿质代谢水分的吸收、运矿质元素的吸收、新陈代谢新陈代新陈代谢的水、无机盐、维生素人和动物三大营养物质的代谢氧化分解脱氨基作用形成组织蛋白糖类蛋白质脂质转化为糖元转化为脂肪氧化分解转化为脂肪参与机体构成转化为糖元有氧呼吸无氧呼吸细胞呼吸微生物与发酵工程过程原料和产物条件场所过程原料和产物条件场所微生物类群微生物的营养代谢生长发酵工程光能生产者体内稳定的化学能(有机物)消费者体内稳定的化学能(有机物)遗体及排出物中的化学能热能化石然料中稳定的化学能热能活跃的化学能(ATP )呼吸热散失机械能生物电能稳定化学能光能渗透势能光合作用同化作用分解者呼吸燃烧呼吸作用五、遗传的物质基础基因库进化实质基因频率基因型比例纯合子性状表现型基因型杂合子基因类型概念叶绿体线粒体染色体DN 显性基因和陷性基因质基因等位基因和非等位基因核基因基因结构双螺旋结构基本单位空间结构化学结构DNA 结三个特性三个特点脱氧核苷酸编码区非编码区非编码区真核细胞基因原核细胞基因内部结构编码区内含子外显子基因功能表达功能传递功能贮存功能复制场所模板原料产物过程特点转录场所模板原料产物过程意义翻译场所模板原料产物过程意义中心法则位置变化突变功能基因分离基因突变诱变育种杂交育种自由组合基因交换基因重组概念特点类型意义一个概念基因工程五面应用四个步骤三种工具二个原理人类基因组计划遗传病染色体异常遗传病单基因遗传病多基因遗传病六、遗传的基本规律七、生物的变异与进化基因半保留复制出现差错准确无误遗传变异(传递信息)质基因细胞质遗传DN双螺旋空间结构特点稳定性多样性转录、翻译酶、激素结构蛋白调控细胞代谢决定细胞结构(表达信息)显性基因基因型纯合子表现型控制等位基因相对性状控制显性性状遗传规律基因分离自由组合细胞核遗传变异规律遗传进化的内因小的变异基因突变基因重组新基因可遗传变异生存斗争(动力)适者生存大的变异新物种三个环节育种(方法)人类遗传病生物的变异表现性(改变)=基因型(改变)+环境条件(改变)可遗传的变异不遗传的变异可遗传的变异染色体水平染色体结构变异:缺失、重复、倒位、易位染色体数目变异非整倍体:单体、缺体、三体等人类遗传病基因突变:碱基替换、移码突变等DN A 基因水平基因重组基因自由组合基因互换进化自然选择达尔文自然选择学说:过度繁殖→生存斗争(手段)→遗传变异(内因、基础)→适者生存(结果)原始物种新物种现代生物进化理论基础:自然选择学说进化单位:种群进化实质:基因频率改变进化环节:突变和基因重组、自然选择、隔离进化方向:自然选择方向推动八、植物生命活动的调节九、人体及动物生命活动的调节概念含量调节植物生长发育向性运动研发运动光、温度等因素植物激素生长素多种激素相互协调共同调节促进和抑制作用特征产生部位感光部位作用部位生长素细胞分裂素赤霉素乙烯脱落酸生长与分布生长与运输发育与实践微量性两重性敏感性作用特征种类作用实验探究适应影响胰岛素生长激素植物生命活动的调节重要的植物激素及生理作用激素调节人和高等动物生命活动的调节体液调节神经调节H +、CO 2等的调节激素调节高等动物激素调节动物行为区别与联系条件反射非条件反射反射兴奋的传导高级神经中枢的调节生命活动和调节人体生命活动的调节和免疫人体的稳态内环境与稳态水和无机盐的平衡和调节血糖的调节免疫十、微生物与发酵工程十一、生物与环境内分离提纯发酵过程扩大培养和接种灭菌培养基的配制菌种的选育细胞结构繁殖方式菌落的概念和特点细菌微生物的类群病毒放线菌孢子生殖菌丝体的结构结构增殖过程核衣壳有些具囊膜合成释放装配吸附注入类型意义运用生物固氮培养基的种类微生物的营养培养基配制原则微生物代谢的人工控制发酵的概念和种类微生物的代谢微生物的代谢调节微生物的代谢产物微生物群体的生长规律影响微生物生长的因素微生物的生长微生物群体PH 值温度氧医药食品工业应发酵工程生产传统发酵产品生产食品添加剂生产单细胞蛋白种内互助抵抗力稳定性J 形曲线种群密度年龄组成性别比例出生率特征种群环境生物群落生物个体生态学生物因素非生物因素生态因素光温度种内关系种间关系共生寄生湿地生态系统海洋生态系统淡水生态系统森林生态系统草原生态系统农田生态系统城市生态系统生态系统水生生态系统陆生生态系统类型成分非生物成分:非生物的物质、能量生物成分生产者食物链营养结构结构单向流动碳循环光合作用能量流动功能生物多样性及其保护。
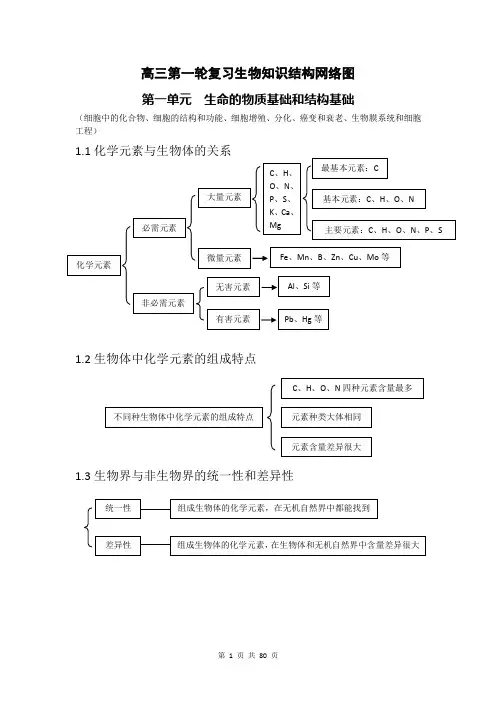
高三第一轮复习生物知识结构网络图第一单元生命的物质基础和结构基础(细胞中的化合物、细胞的结构和功能、细胞增殖、分化、癌变和衰老、生物膜系统和细胞工程)1.1化学元素与生物体的关系1.2生物体中化学元素的组成特点1.3生物界与非生物界的统一性和差异性1.4细胞中的化合物一览表1.5蛋白质的相关计算设 构成蛋白质的氨基酸个数m ,构成蛋白质的肽链条数为n ,构成蛋白质的氨基酸的平均相对分子质量为a , 蛋白质中的肽键个数为x , 蛋白质的相对分子质量为y ,控制蛋白质的基因的最少碱基对数为r ,则 肽键数=脱去的水分子数,为 n m x -= ……………………………………①蛋白质的相对分子质量 x ma y 18-= …………………………………………②或者 x a ry 183-=…………………………………………③1.6蛋白质的组成层次1.7核酸的基本组成单位1.8生物大分子的组成特点及多样性的原因1.9生物组织中还原性糖、脂肪、蛋白质和DNA的鉴定1.10选择透过性膜的特点1.11细胞膜的物质交换功能1.12线粒体和叶绿体共同点1、具有双层膜结构2、进行能量转换3、含遗传物质——DNA4、能独立地控制性状5、决定细胞质遗传6、内含核糖体7、有相对独立的转录翻译系统8、能自我分裂增殖水被选择的离子和小分子其它离子、小分子和大分子亲脂小分子高浓度——→低浓度不消耗细胞能量(ATP)离子、不亲脂小分子低浓度——→高浓度需载体蛋白运载消耗细胞能量(ATP)1.13真核生物细胞器的比较1.14细胞有丝分裂中核内DNA、染色体和染色单体变化规律注:设间期染色体数目为2N个,未复制时DNA含量为2a。
1.15理化因素对细胞周期的影响注:+表示有影响1.16细胞分裂异常(或特殊形式分裂)的类型及结果1.171.18已分化细胞的特点1.19分化后形成的不同种类细胞的特点1.20分化与细胞全能性的关系G2分化程度越低全能性越高,分化程度越高全能性越低分化程度高,全能性也高分化程度最低(尚未分化),全能性最高1.211.22癌细胞的特点1.23衰老细胞的特点水分减少,细胞萎缩,体积变小,代谢减慢 酶的活性降低色素积累,阻碍细胞内物质交流和信息传递 细胞核体积增大,染色体固缩,染色加深 细胞膜通透性改变,物质运输功能降低扁平梭形 球形成纤维细胞癌变如癌细胞膜糖蛋白减少,细胞黏着性降低,易转移扩散。

元素化合物复习中“点”-“线”-“面”-“体”的建构---碱和盐专题复习教学解析元素化合物知识是中学化学课程的重要组成部分,约占中学化学教学内容的60%,它贯穿整个中学化学学习。
无论是概念教学中,还是学生头疼的化学实验、化学计算,实际上是对元素化合物知识在“定性”和“定量”上的综合应用。
由于元素化合物的知识相对繁杂、零碎和分散,学生容易存在知识遗漏与混淆,内容一综合,学生就感觉无从下手了。
所以掌握好元素化合物知识对化学学习很重要。
《碱和盐专题复习》采用“点”-“线”-“面”-“体”的方法,以期在学生头脑中系统、立体的构建氢氧化钠、碳酸钠的知识网络,将其纳入学生的认知结构中,使学生学会从全面、立体的视角认识物质间的转化关系。
一、再现知识主线,弥补知识缺陷复习课不是新课的重复,元素化合物复习时,巧妙设计好问题和载体,围绕元素化合物的基础知识、主干知识、核心知识有效展开复习,从而使学生的知识得以巩固,能力得以提升。
氢氧化钠是初中化学学习中最常见的碱,是碱的代表物,碳酸钠是最常见的盐,是盐的代表物,碱的化学性质即氢氧根离子跟其它离子发生有效的相互作用,碳酸钠的化学性质即碳酸根离子跟其它离子发生有效的相互作用,发生复分解反应的,或产生水、或产生气体或产生沉淀。
学生在学习中感觉物质鉴别、除杂和与实验有关的计算不能灵活运用。
而单纯再现基础知识,并不能提高学生的认识能力。
所以,本节课选取了氢氧化钠变质为情景素材和内容载体,将与氢氧化钠、碳酸钠有关的化学反应蕴含在一个个真实的问题中。
把知识结构转化为问题结构。
学生在解决问题的过程中,掌握知识,形成方法。
1.氢氧化钠遇见空气变质了2.氢氧化钠全部变质了吗?选用哪种方法去除碳酸钠的干扰?除去了碳酸钠的干扰,如何检验氢氧化钠的存在?3.如何除去氢氧化钠中的碳酸钠,以提纯氢氧化钠?二、 构建知识网络,完善认知结构在解决问题的过程中,再现基础知识,以元素化合物之间的转化关系为主干线,由知识点到知识链,最终形成知识网。
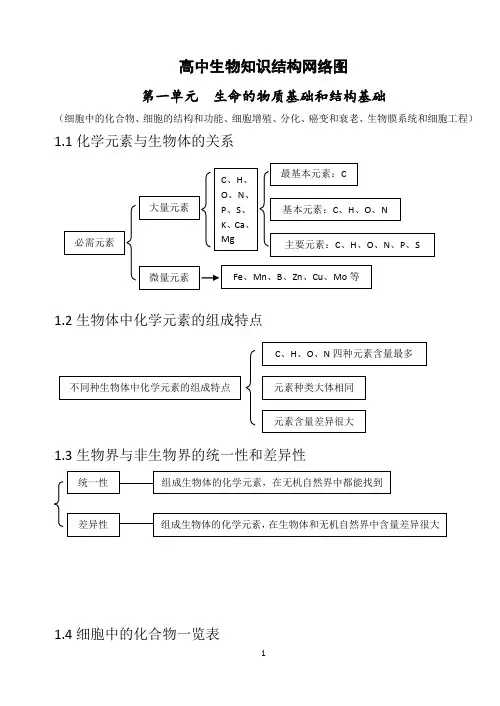
高中生物知识结构网络图第一单元 生命的物质基础和结构基础(细胞中的化合物、细胞的结构和功能、细胞增殖、分化、癌变和衰老、生物膜系统和细胞工程)1.1化学元素与生物体的关系1.2生物体中化学元素的组成特点1.3生物界与非生物界的统一性和差异性1.4细胞中的化合物一览表1.5蛋白质的相关计算设 构成蛋白质的氨基酸个数m ,构成蛋白质的肽链条数为n ,构成蛋白质的氨基酸的平均相对分子质量为a , 蛋白质中的肽键个数为x , 蛋白质的相对分子质量为y ,控制蛋白质的基因的最少碱基对数为r ,则 肽键数=脱去的水分子数,为 n m x -= …………………………………①蛋白质的相对分子质量 x ma y 18-= ………………………………………②或者xary183-=………………………………………③1.6蛋白质的组成层次1.7核酸的基本组成单位1.8生物大分子的组成特点及多样性的原因1.9生物组织中还原性糖、脂肪、蛋白质和DNA的鉴定1.10选择透过性膜的特点1.11水被选择的离子和小分子其它离子、小分子和大分子亲脂小分子高浓度——→低浓度不消耗细胞能量(ATP)离子、不亲脂小分子低浓度——→高浓度需载体蛋白运载消耗细胞能量(ATP)1.12线粒体和叶绿体共同点1、具有双层膜结构2、进行能量转换3、含遗传物质——DNA4、能独立地控制性状5、内含核糖体6、有相对独立的转录翻译系统7、能自我分裂增殖1.13真核生物细胞器的比较1.14细胞有丝分裂中核内DNA、染色体和染色单体变化规律1.15理化因素对细胞周期的影响1.16细胞分裂异常(或特殊形式分裂)的类型及结果1.18已分化细胞的特点 1.19分化后形成的不同种类细胞的特点G 21.20分化与细胞全能性的关系1.211.22癌细胞的特点分化程度越低全能性越高,分化程度越高全能性越低分化程度高,全能性也高分化程度最低(尚未分化),全能性最高扁平梭形 球形成纤维细胞癌变如癌细胞膜糖蛋白减少,细胞黏着性降低,易转移扩散。
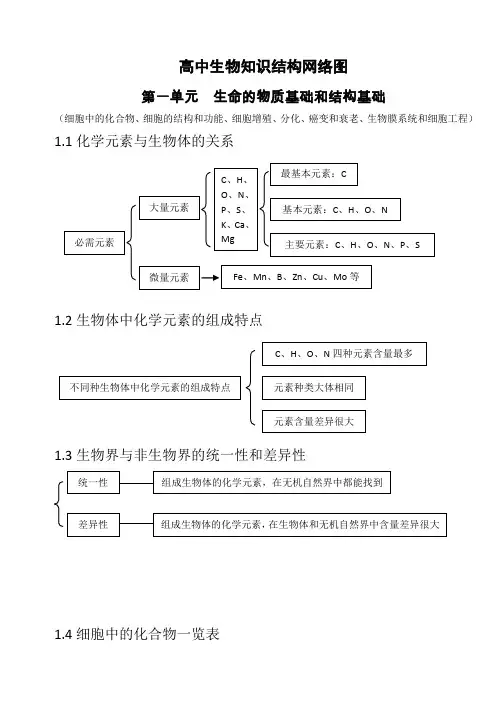
高中生物知识结构网络图第一单元 生命的物质基础和结构基础(细胞中的化合物、细胞的结构和功能、细胞增殖、分化、癌变和衰老、生物膜系统和细胞工程)1.1化学元素与生物体的关系1.2生物体中化学元素的组成特点1.3生物界与非生物界的统一性和差异性1.4细胞中的化合物一览表1.5蛋白质的相关计算设 构成蛋白质的氨基酸个数m ,构成蛋白质的肽链条数为n ,构成蛋白质的氨基酸的平均相对分子质量为a , 蛋白质中的肽键个数为x , 蛋白质的相对分子质量为y ,控制蛋白质的基因的最少碱基对数为r ,则 肽键数=脱去的水分子数,为 n m x -= …………………………………①蛋白质的相对分子质量 x ma y 18-= ………………………………………②或者 x a ry 183-=………………………………………③1.6蛋白质的组成层次1.7核酸的基本组成单位1.8生物大分子的组成特点及多样性的原因1.9生物组织中还原性糖、脂肪、蛋白质和DNA的鉴定1.10选择透过性膜的特点1.111.12线粒体和叶绿体共同点水被选择的离子和小分子其它离子、小分子和大分子亲脂小分子高浓度——→低浓度不消耗细胞能量(ATP)离子、不亲脂小分子低浓度——→高浓度需载体蛋白运载消耗细胞能量(ATP)1、具有双层膜结构2、进行能量转换3、含遗传物质——DNA4、能独立地控制性状5、内含核糖体6、有相对独立的转录翻译系统7、能自我分裂增殖1.13真核生物细胞器的比较1.14细胞有丝分裂中核内DNA、染色体和染色单体变化规律注:设间期染色体数目为2N个,未复制时DNA含量为2a。
1.15理化因素对细胞周期的影响注:+ 表示有影响1.16细胞分裂异常(或特殊形式分裂)的类型及结果1.18已分化细胞的特点 1.19分化后形成的不同种类细胞的特点1.20分化与细胞全能性的关系G 2分化程度越低全能性越高,分化程度越高全能性越低1.211.22癌细胞的特点1.23衰老细胞的特点水分减少,细胞萎缩,体积变小,代谢减慢 酶的活性降低扁平梭形 球形成纤维细胞癌变如癌细胞膜糖蛋白减少,细胞黏着性降低,易转移扩散。
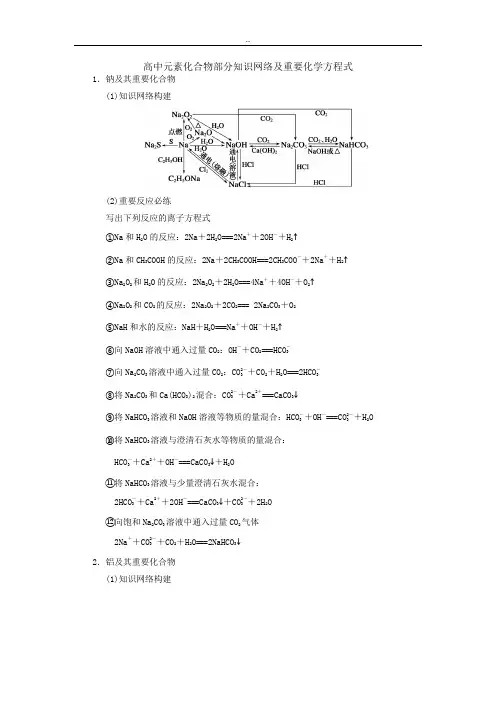
高中元素化合物部分知识网络及重要化学方程式1.钠及其重要化合物(1)知识网络构建(2)重要反应必练写出下列反应的离子方程式①Na和H2O的反应:2Na+2H2O===2Na++2OH-+H2↑②Na和CH3COOH的反应:2Na+2CH3COOH===2CH3COO-+2Na++H2↑③Na2O2和H2O的反应:2Na2O2+2H2O===4Na++4OH-+O2↑④Na2O2和CO2的反应:2Na2O2+2CO2=== 2Na2CO3+O2⑤NaH和水的反应:NaH+H2O===Na++OH-+H2↑⑥向NaOH溶液中通入过量CO2:OH-+CO2===HCO-3⑦向Na2CO3溶液中通入过量CO2:CO2-3+CO2+H2O===2HCO-3⑧将Na2CO3和Ca(HCO3)2混合:CO2-3+Ca2+===CaCO3↓⑨将NaHCO3溶液和NaOH溶液等物质的量混合:HCO-3+OH-===CO2-3+H2O⑩将NaHCO3溶液与澄清石灰水等物质的量混合:HCO-3+Ca2++OH-===CaCO3↓+H2O⑪将NaHCO3溶液与少量澄清石灰水混合:2HCO-3+Ca2++2OH-===CaCO3↓+CO2-3+2H2O⑫向饱和Na2CO3溶液中通入过量CO2气体2Na++CO2-3+CO2+H2O===2NaHCO3↓2.铝及其重要化合物(1)知识网络构建(2)重要反应必练写出下列反应的离子方程式①Al和NaOH溶液的反应:2Al+2OH-+2H2O===2AlO-2+3H2↑②Al(OH)3和NaOH溶液的反应:Al(OH)3+OH-===AlO-2+2H2O③Al(OH)3和盐酸的反应:Al(OH)3+3H+===Al3++3H2O④Al2O3和NaOH的反应:Al2O3+2OH-===2AlO-2+H2O⑤Al2O3和盐酸的反应:Al2O3+6H+===2Al3++3H2O⑥NaAlO2和少量盐酸的反应:AlO-2+H++H2O === Al(OH)3↓⑦NaAlO2和过量盐酸的反应:AlO-2+4H+===Al3++2H2O⑧向NaAlO2溶液中通入过量CO2气体:AlO-2+CO2+2H2O===Al(OH)3↓+HCO-3⑨将NaAlO2与NaHCO3混合:AlO-2+HCO-3+H2O===Al(OH)3↓+CO2-3⑩将NaAlO2与AlCl3溶液混合:3AlO-2+Al3++6H2O===4Al(OH)3↓⑪向AlCl3溶液中加入过量NaOH溶液:Al3++4OH-===AlO-2+2H2O⑫向AlCl3溶液加入过量氨水:Al3++3NH3·H2O===Al(OH)3↓+3NH+4⑬将AlCl3溶液与NaHCO3溶液混合:Al3++3HCO-3===Al(OH)3↓+3CO2↑3.铁及其化合物(1)知识网络构建(2)重要反应必练写出下列反应的方程式,是离子反应的写离子方程式。

初中化学 专题二 物质的组成、结构和分类23234()e,Fe Fe ++⎧⎪⎪⎪⎪⎨⎪⎪⎩1.决定元素种类的是核电荷数(即质子数), 即一种元素和另一种元素的区别是质子数或核电荷数不同2.决定元素化学性质的是最外层电子数,概念:具有相同核电荷数即质子数的一类原子的总称 同种元素具有相同的核电荷数,如F ,都称为铁元素, 但最外层电子数不同,所以它们的化学性质不同3.核电荷数相同的粒子不一定是同种元素,如Ne,HF,H O,NH ,CH 元素223⎧⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎨⎪⎪⎪⎪⎪⎪⎧⎪⎪⎪↓↑⎨⎪⎪⎪⎩⎩分类:金属元素,非金属元素,稀有气体元素种类:地壳中含量居前四位的元素:氧,硅,铝,铁;生物细胞中居前四位的元素:碳,氢,氧,氮表示方法:元素符号,如 氮N,氢H,氧O 单质:同种元素组成,如:Fe,O 存在形式:化合分解 化合物:不同种元素组成,如:Fe O 1.3.υ+-↑分概念:保持物质化学性质的最小微粒分子只保持物质化学性质,物理性质是多个分子集体表现,单个分子无法体现。
2.构成物质的微粒有分子,原子,离子,由什么微粒直接构成,其化学性质由什么来保持。
如:保持NaCl 化学性质的最小微粒为Na 和Cl 由分子构成的物质在发生物理变化时,分子本身没变化分子 4.分子由原子构成,在化学变化中分子可分性质:1.体积小,质量小; 2.不断运动;T ,22,,;,P d υυ⎧⎪⎪⎪⎪⎪⎪⎪⎪⎨⎪⎪⎪↑↓↓⎪↑↑↓⎪⎪⎪⎪⎩子分子分子分子;T 3.相互间有间隔;T 4.同种分子化学性质相同,不同种分子化学性质不同。
表示方法:化学式 如:H O,O1.⎧⎪⎧⎨⎨⎪⎩⎩≈概念:化学变化中的最小微粒1.原子是构成物质的一种微粒,可直接构成物质2.在化学变化中,一种原子不会变成另一种原子, 只是分子破裂,原子重新组合构成别的分子或物质核外电子(带负电)结构:原子(不带电)质子(带正电)原子核(带正电)原子中子(不带电)相等关系:相对原子质量质量数=质子数+中子数一个原子只有一个原子核,体积很小,位于原子中心,集中原4.⎧⎪⎪⎪⎪⎪⎪⎪⎪⎪⎨⎪⎪⎪⎪⎪⎪⎪⎪⎪⎩子全部正电荷2.由于原子质量很小,所以原子核几乎集中了原子的全部质量3.电子所带电荷量与质子所带电荷量相等而电性相反,所以原子显中性原子核内质子数不一定等于中子数2334+-+-+--+⎧⎪⎧⎧>⎪⎪⎪⎨⎪<⎪⎪⎩⎨⎨⎧⎪⎪⎨⎪⎪⎩⎩概念:带电的原子或原子团阳离子--带正电荷,如:Na ,核电荷数核外电子数按离子所带电荷的电性分阴离子--带负电荷,如:Cl ,核电荷数核外电子数离子分类:单核离子(简单离子)--带电荷的原子,如:Na ,Cl按离子的构成来分多核离子(复杂离子)--带电荷的原子团,如CO ,ClO ,NO ,NH 离子所带电荷数=核电荷数-核外电子数,如:⎪⎪⎪⎪⎪⎩2222422343⎧⎪⎧⎧⎪⎪⎪⎪⎨⎪⎪⎪⎪⎪⎩⎪⎪⎪⎪⎧⎧⎨⎪⎨⎪⎪⎪⎪⎪⎨⎪⎪⎨⎪⎪⎪⎪⎪⎩⎪⎪⎪⎪⎩⎩混合物金属 如:Fe,Cu...单质非金属 如:C,S,H ...稀有气体 如:He,Ne,Ar...分类氧化物 如:MgO,H O,CO ...纯净物酸 如:H SO ,HCl...无机化合物化合物碱 如:NaOH,Ca(OH)...盐 如:NaCl,Na CO ...有机化合物,如CH ,CH COOH ⎪⎪⎪⎪⎪⎪⎪⎩定义相同点区别联系原子分子化学变化中最小微粒保持物质化学性质的最小微粒1都是构成物质的基本粒子;2都有一定间隔;3都在不停运动;4不/同种分子化学性质不/相同,不/同种原子性质不/相同化学变化中不能再分化学变化中可再分原子 分子物质构成构成构成定义区别联系应用范围元素原子具有相同核电荷数的一类原子的总称化学变化中的最小微粒是同类原子的总称,只讲种类,不讲个数,无数量多少的含义是微观粒子,既讲种类,又讲数量原子的核电荷数 元素种类原子最外层电子数 元素化学性质决定决定物质宏观组成物质微观组成纯净物混合物概念由同种物质组成两种或两种以上的物质组成组成 1 宏观:由同种物质组成2 微观:由同种微粒构成,对于分子构成的物质而言,由同种分子构成3 有固定不变的组成 1 宏观:由两种或两种以上的物质组成2 微观:由不同微粒构成,若是分子构成则不同分子组成3 无固定组成性质有固定熔、沸点无固定熔沸点,这些物质间发生化学反应,各持自己原有性质举例H ,O 空气,牛奶,牙膏转化纯净物 混合物两种或两种以上物质的简单混合提纯,分离2纯净物纯净纯净22原子离子概念电性表示方法数量关系相似点及转化化学变化中的最小微粒带电的原子或原子团中性,不带电带电阳离子-正电阴离子-负电元素符号;如纳原子,Na,2个纳原子:2Na 元素符号右上角先写出电荷数(1省略),后标出电性(+或-)。

高中生物知识结构网络图第一单元 生命的物质基础和结构基础(细胞中的化合物、细胞的结构和功能、细胞增殖、分化、癌变和衰老、生物膜系统和细胞工程) 1.1化学元素与生物体的关系 1.2生物体中化学元素的组成特点1.3生物界与非生物界的统一性和差异性1.4细胞中的化合物一览表1.5蛋白质的相关计算设 构成蛋白质的氨基酸个数m , 构成蛋白质的肽链条数为n ,构成蛋白质的氨基酸的平均相对分子质量为a , 蛋白质中的肽键个数为x , 蛋白质的相对分子质量为y ,控制蛋白质的基因的最少碱基对数为r , 则 肽键数=脱去的水分子数,为 n m x-= …………………………………①蛋白质的相对分子质量x ma y 18-= ………………………………………②或者x a ry 183-=………………………………………③ 1.6蛋白质的组成层次1.7核酸的基本组成单位1.8生物大分子的组成特点及多样性的原因1.9生物组织中还原性糖、脂肪、蛋白质和DNA的鉴定1.10选择透过性膜的特点1.11细胞膜的物质交换功能1.12线粒体和叶绿体共同点1、具有双层膜结构2、进行能量转换3、含遗传物质——DNA4、能独立地控制性状5、含核糖体6、有相对独立的转录翻译系统7、能自我分裂增殖1.13真核生物细胞器的比较水被选择的离子和小分其它离子、小分子和大分亲脂小分子高浓度——→低浓度不消耗细胞能量(ATP)离子、不亲脂小分子低浓度——→高浓度需载体蛋白运载消耗细胞能量(ATP)1.14细胞有丝分裂中核DNA 、染色体和染色单体变化规律注:设间期染色体数目为2N 个,未复制时DNA 含量为2a 。
1.15理化因素对细胞周期的影响注:+ 表示有影响1.16细胞分裂异常(或特殊形式分裂)的类型及结果1.17细胞分裂与分化的关系1.18已分化细胞的特点 1.19分化后形成的不同种类细胞的特点1.20分化与细胞全能性的关系G 2成纤维细胞癌变永生细胞1.23衰老细胞的特点1.26细胞工程水分减少,细胞萎缩,体积变小,代谢减慢 酶的活性降低色素积累,阻碍细胞内物质交流和信息传递 细胞核体积增大,染色体固缩,染色加深 细胞膜通透性改变,物质运输功能降低-高尔基体-细胞-溶酶脱再1.24细胞的死亡1.27植物组织培养与动物细胞培养的比较1.28植物体细胞杂交与动物细胞融合的比较蝌蚪尾部消失 花瓣凋萎第二单元 生物的新代Ⅰ 植物代部分:酶与ATP 、光合作用、水分代、矿质营养、生物固氮 2.1酶的分类2.2酶促反应序列及其意义酶促反应序列 生物体的酶促反应可以顺序连接起来,即第一个反应的产物是第二个反应的底物,第二个反应的产物是第三个反应的底物,以此类推,所形成的反应链叫酶促反应序列。
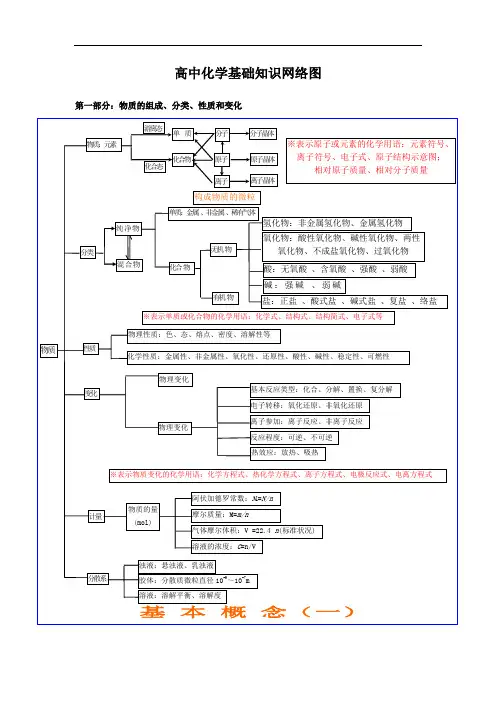
高中化学基础知识网络图第一部分:物质的组成、分类、性质和变化第二部分:基本理论(物质结构、化学反应速率、化学平衡、电解质溶液)第三部分:元素化合物转化关系第四部分:有机化学有机抓住官能团的性质烃 烃的衍生物 糖 蛋白质:多肽、氨基酸(官能团:—NH 2和—COOH ) 高分子化合物 链烃 (脂肪烃) 环烃饱和链烃烷烃:C n H 2n+2(n ≥1)R —CH 3 不饱和链烃 烯烃:C n H 2n (n ≥2) R —CH=CH 2二烯烃:C n H 2n-2(n ≥4)R —CH=CH —CH=CH 2 炔烃:C n H 2n-2(n ≥2) R —C ≡CH环烷烃C n H 2n (n ≥3)芳香烃(苯和苯的同系物)C n H 2n-6(n ≥6)天然高分子:橡胶(聚异戊二烯)、多糖、蛋白质 R卤代烃(官能团:—X ):饱和一卤代烃C n H 2n+1X(n ≥1)R —X 醇 (官能团:—OH ):饱和一元醇C n H 2n+1OH(n ≥1)R —OH 醚 C n H 2n+2O (n ≥2)R —O —R 酚(苯酚)(官能团:—OH )C n H 2n-6O (n ≥2) OH羧酸 (官能团:—COOH ):饱和一元羧酸 C n H 2n+1O 2 (n ≥1)R —COOH醛 (官能团:—CHO )C n H 2n O (n ≥1)R —CHO 酮 (官能团:—CO —)C n H 2n O (n ≥3)R —CO —R ’酯 (官能团:—COO —R ):饱和一元羧酸和饱和一元醇形成的酯 C n H 2n O 2 (n ≥2)R —COOR ’硝基化合物(官能团—NO 2)R —NO 2胺(官能团—NH 2)R —NH 2 单糖:葡萄糖、果糖C 6H 12O 6(互为同分异构) 二糖:蔗糖、麦芽糖C 12H 22O 11(互为同分异构)多糖:淀粉、纤维素(C 6H 12O 6)n (n 值不同) 合成高分子合成塑料合成橡胶合成纤维有机化合物。
高中生物知识结构网络图第一单元 生命的物质基础和结构基础(细胞中的化合物、细胞的结构和功能、细胞增殖、分化、癌变和衰老、生物膜系统和细胞工程)1.1化学元素与生物体的关系1.2生物体中化学元素的组成特点1.3生物界与非生物界的统一性和差异性1.4细胞中的化合物一览表1.5蛋白质的相关计算设 构成蛋白质的氨基酸个数m ,构成蛋白质的肽链条数为n ,构成蛋白质的氨基酸的平均相对分子质量为a , 蛋白质中的肽键个数为x , 蛋白质的相对分子质量为y ,控制蛋白质的基因的最少碱基对数为r ,则 肽键数=脱去的水分子数,为 n m x -= …………………………………①蛋白质的相对分子质量 x ma y 18-= ………………………………………②或者xary183-=………………………………………③1.6蛋白质的组成层次1.7核酸的基本组成单位1.8生物大分子的组成特点及多样性的原因1.9生物组织中还原性糖、脂肪、蛋白质和DNA的鉴定1.10选择透过性膜的特点1.11水被选择的离子和小分子其它离子、小分子和大分子亲脂小分子高浓度——→低浓度不消耗细胞能量(ATP)离子、不亲脂小分子低浓度——→高浓度需载体蛋白运载消耗细胞能量(ATP)1.12线粒体和叶绿体共同点1、具有双层膜结构2、进行能量转换3、含遗传物质——DNA4、能独立地控制性状5、内含核糖体6、有相对独立的转录翻译系统7、能自我分裂增殖1.13真核生物细胞器的比较1.14细胞有丝分裂中核内DNA、染色体和染色单体变化规律1.15理化因素对细胞周期的影响注:+ 表示有影响1.16细胞分裂异常(或特殊形式分裂)的类型及结果1.18已分化细胞的特点 1.19分化后形成的不同种类细胞的特点G 21.20分化与细胞全能性的关系1.211.22癌细胞的特点分化程度越低全能性越高,分化程度越高全能性越低分化程度高,全能性也高分化程度最低(尚未分化),全能性最高扁平梭形球形成纤维细胞癌变如癌细胞膜糖蛋白减少,细胞黏着性降低,易转移扩散。
各类物质之间的相互转化关系的网络图〖复习要点〗:掌握一个知识网络、理解两种反应条件、了解四种离子检验、熟记忆六种物质性质。
1.酸、碱、盐、氧化物之间相互转化关系网络图2.理解两种反应条件复分解反应发生的条件:(1)从定以上分析:复分解反应是两种化合物相互交换成份生成另外两种化合物的反应。
判断一个反应是否是复分解反应不能仅仅依据反应物和生成物的种类来判断,还必须看反应的实质。
如:2NaOH + CO2=Na2CO3+H2O就不属于复分解反应,因为两种反应物没有相互交换成份。
再如:CaCO3+2HCl=CaCl2+H2O+CO2↑,从形式上来看,虽然该反应的产物有三种化合物生成,但却属于复分解反应,该反应的实质是:CaCO3+2HCl=CaCl2+H2CO3,H2CO3不稳定分解为H2O和CO2,因此该却反应属于复分解反应。
(2)复分解反应发生的条件是:①对于反应物来说:酸与碱反应,二者至少有一种要溶于水;酸与盐反应是酸必须溶于水;盐与碱、盐与盐反应时,两种反应物必须全部溶于水。
②对于生成物来说要么有水生成,要么有沉淀生成,要么有气体生成。
金属与盐溶液发生置换反应的条件:金属与盐溶液发生置换反应的条件是(1) 金属的位置:只有排在前面的金属才能把后面的金属从其盐溶液中置换出来;(2) 特殊性:由于钾、钙、钠的化学性质非常活泼,在盐溶液中它们会首先与水反应生成相应的碱和氢气,因而不会置换出盐中的金属;(3) 盐必须溶于水。
(4) 铁与盐溶液反应时生成+2价的亚铁盐,金属与铁盐反应时,要用+2价的亚铁盐。
3.四种离子的检验检验方法(1)SO42-的检验: Ba2+和HNO3→BaSO4(白色沉淀)(2)Cl-的检验: AgNO3和HNO3→AgCl(白色沉淀)(3)NH4+的检验:OH-→NH3→湿润的红色石蕊试纸由红色变蓝色(4)CO32-的检验:HCl→CO2→澄清的石灰水变浑浊4.熟记六种物质复习时,应重点记忆三类物质的典型代表物的物理性质、化学性质、用途:(1)酸的代表物:盐酸、稀硫酸;(2)碱的代表物:氢氧化钠、氢氧化钙;(3)盐的代表物:碳酸钠、硫酸铜。
中考知识点(四)——物质间的转化与推断一、初中化学物质间转化网络关系图1.以碳、氧元素为中心的各物质的转化C CH4CuOFe3O4(1) (2) (5) H2CO3 (23) (21) (20)(22)(6) (7)2(8) (9) (17)(10) (11) Na2CO3 (14) (15) (16)(18)CaCO3 H2O2 CO物质之间转化关系的化学方程式:(1)2C + O2点燃 2CO(2)C + O2点燃 CO2 C + 2CuO 高温 2Cu + CO2↑ 3C+2Fe2O高温4Fe+3CO2↑(3)2CO + O2点燃 2CO2 3CO+Fe2O高温2Fe+3CO2 CO + CuO △ Cu + CO2(4)CO2 + C 高温 2CO(5)CH4+ 2O2点燃 CO2+ 2H2O(6)CO2 + H2O = H2CO3(7)H2CO3 = H2O + CO2↑(8)CO2 + 2NaOH = Na2CO₃ + H2O(9)Na2CO3 + H2SO4 = Na2SO4 + H₂O + CO₂↑ Na2CO3 + 2HCl = 2NaCl + H₂O + CO₂↑(10)CaCO3 + 2HCl = CaCl₂ + H₂O + CO₂↑ CaCO3 高温CaO + CO2↑(11)CO2 + Ca(OH)2 = CaCO3↓+ 2H2O(12)2H2O通电2H2↑+ O2↑(13)2H2 + O2点燃 2H2O 3H2 + Fe2O3高温 2Fe + 3H2O H2 + CuO 加热 Cu + H2O(14)2H2O2 MnO2 2H2O + O2↑(15)2H2O2 MnO2 2H2O + O2↑(16)O2 + 2C 点燃 2CO(17)CO 2 + C 高温 2CO(18)2CO + O 2 点燃 2CO 2(19)O 2 + C 点燃 CO 2(20)2O 2 + 3Fe 点燃 Fe 3O 4(21)O 2 + 2Cu △ 2CuO(22)Fe 2O 3 + 3CO 高温 2Fe + 3CO 2(23)CuO + H 2 加热 Cu + H 2O CuO + H 2SO 4 = CuSO 4 + H 2O2.以钙、铁元素为中心的各物质的转化CaCO 3 FeCl 3 Fe 3O 4(1) (2) (3) (14) (13) (12) (7) CaCl ₂ (6) CaO Fe(OH)FeCl 2(5) (4) (15) (16) (11) (9) Ca(OH)2 FeSO 4物质之间转化关系的化学方程式:(1)CaCO 3 + 2HCl = CaCl ₂ + H ₂O + CO ₂↑(2)CaCl 2 + Na 2CO 3 = CaCO 3↓+ 2NaCl CaCl 2 + K 2CO 3 = CaCO 3↓+ 2KCl(3)CaCO 3 高温CaO + CO 2↑(4)CaO + H 2O = Ca(OH)2(5)Ca(OH)2 + 2HCl = CaCl 2 + 2H 2O Ca(OH)2 + MgCl 2 = Mg(OH)2↓+ CaCl 2(6)Ca(OH)2 +CO 2=CaCO ₃↓+ 2H 2O Ca(OH)2 + Na 2CO 3 = CaCO 3↓+ 2NaOH Ca(OH)2 + K 2CO 3= CaCO 3↓+ 2KOH(7)3Fe + 2O 2 点燃 Fe 3O 4(8)Fe + 2HCl = FeCl 2 + H 2↑ Fe + CuCl 2 = FeCl 2 + Cu(9)Fe + H 2SO 4 = FeSO 4 + H 2↑ Fe + CuSO 4 = FeSO 4 + Cu(10)Fe 2O 3 + 3CO 高温 2Fe + 3CO 2 Fe 2O 3 + 3H 2 高温 2Fe + 3H 2O(11)Fe 2O 3 + 3H 2SO 4 = Fe 2(SO 4)3 + 3H 2O(12)Fe 2O 3 + 6HCl = 2FeCl 3 + 3H 2O(13)Fe(OH)3 + 3HCl = FeCl 3 + 3H 2O(14)FeCl 3 + 3NaOH = Fe(OH)3↓+ 3NaCl 2FeCl 3 + 3Ca(OH)2 = 2Fe(OH)3↓+ 3CaCl 2(15)2Fe(OH)3 + 3H 2SO 4 = Fe 2(SO 4)3 + 6H 2O(16)Fe 2(SO 4)3 + 6NaOH = 2Fe(OH)3↓+ 3Na 2SO 4 Fe 2(SO 4)3 + 3Ca(OH)2 = 2Fe(OH)3↓+3CaSO 43.以酸和碱为中心的知识网络酸碱指示剂CO2(2) (3) (4) (6) (7)Fe2O3 NaOH Na2CO3 H2SO4物质之间反应的化学方程式:(1)Fe + 2HCl = FeCl2 + H2↑(2)Fe2O3 + 6HCl = 2FeCl3 + 3H2O(3)HCl + NaOH = NaCl + H₂O(4)2HCl + Na2CO3 = 2NaCl + H₂O + CO₂↑(5)2HCl + Ca(OH)2 = CaCl2 + 2H2O(6)Ca(OH)2 + Na2CO3 = CaCO3↓ + 2NaOH(7)H2SO4 + Ca(OH)2 = CaSO4+ 2H2O(8)Ca(OH)2 + CO2 = CaCO3↓ + 2H2O4.以几种盐为中心的各物质的转化4 FeSO4物质之间转化关系的化学方程式:(1)CaCO3 + 2HCl = CaCl₂ + H₂O + CO₂↑ CaCO3 高温CaO + CO2↑(2)Na2CO3 + CaCl2 = CaCO3↓+ 2NaCl Na2CO3 + Ca(OH)2 = CaCO3↓ + 2NaOH (3)Na2CO3 + 2HCl= 2NaCl + H₂O + CO₂↑ Na2CO3 + H2SO4 = Na2SO4 + H₂O + CO₂↑(4)Na2CO3 + 2HCl= 2NaCl + H₂O + CO₂↑ Na2CO3 + CaCl2 = CaCO3↓+ 2NaCl(5)NaCl+ AgNO3 = AgCl↓ + NaNO3(6)AgNO3 + NaCl = AgCl↓ + NaNO3 AgNO3 + HCl = AgCl↓ + HNO3(7)BaCl2+ 2AgNO3 = 2AgCl↓ + Ba(NO3)2(8)BaCl2 + H2SO4 = BaSO4↓ + 2HCl BaCl2 + Na2SO4 =BaSO4↓ + 2NaCl(9)CuSO4 + Ba(OH)2 = Cu(OH)2↓+ BaSO4↓ CuSO4 + BaCl2 = CuCl2 + BaSO4↓(10)CuSO4 + Fe = FeSO4 + Cu(11)CuSO4 + 2NaOH = Cu(OH)2↓+ Na2SO4 CuSO4 + Ca(OH)2 = Cu(OH)2↓+ CaSO4二、推断突破口1.物质的颜色(1)固体物质的颜色白色固体:无水CuSO4、Mg0、P2O5、Ca0、Ca(OH)2、NaOH、 NaCl、Na2CO3等红色固体:Cu、Fe2O3等暗红色固体:红磷等绿色固体:Cu2(OH)2C03等淡黄色固体:S等黑色固体:C(木炭粉)、Cu0、MnO2、Fe3O4、Fe(粉)等紫黑色固体:KMnO4等(2)沉淀的颜色(七种常见沉淀)白色:BaSO4、AgCl、CaCO3、BaCO3、Mg(OH)2蓝色:Cu(OH)2红褐色:Fe(OH)3(3)溶液的颜色蓝色溶液:含Cu2+的溶液,如CuSO4溶液黄色溶液:含Fe3+的溶液,如FeCl3溶液浅绿色溶液:含Fe2+的溶液,如FeSO4溶液紫色溶液:KMnO4溶液、紫色石蕊试液(4)火焰的颜色淡蓝色火焰:CH4、H2、S在空气中燃烧发出淡蓝色火焰蓝色火焰:C0在空气中燃烧发出蓝色火焰蓝紫色火焰:S在纯氧中燃烧发出蓝紫色火焰2.物质的气味(1)有刺激性气味的气体:HCl、SO2、NH3等(2)无色无味的气体:O2、H2、N2、CO2、CH4、CO(剧毒)3.特殊反应条件(1)点燃:一般有O2参加反应(2)高温:主要有4个化学反应3CO+Fe2O高温2Fe+3CO2 CaCO3 高温CaO+CO2↑ CO2+C 高温 2CO C+2CuO高温2Cu+CO2↑(3)通电:主要有3个化学反应2H2O通电2H2↑+O2↑ 2Al2O通电4Al+3O2↑(4)催化剂:主要有2个反应2KCl + 3O2↑2H2O2 MnO22H2O+O2↑ 2KClO3MnO₂∆4.化学之最(1)地壳中含量最多的金属元素——铝(2)地壳中含量最多的非金属元素——氧(3)空气中含量最多的物质——氮气(4)最简单的有机物——CH4(5)相对分子质量最小的氧化物——水(6)相同条件下密度最小的气体——氢气(7)相对原子质量最小的原子——氢(8)组成化合物种类最多的元素——碳(9)日常生活中应用最广泛的金属——铁(10)最早使用的金属——铜5.反应的特征现象化学反应的特征现象有:“带火星的木条复燃”、“火星四射”、“澄清石灰水变浑浊”、“物质溶于水温度升高或降低”、“无水硫酸铜变蓝”等模拟预测1. A、B、C是三种初中阶段常见的三种物质,它们之间的反应及转化关系如图所示,(箭头表示转化,横线表示反应),已知B与另外两种物质的元素种类均不相同。
元素化合物的转化关系
、常见金属元素(Na 、Al 、Fe 、Cu )单质及其重要化合物。
1、钠及其重要化合物间的转化关系。
(WH 或 A
HCI
HC1
写出图中标号反应的化学方程式或离子方程式。
① 2Na + 02,
Na 2O 2 (淡黄色)
② 2Na 2O 2 + 2H 2O = 4NaOH + 0 2? 2Na + 2H 2O = 2Na +
+ 20H - + H z f
③ 2Na 2O 2 + 2H 2O = 4NaOH + O 2?
2血2。
2 + 2H 2O = 4Na +
+ 4OH -+ O 2 ?
④ 2Na 2O 2 + 2CO 2 = 2Na 2CO 3 + O 2
⑤ 2NaCl +2 H 2O 通电 2NaOH + H 2 ? + CI 2 ?(氯碱工业) 2C 「+2 H 2O 通电 2OH - + H 2 ? + CI 2 ? ⑥ Na 2CO 3 + H 2O +CO 2 = 2NaHCO 3
CO 3 + H 2O +CO 2 = 2HCO 3
⑦ 2 NaCIO + H 2O +CO 2 = Na 2CO 3+ HCIO 2、铝及其重要化合物间的转化关系。
HC1 出, 通暫熔
融陋'
NaOH
AJ 7
冷浓HNOj
或浓HjSO, NaOH
②
钝化
④HC1
△
NaA10a — 或 ⑦
NaOH
写出图中标号反应的化学方程式或离子方程式。
- 点燃 ① 4AI + 3O 2 2AI 2O 3 ② 2AI + 2NaOH + 2H 2O = 2NaAIO 2 + 3H 2 ? ③ 2AI 2O 3 通电 4AI+3O 2 ? ④ AI 2O 3+6HCI = 2AICI 3+3H 2O
⑤ AI 2O 3 + 2NaOH = 2NaAIO 2 +H 2O
咼温
2AI + Fe 2O 3 2Fe + AI 2O 3
2AI +2OH - +2H 2O = 2AIO 2 +3H 2 ?
+
3+
AI 2O 3 + 6H = 2AI 3
+ 3H 2O AI 2O 3 + 2OH - = 2AIO 2- + H 2O
点燃
* N«CK>
CO Z . H 屮⑥
NaCl 工
C 2H 5OH
C ?H 5ONa
C»(OH )2 HCI
AICI 3
+3NH 3 H 2O = AI(OH) 3 J + 3NH 4CI AICI
3 +3NaOH = AI(OH) 3
J + 3NaCI AI(OH) 3 +
NaOH =NaAIO 2 +2 H 2O AI 3+ +3 AIO 2- +6H 2O = 4AI(OH) 铁及其重要化合物间的转化关系。
FeS
A)
両禺一匹
1
3+
I - .. . +
AI + 3 NH 3 H 2O = AI(OH) 3 J + 3NH 4
AI + 3OH = AI(OH) 3 J AI(OH) 3 + OH - = AIO 2- +2H 2O
NaOH
HC1
Fe(OHk
a+Hp
⑤
④吠叫
KSCN
u HfHQ ⑧ u 一 FeCl,匸=:产
FetOH), △ 或
Cu
③
HC1 写出图中标号反应的化学方程式或离子方程式。
① ② ③ 咼温 ④ ⑤ ⑦ ⑧ 4、
3 Fe +4H 2O … Fe 3O
4 + 4H 2? Fe + 2HCI = FeCI 2 + H 2f 2FeCI 3 + Fe = 3FeCb 2FeCI 3 + Cu = 2FeCI 2 + CuCI 2
2FeCI 2 + CI 2 = 2FeCI 3
4Fe (OH)2 + O 2 + 2H 2O = 4Fe (OH) 3
Fe 2O 3 + 3CO 2Fe + 3CO 2 点燃 3 Fe + 2O 2 : Fe 3O 4 Fe + 2H + = Fe 2+ + 3+ 2+ 2Fe + Fe = 3Fe 3+ 2+ 2+
2Fe + Cu = 2Fe +Cu
2+ 3+ 2 Fe + CI 2 = 2 Fe + 2CI - ⑥ 2 Fe(OH) 3
Fe 2O 3 + 3H 2O
FeCb +3NH 3 H 2O = Fe (OH) 3 J + 3NH 4CI 铜及其重要化合物间的转化关系。
3+
I _ _ .. . +
Fe + 3 NH 3 H 2O = Fe (OH) 3 J + 3NH 4
C U (NO 3)
A
> CuO 吋
HC1
込 CuCl 2
C U (OH)2
写出图中标号反应的化学方程式或离子方程式。
① ② 2Cu + S Cu 2S Cu+4HNO 3 (浓)=Cu(NO 3)2+ 2H 2。
+ 2NO 2 f 3Cu+8HNO 3 (稀)= 3Cu(NO 3)2+ 4H 2O + 2NO f Fe + Cu (NO 3)2 = Fe(NO 3)2+ Cu 「二-C_:2+
CuCI ? 通^ Cu + CI 2f
Cu+4H +2NO 3-= Cu + 2H 2O + 2NO 2^ + - 2+ 木
3Cu+8H +2NO 3 = Cu + 2H 2O + 4NO f Fe + Cu 2+ = Fe 2+ + Cu
写出图中标号反应的化学方程式或离子方程式。
—点燃—点燃
①Cu + CI2 == CuCl2 ② 2Fe + 3C“3FeCb
③2Na0H + Cl 2 = NaCIO + NaCI + H 2O 20H-+ CI2 = CIO -+ Cl -+ H2O
④MnO2+4HCK 浓) ---- MnCl 2+CI2 t + 2H 2O MnO2+4H++2C「------- M n 2++Cl2 t +2出0
⑤2NaCI 通电 2Na + Cl2t
⑥Cl2 + H2O - J HCI + HCIO CI2 + H2O - 〜H ++ C「+ HCIO
⑦Ca(CIO)2 + CO2 + H2O = CaCO3 + 2HCIO
2、硫及其重要化合物间的转化关系。
① Fe + SFeS A 人
③CU+2H2SO4 (浓)CuSO4 +2H2O+SO2T
④H2SO4+ Ba(OH)2 = BaSO4 J +2出。
⑤SO2 +2NaOH = W2SO3 + H2O
⑥SO2 +CI2+ 2H2O = H2SO4 + 2HCI
C+2H2SO4 (浓)2H2O+CO2T +2SO2?
2H++SO42-+ Ba2++2OH '= Ba SO4 +2出0
- 2-
SO2 +20H = S03 + H20
+ 2- -
SO2 +CI2+ 2H2O = 4H +S04 + 2CI
二、常见非金属元素(H、C、N、0、Si、S、Cl)单质及其重要化合物。
1、氯及其重要化合物间的转化关系。
5燃烧
写出图中标号反应的化学方程式或离子方程式。
催化剂
② 2SO2+O2 加热.2SO3
3、氮及其重要化合物间的转化关系。
- -
2-
NaHCO 3 + NaOH = Na 2CO 3 + H 2O
HCO 3 + OH = CO 3 + H 2O
⑥ Ca(HCO 3)2 + 2NaO H =CaCO 3 J +Na 2CO 3+ 2H 2O
①
Ca(OH)3
NH 4C) ③{匕催化利
HC1
严产
△ H.n
NH/H Z O NH/+OH - ⑦
写出图中标号反应的化学方程式或离子方程式。
△
① 2NH 4CI+Ca(OH) 2^=CaCb+2H 2O+2NH 3 f ③ 4NH 3 +5O 2
4NO + 6H 2O
⑤ 3CU+8HNO 3 (稀)= 3Cu(NO 3)2+ 4H 2O + 2NO f ⑥ CU+4HNO 3 (浓)=Cu(NO 3)2+ 2H 20 + 2N0 2 f ⑦ 8NH 3+6NO 2= 7N 2+ 12H 2O
催化剂
②N 2 + 3H 2 高温高压“ 2NH 3
④ 3NO 2 + H 2O = 2HNO 3 + NO
+
-
2+ A
3Cu+8H +2NO 3 = Cu + 2H 2O + 4NO f Cu+4H ++2NO 3- = Cu 2++ 2H 2O + 2NO 2 f
CaCOj*
frCatHC^
Mg
Na0H
叫0鼻宣T HQ *
③NaOH
或叫
------- 时心④巴6耳轮
△
写出图中标号反应的化学方程式或离子方程式。
① 2 Mg + CO 2 点燃 2MgO + C
咼温
② SiO 2 + 2C
Si + 2CO f
③ SiO 2 + 2NaOH = Na 2SQ 3 + H 2O
④ Na 2SiO 3 + 2HCI = 2NaCI + H 2SQ 3 J Na 2SiO 3 + H 2O +CO 2 = H 2SQ 3 J +Na 2CO 3
⑤ 2NaHCO 3
Na 2CO 3 + H 2O +CO 2 f
NaOH
NOj w _ ■ HN (\ ⑥ G
O z
(1
c
NaOH
C ②
碳硅及其重要化合物间的转化关系。
CH
C02十
A
JNaCH。