猪瘟抗体检测
- 格式:ppt
- 大小:1.75 MB
- 文档页数:10

非洲猪瘟病原学检测方法介绍非洲猪瘟(African swine fever, ASF)是一种高致病性的猪病,对于猪养殖业来说是一种严重威胁。
为了及时有效地进行疫情监测和病原学分析,科学家们发展了多种非洲猪瘟病原学检测方法。
本文将对这些检测方法进行详细的探讨。
PCR方法传统PCR1.样品收集:从患病猪只的脾脏、淋巴结或血液中收集样品。
2.DNA提取:使用DNA提取试剂盒将样品中的DNA提取出来。
3.PCR反应体系:设置PCR反应体系,其中包括引物、模板DNA、酶和缓冲液。
4.PCR扩增程序:设定PCR扩增程序,包括一系列不同温度的循环反应。
5.结果分析:利用凝胶电泳的方法,观察PCR产物的大小。
实时定量PCR1.样品收集和DNA提取:与传统PCR相同。
2.PCR反应体系:与传统PCR相同,但引入了荧光探针。
3.实时定量PCR程序:设定实时定量PCR程序,包括多个不同温度的循环反应。
4.数据分析:根据荧光信号的强度和阈值周期数,计算出病毒数量。
优点•灵敏度高:PCR方法能够检测到非洲猪瘟病原体的极低浓度。
•特异性强:引物的设计使得PCR方法能够区分非洲猪瘟病原体和其他相关病原体。
•快速性:PCR方法可以在短时间内得到结果。
缺点•对实验操作要求高:PCR方法需要精确计量样品和试剂。
•易受污染:PCR方法容易受到外部环境中目标DNA的污染。
•不适合现场应用:PCR方法的设备和试剂有一定的成本,不适合一些资源有限的地区。
ELISA方法直接ELISA1.样品准备:从患病猪只的血液中收集样品。
2.酶标板涂层:将非洲猪瘟病毒的抗原涂在酶标板上。
3.样品加入:将已稀释的血清样品加入到酶标板中。
4.洗涤步骤:用洗涤缓冲液洗涤酶标板,去除未结合的抗体。
5.反应步骤:加入与非洲猪瘟病毒抗体标记的酶联二抗。
6.洗涤步骤:洗涤酶标板,去除未结合的酶联二抗。
7.显示步骤:加入底物,使酶与底物反应产生可见的颜色。
8.终止反应:加入终止液停止酶的反应。


非洲猪瘟的实验室检测技术与质量控制非洲猪瘟是一种高度传染性的猪病,对猪养殖业造成了巨大的经济损失。
为了及早发现和控制非洲猪瘟的传播,实验室检测技术和质量控制在疾病监测和病毒鉴定中起着至关重要的作用。
本文将重点介绍非洲猪瘟的实验室检测技术,并探讨质量控制在检测中的重要性。
一、实验室检测技术1. PCR技术聚合酶链反应(PCR)是非洲猪瘟病毒检测中最常用的技术之一。
它能够从动物组织或血液样本中快速检出病毒的核酸。
PCR技术具有高灵敏度和高特异性,可以在感染初期就进行检测。
此外,PCR技术还可以区分非洲猪瘟病毒与其他相关病毒的差异,提高了检测的准确性。
2. ELISA技术酶联免疫吸附测定法(ELISA)是一种常用的检测非洲猪瘟病毒抗体的技术。
ELISA技术通过检测动物血清中的特定抗体水平来确定是否有非洲猪瘟病毒感染。
ELISA技术具有高效、准确、简便的特点,并可以进行大量样本的快速筛查。
3. 病毒分离与鉴定病毒分离与鉴定是为确定病原体是否存在以及其类型、亚型和基因组序列等信息提供关键数据的技术。
通过将实验室动物感染或组织样本接种到适当的细胞培养物中,可以成功分离非洲猪瘟病毒。
然后,通过电镜观察和核酸测序等方法,可以鉴定病毒的特征和亚型。
二、质量控制在非洲猪瘟实验室检测中,质量控制起着至关重要的作用,可以保证检测结果的准确性和可靠性。
以下是一些常用的质量控制措施:1. 内部质控实验室应建立内部质控计划,包括使用已知标准样本进行日常质控,以确保实验的稳定性和准确性。
这些标准样本应包括阳性对照、阴性对照和质量控制样本,用于验证实验室的操作流程和仪器设备的性能。
2. 外部质控参与外部质控项目有助于实验室评估其检测结果的准确性和可靠性。
外部质控项目由国家或国际组织组织,实验室需按要求参加,接受其他实验室的盲样品检测,并比对结果评估自身实验室的准确性。
3. 人员培训和认证实验室工作人员需要进行相关培训,包括病毒检测技术的理论和实践,操作规范以及质量控制流程。


猪瘟病毒IgG抗体检测ELISA试剂盒使用说明书
【产品简介】
猪瘟病毒(CSFV)是目前危害国内养猪业一种高发病率、高死亡率和高度接触传染的病毒。
在猪的免疫预防工作中,最值得关注的就是强化免疫的接种时机问题。
在过高的抗体水平进行免疫,过高的抗体水平还会中和疫苗,影响疫苗的免疫效果,导致免疫失败;在较低的抗体水平进行免疫,又会出现抗体保护真空期,威胁猪的健康。
该试剂盒检测反映抗体水平,利于指导免疫时机。
【使用时间】
①猪瘟病毒疫苗免疫后免疫效果监测
②平时的抗体监测
【检测原理】
包被经纯化的猪瘟病毒,抗猪IgG抗体作为酶标记抗体,利用间接法来检测被检材料中是否含有猪瘟病毒抗体。
【产品内容】
7. 剩余样品及废弃物应经121℃高压蒸汽灭菌30分钟,或用5.0g/L次氯酸钠等消毒剂处理30分钟后废弃。
【保存与有效期】
于2~8℃避光保存,有效期自成品检定合格之日起为12个月。

4种猪瘟病毒抗体检测方法的比较马超英【摘要】为比较4种猪瘟病毒抗体检测方法的优缺点,应用正向间接血凝试验(IHA),间接ELISA、Dot-ELISA、胶体金免疫层析试纸条(GICA)4种方法分别对142份猪血清样品进行检测.结果表明,间接ELISA方法检出阳性样品119份,IHA检出阳性样品117份,Dot-ELISA检出阳性样品115份,GICA检出阳性样品109份.结果提示,在对猪瘟病毒抗体进行检测时,间接ELISA由于其灵敏性高,可作为首选检测方法,但操作时需要避免假阳性的出现;正向间接血凝试验虽然灵敏度稍低,对血清质量要求高,但结果准确,是猪瘟抗体检测必不可少的检测方法,适合个体检测;胶体金试纸条和dot-ELISA检测时间较短、操作简单、无需特殊仪器设配,由于受其敏感性较低所限,适合对畜群进行检测.【期刊名称】《动物医学进展》【年(卷),期】2012(033)010【总页数】4页(P128-131)【关键词】猪瘟抗体;检测方法;优缺点【作者】马超英【作者单位】青海省海西州乌兰县铜普兽医站,青海乌兰817000【正文语种】中文【中图分类】S852.651猪瘟(Classical swine fever,CSF)是由猪瘟病毒(Classical swine fever virus,CSFV)引起猪的一种高度接触性、致死性的传染病,临床上主要以稽留高热、皮肤和黏膜出现大量出血点为主要特征[1]。
猪瘟具有高度传染性,主要通过呼吸道和消化道传染,传播速度快,发病率和病死率高,给全球养猪业造成了巨大的经济损失,世界动物卫生组织(OIE)将其列为必须报告的动物传染病,我国也将其列为一类动物疫病,是严重危害我国养猪业的最重要的疫病之一[2-6]。
近年来,我国猪瘟的流行和发病特点发生了很大变化,转变为隐性感染和亚病毒感染,在临床表现上也更加复杂,既有区域性流行,又有零星散发,既有高病死率的急性症状,又有持续感染的温和性症状趋于复杂化,出现了所谓“非典型猪瘟”、“温和型猪瘟”和“带毒母猪综合征”,在病理剖检上也常常不同于典型猪瘟的病理变化,给兽医临床诊断带来了很大困难[7]。

猪瘟抗体检测方法猪瘟,即猪繁殖与呼吸综合征,是由猪瘟病毒引起的一种严重的传染病,对猪群健康和养殖业产生了重大影响。
为了及时控制疫情和保护养殖业的发展,猪瘟抗体检测方法非常重要。
猪瘟抗体检测方法主要包括传统血清学法和分子生物学法。
传统血清学法主要是利用抗原-抗体反应原理进行检测,分子生物学法则是通过检测猪瘟病毒核酸进行诊断。
下面我将详细介绍这两种方法。
传统血清学法中最常用的方法是血清病毒中和试验。
该方法通过将待检血清与猪瘟病毒进行反应,观察病毒和抗体的相互作用。
这种方法的优点是简单、经济、可靠,适用于大规模的抗体检测。
但是存在一些局限性,如需要对待测血清和病毒进行配对,病毒株的选择和制备需要一定的经验和技术,且过程较为繁琐。
另一种传统血清学方法是酶联免疫吸附试验(ELISA)。
该方法利用特异性的酶标记抗体来检测待测血清中的猪瘟病毒抗体。
ELISA具有操作简单、灵敏度高、多重样品同时检测等优势。
此外,还可以通过改变试剂盒中抗原的性质,进一步检测不同类型的抗体,如IgM和IgG。
但是,该方法需要进行酶标仪等专门设备的检测,成本较高。
分子生物学法主要是通过检测猪瘟病毒核酸来进行诊断。
常用的方法包括聚合酶链反应(PCR)和实时荧光定量PCR(RT-qPCR)。
PCR是一种高度敏感且特异的检测方法,通过扩增待检样品中的病毒核酸,可以快速检测出病毒的存在。
RT-qPCR则能实时监测PCR反应的过程,具有更高的精确性和灵敏度。
此外,PCR还可以进行基因测序,用于病毒株的分型和溯源研究。
然而,分子生物学法虽然灵敏度高,但仍存在一些局限性。
首先,该方法对设备和技术要求较高,需要专业的实验室和操作人员。
其次,由于病毒基因组的变异性较大,需要选择合适的引物和探针,以确保检测的准确性。
此外,病毒核酸在环境中的稳定性较差,易受到污染和降解的影响,可能导致假阴性结果。
综上所述,猪瘟抗体检测方法在疫情监测、疫苗评估和动物检疫等方面具有重要作用。

实验一猪瘟病毒抗体检测试剂配制一、基本原理酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)是一类在固相载体上进行免疫酶染色的免疫酶技术,既可检测抗原,又可检测抗体。
其基本原理是,抗原或抗体吸附到固相载体表面后,仍保持其免疫活性,可与相应的酶标记抗体(或抗原)结合形成免疫复合物。
这一复合物仍保持其免疫活性和酶的催化活性,在遇到相应的底物时,可催化底物水解、氧化或还原,从而产生有色物质,因颜色反应的深浅与相应的抗体或抗原量成正比,故可借助于颜色反应的深浅来定量抗体或抗原。
该技术具有敏感性高、特异性强、简便、易于大规模检测的特点。
二、仪器pH仪;96孔聚苯乙烯微量反应板;移液枪;离心管;离心机,酶标仪。
三、方法步骤1.待检血清样品:取免疫猪瘟疫苗的动物血清样品,用样品稀释液倍比稀释。
1:10、1:100、1:200、1:400、1:800、1:1600用1.5ml离心管分装,4℃保存备用。
(含新城疫病毒的鸡胚尿囊液)、抗新城疫病毒鸡免疫球蛋白、抗新城疫病毒兔血清(用新城疫病毒抗原免疫家兔制备)、市售酶标羊抗兔IgG(HRP-羊抗兔IgG)。
2.包被液配制 0.1mol/L pH9.6碳酸盐缓冲液。
3.洗涤液 0.02mol/L pH7.4 PBS(含0.15 mol/L NaCl、0.05%吐温-20)。
分装。
4.稀释液 0.02mol/L pH7.4PBS中含有0.15 mol/L NaCl、0.05%吐温-20、10%犊牛血清或1%牛血清白蛋白。
5.底物溶液 0.1mol/L pH5.0磷酸盐(Na2HPO4)-柠檬酸缓冲液100mL(含40毫克邻苯二胺、0.15mL 30% H2O2)。
6. 2mol/L H2SO4(浓H2SO4 22.2 mL加水177.8mL)。
7.抗原包被用0.1mol/L pH9.6碳酸盐缓冲液将猪瘟病毒抗原稀释到所需浓度,然后加于聚苯乙烯微量反应板孔中,每孔200μL,4℃包被过夜。

非洲猪瘟病原学检测方法一、病原学检测方法的意义非洲猪瘟是一种高度传染性、致死性极强的疾病,对于保障畜牧业生产和人类健康具有重要意义。
因此,开展非洲猪瘟的病原学检测可以及时发现感染情况,采取相应措施防止疫情扩散。
二、样品采集与处理1. 畜禽样品采集在非洲猪瘟流行地区,应优先选择临床表现明显的动物作为样本。
如发现有死亡或严重呼吸道感染等情况,应优先采集样品。
同时,在采集样品时要注意不要污染环境和其他动物。
2. 样品处理将采集到的血液、组织、粪便等样品放入离心管中,离心3000-5000转/分10-15分钟,将上清液转移到新管中保存。
如需长期保存,在-80℃下冷冻保存。
三、实验室检测方法1. PCR法检测PCR法是目前最常用的非洲猪瘟检测方法之一。
其基本原理是利用DNA聚合酶扩增技术,将病原体的DNA扩增到足够数量,再通过凝胶电泳等方法进行检测。
PCR法具有灵敏度高、特异性强、快速准确等优点。
2. ELISA法检测ELISA法是一种基于抗体抗原反应的检测方法,可以检测非洲猪瘟病毒的抗体水平。
其基本原理是将样品中的抗体与标记有特定抗原的酶结合,通过比色反应来判断是否存在非洲猪瘟抗体。
3. 病毒分离法检测病毒分离法是通过将样品中的病毒分离出来,并通过电镜、PCR等方法进行检测。
该方法具有灵敏度高、特异性强等优点,但需要较长时间和专业技术支持。
四、注意事项1. 样品采集时要注意防止污染和交叉感染。
2. 在实验室操作时要严格遵守操作规程,注意个人防护措施。
3. 不同检测方法的结果可能存在差异,应综合考虑多种因素进行判断。
4. 检测结果应及时报告相关部门,采取相应的防控措施。
五、总结非洲猪瘟是一种严重的畜牧业疾病,开展病原学检测可以及时发现感染情况,采取相应措施防止疫情扩散。
在样品采集和实验室检测过程中要注意个人防护和操作规程,选择合适的检测方法进行检测,及时报告检测结果并采取相应的防控措施。

非洲猪瘟的检测技术非洲猪瘟(African Swine Fever,简称ASF)是一种由非洲猪瘟病毒引起的急性、高度接触性疾病,对猪类的危害极大,病死率高达100%,给猪产业造成了巨大的经济损失。
随着全球化的发展和人类社会的进步,非洲猪瘟病毒的传播范围也越来越广泛,对人们的生活和经济安全带来了严重威胁,因此非洲猪瘟的检测技术成为了猪农、兽医等相关行业关注的重点。
非洲猪瘟的检测技术主要包括病毒检测、抗体检测和临床症状检测等多种方法。
病毒检测是判断猪只是否感染非洲猪瘟病毒的关键手段,目前主要采用的方法有PCR检测、病毒分离和鉴定等。
抗体检测则是判断猪只是否已经患病或者曾经感染过非洲猪瘟病毒的重要手段,目前主要采用的方法有ELISA检测等。
临床症状检测则是通过观察猪只的临床表现来判断是否感染了非洲猪瘟病毒,这是一种传统的检测方法,但准确性比较低,容易出现漏诊和误诊。
随着科技的不断发展和进步,非洲猪瘟的检测技术也在不断创新和完善。
下面我们将分别介绍几种常用的非洲猪瘟检测技术及其特点。
1. PCR检测PCR技术在非洲猪瘟的检测中具有很高的灵敏度和特异性,能够快速准确地判断猪只是否感染了非洲猪瘟病毒。
PCR技术还可以通过多重PCR方法同时检测多种病毒,提高了检测的效率和准确性。
PCR技术也存在一定的局限性,比如需要专业的实验室设备和技术人员、易受试剂质量和操作规范等因素的影响等。
2. ELISA检测ELISA(Enzyme-Linked Immunosorbent Assay)是一种通过酶标记抗体或抗原,采用酶底物显色反应进行定量或半定量分析的技术。
在非洲猪瘟的检测中,ELISA技术主要用于检测猪只体内的非洲猪瘟病毒抗体,从而判断猪只是否已经患病或者曾经感染过非洲猪瘟病毒。
ELISA技术的原理是,将待检血清与已知的非洲猪瘟病毒抗原进行特异性结合,然后用酶底物显色反应进行检测分析。
3. 病毒分离和鉴定病毒分离和鉴定是一种通过分离和培养病毒来判断猪只体内是否存在非洲猪瘟病毒的技术。
猪瘟病毒抗体ELISA检测方法原理猪瘟病毒(CSFV)ELISA抗体检测试剂盒,酶标板包被猪瘟病毒E2抗原(gp55蛋白),如果待检样品中含有猪瘟抗体,与其包被的抗原结合后,将阻断HRP酶标记的E2单克隆抗体与包被的抗原结合后,将阻断的HRP酶标记的E2单克隆抗体与包被抗原的结合,从而减少显色反应。
试剂IX洗涤液:10X洗涤缓冲液用蒸偏水稀释10倍配成IX洗涤液、TMB 底物液。
设备耗材单道微量移液器和吸头、计时器、加样槽、蒸储水、酶标仪(450nm)Q操作步骤1.试剂盒内所有组份取出,在恒温箱(25+3。
C)中放置至少60分钟,恢复至室温,打开铝箔袋取出抗原包被板。
2.在稀释板中加入70μL样品稀释液,各孔加入70UL血清样品。
同样比例稀释阳性对照血清(PC)与阴性对照血清(NC),充分混匀。
于抗原包被板孔中分别加入100UL稀释后的样品以及100UL稀释后阴性对照血清(NC)和阳性对照血清(PC)o盖上封板膜,室温(25±3。
C)下孵育60分钟。
3.洗板,弃去孔中液体,每孔加300ULl倍洗涤液,洗涤3次。
最后一次洗涤后将酶标版在吸水纸上轻轻拍干,严禁各步骤之间孔板出现干燥情况。
每孔加入IOoULCSFVE2HRP标记抗体。
盖上封板膜,室温(25±3。
C)下孵育30分钟。
4.重复步骤1、2、3o5.每孔加入100μLTMB底物液。
6.盖上封板膜,室温(25±3°C)下孵育15分钟。
每孔加入50μL终止液,终止酶促反应。
使用45Onm波长测量吸光度值。
7.结果判定与计算。
用酶标仪测定0D450nm0结果判读1.阴性对照(Ne)OD45Omin平均值>0.7;阳性对照(PC)Pl平均值>50沆2.计算公式通过下面公式计算样品竞争值觥PD。
PI(阻断百分率)=(NCOD均值-样品OD值)÷NCOD均值×100%如果结果可疑,检查样品(是否被细菌污染等)并再次检测。
三分钟帮您看懂抗体检测报告——猪瘟篇各位猪友在看完前几期中牧生物平台推送的内容后,是否对猪场防疫与疫苗使用有了更全面的认识呢?小编我是获益匪浅。
那么各位猪友在因地制宜地采用综合性的管控措施之后,又是否对即将获得的收益多了一份期待?等等……先别着急。
在无限的期许当中,由提升生产管理所带来的滚滚财源,是否真的能化虚为实?进一步的说,如何检验我们在猪场防疫方面所取得的成果呢?科学准确的抗体检测报告给您答案!最近几年,一些有条件的养殖场已经定期开展抗体检测工作。
那么在投入大量人力、物力后拿到手的抗体检测报告,您是否真的读的懂呢?本期中牧生物的专题,小编就与您一起来探究抗体检测报告里的门道。
目前,市场上最为常见的抗体检测报告主要有:猪瘟,蓝耳病,伪狂犬,口蹄疫,乙脑,细小,圆环等。
本次我们就选取公认的猪瘟阻断Elisa检测方式,以猪瘟抗体检测的金标准IDEXX检测试剂盒为例。
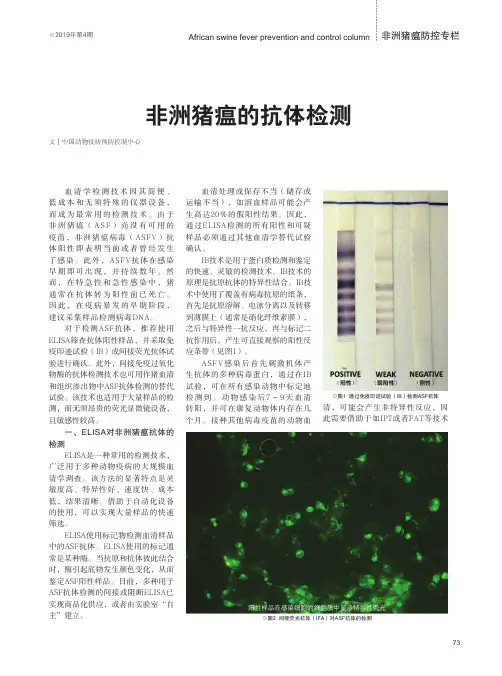
首先,从原理出发,通过一张图来看看猪瘟抗体检测。
上图所示的阻断法检测猪瘟疫苗抗体的原理,可以简单的概括为:第3步中加入的酶标记物(抗猪瘟病毒的单克隆抗体),与被检血清中的抗猪瘟病毒抗体,两者竞争与包被抗原结合。
而第2步加入的被检血清中如果大量含有抗猪瘟病毒抗体,就会阻断酶标物抗体与包被抗原的结合。
最后加入底物显色。
被检血清中猪瘟病毒抗体越多,阻断率越高,颜色越浅。
猪瘟疫苗的免疫评估一般关注两点:1.阳性率:猪瘟抗体(阻断率(Blocking)≥40%,判为阳性结果;30%<Blocking<40%,判为可疑结果;Blocking≤30%,判为阴性结果)。
免疫合格率:阻断率(Blocking)≥50%的,即为免疫合格(断奶仔猪猪瘟第一次免疫受母源抗体干扰,≥30%可视为合格)。
免疫合格的比例即为免疫合格率。
2.变异系数:Coefficient of Variation(CV)变异系数计算的是平均个体的变化,以平均滴度背离的百分数来表示公式如下:变异系数 CV = 标准偏差(STDEV)/平均阻断率×100%CV≤40%,显示了群内猪只有一个均衡的、相似反应。
猪瘟病毒抗体阻断ELISA检测方法本方法是用于检测猪血清或血浆中猪瘟病毒抗体的一种阻断ELISA方法,通过待测抗体和单克隆抗体与猪瘟病毒抗原的竞争结合,采用辣根过氧化物酶与底物的显色程度来进行判定。
1 操作步骤在使用时,所有的试剂盒组分都必须恢复到室温18~25℃。
使用前应将各组分放置于室温至少1小时。
1.1 分别将50uL样品稀释液加入每个检测孔和对照孔中。
1.2 分别将50uL的阳性对照和阴性对照加入相应的对照孔中,注意不同对照的吸头要更换,以防污染。
1.3 分别将50uL的被检样品加入剩下的检测孔中,注意不同检样的吸头要分开,以防污染。
1.4 轻弹微量反应板或用振荡器振荡,使反应板中的溶液混匀。
1.5 将微量反应板用封条封闭置于湿箱中(18~25℃)孵育2小时,也可以将微量反应板用封条置于湿箱中孵育过夜。
1.6 吸出反应孔中的液体,并用稀释好的洗涤液洗涤3次,注意每次洗涤时都要将洗涤液加满反应孔。
1.7 分别将100uL的抗CSFV酶标二抗(即取即用)加入反应孔中,用封条封闭反应板并于室温下或湿箱中孵育30分钟。
1.8 洗板(见1.6)后,分别将100uL 的底物溶液加入反应孔中,于避光、室温条件下放置10分钟。
加完第一孔后即可计时。
1.9 在每个反应孔中加入100uL终止液终止反应。
注意要按加酶标二抗的顺序加终止液。
1.10 在450nm处测定样本以及对照的吸光值,也可用双波长(450nm和620nm)测定样本以及对照的吸光度值,空气调零。
1.11 计算样本和对照的平均吸光度值。
计算方法如下:计算被检样本的平均值OD450(=ODTEST)、阳性对照的平均值(=ODPOS)、阴性对照的平均值(=ODNEG)。
根据以下公式计算被检样本和阳性对照的阻断率; ODNEG- ODTEST 阻断率=———————×100% ODNEG 2 试验有效性阴性对照的平均OD450应大于0.50。