猪瘟抗体
- 格式:doc
- 大小:66.00 KB
- 文档页数:2


猪瘟抗体快速检测试剂盒——(胶体金法)使用说明书【名称】通用名称:猪瘟抗体快速检测试剂盒(胶体金法)英文名称:Rapid Anti-CSFV Test汉语拼音:Zhuwen Kangti Kuaisu Jiance ShijiHe(Jiaoti Jin Fa)【用途】用于检测猪血清/血浆/全血样品中猪瘟(Classical Swine Fever, CSF)抗体。
【实验原理】猪瘟抗体快速检测试剂盒(胶体金法),系采用胶体金免疫层析技术,检测样品(血清、血浆或全血)中猪瘟抗体的方法。
在玻璃纤维纸上预包被金标记灭活猪瘟抗原(Au-Agl),在硝酸纤维素膜上检测线和对照线处分别包被猪瘟抗原(Ag2)和兔抗猪瘟抗体。
当检测样品为阳性时,样品中猪瘟抗体与胶体金标记猪瘟抗原(Au-Ag1)结合形成复合物,由于层析作用复合物沿纸条向前移动,经过检测线时与预包被的猪瘟抗原(Ag2)形成“Au-Ag1-猪瘟抗体-Ag2-固相材料”免疫复合物而凝聚显色,游离金标记抗原则在对照线处与兔抗猪瘟抗体结合而富集显色。
阴性样品则仅在对照线处显色。
操作简便,快速,结果直观、准确,灵敏度高,容易判定。
【试剂盒组成】1.猪瘟抗体检测卡50头份2.说明书1份3.一次滴管50根【操作方法】1.用1.5ml样品管,采血0.5-1ml待检测血清自然析出或用离心机离心10分钟左右,使血清析出。
2.将检测卡平置于桌面上,用吸管吸取被检血清,在检测卡的椭圆形加样孔内加入2滴约80~100ul。
在室温下反应20分钟判定结果。
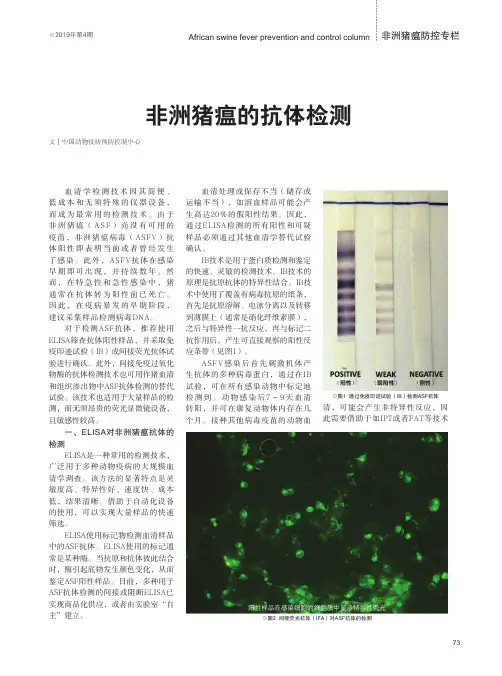
(检测卡如在4℃保存,必须恢复至室温后方可进行检测)【结果判定】阳性:对照线区(C)和检测线区(T)各出现一条紫红色线。
检测线(T)的颜色越深,表明猪瘟抗体的滴度越高。
阴性:只有对照线区(C)出现一条紫红色线。
无效:未出现紫红色线或只在检测区(T)出现紫红色线,对照线区(C)未出现紫红色线。
【诊断参考】被检样品加样后20分钟可与对照卡的色带滴度进行参考比较。


猪瘟病毒IgG抗体检测ELISA试剂盒使用说明书
【产品简介】
猪瘟病毒(CSFV)是目前危害国内养猪业一种高发病率、高死亡率和高度接触传染的病毒。
在猪的免疫预防工作中,最值得关注的就是强化免疫的接种时机问题。
在过高的抗体水平进行免疫,过高的抗体水平还会中和疫苗,影响疫苗的免疫效果,导致免疫失败;在较低的抗体水平进行免疫,又会出现抗体保护真空期,威胁猪的健康。
该试剂盒检测反映抗体水平,利于指导免疫时机。
【使用时间】
①猪瘟病毒疫苗免疫后免疫效果监测
②平时的抗体监测
【检测原理】
包被经纯化的猪瘟病毒,抗猪IgG抗体作为酶标记抗体,利用间接法来检测被检材料中是否含有猪瘟病毒抗体。
【产品内容】
7. 剩余样品及废弃物应经121℃高压蒸汽灭菌30分钟,或用5.0g/L次氯酸钠等消毒剂处理30分钟后废弃。
【保存与有效期】
于2~8℃避光保存,有效期自成品检定合格之日起为12个月。


猪瘟抗体检测方法猪瘟,即猪繁殖与呼吸综合征,是由猪瘟病毒引起的一种严重的传染病,对猪群健康和养殖业产生了重大影响。
为了及时控制疫情和保护养殖业的发展,猪瘟抗体检测方法非常重要。
猪瘟抗体检测方法主要包括传统血清学法和分子生物学法。
传统血清学法主要是利用抗原-抗体反应原理进行检测,分子生物学法则是通过检测猪瘟病毒核酸进行诊断。
下面我将详细介绍这两种方法。
传统血清学法中最常用的方法是血清病毒中和试验。
该方法通过将待检血清与猪瘟病毒进行反应,观察病毒和抗体的相互作用。
这种方法的优点是简单、经济、可靠,适用于大规模的抗体检测。
但是存在一些局限性,如需要对待测血清和病毒进行配对,病毒株的选择和制备需要一定的经验和技术,且过程较为繁琐。
另一种传统血清学方法是酶联免疫吸附试验(ELISA)。
该方法利用特异性的酶标记抗体来检测待测血清中的猪瘟病毒抗体。
ELISA具有操作简单、灵敏度高、多重样品同时检测等优势。
此外,还可以通过改变试剂盒中抗原的性质,进一步检测不同类型的抗体,如IgM和IgG。
但是,该方法需要进行酶标仪等专门设备的检测,成本较高。
分子生物学法主要是通过检测猪瘟病毒核酸来进行诊断。
常用的方法包括聚合酶链反应(PCR)和实时荧光定量PCR(RT-qPCR)。
PCR是一种高度敏感且特异的检测方法,通过扩增待检样品中的病毒核酸,可以快速检测出病毒的存在。
RT-qPCR则能实时监测PCR反应的过程,具有更高的精确性和灵敏度。
此外,PCR还可以进行基因测序,用于病毒株的分型和溯源研究。
然而,分子生物学法虽然灵敏度高,但仍存在一些局限性。
首先,该方法对设备和技术要求较高,需要专业的实验室和操作人员。
其次,由于病毒基因组的变异性较大,需要选择合适的引物和探针,以确保检测的准确性。
此外,病毒核酸在环境中的稳定性较差,易受到污染和降解的影响,可能导致假阴性结果。
综上所述,猪瘟抗体检测方法在疫情监测、疫苗评估和动物检疫等方面具有重要作用。




如何确定猪瘟抗体是疫苗产生还是野毒感染?如何鉴别检测出的抗体是由于注射疫苗产生的保护性抗体,还是由于感染猪瘟病毒产生的抗体?福州大北农生物技术有限公司曾亮明张渊魁鉴于我国制备猪瘟疫苗所用种毒是C株,所以靠抗体检测无法鉴别猪瘟疫苗毒和猪瘟野毒。
在疫苗接种剂量正常的情况下,可以根据抗体水平高低和整齐度粗略判断是否是猪瘟野毒刺激产生的抗体。
当抗体水平异常升高且抗体整齐度很差时可初步认为有猪瘟野毒存在。
此外,由于疫苗毒在猪体内的存留时间不超过3周,因此,如要判断猪群是否感染猪瘟野毒,可在猪瘟弱毒疫苗免疫3周后进行猪瘟抗原检测。
瑞普保定生物药业有限公司技术总监尤永君目前,国内还没有适合各种猪瘟疫苗的标准方法。
现在国内存在的所谓基因缺失苗,该疫苗就是对猪瘟兔化弱毒进行改造,使其缺失某一段基因(如E0)或某一段特殊片段(如E2),但其免疫原性不改变,以缺失的基因所表达的蛋白作为诊断抗原,能够区别疫苗接种猪和自然感染猪产生的抗体。
中牧实业股份有限公司生物制品商务部经理苏晓齐通过观察群体抗体水平的离散度来初步区分判断疫苗抗体和野毒抗体是一种简单适用的方法。
牡丹江金源种猪繁育有限责任公司技术总监李国友距离做猪瘟疫苗比较近的时间所出现的抗体(据秦玉明2003年报道,利用RT-PCR检测,接种猪瘟兔化弱毒自接种后2天一直到接种后16天,在接种猪的血液中均检测到病毒RNA存在,而接种后20天血液中未检测到病毒RNA分子),很难鉴别是疫苗抗体还是感染猪瘟病毒产生的抗体。
中国畜牧兽医学会动物传染病学分会万遂如当前使用中监所提供的猪瘟单抗ELISA试剂盒就可有效的区别猪瘟疫苗与野毒感染所产生的抗体。
华中农业大学动物医学院教授何启盖由于猪瘟疫苗毒株致弱机理没有完全了解,疫苗毒株和野毒之间没有明显的大段基因缺失导致抗原组成的差异;虽然,已经有实验室获得了区分猪瘟野毒和弱毒的单克隆抗体,有望用于区分石门野毒株和兔化弱毒株,说明这两种毒株之间还是由一定的抗原差异,但是目前临床上无法区分疫苗免疫和猪瘟野毒感染的抗体。
三分钟帮您看懂抗体检测报告——猪瘟篇各位猪友在看完前几期中牧生物平台推送的内容后,是否对猪场防疫与疫苗使用有了更全面的认识呢?小编我是获益匪浅。
那么各位猪友在因地制宜地采用综合性的管控措施之后,又是否对即将获得的收益多了一份期待?等等……先别着急。
在无限的期许当中,由提升生产管理所带来的滚滚财源,是否真的能化虚为实?进一步的说,如何检验我们在猪场防疫方面所取得的成果呢?科学准确的抗体检测报告给您答案!最近几年,一些有条件的养殖场已经定期开展抗体检测工作。
那么在投入大量人力、物力后拿到手的抗体检测报告,您是否真的读的懂呢?本期中牧生物的专题,小编就与您一起来探究抗体检测报告里的门道。
目前,市场上最为常见的抗体检测报告主要有:猪瘟,蓝耳病,伪狂犬,口蹄疫,乙脑,细小,圆环等。
本次我们就选取公认的猪瘟阻断Elisa检测方式,以猪瘟抗体检测的金标准IDEXX检测试剂盒为例。
首先,从原理出发,通过一张图来看看猪瘟抗体检测。
上图所示的阻断法检测猪瘟疫苗抗体的原理,可以简单的概括为:第3步中加入的酶标记物(抗猪瘟病毒的单克隆抗体),与被检血清中的抗猪瘟病毒抗体,两者竞争与包被抗原结合。
而第2步加入的被检血清中如果大量含有抗猪瘟病毒抗体,就会阻断酶标物抗体与包被抗原的结合。
最后加入底物显色。
被检血清中猪瘟病毒抗体越多,阻断率越高,颜色越浅。
猪瘟疫苗的免疫评估一般关注两点:1.阳性率:猪瘟抗体(阻断率(Blocking)≥40%,判为阳性结果;30%<Blocking<40%,判为可疑结果;Blocking≤30%,判为阴性结果)。
免疫合格率:阻断率(Blocking)≥50%的,即为免疫合格(断奶仔猪猪瘟第一次免疫受母源抗体干扰,≥30%可视为合格)。
免疫合格的比例即为免疫合格率。
2.变异系数:Coefficient of Variation(CV)变异系数计算的是平均个体的变化,以平均滴度背离的百分数来表示公式如下:变异系数 CV = 标准偏差(STDEV)/平均阻断率×100%CV≤40%,显示了群内猪只有一个均衡的、相似反应。
精制克隆猪瘟抗体
一、英文名称:Classical Swine Fever antibody(cloned)
二、分子式:H2L2 分子量:145-185KD
三、质量标准:企业标准,≥200mg/ml;
四、突出特点
1、特异性直接中和猪瘟病毒;
2、刺激免疫系统,激活T细胞系统增强对病毒等异源微生物的触杀能力;刺激B细胞的粗面内质网,刺激产生二次应答,
激活和促进猪瘟抗体的大量合成;激活补体系统,调节和提高肌体免疫力;
3、纯度高、无杂病原、可常温保存;
4、效果稳定、使用过程中可以有明确的指标检测;
5、无过敏原、无残留、使用安全,不影响产品出口质量;
6、可以与各种抗生素联合使用;
7、吸收迅速;
8、分布广泛:能够遍部血液所及的部位,能够透过血脑和胎盘;
9、长效特性:一般使用后可保护3-7天;
10、给药方式多样:可以肌肉注射、也可静脉给药;
11、溶剂简单:水;
12、本品克隆分离、纯化、灭活、防酶解、保活性等程序技术和工艺为国际一流标准。
五、作用机理
能够特异性地与相应的猪瘟抗原结合,而直接中和并杀灭病原物,同时引导B、T淋巴系统产生更多的同类抗体,增强对病原物的记忆、识别水平、进一步提高肌体系统的主动防御能力,激活吞噬系统快速高效清除体内病原物,达到肌体净化之目的机能。
这种特异性结合抗原特性是由其V区(尤其是V区中的高变区)的空间构成所决定的,抗原结合点由L链和H链超变区组成,与相应抗原上的表位互补,借助静电力、氢键以及范德华力等次级键相结合,由于不同抗原分子上有相同的抗原决定簇,或有相似的抗原决定簇,一种抗体可与两种以上的抗原发生反应,即:交叉反应,因此,本品还有杀灭类似病原微生物的能力,并且还有其它的效应作用:
1、调节炎症性细胞因子的合成和释放:Ig对某些细胞因子产生的调节是通过控制其转录水平而实现的,目前
已被证实的受这种转录调节的细胞因子有IL-6,TNF-γ,IL-1,IL-8,Ig与FcRs的作用还可导致细胞内第二信使环磷酸腺苷水平升高,从而激活环磷酸腺苷依赖的蛋白激酶的磷酸化,最终通过相应的信号传导途径调节细胞因子的产生.Ig中包含某些细胞因子的特异性中和抗体;2、调节补体的激活:Ig可结合补体C 3b ,C 4b 片段,阻断其与靶细胞的结合;3、促进内源性IgG的清除:内源性IgG水平的调节主要依赖于机体对其分解代谢的强弱.
当体内IgG水平增高时,过多的IgG与保护性受体FcRn结合,使IgG的分解加强,从而维持IgG的水平,这种清除作用已被广泛地应用于自身免疫性疾病的治疗;4、中和自身抗体(抗自身抗体功能):自身免疫性疾病的发生是由于体内自身反应性B淋巴细胞产生大量的自身抗体作用于自身抗原,导致组织细胞的破坏.Ig含有正常动物体内的抗特异性自身抗体的抗体,可与自身抗体的可变区结合,从而减少与自身抗原的结合;5、中和上层抗原:上层抗原是来源于微生物的抗原物质,例如:葡萄球菌内毒素B(SEB),可激活T细胞,使其表达特异的T细胞受体Vβ序列,并有较强的亲和力,同时SEB与Ⅱ型主要组织相容性抗原复合物分子的某些区域相结合,上层抗原在主要组织相容性抗原复合物分子和T细胞受体分子间架起桥梁而进一步促进T细胞激活,同样可激活单核/巨噬细胞系统;6、调节淋巴细胞和单核细胞的增殖与凋亡: Ig可抑制淋巴细胞的增殖,这种作用主要是通过干扰调控细胞生长和死亡的基因表达来实现,此外,Ig对细胞因子网络的调节也对淋巴细胞的增殖产生正调节作用,例如IL-4水平的下降可抑制Th0细胞向Th2的分化,而IL-2的存在可以诱导T细胞的增殖和分化.因此Ig在体内可通过上调IL-2水平,下调T细胞增殖来维持T细胞数目的稳定; 7、Ig可通过间接作用使神经髓鞘修复:在胶质细胞及其前体细胞的抗体介导性的补体损伤过程中起着保护作用,它是通过抗体联合介导的,而不影响补体激活过程.这种对炎症过程的抑制作用,可能是Ig发挥髓鞘修复作用的基础;8、Ig具有脑组织的局部作用,对脑脊液有渗透性,因血管-神经屏障在神经根部及神经末端不完整,Ig可自由地在这些部位进入神经而发挥系统和局部的作用.
六、药动学特点
在体内迅速产生作用,动物给药后1h血浆中抗体蛋白浓度提高15-33%,活化补体,有效作用期可维持5-7天。
七、毒性实验结果
1、急性毒性实验表明:小鼠、大鼠口服、肌注、静脉注射的半数致死量LD50均在10000毫克以上/千克体重;
2、特殊毒性实验表明:单克隆猪瘟抗体无“三致”作用(致畸、致癌、致突变)及繁殖毒性。
八、临床应用:
1、猪瘟抗体对猪瘟发病的早、中期治疗效果确实;
2、在没有条件进行猪瘟抗体水平检测、猪瘟病毒感染阳性检测的猪场,一旦有病猪被确诊或疑似为猪瘟疾病的情况下,
利用“猪瘟抗体对猪瘟病毒具有中和作用”原则,对全体未发病猪注射猪瘟抗体蛋白IgG能够中和、清除被猪瘟病毒感染且处于潜伏期的猪体内的猪瘟病毒,达到净化目的;并观察7天无异常后,全体注射猪瘟疫苗能够达到最高的疫苗免疫效果整齐度;
3、对存在猪瘟隐性感染或出现免疫耐受的母猪群所繁殖的后代进行出生后24小时内补充猪瘟抗体,能够极大提高
成活率;
九、用法用量:肌肉或静脉给药,猪0.0625-0.125ml/kg体重;仔猪口服给药仅限出生起36小时内;
十、包装、规格:50千克/件
十一:特别说明:其它类似品有:猪蓝耳、猪伪狂犬等抗体。