DA7600实时荧光定量PCR仪确认方案模板
- 格式:doc
- 大小:88.00 KB
- 文档页数:9
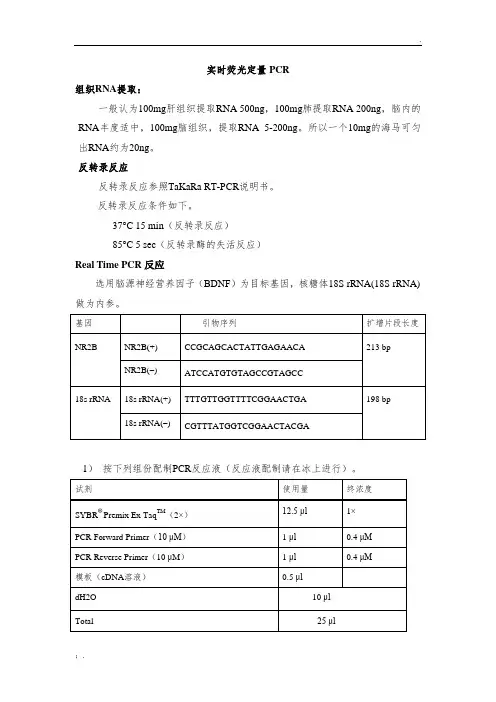
实时荧光定量PCR
组织RNA提取:
一般认为100mg肝组织提取RNA 500ng,100mg肺提取RNA 200ng,脑内的RNA丰度适中,100mg脑组织,提取RNA 5-200ng。
所以一个10mg的海马可匀出RNA约为20ng。
反转录反应
反转录反应参照TaKaRa RT-PCR说明书。
反转录反应条件如下。
37°C 15 min(反转录反应)
85°C 5 sec(反转录酶的失活反应)
Real Time PCR反应
选用脑源神经营养因子(BDNF)为目标基因,核糖体18S rRNA(18S rRNA)做为内参。
1)按下列组份配制PCR反应液(反应液配制请在冰上进行)。
全班40人,分为5组,每组做8管。
4管做BDNF,4管做18S rRNA。
4管BDNF 或者18S rRNA,采用相应的正反PCR引物。
每种基因做两个模板,一个模板采用原液浓度,一个模板采用稀释一倍浓度,体积均为0.5 μl。
2)三步法PCR
首先95°C 作用3 min。
PCR进行35个循环。
步骤温度时间
变性95°C 30 秒
退火58°C 30 秒
延伸72°C 30 秒
融解曲线
温度时间变温速度
95°C 0秒20°C/秒
55°C 15秒20°C/秒
95°C 0秒0.1°C/秒。

人乳头瘤病毒6,11型核酸检测标准操作规程(PCR-荧光探针法)1.目的:规范人乳头瘤病毒(HPV)6,11型核酸检测操作流程,保证检测结果的准确性。
2.应用范围:PCR实验室。
3.职责:3.1 文件编写:实验室技术员。
3.2 文件审核:实验室主管。
3.3 文件审批:实验室主任。
3.4 执行:PCR实验室所有工作人员。
4. 参考文献:4.1《中山大学达安基因股份有限公司人乳头瘤病毒(6,11型)核酸定量检测试剂盒(PCR-荧光法)说明书》4.2《中山大学达安基因股份有限公司DA7600核酸序列检测系统用户手册》5. 内容:5.1 检测方法:PCR-荧光探针法。
5.2 实验原理:采用一对特异性引物和一条特异性荧光探针,配以PCR反应液、耐热DNA聚合酶(Taq酶)、核苷酸单体(dNTPs)等成分,通过PCR体外扩增法,即高温变性、低温退火、适温延伸进行DNA扩增,并对PCR全过程进行实时监测,从而定量检测人乳头瘤病毒(HPV)6,11型DNA。
5.3 性能参数:5.3.1 检测下限: 5.0×102基因拷贝/ml。
5.3.2 线性范围:5.0×102~5.0×108基因拷贝/ml。
5.4 标本采集:由合作单位按照以下要求进行采集。
5.4.1 标本类型:泌尿生殖道分泌物棉拭子、生殖道刮片、组织活检标本等。
5.4.1.1 男性尿道分泌物:用细小棉拭子伸入尿道约2~4厘米,捻动拭子采集分泌物,将棉拭子置于无菌试管中,密封送检(采集分泌物前2小时禁小便)。
5.4.1.2 女性生殖道分泌物:用无菌生理盐水棉球洗去宫颈外分泌物,再用宫颈刷或无菌棉拭子插入宫颈内,停5秒后旋动宫颈刷或棉拭子采集宫颈分泌物,将宫颈刷或棉拭子置于无菌试管中,密封送检。
5.4.1.3 女性尿道分泌物:用无菌生理盐水棉球洗净尿道口,再用无菌棉拭子插入尿道约2厘米,捻动拭子采集分泌物,将棉拭子置于无菌试管中,密封送检。

全自动生化分析仪7600标准化操作程序文件单位:山东省平度市人民医院部门:检验科生化室文件编号: SHJW20110310版本:第二版批准实施日期: 2011年03月10日有效期:一年复审计划:每年进行复审,测定系统发生变化时需进行修订编写者:张关磊审批者:张建军保管者:张建军修订记录:全自动生化分析仪7600标准化操作规程1、操作流程开机检查→打开电源→水源→仪器状态确认→试剂准备→校验与质控测定→一般样品测定→复查样品测定→急查样品测定→仪器状态测定→结束操作→关闭电源、水源→关机检查。
2、基本使用流程2.1开机检查接通电源前需进行开始工作检查,如加样机构、试剂分注机构、反应容器清洗机构、各种清洗液量的检查。
操作部检查、轨道的检查。
样品针、试剂针有无脏物附着、是否弯曲。
反应容器清洗喷嘴和试剂吸量器是否有漏气和气泡等。
2.2打开水源、电源此法只对不使用定时器的仪器说明。
(1)打开水源开关和纯水机电源,水压要求0.5-3.5Kgf/cm2,电传导率为1us/cm以下。
(2)打开样品供给部左侧的电源开关(绿色按钮),为了使试剂藏库工作,分电盘的开关通常是开着的。
仪器显示初始画面并自动进行初期动作。
所有指定准备工作进行完呈待机状态。
2.3仪器状态确认(1)报警确认:仪器发生报警时,触摸“报警”(Alarm)键,显示报警窗口,显示详细说明和处理方法,按处理方法进行处理。
(2)流路内气泡的确认:若发现流路内有气泡,则触摸实用工作键(Utility)键、维护(Maintenance)键,显示维护保养画面。
触摸维护“排气”后,按“实行”(Select)键。
(3)吸光度的确认:检查吸光度值,确认检查值在允许范围内。
A.触摸“Maintenance”键,维护画面打开。
B.触摸“Maintenance”键,“光度计检查”键后,按“实行”(Select)键。
(4)反应槽温度的确认:A.触摸主菜单的观察(System Overview)键,观察窗口打开。


实时荧光定量PCR:实时荧光定量PCR (Quantitative Real-time PCR)是一种在DNA扩增反应中,以荧光化学物质测每次聚合酶链式反应(PCR)循环后产物总量的方法。
通过内参或者外参法对待测样品中的特定DNA序列进行定量分析的方法。
·Real-timePCR是在PCR扩增过程中,通过荧光信号,对PCR 进程进行实时检测。
由于在PCR扩增的指数时期,模板的Ct值和该模板的起始拷贝数存在线性关系,所以成为定量的依据。
原理:所谓实时荧光定量PCR技术,是指在PCR反应体系中加入荧光基团,利用荧光信号积累实时监测整个PCR进程,最后通过标准曲线对未知模板进行定量分析的方法。
检测方法1.SYBRGreenⅠ法:在PCR反应体系中,加入过量SYBR荧光染料,SYBR荧光染料特异性地掺入DNA双链后,发射荧光信号,而不掺入链中的SYBR 染料分子不会发射任何荧光信号,从而保证荧光信号的增加与PCR 产物的增加完全同步。
SYBR定量PCR扩增荧光曲线图PCR产物熔解曲线图(单一峰图表明PCR扩增产物的单一性)2.TaqMan探针法:探针完整时,报告基团发射的荧光信号被淬灭基团吸收;PCR 扩增时,Taq酶的5’-3’外切酶活性将探针酶切降解,使报告荧光基团和淬灭荧光基团分离,从而荧光监测系统可接收到荧光信号,即每扩增一条DNA链,就有一个荧光分子形成,实现了荧光信号的累积与PCR产物的形成完全同步。
服务流程1.客户认真写好订单,提供待检基因相关信息;2.签订技术服务合同,支付预付款(30-50%);3.设计合成定量PCR引物(或客户提供文献引物委托本公司合成);4.DNA/RNA的抽提、定量、RNA反转录;5.PCR预实验,主要检测引物的特异性和扩增效率;6.正式定量实验:对所有样品上机检测;7.实验结果和数据分析,形成报告。
收费标准优惠包干价:120元/样/基因(SYBRgreenI法,相对定量)(含RNA提取,反转录,引物合成费用,上机测试费用(3个重复);一个内参免费(内参3个重复)技术原理将标记有荧光素的Taqman探针与模板DNA混合后,完成高温变性,低温复性,适温延伸的热循环,并遵守聚合酶链反应规律,与模板DNA互补配对的Taqman探针被切断,荧光素游离于反应体系中,在特定光激发下发出荧光,随着循环次数的增加,被扩增的目的基因片段呈指数规律增长,通过实时检测与之对应的随扩增而变化荧光信号强度,求得Ct值,同时利用数个已知模板浓度的标准品作对照,即可得出待测标本目的基因的拷贝数。

实时荧光定量PCR具体实验步骤
实时荧光定量(Real Time quantitative PCR)是检测RNA或DNA的一种常用技术,通过检测特定目标的增加(或减少),可以用来测定RNA 或DNA的表达水平,或者基因等的转录水平。
下面我们就对实时荧光定量PCR(RT-qPCR)的实验步骤进行具体介绍。
1.搭建实验
第一步是搭建实验,即准备实验所需的干燥试剂,第二步是准备RNA 样本,第三步是准备标准曲线,最后是根据实验需要准备实验板和实验试管。
2、RNA样品提取
在实验中,会使用到多种RNAs,一般情况下使用TRIzol或Phenol 抽提方法进行RNA抽提,不同的细胞、组织中RNA的杂质含量不一样,因此需要根据实验需求进行适当调整抽提浓度。
3、RT-qPCR反转录
在RT-qPCR反转录之前,首先要准备反转录试剂,一般采用qPCR反转录试剂盒,这种试剂盒含有足够的反转录荧光探针以及反转录引物,它可以有效帮助反转录过程。
反转录过程通过复制DNA片段的过程完成,最终转录出的cDNA存在细胞核中。
4、qPCR扩增实验
qPCR扩增实验是在反转录完成后进行,一般来说,这个步骤可以采用qPCR扩增试剂盒,该试剂盒中包含所需的扩增物质如DNA聚合酶、前驱核苷酸、dNTPs,检测细胞核中的cDNA。

D A7600实时荧光定量P C R仪确认方案模板-CAL-FENGHAI-(2020YEAR-YICAI)_JINGBIAN确认文件类别:确认方案编号:部门:质量部页码:共11页,第2页DA7600PCR扩增仪方案与报告版次:新订替代:起草:年月日审阅会签:(确认小组)批准:年月日目录1.概述 (4)2.确认目的 (4)3.确定确认范围 (4)4.确定确认小组成员及职责 (4)确认小组成员及确认小组负责人 (4)人员 (4)评价方法: (4)标准: (5)5.风险评估 (5)评估概述 (5)评估方法 (5)6.确认内容 (9).安装确认 (9)安装信息 (9)仪器放置检查 (9)操作规程等资料确认 (10)运行确认 (10)基本称重功能确认 .................................................. 错误!未定义书签。
校正功能确认 ........................................................ 错误!未定义书签。
性能确认 ................................................................... 错误!未定义书签。
准确度...................................................................... 错误!未定义书签。
天平重现性检查: .................................................. 错误!未定义书签。
四角偏差检查: ...................................................... 错误!未定义书签。
7确认计划安排....................................................... 错误!未定义书签。

实用标准文案
大型仪器设备购置论证报告
仪器设备名称实时荧光定量PCR仪
项目名称生态环境科技平台
项目负责人陈建荣
填表日期2017年4月12日
实验室管理处制
填表说明
1.单价10万元及以上仪器设备的申购均需填写此表,并与
申购计划一起上报有关部门。
2.所在学院(部门)组织3—7人单数技术专家进行论证,并通知项目经费管理、设备管理等部门参加论证。
申请单一来源采购的需3人以上单数非本校专家参加论证;未列入全省统一论证进口产品范围的进口产品需5人以上单数非本校专家参加论证。
3.论证会由专家组组长主持,主要程序为:申购人报告、现场考察、专家质询与讨论、专家组形成论证意见并签名。
4.专家论证同意,经学院(部门)、项目经费管理部门签字并盖章后,报本科教学部(实验室管理处)网上公示一周无异议后实施。
5.此表一式1份(如设备为进口设备,请提交2份)。

实时荧光定量P C R仪大型仪器设备购置论证报
告
YKK standardization office【 YKK5AB- YKK08- YKK2C- YKK18】
大型仪器设备购置论证报告
仪器设备名称实时荧光定量PCR仪
项目名称生态环境科技平台
项目负责人陈建荣
填表日期2017年4月12日
实验室管理处制
填表说明
1.单价10万元及以上仪器设备的申购均需填写此表,并与申购计划一起上报有关部门。
2.所在学院(部门)组织3—7人单数技术专家进行论证,并通知项目经费管理、设备管理等部门参加论证。
申请单一来源采购的需3人以上单数非本校专家参加论证;未列入全省统一论证进口产品范围的进口产品需5人以上单数非本校专家参加论证。
3.论证会由专家组组长主持,主要程序为:申购人报告、现场考察、专家质询与讨论、专家组形成论证意见并签名。
4.专家论证同意,经学院(部门)、项目经费管理部门签字并盖章后,报本科教学部(实验室管理处)网上公示一周无异议后实施。
5.此表一式1份(如设备为进口设备,请提交2份)。

PCR定量实验方案实验目的本实验旨在通过聚合酶链式反应(PCR)定量检测目标DNA的数量。
通过PCR 定量实验,可以快速、准确地确定目标DNA的含量,为后续实验提供数据支持。
实验原理PCR定量实验基于聚合酶链式反应的基本原理,通过反复复制目标DNA序列,使其数量呈指数增加,并通过荧光信号在PCR循环的各个阶段实时监测目标DNA的增长情况。
荧光信号的强度与目标DNA的初始量成正比,从而可以定量测量目标DNA的数量。
实验步骤1.样本处理:–收集待检测样本,并提取目标DNA。
–使用核酸定量仪检测目标DNA的浓度,并计算出适当的稀释倍数。
–将目标DNA按照所需的浓度稀释,并制备出一系列不同浓度的DNA标准曲线样品。
2.PCR反应体系准备:–准备PCR反应混合液,包括模板DNA、引物、荧光探针、酶和缓冲液等。
–按照所需的PCR反应体系,按比例向反应管中加入相应的试剂,确保反应混合液的配制准确。
3.反应条件设置:–设置PCR反应的温度和时间参数,包括初始变性、循环变性、退火和延伸等步骤。
–根据目标序列的特性和引物设计,调整PCR反应的温度梯度、循环次数等参数,以实现最佳放大效果。
4.PCR反应实施:–将PCR反应混合液分装到反应管中,注意避免产生交叉污染。
–将反应管放入PCR仪中,按照设定的温度和时间参数运行PCR反应。
–实时监测PCR反应过程中荧光信号的强度变化,记录关键点的荧光信号值。
5.数据分析:–将PCR反应过程中记录的荧光信号值绘制成实时荧光曲线图。
–根据所制备的DNA标准曲线样品,通过荧光信号值反推目标DNA的初始量。
–根据目标DNA的初始量和稀释倍数,计算样本中目标DNA 的浓度。
实验注意事项1.实验操作前,准备好PCR反应所需的所有试剂和设备,并保持反应管和工作台的清洁。
2.操作过程中,注意避免产生交叉污染,尤其是在样本处理和PCR反应准备阶段。
3.严格按照PCR反应体系准备说明书中的比例和操作要求进行试剂的配制和混合。

实时荧光定量PCR详细操作步骤流程!原理实时荧光定量PCR技术,是指在PCR反应体系中加入荧光基团,利用荧光信号积累实时监测整个PCR进程,最后通过标准曲线对未知模板进行定量分析的方法。
步骤一、样品RNA的抽提1. 取冻存已裂解的细胞,室温放置5分钟使其完全溶解。
2. 两相分离每1 ml的TRIZOL试剂裂解的样品中加入0.2 ml的氯仿,盖紧管盖。
手动剧烈振荡管体15秒后,15到30℃孵育2到3分钟。
4℃下12 000 rpm离心15分钟。
离心后混合液体将分为下层的红色酚氯仿相,中间层以及无色水相上层。
RNA全部被分配于水相中。
水相上层的体积大约是匀浆时加入的TRIZOL试剂的60%。
3. RNA沉淀将水相上层转移到一干净无RNA酶的离心管中。
加等体积异丙醇混合以沉淀其中的RNA,混匀后15到30℃孵育10分钟后,于4℃下12 000 rpm 离心10分钟。
此时离心前不可见的RNA 沉淀将在管底部和侧壁上形成胶状沉淀块。
4. RNA清洗移去上清液,每1 mlTRIZOL试剂裂解的样品中加入至少1 ml的75%乙醇(75%乙醇用DEPCH2O配制),清洗RNA 沉淀。
混匀后,4℃下7 000 rpm离心5分钟。
5. RNA干燥小心吸去大部分乙醇溶液,使RNA沉淀在室温空气中干燥5-10分钟。
6. 溶解RNA沉淀溶解RNA时,先加入无RNA酶的水4 0ul用枪反复吹打几次,使其完全溶解,获得的RNA溶液保存于-80℃待用。
二、 RNA质量检测1. 紫外吸收法测定先用稀释用的TE溶液将分光光度计调零。
然后取少量RNA溶液用TE稀释(1:100)后,读取其在分光光度计260nm和280nm处的吸收值,测定RNA溶液浓度和纯度。
(1)浓度测定A260下读值为1表示40 ug RNA/ml。
样品RNA浓度(μg/ml)计算公式为:A260 x 稀释倍数 x 40 ug/ml。
具体计算如下:RNA溶于40 ul DEPC水中,取5 ul,1:100稀释至495 ul的TE 中,测得A260 = 0.21RNA 浓度= 0.21 x 100 x 40 ug/ml = 840 ug/ml 或 0.84 ug/ul 取5 ul用来测量以后,剩余样品RNA为35 ul,剩余RNA总量为:35 ul x 0.84 ug/ul = 29.4 ug(2)纯度检测RNA溶液的A260/A280的比值即为RNA纯度,比值范围1.8到2.1。
PCR仪确认方案PCR仪是一种用于扩增DNA片段的仪器,是分子生物学实验室中常用的设备之一、为了确保PCR仪的准确性和可靠性,需要进行PCR仪的确认方案。
下面是一个详细的PCR仪确认方案,包括仪器准备、性能测试和验证步骤。
一、仪器准备1.确定确认PCR仪的固定条件,例如温度范围、时间设置等。
2.准备PCR仪所需的耗材,包括PCR试管、PCR反应物、引物等。
3.清洁PCR仪的工作台面和内部,确保无灰尘和杂质。
二、性能测试1.温度精确度测试a.使用温度计分别测量PCR仪的加热块和冷却块的温度,记录温度值。
b.以设置的温度为目标值,在PCR反应槽中设置温度计,进行温度稳定性测试。
c.比较目标温度和实际温度之间的差异,计算温度偏差。
2.温度一致性测试a.在PCR反应槽中放置数个PCR试管,每个试管中加入相同的反应物。
b.设置PCR仪的温度循环程序,进行温度一致性测试。
c.检查各个PCR试管中的反应物扩增结果,评估PCR仪温度循环的一致性。
3.温度均匀性测试a.在PCR反应槽中设置多个温度计,测量不同位置的温度。
b.运行PCR仪的温度循环程序,观察和记录各个位置的温度。
c.比较各个位置的温度差异,计算温度均匀性。
4.反应时间测试a.在PCR反应槽中放置PCR试管,设置不同的扩增时间。
b.完成PCR反应后,分析PCR试管中的扩增结果,评估PCR仪的反应时间准确性。
三、验证1.重复性验证a.准备相同的PCR反应物和程序,分别在不同的PCR仪上进行PCR扩增。
b.比较各个PCR仪之间的扩增结果,评估其重复性。
2.敏感性验证a.准备不同浓度的DNA样品,分别加入PCR反应槽进行PCR扩增。
b.比较不同浓度DNA样品的扩增结果,评估PCR仪的敏感性和线性范围。
3.特异性验证a.准备包含目标基因和非目标基因的PCR反应槽,进行PCR扩增。
b.检查PCR试管中的扩增产物,确认PCR仪的特异性。
四、记录和分析结果1.记录每个测试项目的结果,包括温度精确度、温度一致性、温度均匀性、反应时间等。
乙型肝炎病毒DNA定量检测室内质控品的制备及应用研究目的自制乙型肝炎病毒DNA室内质控血清并探讨其在临床标本检验中的应用价值。
方法用检测后的患者标本自制阳性室内质控血清,用实时荧光定量PCR检测血清HBV-DNA,记录2013年1~5月质控结果、标准曲线的斜率、截距、相关系数和相关结果的均值(x)、标准差(s)及变异系数(cv);结果自制质控物结果对数的累计数据x±2s范围为 4.3~5.34,在该质控的参考值范围内;结论本实验室采用Taqman实时荧光定量PCR法检测HBV-DNA实验中,质控品稳定性良好,可联合运用多参数同时监测的质控方法进行,能保证为临床提供有效可靠的准确结果。
标签:聚合酶链式反应;室内质控;斜率;截距;相关系数乙型肝炎属于我国高发的流行性疾病。
日前为止,我国慢性乙型肝炎病毒感染者约为1.3亿,其中慢性乙型肝炎患者约5000万例。
HBV DNA定量检测可反映病毒复制水平,主要用于慢性HBV感染的诊断、治疗适应证的选择及抗病毒疗效的判断[1]。
一般当患者肝功波动,转氨酶升高,乙肝病毒复制指标阳性,肝功处于代偿阶段的时候,抗病毒治疗最为合适[2]。
实时荧光定量PCR是目前核酸定量检测较为理想和方便的方法之一,而Taqman探针技术的应用更大大增加了探针的杂交稳定性,使结果更精确、分辨率更高[3]。
但其结果因反应体系、系统误差、检测条件、人员等多种因素影响,易致结果的批内、批间差异较大,因此需要好的质控方法和质控品保证结果的稳定性和可靠性。
我室收集2013年1~5月对自制HBV-DNA阳性质控血清检测的质控结果、标准曲线和相关结果的均值(x)、标准差(s)及变异系数(cv)进行累积数据评价,斜率、截距、相关系数结果分析如下。
1 材料与方法1.1 试剂与仪器仪器为广州中山大学达安基因股份有限公司生产的DA7600荧光定量扩增分析仪,试剂为该公司配套试剂。
1.2 质控血清来源选取日常患者无溶血、无脂血、无黄疸的阳性血清标本(乙肝病毒定量值104~105),收集标本血清20ml,混匀,进行HBV-DNA定量检测,结果为6.93×104,对数值为4.84,在预期范围内。
实时荧光定量PCR仪快速操作指南1.连接电源从包装箱里取出仪器放置在实验台上,拿出电源线和电源适配器,将电源线一端与电源适配器相连,另一端连接至交流220V电源插座(AC85~264V)电源适配器的输出端连接到仪器电源插孔。
接口插入仪器电源插孔,注意插孔方向箭头方向朝上。
打开仪器背面的电源开关开启仪器,仪器自检成功,自动进入到软件界面。
2.样品准备◼准备试剂Q1600实时荧光定量PCR仪使用0.2ml透明离心试管根据试剂要求选用10-100μl合适的加液量。
◼离心操作配置完成试剂样本的试管在放入仪器之前,要用离心机进行离心操作,确保试剂液体处于试管底部,且液体内部不含有气泡。
◼放置样品将反应管按照顺序放入加热孔内。
3.设置程序,运行实验软件操作基本步骤:◼新建实验新建实验,选择运行槽◼基本设置设置实验名称,实验类型,检测项目,选择使用的染料。
◼样本设置设置样品名称,样本ID号,选择样本类型◼程序设置设置需要的反应程序◼保存文件单击保存,保存实验文件◼运行单击运行,运行实验。
4.结果分析◼实验结束,软件自动计算Ct值,根据判定规则自动出结果。
◼如需进行熔解分析和基因分型,在软件分析类型里选择相应的分析功能。
5.结果导出◼导出实验结果单击导出,导出实验数据。
◼结果打印连接配置的热敏打印机,选中要打印的样品孔,单击打印,打印实验结果。
6.关闭仪器◼实验结束,取出反应管◼长按仪器前面板关机按键,关闭仪器◼长时间不使用仪器,请关闭仪器背部左下角电源开关。
确认文件江西瑞济生物工程技术股份有限公司类别:确认方案编号:部门:质量部页码:共11页,第1页DA7600PCR扩增仪方案与报告版次:☐新订☐替代:起草:年月日审阅会签:(确认小组)批准:年月日目录1.概述 (3)2.确认目的 (3)3.确定确认范围 (3)4.确定确认小组成员及职责 (3)4.1确认小组成员及确认小组负责人 (3)4.2人员 (3)4.2.1评价方法: (3)4.2.2标准: (4)5.风险评估 (4)5.1评估概述 (4)5.2评估方法 (4)6.确认内容 (7)6.1.安装确认 (7)6.1.1安装信息 (7)6.1.2仪器放置检查 (7)6.1.3操作规程等资料确认 (8)6.2运行确认 (8)6.2.1基本称重功能确认................... 错误!未定义书签。
6.2.2 校正功能确认 ..................... 错误!未定义书签。
6.3性能确认............................. 错误!未定义书签。
6.3.1准确度............................. 错误!未定义书签。
6.3.2天平重现性检查:................... 错误!未定义书签。
6.3.3四角偏差检查:..................... 错误!未定义书签。
7确认计划安排........................... 错误!未定义书签。
9.确认结果评定与结论 .................... 错误!未定义书签。
10.拟订日常监测程序及确认周期............ 错误!未定义书签。
1.概述DA7600实时荧光定量PCR仪,是中山大学达安基因公司推出的具有全自动、实时监测、定量分析的DNA荧光检测系统。
结合半导体致冷器实现PCR扩增过程,并通过高灵敏度的光电系统和高通量光纤导光系统对荧光信号进行实时监测,实现同时对样品的扩增和检测。
PCR仪确认方案TS-52-0001设备编号:有限公司确认立项申请表参加仪器确认人员亳州詹政中药饮片有限公司确认文件目录1.概述2.目的3.范围4.确认小组成员及职责5.方案执行6.内容6.1.文件检查6.2. 安装确认6.3. 运行确认6.4. 性能确认6.5. 确认结论6.6. 再确认7. 参考文件8. 风险评估1.概述PCR仪为化验室常用仪器,为确认该仪器各项性能仍符合要求,制订本方案对该仪器进行确认。
1.1. 仪器概况本台 PCR仪是仪器有限公司生产的可任意控程的梯度温度仪。
最佳的、恒定的升降温速率,大大降低了摸索性试验的工作强度从而提高了试验的效率与质量。
1.2. 仪器用途该仪器用于乌梢蛇、蕲蛇、川贝母等聚合链式反应(简称PCR)。
2.确认目的对该仪器进行安装确认、运行确认及性能确认,以确定仪器是否仍具有良好的升降温性能,是否仍能满足日常分析测试工作的需要。
3.范围适用于 PCR仪的确认。
4.确认小组成员及职责5.方案执行所有的空白记录都要被填写,如果项目不适用,用单线划掉,签名并注明日期。
所有的测试项目都应完成,若未完成应记录,按偏差处理,并说明相关原因和解决的措施。
所有的偏差均要求记录,并用适当的方法评估其影响,并证明采取的纠正措施是可以被接受的。
6.内容6.1.文件检查6.1.1.目的确保与本次确认的相关文件都齐全。
6.1.2.程序6.1.2.1.确定仪器使用说明书等相关原始资料和技术文件齐全。
6.1.2.2.相关人员接受了确认方案及相关操作规程的培训。
6.1.2.3.确认方案中涉及的所有仪器均经过校准,并在有效期内,且有必需的相关证书。
6.1.3.可接受标准根据确认“表1 文件检查记录”的要求,核对相关文件,确保文件完整。
相关人员接受了确认方案及相关操作规程的培训。
6.1.4.原始记录检查记录见“表1.文件检查记录”。
表1 文件检查记录(一)仪器原始资料及操作规程检查检查人:日期:复核人:日期:(二)文件培训检查检查人:日期:复核人:日期:6.2. 具体确认步骤6.2.安装确认6.2.1.目的由于在初始安装K960型PCR仪时,未进行系统的安装确认,故在本次确认中,重新对零配件和仪器的安装条件进行确认,保证各项检查项目结果合格,仪器的安装正确,且能正常运行。
确认文件类别:确认方案编号:部门:质量部页码:共11页,第1页DA7600PCR扩增仪方案与报告版次:新订替代:起草:年月日审阅会签:(确认小组)批准:年月日目录1.概述 (3)2.确认目的 (4)3.确定确认范围 (4)4.确定确认小组成员及职责 (4)4.1确认小组成员及确认小组负责人 (4)4.2人员 (5)4.2.1评价方法: (5)4.2.2标准: (5)5.风险评估 (6)5.1评估概述 (6)5.2评估方法 (6)6.确认内容 (10)6.1.安装确认 (10)6.1.1安装信息 (10)6.1.2仪器放置检查 (10)6.1.3操作规程等资料确认 (11)6.2运行确认 (11)6.2.1基本称重功能确认.......................................... 错误!未定义书签。
6.2.2 校正功能确认.............................................. 错误!未定义书签。
6.3性能确认.............................................................. 错误!未定义书签。
6.3.1准确度............................................................... 错误!未定义书签。
6.3.2天平重现性检查:.......................................... 错误!未定义书签。
6.3.3四角偏差检查:.............................................. 错误!未定义书签。
7确认计划安排....................................................... 错误!未定义书签。
9.确认结果评定与结论............................................ 错误!未定义书签。
确认文件
类别:确认方案编号:
部门:质量部页码:共11页,第1页
DA7600PCR扩增仪
方案与报告
版次:☐新订☐替代:
起草:年月日审阅会签:
(确认小组)
批准:年月日
目录
1.概述 (2)
2.确认目的 (2)
3.确定确认范围 (3)
4.确定确认小组成员及职责 (3)
4.1确认小组成员及确认小组负责人 (3)
4.2人员 (3)
4.2.1评价方法: (3)
4.2.2标准: (3)
5.风险评估 (4)
5.1评估概述 (4)
5.2评估方法 (4)
6.确认内容 (7)
6.1.安装确认 (7)
6.1.1安装信息 (7)
6.1.2仪器放置检查 (7)
6.1.3操作规程等资料确认 (8)
6.2运行确认 (8)
6.2.1基本称重功能确认 (8)
6.2.2 校正功能确认 (9)
6.3性能确认 (9)
6.3.1准确度 (9)
6.3.2天平重现性检查: (10)
6.3.3四角偏差检查: (11)
7确认计划安排 (11)
9.确认结果评定与结论 (11)
10.拟订日常监测程序及确认周期 (12)
1.概述
DA7600实时荧光定量PCR仪,是中山大学达安基因公司推出的具有全自动、实时监测、定量分析的DNA荧光检测系统。
结合半导体致冷器实现PCR扩增过程,并通过高灵敏度的光电系统和高通量光纤导光系统对荧光信号进行实时监测,实现同时对样品的扩增和检测。
友好的全中文计算机界面,可满足不同PCR实验的需求。
其反应速度及准确性、操作实用性和使用灵活性均有较好的提高,能满足科研工作者对于定量PCR系统高通量方面的要求,是特异性靶基因检测与定量的一体化平台。
它主要有一台DA7600和PC计算机及显示器组成。
2.确认目的
通过用HCV荧光PCR检测试剂盒来确认DA7600实时荧光定量PCR仪的扩增和检测体系精密度、线性、准确度等,验证仪器能否正常准确运行,给出可靠的分析结果,以及48孔孔间差异是否在允许范围内。
3.确定确认范围
本方案适用于DA7600实时荧光定量PCR仪运行确认及性能确认。
4.确定确认小组成员及职责
4.1确认小组成员及确认小组负责人
列出参加DA7600确认的所有人员名单,评价培训情况是否符合操作的要求。
4.2.1评价方法:
查阅培训档案,确认是否对有关操作者进行了相关培训,包括:
1、DA7600实时荧光定量PCR仪操作,维护保养规程
2、《DA7600中文操作说明书》
3、《GBT 27921-2011 风险管理风险评估技术》
4、确认方案实施培训
4.2.2标准:
在本方案实施前,应对方案实施过程中涉及人员进行培训且考核合格,以保证方案顺利实施。
人员培训情况表
确认人:日期:
复核人:日期:
5.风险评估
5.1评估概述
作为植入性医疗器械生产企业,产品的质量控制至关重要,而检验仪器又作为质量控制必不可少的设备。
因此,为了进一步提高质量部对仪器的管理水平,发现并尽可能消除一些潜在的风险对实验和检验结果造成的威胁,现依据《GBT 27921-2011 风险管理风险评估技术》标准对本仪器进行风险评估,对存在的缺陷及质量风险给出合理分析和防范措施。
5.2评估方法
本方法采用失效模式和影响分析(FMEA)程序.同时风险识别风险管理小组成员使用头脑风暴法,分析了仪器室可能出现的各种偏离正常的偏差,即潜在的失效模式、
失效模式可能造成的影响、该影响对检品质量、安全造成的危害以及这些危害的严重程度、危害发生的可能性及可检测性。
(见表一:仪器室潜在失效模式及分析表)说明:严重程度用1-10的数字来表示,其中,1表示对检测数据几乎无影响;2-4表示对检测数据影响较轻微;5-7表示对检测数据产生中等影响;8-10表示会对检测数据造成严重影响
可能性用1-10的数字表示,其中,1表示几乎不可能发生;2-4表示发生的可能性较小;5-7表示发生的可能性为中等,8-10表示发生的可能性很大。
可检测性用1-10的数字表示,其中,1表示完全可以检测出来;2-4表示在一定程度上可以检测;5-7表示检测的可能性较小;8-10表示几乎无法检测。
第6 页共9 页
6.确认内容
DA7600实时荧光定量PCR仪确认工作由质量部有关人员参与实施。
6.1.安装确认
6.1.1安装信息
6.1.2仪器放置检查
复核人:日期
6.1.3操作规程等资料确认
复核人:日期
6.2运行确认
6.2.1 PC计算机运行环境确认
运行环境确认内容检查配套计算机能否正常开机运行,是否有中病毒等现象,能否为DA7600运行软件和分析软件提供安装平台和运行平台。
6.2.1.1 结果记录
复核人:日期
6.2.2DA7600运行软件及分析软件的确认
软件确认内容双击电脑桌面上的DA7600运行软件及分析软件的图标,看应用软件能否打开,能否正常使用。
6.2.2.1 结果记录
6.2.3.1. 灵敏度和线性
6.2.3.1.1方法利用HCV荧光PCR检测试剂盒,取12支HCV反应管,并分别
使用HCV 标准参考品(1.0E4,1.0E5,1.0E6,1.0E7)、阴性对照、空白对照,
均做复管,按照说明书的操作步骤进行。
6.2.3.1.2 合格标准(1)空白对照和阴性对照无起跳(2)标准参考品标准曲线的相关系数R≥0.98,复管重复性良好。
6.2.3.1.3 数据记录
6.2.3.2 孔间差异
6.2.3.2.1方法:利用HBV荧光PCR检测试剂盒,取出48支反应管,每支分别加入相同的模板HBV 标准参考品1.0E4,同时进行实时扩增检测。
6.2.3.2.2合格标准(1)空白、阳性对照无起跳(2)每孔相对偏差值不大于8% 4.3.2.3 数据记录 4.3.2.4 数据分析孔间差计算方法CTi ×100% (CT1 +CT2 +CT3 +……CTn)/n
7 异常情况处理
在验证的过程中,应严格按照验证方案操作,若出现个别项目不合格,应查明原因后重新进行验证。
如果属于仪器设备原因,则由验证小组和质量部负责人协同处理或联系厂家进行维修,并填写相应记录。
8 验证最终结果分析和评定
评定人:评定时间:
9再验证周期
9.1 在一般情况下每一年验证一次。
9.2 如更更换仪器零部件或重大维修,完成后均要再次验证,以证明更换零部件及维修对仪器的正常使用没有影响。
9.3 再验证启动时,按照完整程序进行。
10 验证批准批准人:批准时间:。