实时荧光定量PCR详细操作步骤
- 格式:doc
- 大小:110.00 KB
- 文档页数:3
实时荧光定量PCR
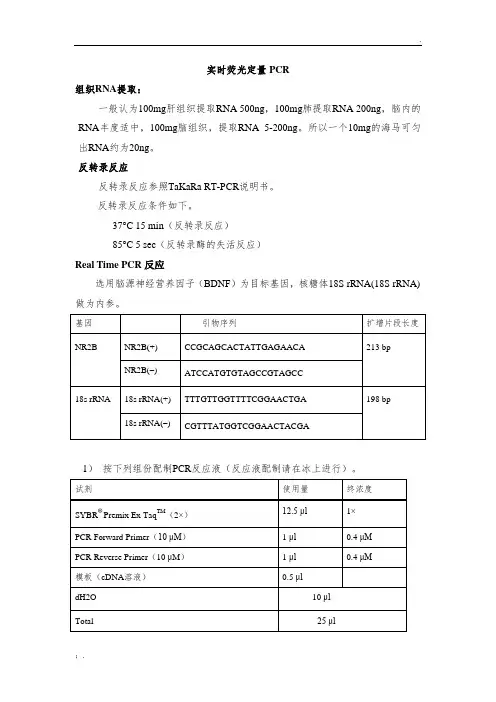
组织RNA提取:
一般认为100mg肝组织提取RNA 500ng,100mg肺提取RNA 200ng,脑内的RNA丰度适中,100mg脑组织,提取RNA 5-200ng。
所以一个10mg的海马可匀出RNA约为20ng。
反转录反应
反转录反应参照TaKaRa RT-PCR说明书。
反转录反应条件如下。
37°C 15 min(反转录反应)
85°C 5 sec(反转录酶的失活反应)
Real Time PCR反应
选用脑源神经营养因子(BDNF)为目标基因,核糖体18S rRNA(18S rRNA)做为内参。
1)按下列组份配制PCR反应液(反应液配制请在冰上进行)。
全班40人,分为5组,每组做8管。
4管做BDNF,4管做18S rRNA。
4管BDNF 或者18S rRNA,采用相应的正反PCR引物。
每种基因做两个模板,一个模板采用原液浓度,一个模板采用稀释一倍浓度,体积均为0.5 μl。
2)三步法PCR
首先95°C 作用3 min。
PCR进行35个循环。
步骤温度时间
变性95°C 30 秒
退火58°C 30 秒
延伸72°C 30 秒
融解曲线
温度时间变温速度
95°C 0秒20°C/秒
55°C 15秒20°C/秒
95°C 0秒0.1°C/秒。

实时荧光定量PCR技术实验操作流程
1.RNA提取:
针对茎环状结构RT引物,RNA正常提取就好;对于Oligod(T)特异的RT引物,尽量用特殊试剂盒提取miRNA。
2.反转录:
反转录过程对酶没有特殊要求,操作按照反转录酶的说明书进行。
对于引物,在反转录过程中只需加入Oligod(T)特异的RT引物或茎环状结构RT引物,不需要另外添加其他RT引物。
用Oligod(T)特异的RT引物时,RNA需要进行3'Poly(A)加尾处理。
内参基因不需要单独设计RT引物,可以用荧光定量PCR的反向引物作为RT引物。
3.荧光定量PCR:
先优化PCR体系(引物浓度、退火温度等),进行引物测试,确保扩增曲线正常且溶解曲线为单一的尖峰,阴性对照无扩增,则引物测试合格,再进行后续实验(常规操作)。

实时荧光定量PCR具体实验步骤
实时荧光定量(Real Time quantitative PCR)是检测RNA或DNA的一种常用技术,通过检测特定目标的增加(或减少),可以用来测定RNA 或DNA的表达水平,或者基因等的转录水平。
下面我们就对实时荧光定量PCR(RT-qPCR)的实验步骤进行具体介绍。
1.搭建实验
第一步是搭建实验,即准备实验所需的干燥试剂,第二步是准备RNA 样本,第三步是准备标准曲线,最后是根据实验需要准备实验板和实验试管。
2、RNA样品提取
在实验中,会使用到多种RNAs,一般情况下使用TRIzol或Phenol 抽提方法进行RNA抽提,不同的细胞、组织中RNA的杂质含量不一样,因此需要根据实验需求进行适当调整抽提浓度。
3、RT-qPCR反转录
在RT-qPCR反转录之前,首先要准备反转录试剂,一般采用qPCR反转录试剂盒,这种试剂盒含有足够的反转录荧光探针以及反转录引物,它可以有效帮助反转录过程。
反转录过程通过复制DNA片段的过程完成,最终转录出的cDNA存在细胞核中。
4、qPCR扩增实验
qPCR扩增实验是在反转录完成后进行,一般来说,这个步骤可以采用qPCR扩增试剂盒,该试剂盒中包含所需的扩增物质如DNA聚合酶、前驱核苷酸、dNTPs,检测细胞核中的cDNA。

实时荧光定量PCR (Quantitative Real-time PCR)是一种在DNA扩增反应中,以荧光化学物质测每次聚合酶链式反应(PCR)循环后产物总量的方法。
通过内参或者外参法对待测样品中的特定DNA序列进行定量分析的方法。
·Real-timePCR是在PCR扩增过程中,通过荧光信号,对PCR 进程进行实时检测。
由于在PCR扩增的指数时期,模板的Ct值和该模板的起始拷贝数存在线性关系,所以成为定量的依据。
①取冻存已裂解的细胞,室温放置5分钟使其完全溶解。
②两相分离每1ml的TRIZOL试剂裂解的样品中加入0.2ml的氯仿,盖紧管盖。
手动剧烈振荡管体15秒后,15到30℃孵育2到3分钟。
4℃下12000rpm离心15分钟。
离心后混合液体将分为下层的红色酚氯仿相,中间层以及无色水相上层。
RNA全部被分配于水相中。
水相上层的体积大约是匀浆时加入的TRIZOL试剂的60%。
③RNA沉淀将水相上层转移到一干净无RNA酶的离心管中。
加等体积异丙醇混合以沉淀其中的RNA,混匀后15到30℃孵育10分钟后,于4℃下12000rpm 离心10分钟。
此时离心前不可见的RNA沉淀将在管底部和侧壁上形成胶状沉淀块。
④RNA清洗移去上清液,每1mlTRIZOL试剂裂解的样品中加入至少1ml的75%乙醇(75%乙醇用DEPCH2O配制),清洗RNA 沉淀。
混匀后,4℃下7000rpm离心5分钟。
⑤RNA干燥小心吸去大部分乙醇溶液,使RNA沉淀在室温空气中干燥5-10分钟。
⑥溶解RNA沉淀溶解RNA时,先加入无RNA酶的水40μl 用枪反复吹打几次,使其完全溶解,获得的RNA溶液保存于-80℃待用。

实时荧光定量PCR操作指南实时荧光定量聚合酶链反应(quantitative real-time PCR,qRT-PCR)是一种常用的分子生物学技术,广泛应用于基因表达、病毒检测、疾病诊断等领域。
本文将为您提供一份详细的实时荧光定量PCR操作指南,以帮助您正确高效地进行实验。
一、前期准备1.仪器准备确保实时荧光定量PCR仪的工作状态正常,能够提供稳定的温控和荧光检测功能。
2.试剂准备准备好使用的引物和探针、反转录酶、核酸模板、PCR酶、荧光探针等试剂,并按照相关说明进行稀释和储存。
3.实验室操作保持实验室环境清洁整洁,确保试剂和样品不受外界污染。
佩戴实验手套和口罩,避免DNA污染。
二、PCR体系设置根据您的实验目的和试剂系统的要求,设置PCR反应的体积和组分。
1.配置PCR体系a.将反向转录试剂盒中的试剂按照说明书中的比例进行配置,包括引物、探针、反转录酶、核酸模板等。
b.添加核酸模板到体系中,确保模板的质量和浓度适合实验要求。
c.添加合适的PCR酶,如Taq DNA聚合酶、Platinum Taq DNA聚合酶等。
d.添加稀释的胶原酶。
2.装管设置a.在无菌条件下,将PCR反应体系分装至PCR管中。
b.避免气泡的产生,确保体系均匀混合。
三、PCR参数设置根据实验需求和试剂系统的建议,设置PCR反应的温度和时间参数。
1.反转录步骤a.按照试剂盒说明书的建议,设置反转录温度和时间。
常见的反转录参数为42℃,60分钟。
2.PCR扩增步骤a.设置初始变性温度和时间。
常见的初始变性参数为95℃,5分钟。
b.设置PCR循环数和每个循环的温度和时间。
常见的PCR循环参数为95℃,15秒;60℃,1分钟,共40个循环。
c.设置荧光检测温度和时间。
根据荧光探针的特性,设置合适的温度和时间窗口。
四、数据分析和结果解读1.数据采集实时荧光定量PCR仪会自动记录荧光信号和温度变化数据,确保您保存这些数据供后续分析和结果解读使用。

qpcr的操作流程
实时荧光定量PCR(qPCR)是一种高效、准确的分子生物学技朧,广泛应用于基因表达分析、病原体检测、基因型鉴定等领域。
下面将介绍qPCR的操作流程。
1. 样品处理:首先需要从样品中提取RNA或DNA,并进行适当
的纯化处理。
确保提取的核酸质量和浓度符合实验要求。
2. 质控检测:对提取的核酸进行质控检测,包括测定纯度、浓
度和完整性。
确保核酸的质量符合实验要求。
3. 反转录:对RNA进行反转录反应,将RNA转录为cDNA。
反
转录反应需要使用逆转录酶和引物,确保反转录产物的质量和完整性。
4. 准备qPCR反应体系:根据实验设计和引物设计,准备qPCR
反应体系。
包括模板DNA或cDNA、引物、探针、核酸酶、缓冲液等。
确保反应体系的配比准确。
5. 进行qPCR反应:将准备好的反应体系加入到qPCR仪器中,
进行PCR扩增反应。
根据实验设计和引物特性,设置合适的PCR程
序和参数。
6. 数据分析:分析qPCR反应的数据,包括计算Ct值、绘制标
准曲线、计算目标基因的相对表达量等。
确保数据的准确性和可靠性。
7. 结果解读:根据数据分析结果,解读实验结果。
判断目标基因的表达水平、基因型等信息,为后续实验和研究提供参考。
总的来说,qPCR操作流程包括样品处理、质控检测、反转录、准备反应体系、进行PCR反应、数据分析和结果解读等步骤。
通过严格的实验设计和操作规范,可以获得准确、可靠的实验结果,为分子生物学研究提供重要的数据支持。

实时荧光定量PCR详细操作步骤流程!原理实时荧光定量PCR技术,是指在PCR反应体系中加入荧光基团,利用荧光信号积累实时监测整个PCR进程,最后通过标准曲线对未知模板进行定量分析的方法。
步骤一、样品RNA的抽提1. 取冻存已裂解的细胞,室温放置5分钟使其完全溶解。
2. 两相分离每1 ml的TRIZOL试剂裂解的样品中加入0.2 ml的氯仿,盖紧管盖。
手动剧烈振荡管体15秒后,15到30℃孵育2到3分钟。
4℃下12 000 rpm离心15分钟。
离心后混合液体将分为下层的红色酚氯仿相,中间层以及无色水相上层。
RNA全部被分配于水相中。
水相上层的体积大约是匀浆时加入的TRIZOL试剂的60%。
3. RNA沉淀将水相上层转移到一干净无RNA酶的离心管中。
加等体积异丙醇混合以沉淀其中的RNA,混匀后15到30℃孵育10分钟后,于4℃下12 000 rpm 离心10分钟。
此时离心前不可见的RNA 沉淀将在管底部和侧壁上形成胶状沉淀块。
4. RNA清洗移去上清液,每1 mlTRIZOL试剂裂解的样品中加入至少1 ml的75%乙醇(75%乙醇用DEPCH2O配制),清洗RNA 沉淀。
混匀后,4℃下7 000 rpm离心5分钟。
5. RNA干燥小心吸去大部分乙醇溶液,使RNA沉淀在室温空气中干燥5-10分钟。
6. 溶解RNA沉淀溶解RNA时,先加入无RNA酶的水4 0ul用枪反复吹打几次,使其完全溶解,获得的RNA溶液保存于-80℃待用。
二、 RNA质量检测1. 紫外吸收法测定先用稀释用的TE溶液将分光光度计调零。
然后取少量RNA溶液用TE稀释(1:100)后,读取其在分光光度计260nm和280nm处的吸收值,测定RNA溶液浓度和纯度。
(1)浓度测定A260下读值为1表示40 ug RNA/ml。
样品RNA浓度(μg/ml)计算公式为:A260 x 稀释倍数 x 40 ug/ml。
具体计算如下:RNA溶于40 ul DEPC水中,取5 ul,1:100稀释至495 ul的TE 中,测得A260 = 0.21RNA 浓度= 0.21 x 100 x 40 ug/ml = 840 ug/ml 或 0.84 ug/ul 取5 ul用来测量以后,剩余样品RNA为35 ul,剩余RNA总量为:35 ul x 0.84 ug/ul = 29.4 ug(2)纯度检测RNA溶液的A260/A280的比值即为RNA纯度,比值范围1.8到2.1。

实时荧光定量PCR具体实验步骤1.提取样本RNA/DNA:首先,从研究对象中提取出所需的RNA或DNA样本。
可以使用商业化的提取试剂盒来完成这一步骤。
2. 反转录酶链反应(RT):如果提取的样本为RNA,则需要先进行反转录酶链反应,将RNA转录成cDNA(即DNA拷贝),反转录酶具有多样性(M-MLV逆转录酶)和过程性(RTase)。
3.准备PCR反应体系:根据实验所需的扩增模板和引物,将PCR反应体系按照厂家提供的信息制备,通常需要包括PCR反应缓冲液、dNTPs、引物、酶、模板DNA/cDNA和稀释水。
4. 调整荧光探针的浓度:如果实验中使用到了荧光探针(如TaqMan探针、MGB探针等),需要根据实验要求对荧光探针的浓度进行调整。
5.放置PCR板:将所需的PCR试管或板放置在适当的位置,以便加载反应体系。
6.反应体系加载:按照实验所需的样品数量和模板浓度,依次向PCR反应管或板中加入反应体系。
注意,需要设置相应的阳性对照和阴性对照。
7.封闭PCR反应管/板:闭合PCR反应管或板,以防止反应体系的挥发和样品的交叉污染。
8.准备PCR仪:根据PCR仪的要求,调整PCR仪的温度和时间参数。
9.PCR扩增:将已封闭的PCR反应管或板放置在预热的PCR仪中,开始PCR扩增。
根据实验需要,设置不同的PCR程序(如热启动PCR、两步PCR和三步PCR等)。
10. 实时监测PCR过程:在PCR反应过程中,实时监测PCR反应管或板中产生的荧光信号,并记录下每个周期(cycle)的荧光值。
11. 数据分析:根据荧光信号的变化,结合标准曲线法或相对表达量法,对PCR反应中目标序列的数量进行定量分析。
常见的分析软件包括Stratagene MxPro QPCR软件和Applied Biosystems SDS软件等。
12.结果分析和解释:根据数据分析的结果,对实验结果进行解释和讨论,并在图表中呈现。
13. 结果验证:可以使用其他方法验证RT-qPCR的结果,如Western blotting、细胞免疫化学分析等。

实时荧光定量PCR仪操作流程实时荧光定量PCR(Polymerase Chain Reaction)仪是一种常用的分子生物学实验仪器,用于定量检测DNA或RNA样本中的特定序列。
通过对PCR反应进行荧光检测,可以实时监测目标序列的扩增过程,并且具有高灵敏度和高特异性的优势。
下面将介绍实时荧光定量PCR 仪的操作流程,以帮助您正确进行实验。
1. 准备工作在开始实时荧光定量PCR实验之前,需要准备以下实验器材和试剂:(1)实时荧光定量PCR仪:确保仪器已预热至适当的温度;(2)PCR反应管或板:根据实验需要选择适当的规格;(3)PCR试剂盒:包括DNA模板、引物、探针、酶等;(4)DNA/RNA样本:按照实验设计合理稀释或提取,确保样本质量良好;(5)聚合酶链式反应混合液(PCR Mix):根据试剂盒说明配置混合液。
2. 操作步骤(1)设置PCR仪参数:将需要的实验参数输入PCR仪中,包括扩增阶段的温度、时间和循环次数等。
(2)制备PCR反应体系:按照试剂盒说明书中的配方将PCR Mix、DNA模板、引物和探针等加入PCR反应管或板中。
(3)密封反应管或板:确保反应管或板密封良好,避免样品蒸发或污染。
(4)放入PCR仪:将密封好的PCR反应管或板放入PCR仪中,确保仪器已预热至适当的温度。
(5)运行实验:启动PCR仪,开始实时荧光定量PCR反应。
仪器会根据设置的参数自动进行温度循环和荧光信号监测。
(6)数据分析:实验进行过程中,可以通过PCR仪的软件实时监测扩增曲线和荧光信号,获得相关的实验数据。
(7)结果解读:根据实验目的和结果,对荧光信号和扩增曲线进行分析和解读,获得所需的定量PCR结果。
3. 注意事项(1)实验操作应按照严格的无菌操作要求进行,避免PCR反应受到外部污染。
(2)实时荧光定量PCR仪涉及的试剂和标本具有一定的生物安全风险,应按照相关安全规范进行操作和处理。
(3)准确的数据记录和标注是保证实验结果可靠性的重要环节,务必在实验过程中进行详细记录。

实时荧光定量pcr的方法实时荧光定量PCR(Real-time quantitative PCR,qPCR),也称为荧光定量PCR,是一种常用于检测和定量DNA或RNA的分子生物学技术。
相比传统的PCR方法,实时荧光定量PCR具有更高的灵敏度、准确性和特异性,能够量化目标核酸序列的含量。
实时荧光定量PCR的原理主要包括PCR反应的进行和荧光信号的检测与实时监测。
PCR反应是通过逐渐升高的温度循环,使DNA链解链、引物与模板相互结合,合成新的DNA链,不断扩增目标序列的过程。
荧光信号的检测是通过加入特定的荧光探针,在PCR反应过程中的每个循环都量化目标序列的含量,并以荧光信号的强度来表示。
下面将详细介绍实时荧光定量PCR的方法及其一般步骤。
1. 样品处理与提取:首先需要从待测样品中提取出目标DNA或RNA的模板,并进行适当的处理。
比如,可以使用细胞裂解液或提取试剂盒来裂解和纯化细胞或组织中的核酸。
2. 反转录:对于需要检测的RNA目标,需要先将其反转录为cDNA。
这一步骤通常使用反转录酶和适当的引物,在一定的温度条件下合成cDNA。
反转录反应通常在37-42C进行。
3. 扩增反应体系制备:根据实验需要和反应装置的规格,配制好PCR反应的体系。
体系中的成分通常包括模板DNA(cDNA或DNA模板)、引物(前向引物和逆向引物)、荧光标记探针(如TaqMan探针)、聚合酶(如Taq DNA聚合酶)、dNTPs等。
4. PCR扩增条件设置:根据模板DNA的长度和序列特性,设置PCR反应的温度和时间条件。
通常,PCR反应的温度包括初始变性(95C)、扩增(56-72C)和延伸(72C)等多个循环。
5. 荧光信号的检测与实时监测:PCR反应过程中,可以通过专用的实时荧光定量PCR仪器进行检测和监测。
这类仪器常常能够实时记录PCR反应的荧光信号强度,并产生实时的反应曲线图。
根据荧光信号的强度变化,可以推断目标DNA 或RNA的含量。

实时荧光定量PCR详细操作步骤1.准备试剂和样品a.预先准备PCR反应混合溶液包括引物、探针、酶和缓冲液的混合物。
b.从样品中提取RNA或DNA,并在低温下保存以避免降解。
c.根据需要进行RNA或DNA的定量和纯化。
2.设计引物和探针a.根据目标序列设计引物和探针。
b.引物应具有适当的长度、GC含量和熔点。
c. 控制探针以与目标序列选择相应的荧光染料,如SYBR Green或TaqMan探针。
3.准备反应混合物a.在无菌条件下将PCR反应混合物配制到适当的反应管中,每个反应管中包含适当浓度的引物、探针和模板DNA。
b.避免反应管中引物和探针暴露在光下。
c.快速离心反应管以使反应物沉入管底。
4.设置PCR程序a.启动PCR仪,设置反应条件,包括温度、时间和周期数。
b.通常,PCR程序包括初始化步骤,如酶激活和DNA解链,随后进行多个循环,每个循环包括DNA扩增和荧光信号检测步骤。
5.进行PCR扩增a.将反应管置于PCR仪中,在适当的温度下进行PCR扩增。
温度通常在95°C和60°C之间变化。
b.扩增过程中会产生新的DNA分子,PCR仪的热循环可使目标序列按指数方式扩增。
6.监测荧光信号a.在每个循环的特定温度下,荧光信号被激活,并通过PCR仪的探测系统检测。
b.荧光信号的大小与含有荧光标记分子的DNA分子数量成正比。
7.分析数据a.在扩增过程中记录每个循环的荧光信号。
b.使用PCR仪的软件分析数据,生成标准曲线,计算目标序列的相对丰度。
8.结果解释a.使用阈值循环数(Ct)来表示目标序列在每个样本中的相对丰度。
b.相对丰度可以通过与参照基因进行相对定量或通过绝对定量法计算获得。
总结:实时荧光定量PCR是一种准确量化DNA、RNA和蛋白质的方法,它包括准备试剂和样品、设计引物和探针、准备反应混合物、设置PCR程序、进行PCR扩增、监测荧光信号、分析数据和结果解释等步骤。
通过qPCR,我们可以准确测量目标序列的相对丰度,并在许多生物学研究和诊断领域中发挥重要作用。
实时荧光定量PCR操作步骤以下实验步骤仅供参考:1 样品RNA的抽提①取冻存已裂解的细胞,室温放臵5分钟使其完全溶解。
②两相分离每1ml的TRIZOL试剂裂解的样品中加入0.2ml的氯仿,盖紧管盖。
手动剧烈振荡管体15秒后,15到30℃孵育2到3分钟。
4℃下12000rpm离心15分钟。
离心后混合液体将分为下层的红色酚氯仿相,中间层以及无色水相上层。
RNA全部被分配于水相中。
水相上层的体积大约是匀浆时加入的TRIZOL试剂的60%。
③RNA沉淀将水相上层转移到一干净无RNA酶的离心管中。
加等体积异丙醇混合以沉淀其中的RNA,混匀后15到30℃孵育10分钟后,于4℃下12000rpm 离心10分钟。
此时离心前不可见的RNA沉淀将在管底部和侧壁上形成胶状沉淀块。
④RNA清洗移去上清液,每1mlTRIZOL试剂裂解的样品中加入至少1ml的75%O配制),清洗RNA沉淀。
混匀后,4℃下7000rpm离心乙醇(75%乙醇用DEPCH25分钟。
⑤RNA干燥小心吸去大部分乙醇溶液,使RNA沉淀在室温空气中干燥5-10分钟。
⑥溶解RNA沉淀溶解RNA时,先加入无RNA酶的水40μl用枪反复吹打几次,使其完全溶解,获得的RNA溶液保存于-80℃待用。
2 RNA质量检测1)紫外吸收法测定先用稀释用的TE溶液将分光光度计调零。
然后取少量RNA溶液用TE稀释(1:100)后,读取其在分光光度计260nm和280nm处的吸收值,测定RNA溶液浓度和纯度。
①浓度测定A260下读值为1表示40 µg RNA/ml。
样品RNA浓度(µg/ml)计算公式为:A260 ×稀释倍数× 40 µg/ml。
具体计算如下:RNA溶于40 µl DEPC水中,取5ul,1:100稀释至495µl的TE中,测得A260 = 0.21RNA 浓度= 0.21 ×100 ×40 µg/ml = 840 µg/ml 或 0.84 µg/µl取5ul用来测量以后,剩余样品RNA为35 µl,剩余RNA总量为:35 µl × 0.84 µg/µl = 29.4 µg②纯度检测RNA溶液的A260/A280的比值即为RNA纯度,比值范围1.8到2.1。
ABI7500实时荧光定量操作程序ABI7500实时荧光定量PCR(Polymerase Chain Reaction)操作程序是用于检测目标DNA的数量的一种实验方法。
在该操作程序中,使用ABI7500实时荧光定量PCR系统的仪器和相关试剂来进行PCR反应,然后通过荧光信号的变化,对PCR反应中目标DNA的数量进行定量。
下面是ABI7500实时荧光定量PCR操作程序的详细步骤:1.实验前准备a.准备所需试剂,包括PCR引物、PCR酶、荧光探针等。
b.预备PCR工作站,如PCR工作台、离心机、PCR仪等。
c.准备PCR反应管,标记每管的样品编号。
2.反应体系构建a.准备PCR反应液,根据实验需要,将反应组分如PCR引物、PCR酶、模板DNA、dNTPs等加入PCR反应管中。
b. 加入SYBR Green或荧光探针,用于在PCR反应过程中检测目标DNA。
3.试剂混合与装样a.将PCR反应液和样品混合均匀。
b.装样到ABI7500实时荧光定量PCR系统中的反应孔中,注意避免气泡的产生。
4.设置PCR程序a.打开ABI7500实时荧光定量PCR系统的软件界面,选择合适的PCR 模板。
b.设置PCR程序,包括温度、时间和荧光信号的检测。
5.PCR反应a.开始PCR反应,系统会根据设置的程序进行温度循环,在每个循环中,会记录荧光信号的变化。
b.实时监测荧光信号,根据荧光信号的变化来判断PCR反应的进行情况。
6.数据分析a.实时记录荧光信号的数值,生成实时荧光曲线。
b.通过计算机软件对实时荧光曲线进行数据分析,计算目标DNA的相对定量值。
7.结果解读a.根据相对定量值来判断样品中目标DNA的数量。
b.结果的解读可以通过进行标准曲线法或内部参照法进行。
8.结束实验a.关闭ABI7500实时荧光定量PCR系统。
b.清理和消毒实验区域和实验工具。
总结:ABI7500实时荧光定量PCR操作程序包括实验前准备、反应体系构建、试剂混合与装样、设置PCR程序、PCR反应、数据分析、结果解读和结束实验等步骤。
实时荧光定量PCR(Real-Time PCR)实验流程一、RNA的提取(详见RNA提取及反转录)不同组织样本的RNA提取适用不同的提取方法,因为Real-Time PCR对RNA样品的质量要求较高,所以,正式实验前要选择一款适合自己样品的提取方法,在实验过程中要防止RNA 的降解,保持RNA的完整性。
在总RNA的提取过程中,注意避免mRNA的断裂;取2ug进行RNA的甲醛变性胶电泳检测,如果存在DNA污染时,要用DNase I进行消化(因为在处理过程中RNA极易降解,建议体系中加入适量RNA酶抑制剂)。
二、DNase I 消化样品RNA 中的DNA用DNase I 消化DNA组份加量模板(RNA) 10ugRNase Inhibitor 4ulDNase I buffer 10ulDNase I 10ulDEPC处理H2O 至100ul混匀,37℃90min三、RNA琼脂糖凝胶电泳1.1%的琼脂糖凝胶电泳凝胶的配制:1)称取琼脂糖0.45g放入三角瓶中,向其中加入4.5ml的10×MOPS缓冲液和39.5ml 的DEPC水,放微波炉里溶化。
2)待冷却到60摄氏度左右时,加入1ml甲醛,摇匀(避免产生气泡)。
倒入凝胶板上凝固30min。
2.取各个RNA样品4µl,加入6×RNA电泳上样缓冲液2µl混匀,加入变性胶加样孔中。
3.120V电压下电泳25min。
用凝胶紫外分析仪观察,照相保存。
4.RNA电泳结果如下图所示。
可见28S和18S两条明亮条带,无DNA条带污染。
四.RNA反转录为cDNA反转录程序(以MBI的M-MLV为例) 组份加量(20ul体系) 加量(40ul 体系)模板(RNA) 0.1~2.5ug(根据条带的亮度适当调整) 3ug(根据条带的亮度适当调整)引物T18(50uM)(或其他引物) 2.0ul 4.0ulDEPC处理H2O 至12.5ul 至25ul混匀,70℃5min,立即冰浴5*buffer 4.0ul 8.0uldNTP(10mM) 2.0ul 4.0ulRNase Inhibitor 0.5ul 1.0ul混匀,37℃5minM-MLV 1.0ul 2.0ul42℃60min ,70℃10min反转录引物的选择与Real-Time PCR引物设计的要求1)随机六聚体引物:当特定mRNA由于含有使反转录酶终止的序列而难以拷贝其全长序列时,可采用随机六聚体引物这一不特异的引物来拷贝全长mRNA。
实时荧光定量PCR仪快速操作指南1.连接电源从包装箱里取出仪器放置在实验台上,拿出电源线和电源适配器,将电源线一端与电源适配器相连,另一端连接至交流220V电源插座(AC85~264V)电源适配器的输出端连接到仪器电源插孔。
接口插入仪器电源插孔,注意插孔方向箭头方向朝上。
打开仪器背面的电源开关开启仪器,仪器自检成功,自动进入到软件界面。
2.样品准备◼准备试剂Q1600实时荧光定量PCR仪使用0.2ml透明离心试管根据试剂要求选用10-100μl合适的加液量。
◼离心操作配置完成试剂样本的试管在放入仪器之前,要用离心机进行离心操作,确保试剂液体处于试管底部,且液体内部不含有气泡。
◼放置样品将反应管按照顺序放入加热孔内。
3.设置程序,运行实验软件操作基本步骤:◼新建实验新建实验,选择运行槽◼基本设置设置实验名称,实验类型,检测项目,选择使用的染料。
◼样本设置设置样品名称,样本ID号,选择样本类型◼程序设置设置需要的反应程序◼保存文件单击保存,保存实验文件◼运行单击运行,运行实验。
4.结果分析◼实验结束,软件自动计算Ct值,根据判定规则自动出结果。
◼如需进行熔解分析和基因分型,在软件分析类型里选择相应的分析功能。
5.结果导出◼导出实验结果单击导出,导出实验数据。
◼结果打印连接配置的热敏打印机,选中要打印的样品孔,单击打印,打印实验结果。
6.关闭仪器◼实验结束,取出反应管◼长按仪器前面板关机按键,关闭仪器◼长时间不使用仪器,请关闭仪器背部左下角电源开关。
实时荧光定量pcr的方法
实时荧光定量PCR(real-time quantitative PCR)是一种用于精确测量DNA 或RNA样本中特定目标序列数量的分子生物学技术。
该方法结合了传统PCR 技术和荧光探针技术,可以在PCR反应过程中实时监测和定量特定目标序列的扩增量。
实时荧光定量PCR的步骤如下:
1. 准备反应体系:包括特定目标序列的引物和荧光探针、PCR反应缓冲液、酶和DNA模板。
2. PCR反应:将反应体系放入实时荧光定量PCR仪中进行扩增反应。
PCR过程中,引物与DNA模板结合,酶进行DNA合成,目标序列得到扩增。
3. 荧光探针监测:在PCR反应中,荧光探针与目标序列结合,产生荧光信号。
实时荧光定量PCR仪会实时监测和记录荧光信号的强度。
4. 数据分析:实时荧光定量PCR仪会根据荧光信号的强度,通过计算机算法来计算目标序列的起始数量。
可以利用标准曲线法或相对定量法进行数据分析,得到目标序列的绝对或相对数量。
实时荧光定量PCR具有高灵敏度、高特异性、高准确性和广泛线性范围等优点,
广泛应用于分子生物学、医学诊断、基因表达分析等领域。
实时定量PCR步骤实时定量PCR(Real Time Quantitative PCR)是一种用于检测和定量DNA序列或基因表达水平的方法。
它是PCR技术的变体,可以实时监测PCR反应的进行,并在放大过程中定量目标DNA序列的数量。
下面是实时定量PCR的详细步骤:步骤1:实验准备1.1收集所需的实验材料,包括PCR反应液组分(引物、探针、dNTPs、缓冲液、聚酶等)、PCR管和盖膜、模板DNA样品、阳性和阴性对照样品等。
1.2预先冷藏和解冻所有的试剂和样品。
1.3清洁操作台面,并准备离心机、实时荧光PCR仪和计算机等设备。
步骤2:引物和探针设计2.1根据待测目标序列,使用生物信息学工具设计引物和探针,确保具有高度特异性和高扩增效率。
2.2检查引物和探针的熔解温度是否相近,并避免二次结构和杂交问题。
步骤3:制备PCR反应液3.1根据PCR反应体系计算所需的试剂量,并根据实验板的数量和样品数量,按比例制备PCR反应液。
3.2在一个干净的离心管中,将缓冲液、dNTPs、引物、探针、酶和染料等反应组分按照特定顺序加入。
3.3使用纯水调整总反应体积,确保每个样品反应液体积相等。
步骤4:添加模板DNA4.1准备好模板DNA样品,可以是基因组DNA、cDNA或其他。
4.2将模板DNA分别加入各个PCR反应管中,注意避免污染和交叉污染。
步骤5:进行PCR反应5.1将PCR反应管密封,并在PCR仪上进行扩增。
此时,PCR仪应可提供实时荧光信号监测功能。
5.2设置PCR仪的温度程序和循环次数,通常包括热激活、扩增和延伸等不同的阶段。
5.3监测PCR仪上的实时荧光信号,并记录下所有的扩增曲线。
实时荧光信号的强度与扩增产物的数量成正比。
5.4在每个PCR循环的结束时,建议进行一次熔解曲线分析,以确定PCR产物的特异性。
步骤6:数据分析6.1使用PCR仪上的软件工具,导出扩增曲线数据。
6.2使用阈值周期(Ct)方法,根据扩增曲线与阈值线的交叉点来定量反应液中目标序列的数量。
实时荧光定量PCR
组织RNA提取:
一般认为100mg肝组织提取RNA 500ng,100mg肺提取RNA 200ng,脑内的RNA丰度适中,100mg脑组织,提取RNA 5-200ng。
所以一个10mg的海马可匀出RNA约为20ng。
反转录反应
反转录反应参照TaKaRa RT-PCR说明书。
反转录反应条件如下。
37°C 15 min(反转录反应)
85°C 5 sec(反转录酶的失活反应)
Real Time PCR反应
选用脑源神经营养因子(BDNF)为目标基因,核糖体18S rRNA(18S rRNA)做为内参。
1)按下列组份配制PCR反应液(反应液配制请在冰上进行)。
全班40人,分为5组,每组做8管。
4管做BDNF,4管做18S rRNA。
4管BDNF 或者18S rRNA,采用相应的正反PCR引物。
每种基因做两个模板,一个模板采用原液浓度,一个模板采用稀释一倍浓度,体积均为0.5 μl。
2)三步法PCR
首先95°C 作用3 min。
PCR进行35个循环。
步骤温度时间
变性95°C 30 秒
退火58°C 30 秒
延伸72°C 30 秒
融解曲线
温度时间变温速度
95°C 0秒20°C/秒
55°C 15秒20°C/秒95°C 0秒0.1°C/秒。