元素和原子的区别
- 格式:doc
- 大小:27.50 KB
- 文档页数:1

元素的质量和相对原子质量的区别全文共四篇示例,供读者参考第一篇示例:元素的质量和相对原子质量是化学中非常重要的概念,它们之间有着紧密的联系,但又有着明显的区别。
在化学研究和实验中,我们常常需要对这两个概念进行区分和理解,以便正确地应用到实际的实验和理论研究中。
让我们来了解一下元素的质量是什么意思。
元素的质量可以指的是该元素在物质中所占的质量,也可以指的是该元素所拥有的原子的总质量。
在很多情况下,我们也可以用元素的质量来表示该元素的相对原子质量,即该元素相对于碳-12同位素的质量比值。
元素的质量是一个宏观的概念,它可以用来描述化学物质的性质和变化。
相对原子质量则是一个微观的概念,它是指一个原子在海尔客特常量下的质量,通常用单位原子质量来表示。
相对原子质量是元素的一个固有属性,代表了元素中原子的平均质量。
相对原子质量是一个比较小的量,通常以单位原子质量的形式出现。
元素的质量和相对原子质量之间的区别还体现在应用上。
在实验中,我们通常用元素的质量来计算物质的质量分数和化学动力学等参数,而相对原子质量则更多地用于描述化学元素的性质和特性。
通过对元素的质量和相对原子质量的研究与理解,我们可以更深入地了解化学元素的本质和特性,为化学研究提供更加准确和有力的支持。
第二篇示例:元素是构成物质的基本单位,是化学世界的基本构成单元。
元素的质量和相对原子质量是描述元素的重要概念,但它们之间有一定的区别。
元素的质量是指一个元素在标准条件下的重量,通常以克(g)为单位表示。
元素的质量是一个具体的数值,可以通过称量等方法来测量。
元素的质量不仅取决于其原子的数量,还取决于元素中的同位素的比例。
相对原子质量是指一个元素的原子质量相对于碳-12的原子质量的比值。
相对原子质量是一个相对概念,通常没有单位。
相对原子质量的计算是以碳-12的原子质量为基准来比较其他元素的原子质量大小。
氢的相对原子质量约为1,氢的原子质量大约是碳-12的1/12。

九年级上册化学元素笔记一、元素的概念。
1. 定义。
- 元素是质子数(即核电荷数)相同的一类原子的总称。
例如,氧元素是所有质子数为8的原子的总称,这些原子不管中子数是否相同(如氧 - 16、氧 - 18等),都属于氧元素。
2. 理解要点。
- 元素只讲种类,不讲个数。
例如,我们可以说“水是由氢元素和氧元素组成的”,而不能说“水是由两个氢元素和一个氧元素组成的”。
二、元素符号。
1. 书写。
- 由一个字母表示的元素符号要大写,如H(氢)、C(碳)、N(氮)等。
- 由两个字母表示的元素符号,第一个字母大写,第二个字母小写,如Na (钠)、Mg(镁)、Al(铝)等。
2. 意义。
- 宏观意义:表示一种元素。
例如,H表示氢元素。
- 微观意义:表示这种元素的一个原子。
例如,H还表示一个氢原子。
- 如果在元素符号前面加上数字,就只表示原子的个数。
例如,2H表示2个氢原子,不再表示氢元素。
三、元素周期表。
1. 结构。
- 横行(周期):元素周期表有7个横行,即7个周期。
同一周期元素原子的电子层数相同,从左到右原子序数(质子数)依次递增。
- 纵行(族):元素周期表有18个纵行,其中8、9、10三个纵行共同组成一个族,所以共有16个族。
同一族元素原子的最外层电子数相同(He除外),化学性质相似。
2. 信息。
- 原子序数:元素周期表中每种元素都有一个编号,这个编号叫做原子序数。
原子序数=质子数 = 核电荷数=核外电子数。
- 元素符号:在元素周期表中每个方格内都标有元素符号,如氢元素对应的符号是H。
- 元素名称:方格内还标有元素的名称,如氢。
- 相对原子质量:通常取整数,是一个比值,单位为“1”,如氢的相对原子质量约为1。
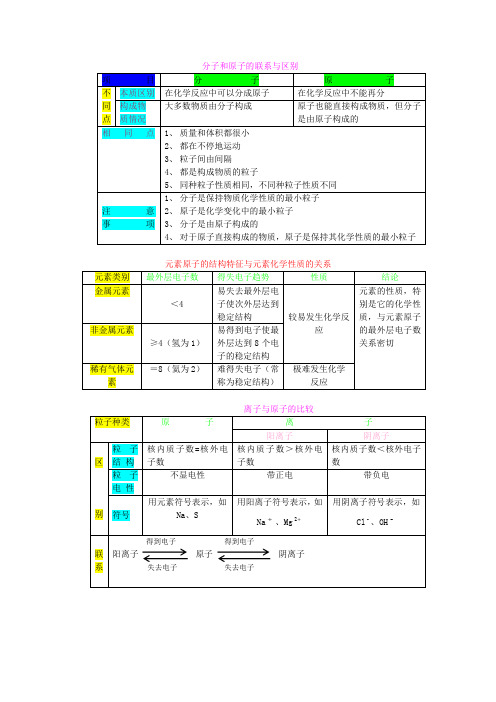
四、元素与原子的区别与联系。
1. 区别。
- 元素是宏观概念,只讲种类,不讲个数,用于描述物质的组成。
例如,水是由氢元素和氧元素组成的。
- 原子是微观概念,既讲种类,又讲个数,用于描述分子或某些物质的构成。
例如,一个水分子是由两个氢原子和一个氧原子构成的。


分子、原子、离子、元素和化学式元素:具有相同核电荷数(即核内质子数)的一类原子总称元素。
原子的核电荷数(即核内质子数)决定原子或离子的元素种类。
①大部分单个的元素符号表示:一种元素、该元素的一个原子、一种单质但H N O Cl等符号不能表示单质,它们的单质是:H2 N2 O2 Cl2②地壳中元素按质量分数由多至少前四位是:O氧 Si硅 Al铝 Fe铁。
铝是地壳中含量最多的金属元素。
③化学的“语法”: “某分子”由“某原子构成”“某物质”由“某元素组成”或“某某分子构成”(金属单质、稀有气体讲由某原子直接构成)例:水由氢元素和氧元素组成,水由水分子构成。
1个水分子由2个氢原子和1个氧原子构成元素、物质都是宏观概念,只表示种类,不表示个数。
不能说“水是由二个氢元素和一个氧元素组成”④具有相同核电荷数的粒子不一定是同种元素,下列粒子有相同的核电荷数:⑴ H2和He ⑵ CO、N2和Si ⑶ O2、S和 S2- ⑷ OH-和 F-元素、分子和原子的区别与联系元素组成物质宏观概念,只讲种类,不讲个数同类原子总称构成构成微观概念,既讲种类,又讲个构成数原子分子粒子:如原子、离子、分子、电子、质子等,它们都是微观概念,既表示种类又可表示个数。
分子、原子、离子都是构成物质的粒子。
金属单质和稀有气体由原子直接构成;非金属单质、非金属与非金属形成的共价化合物由分子构成,化合物中既有金属元素又有非金属元素的离子化合物是由离子构成。
分子:分子是保持物质化学性质的最小粒子。
分子由原子构成,例:1个水分子由2个氢原子和1个氧原子构成原子:原子是化学变化中的最小粒子。
(注意:原子不是构成物质的最小粒子。
)原子的的构成:原子由核外带负电的电子和带正电的原子核构成,原子核由带正电的质子和不带电的中子构成。
在不显电性的粒子里:核电荷数=质子数=核外电子数注意:原子不是构成物质的最小粒子。
原子只是化学变化中的最小粒子;普通氢原子核中只有质子无中子,氢原子的原子核就是一个质子。

元素的质量和相对原子质量的区别全文共四篇示例,供读者参考第一篇示例:元素的质量和相对原子质量是化学领域常见的两个概念。
虽然它们都有关于元素质量的含义,但是它们之间存在一些区别。
在本文中,我们将深入探讨元素的质量和相对原子质量之间的区别。
让我们先来了解一下元素的质量是什么意思。
元素的质量指的是元素本身所含有的质量。
每种元素都有其特定的质量,这是由元素所含有的原子数量和原子质量决定的。
元素的质量可以是任意单位,比如克、毫克、克拉等。
而相对原子质量则是指某种元素的一个基本单位质量与碳-12同位素质量的比值。
相对原子质量是用来表示元素相对原子质量大小的数值,是标准质量单位下元素的质量。
在化学元素周期表中,每一个元素都有一个对应的相对原子质量。
相对原子质量通常用单位原子质量(amu)来表示。
需要注意的是,元素的质量和相对原子质量的计算方法也有一定的差异。
元素的质量通常是通过实验测量得出的,可以通过物理天平等设备来测量元素的质量。
而相对原子质量则是通过元素的同位素质量和相对丰度的加权平均值来计算得出的。
相对原子质量的计算法则更多地使用了物理学和化学的知识。
元素的质量和相对原子质量虽然有一定的区别,但二者都是用来描述元素质量的概念。
通过深入了解两者之间的区别,我们可以更好地理解元素的性质和特点,为化学领域的研究提供更多的参考和指导。
愿本文内容能够为您对元素质量和相对原子质量的认识有所帮助。
第二篇示例:元素是构成物质世界的基本单位,它们主要由原子构成。
原子是元素的基本单位,每种元素的原子都有特定的质量。
在化学研究和实践中,我们经常会听到关于元素质量和相对原子质量的概念。
虽然它们都与元素的质量有关,但是它们的含义和应用是不同的。
让我们来了解一下元素的质量。
元素的质量是指该元素所有原子的总和质量。
每种元素的原子有特定的质量,通常用原子量或者质量数来表示。
元素的质量是由其原子的质量和数量决定的。
在实验室中,我们可以通过称量的方法来测量元素的质量,如称量天平。
元素与原子的区别举例讲解
元素与原子是化学中的两个基本概念。
下面是它们的区别,并举例讲解:
1. 元素:
元素指的是化学中无法分解成其他物质的纯粹物质。
元素由具有相同原子序数(即原子核中质子的数目)的原子组成。
每个元素都有特定的化学符号,如氧元素的化学符号是O,铁元素的化学符号是Fe等。
元素之间可以通过化学反应或核反应进
行转化。
举例:金属铜是一种元素,其化学符号是Cu。
无论将铜分成
多小的碎片,它们仍然是由铜原子组成,无法被进一步分解为其他物质。
2. 原子:
原子是构成物质的最基本单位。
它是由质子、中子和电子组成的。
原子中的质子和中子集中在原子核中,而电子则绕核运动。
每个元素的原子都有特定的原子序数和原子质量。
原子通过化学反应或核反应进行重新组合,形成不同的物质。
举例:氧元素的原子是氧原子,其原子序数为8。
一个氧原子
由8个质子、8个中子和8个电子组成。
当两个氧原子通过共
享电子结合起来时,它们形成氧气分子(O2)。
总结:
元素是化学中无法分解的纯粹物质,由具有相同原子序数的原
子组成。
而原子则是构成物质的最基本单位,由质子、中子和电子组成。
元素由原子组成,而原子通过化学反应或核反应进行重新组合,形成不同的物质。
分子原子元素知识点总结一、分子、原子、元素的概念及区别1. 分子:分子是由两个或更多原子通过共用电子键结合在一起的结构。
分子可以是同一种原子的,也可以是不同原子的。
例如氧气分子(O2)由两个氧原子组成。
2. 原子:原子是构成物质的基本单位,具有化学性质的最小单位。
原子由质子、中子和电子组成。
质子和中子位于原子核中,而电子则绕核运动。
3. 元素:元素是由同一种原子组成的物质。
元素是由同一种原子组成的单一化学物质,具有特定的原子序数和原子量。
目前已知的元素共118种,其中92种是自然存在的,其余的是人工合成的。
二、分子原子元素的性质1. 原子的性质(1)质子、中子和电子是原子中的基本粒子,它们决定了原子的性质。
质子的数量决定了原子的元素,中子的数量决定了同一元素的同位素,而电子的数量决定了原子的化学性质。
(2)原子的大小:原子的大小一般以原子半径来表示,原子的半径与原子核的质子数和原子核外的电子数有关。
(3)原子的质量:原子的质量一般以原子量来表示,原子的质量与质子和中子的质量有关。
(4)原子的化学性质:原子的化学性质主要与其外层电子的排布有关。
原子通过失去、获得或共享电子来形成化学键,从而参与化学反应。
2. 分子的性质(1)分子的大小:分子的大小一般以分子的长度、角度和对称性来描述,不同的分子具有不同的形状和大小。
(2)分子的质量:分子的质量一般以分子量来表示,分子的质量与其中原子的种类和数量有关。
(3)分子的化学性质:分子的化学性质主要与其中原子的排布和结合方式有关。
分子中原子之间通过共价键或离子键相连,从而形成分子的结构和性质。
3. 元素的性质(1)元素的原子序数:元素的原子序数是该元素所拥有的质子数量,也是元素周期表中的位置。
原子序数不同的元素具有不同的化学性质。
(2)元素的原子量:元素的原子量是指元素一个原子的质量,原子量通常以标准原子质量单位来表示。
(3)元素的物理性质:元素的物理性质主要与其原子结构有关,包括原子大小、原子量、原子序数等。
元素原子区别
元素和原子的区别在于它们拥有完全不同的性质。
元素是一种基本的物质,可以分解成原子,而原子则是一个最小的物质,由电子、质子和中子组成。
1、实质上的区别
元素是基本的物质,可以在自然中发现,如水,空气,岩石等。
另一方面,原子是最小的物质,不能再分解,它是由电子、质子和中子组成的,它们之间彼此粘连。
2、形成机制的区别
元素是在基本原子状态下形成的,不能再分解并且其形成机制不容易发现。
而原子形成的机制是通过原子碰撞达到能量平衡,以生成更大的原子数量来实现了原子和分子形成的过程。
3、性质上的区别
元素的性质取决于它的原子结构,它可以是某种晶体,液体或气态,也可以是纯粹的物质,这取决于原子结构中各原子组合的数量。
而原子的性质则是由它们内部的电子和核结构决定的,因为他们不能被分解,它们的性质是唯一的。
- 1 -。