第一节甲烷 烷烃导学案
- 格式:doc
- 大小:295.01 KB
- 文档页数:13
甲烷的结构和性质班级姓名小组【学习目标】1. 结合教师讲解,正确复述有机物、烃的概念,并进行概念辨析。
2. 结合课本P60页内容,正确说出CH4的存在、用途、空间结构、分子极性,并区分分子式、电子式、球棍模型、比例模型。
3. 结合课本P61页,正确复述CH4物理性质以及CH4和Cl2反应现象,并能书写相关方程式。
4. 结合课本P62页取代反应定义,准确分析取代反应原理,并归纳其与置换反应的异同。
【重点难点】重点:CH4的结构、性质。
取代反应概念、原理、特点。
难点:取代反应原理。
【导学流程】一.知识链接1.有机物:含碳化合物,(不包括CO、CO2、碳酸、碳酸盐、碳化物如CaC2、氰化物如NaCN、硫氰化物如KSCN)2.烃:只含有C元素和H元素的化合物。
思考:烃完全燃烧的产物是什么?3.CHCl3:俗称氯仿,可以做有机溶剂。
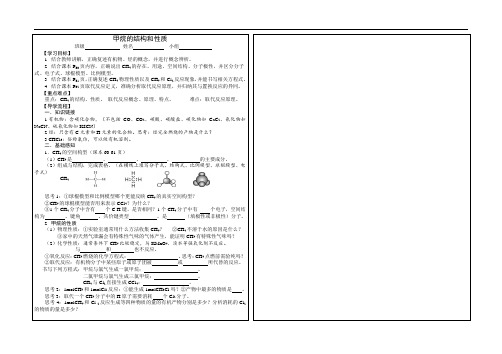
二.基础感知1.CH4的空间构型(课本60-61页)(1)CH4是、、、的主要成分。
(2)组成与结构,完成表格。
(在横线上填写分子式、结构式、比例模型、球棍模型、电子式)CH4思考1:①球棍模型和比例模型哪个更能反映CH4的真实空间构型?②CH4的球棍模型能否用来表示CCl4?为什么?③1个CH4分子中含有个C-H键,是否相同?1个CH4分子中有个电子,空间结构为。
键角。
共价键类型。
是(填极性或非极性)分子。
2. 甲烷的性质(1)物理性质:①实验室通常用什么方法收集CH4?②CH4不溶于水的原因是什么?③家中的天然气泄漏会有特殊性气味的气体产生,能证明CH4有特殊性气味吗?(2)化学性质:通常条件下CH4比较稳定,与KMnO4、溴水等强氧化剂不反应。
与和也不反应。
①氧化反应:CH4燃烧的化学方程式:。
思考:CH4点燃前需验纯吗?②取代反应:有机物分子中某些原子或原子团被或所代替的反应。
书写下列方程式:甲烷与氯气生成一氯甲烷:。
二氯甲烷与氯气生成三氯甲烷:。
CH4与Cl2直接生成CCl4:。
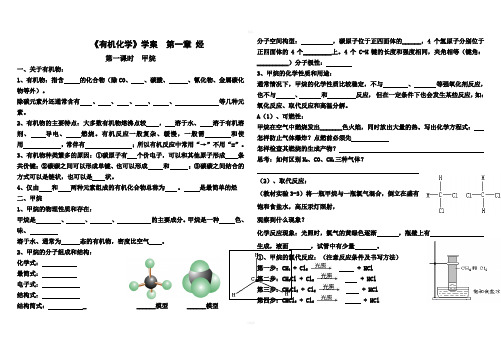
《有机化学》学案第一章烃第一课时甲烷一、关于有机物:1、有机物:指含的化合物(除CO、、碳酸、、氰化物、金属碳化物等外)。
除碳元素外还通常含有、、、、、等几种元素。
2、有机物的主要特点:大多数有机物熔沸点较,溶于水、溶于有机溶剂、导电、燃烧。
有机反应一般复杂、缓慢,一般需和使用,常伴有;所以有机反应中常用“→”不用“=”。
3、有机物种类繁多的原因:①碳原子有个价电子,可以和其他原子形成条共价键;②碳碳之间可以形成单键、也可以形成和;③碳碳之间结合的方式可以是链状,也可以是状。
4、仅由和两种元素组成的有机化合物总称为。
是最简单的烃二、甲烷1、甲烷的物理性质和存在:甲烷是、、、的主要成分。
甲烷是一种色、味、溶于水、通常为态的有机物,密度比空气。
2、甲烷的分子组成和结构:化学式:最简式:电子式:结构式:结构简式: _ ______模型 ______模型分子空间构型:,碳原子位于正四面体的______,4个氢原子分别位于正四面体的4个_________上。
4个C-H键的长度和强度相同,夹角相等(键角:__________)分子极性:3、甲烷的化学性质和用途:通常情况下,甲烷的化学性质比较稳定,不与、等强氧化剂反应,也不与、和反应,但在一定条件下也会发生某些反应,如:氧化反应、取代反应和高温分解。
A(1)、可燃性:甲烷在空气中燃烧发出_______色火焰,同时放出大量的热。
写出化学方程式:怎样防止气体爆炸?点燃前必须先怎样检查其燃烧的生成产物?思考:如何区别H2、CO、CH4三种气体?(2)、取代反应:(教材实验3-3)将一瓶甲烷与一瓶氯气混合,倒立在盛有饱和食盐水,高压汞灯照射,观察到什么现象?化学反应现象:光照时,氯气的黄绿色逐渐,瓶壁上有生成,液面,试管中有少量。
①、甲烷的氯代反应:(注意反应条件及书写方法)第一步:CH4 + Cl2 + HCl第二步:CH3Cl + Cl2 + HCl第三步:CH2Cl2 + Cl2 + HCl第四步:CHCl3 + Cl2 + HCl名称(俗称)一氯甲烷二氯甲烷三氯甲烷()四氯甲烷()化学式常温下状态_____态_____态_____态_____态溶解性________溶于水,____________溶于有机溶剂主要用途重要的___________③、取代反应:有机物分子里的某些或被或所替代的反应。

一、甲烷1、烃的定义:2、甲烷的结构:分子式:电子式:结构式:空间构型:【注意】(1)甲烷是烃类分子中组成最简单的烃,也是含碳质量分数最____的烃,或含有氢质量分数最___的烃,这可作为某些有机推断题的解题突破口(2)常见的物质(微粒)中是正四面体结构的有:__________________________________________(3)_________________________________________主要成分都是甲烷。
练1、下列各图均能表示甲烷的分子结构,哪一种更能反映其真实存在状况()3、甲烷的物理性质:4、甲烷的化学性质:(1)甲烷的氧化反应(可燃性)反应方程式:甲烷在空气中或氧气中点燃,完全燃烧生成二氧化碳和水,同时放出大量的热,还伴有淡蓝色的火焰。
【注意】Ⅰ、燃烧火焰为淡蓝色的物质有:甲烷、硫化氢、氢气等气体,硫在空气中燃烧(在纯氧中为蓝紫色),酒精在空气中燃烧,一氧化碳在空气中燃烧是火焰为蓝色Ⅱ、甲烷与空气或氧气的混合气体点燃时,发生爆炸,因此点燃时要验纯。
甲烷与氧气恰好反应是爆炸最强烈时的体积比。
【练习】当空气中混有5%~15%的甲烷时,点燃会发生爆炸,当爆炸最强烈时,甲烷的含量为(氧气在空气中体积分数为20%)(2)甲烷的取代反应取代反应的定义:甲烷与氯气取代反应的条件: 现象反应方程式:产物有五种:两种气体 三种液体其中 是极性分子三氯甲烷:又叫 是重要的有机溶剂四氯甲烷:又叫 也是重要的有机溶剂,可做灭火剂。
甲烷的化学性质比较稳定,不能使高锰酸钾、溴水褪色,也不能与强酸强碱反应练习:甲烷分子是以碳原子为中心的正四面体结构,而不是正方形的平面结构,理由是( )A .CH 3Cl 不存在同分异构体B .CH 2Cl 2不存在同分异构体C .CHCl 3不存在同分异构体D .CH 4是非极性分子①1mol 甲烷完全和氯气发生取代反应,生成等物质的量的四种取代物时消耗氯气的物质的量为多少?②1摩尔甲烷完全和氯气发生取代反应,生成1mol 四氯化碳需要氯气多少摩尔?(3)甲烷高温分解甲烷在隔绝空气的条件下,高温分解,可制炭黑CH 4C+2H 2 2CH 4 C 2H 2+3H 2 【练习】1.隔绝空气加强热,甲烷可分解为乙炔和氢气,若有80%的甲烷发生这样的分解,所得混合气体的密度是相同条件下氦气密度的倍数是( )A .2B .2.23C .3.46D .4.442.一定量的甲烷燃烧后得到的产物是CO 、CO 2、H 2O (气),此混合物重49.6 g ,当其缓慢通过无水氯化钙时,氯化钙增重25.2 g ,原混合气体中CO 2的质量为( )gA .12.5B .13.2C .19.7D .24.43.将甲烷和氧气的混合气体通过过氧化钠(密闭容器)中,在150℃条件下用电火花引发后,三种物质都恰好反应,容器内压强近似为零,由此,可知原混合物中三种物质的物质的量之比为 ;反应后容器中的物质是5、 甲烷的实验室制法高温 高温原理:用无水醋酸钠和碱石灰共热反应方程式:装置:与制、的装置是相同的【注意】不能用醋酸钠溶液或晶体,必须用无水醋酸钠碱石灰中氧化钙的作用:①可以减弱氢氧化钠对玻璃的腐蚀②可以防止反应物吸水③可以使反应物疏松使气体易于逸出【想一想】将醋酸铵与氢氧化钠固体混合加热可能发生哪些反应?二.烷烃1、烷烃的定义:结构特点:①链状:可以带支链,注意分子中的碳原子并不是直线状的,而是锯齿状②相邻碳原子之间均以共价单键相连,碳原子其余价键均被氢原子饱和(在含相同碳原子数的烃类中,以烷烃含氢原子数最多,或者说含碳量最低)2、烷烃的命名:1)习惯命名法:碳原子数后加一个“烷”字,就是简单烷烃的名称。

高中化学选修5导学案:脂肪烃(第1课时-烷烃【学习目标】1、了解甲烷及烷烃的物理性质;2、掌握甲烷的结构特点和化学性质;3、掌握取代反应的特点;4、了解环烷烃的性质。
一、预习必修2-P60~62并回答问题1、甲烷的物质性质如何,其实验室收集方法有哪些?2、请你概括甲烷的化学性质有哪些?3、烷烃的通式是?烷烃的物理性质呈现规律性变化,具体是如何变化的?二、预习自测1、甲烷的分子结构(展示1(1分子式:电子式:结构式:(2甲烷分子构型是:以原子为中心,通过个共价键与原子结合而成的;键角为。
2、分别写出下列物质的结构简式并填空(展示2乙烷丙烷正丁烷它们的关系为,属于烃,分子通式为。
3、戊烷有三种同分异构体,请写出结构简式并命名(展示34、经定量分析得某烃分子中含C 75%、H 25%(质量分数,标准状况下密度为0.717g/L,求该烃的分子式。
(展示4三、我的疑惑—请将预习中未能解决的问题和疑惑写下来,准备课堂上与老师和同学探究解决。
四、小组合作探究1:烷烃的物理性质①递变性:在常温下,C1—4的烷烃为态, C5—16的烷烃为态, C17以上的烷烃为态。
密度随碳原子个数增加逐渐,但都小于1g/cm3。
②相似性:烷烃(所有烃均不溶于水,均比水轻。
探究2:烷烃的化学性质1、较稳定,不与强酸、强碱反应;也不与KMnO4反应(即不能使KMnO4溶液褪色2、可燃性:(不仅是烷烃,所有烃均具有CH4 + O2→ CH3-CH3 + O2→C n H 2n+2 + O 2 → C x H y + O 2 →3、与卤素单质的蒸气在光照条件下发生取代反应(1 CH 4 + Cl 2【思考】①CH 4分子中的4个H 是等价的,那么,与Cl 2反应时,只能取代其中的一个H 吗? ②CH 4与Cl 2在光照下,产物是只有CH 3Cl 和HCl ,还是CH 3Cl 、CH 2Cl 2、CHCl 3、CCl 4、HCl 四者全有?所有产物中量最多的是。

靖边职教中心化学基础导学案编写:曹进步班级姓名§12.2 甲烷烷烃(一)导学案学习目标:1、了解甲烷的物理性质、分子组成及结构和实验室制法等;2、掌握甲烷的主要化学性质重点难点:甲烷的化学性质【自主学习】1、甲烷的分子组成和结构:分子式:电子式:结构式:分子空间构型:2、甲烷的物理性质和存在:甲烷是一种色、味、溶于水、密度比空气,是和的主要成分。
3、甲烷的实验室制法(1)反应方程式:(2)气体发生装置:(3)气体收集方法:4、甲烷的化学性质和用途:甲烷很稳定,可以用什么方法验证?通常不与、和反应,但在一定条件下也会发生某些反应,如:取代反应、氧化反应和高温分解。
写出有关化学方程式。
(1)氧化反应(可燃性):(2)取代反应:①、甲烷的氯代反应:(注意反应条件及书写方法)第一步:CH4+ Cl2+ HCl第二步:CH3Cl + Cl2+ HCl第三步:CH2Cl2+ Cl2+ HCl第四步:CHCl3+ Cl2+ HCl②产物呈气态的有;呈液态的有③取代反应概念:(3)受热分解:(4)用途:甲烷是一种很好的,并可用来制取等。
【合作探究】怎样检查甲烷燃烧的生成产物?【课堂检测】1、下列物质中不属于有机物的是( )A、CO(NH2)2B、CO2C、CCl4D、CH3CH2OH2、下列说法正确的是()A、有机物都不溶于水,易溶于有机溶剂B、有机物只能从有机生命体中取得C、组成中仅有C、H两种元素的有机物叫烃D、有机物不具备无机物的性质,都是非电解质3.下列气体的主要成分不是甲烷的是( )A.沼气B.天然气C.水煤气D.坑道所产生的气体4、下列反应属于取代反应的是( )A、甲烷燃烧B、由甲烷制取氯仿C、由甲烷制炭黑D、钠与水反应制得H25、在一定条件下,能与甲烷发生反应的是()A.浓硫酸B.氢氧化钠溶液C.溴蒸汽D.高锰酸钾溶液图5-1。

第⼀节甲烷烷烃导学案第⼀章烃第⼀节甲烷烷烃新知探究⼀甲烷【学习⽬标】1.了解有机物的概况;了解⾃然界中甲烷的存在及储量情况,了解甲烷对⼈类⽣产和⽣活的意义。
2.会写甲烷的分⼦式、结构式、电⼦式,知道甲烷的结构特点;知道甲烷能发⽣氧化反应和取代反应,会写化学⽅程式;知道取代反应的概念和甲烷发⽣取代反应时的断键和成键情况。
3.通过对甲烷的学习,初步建⽴有机物“结构——性质——⽤途”的学习⽅法。
4.从⽣活实际⼊⼿,加深对有机物的整体认识,初步形成对于有机化学领域的学习兴趣。
【⾃主学习】阅读必修2第三章前⾔及第⼀节P60-62和选修5引⾔、第⼀章前⾔及第⼆节P7-8相关内容知识点⼀认识有机物[思考]请对下列物质进⾏分类: CO2、碳酸、CH3COOH、酒精、蔗糖、甲烷。
你对有机物和有机化学了解多少?知识梳理1、有机物:指⼤部分含的化合物(除CO、、碳酸、、氰化物、⾦属碳化物等外)。
除碳元素外还通常含有等⼏种元素。
2、有机物的主要特点:⼤多数有机物熔沸点,燃烧、导电、溶于⽔、溶于有机溶剂。
有机反应⼀般,⼀般需和使⽤,常伴有;所以有机反应中常⽤“→”不⽤“=”。
3、有机物种类繁多的原因:①碳原⼦有个价电⼦,可以和其他原⼦形成个共价键;②碳碳之间可以形成单键、也可以形成和;③碳碳之间结合的⽅式可以是链状,也可以是状。
4、仅由和两种元素组成的有机化合物总称为烃。
是最简单的烃。
5、研究有机物的的科学叫做有机化学。
迁移应⽤1.下列关于有机物的说法正确的是A.凡是含碳元素的化合物都属于有机物 B.有机物只含有碳、氢两元素C.有机物不但存在于动植物体内,⽽且可以通过⼈⼯的⽅法合成D.都属于⾮电解质,其⽔溶液都不导电2.下列物质中属于有机物的是①酒精;②⼀氧化碳;③KSCN;④甲烷;⑤红糖;⑥CCl4;⑦CO(NH2)2;⑧⽯灰⽯;⑨⾷⽤油;⑩醋酸A.①②④⑤⑨B.①④⑤⑥⑦⑨⑩C.①③④⑤⑦⑧⑨⑩D.①④⑤⑥⑩3.下列关于烃的说法正确的是A.含有碳、氢元素的有机物 B.含有碳元素的化合物C.仅由碳、氢两种元素组成的有机物 D.完全燃烧只⽣成⼆氧化碳和⽔的化合物4.下列物质属于烃类的是A.C6H6B.H2CO3C.C2H4O D.CHCl3知识点⼆甲烷的组成和结构[思考]沼⽓的成分是什么?写出其化学式、结构式及成键类型,其结构有何特点?知识梳理1.存在和⽤途(1)存在:甲烷是________、________、油⽥⽓和煤矿坑道⽓的主要成分。
一点通教育学科导学案 科目 化学 课 题 甲烷及其烷烃 学习目标与考点分析1. 了解烃的基本概念及其甲烷的性质2. 掌握烷烃的基本概念及其性质3. 掌握同系物同分异构体的概念 学习重点烃的基本概念及其性质 学习方法 上课认真听讲----课堂积极思考----课后按时完成作业学习内容与过程有机物:组成里含 碳 元素的化合物。
(CO 、CO 2、H 2CO 3 及其盐除外)烃:仅由 碳 和 氢 两种元素组成的化合物。
一、甲烷1. 甲烷的分子组成和结构(1)分子组成:分子式:CH 4(2)分子结构:①电子式: H C H②结构式 H C H④分子结构示意图:⑤结构特点:整个分子呈 正四面体 型结构,4个C —H 键的键长、键角、键能(强度)完全相同,键的空间排列对称,键角为 109°28 ,分子为非极 性分子。
2.甲烷的存在及物理性质:甲烷是一种 无 色、 没有气味 的气体, 极难 溶于水,密度比空气 小 。
3.甲烷的化学性质:比较稳定,通常不与 强酸 、 强碱 、 强氧化 剂反应。
在特定条件下,也会发生某些反应。
KMnO 4 (H +) 通入CH 4 (不褪色)Br 2水(橙色) 通入CH 4 (不褪色)(1) 氧化反应:甲烷是一种优良的气体燃料,通常状况下,mol 甲烷完全燃烧,生成CO 2 和H 2O, 放出890kJ 热量。
甲烷在空气中燃烧的爆炸极限:甲烷含量(体积分数)5%~15.4% 。
CH 4(g )+ 2O 2 (g ) 点燃CO 2(g)+2H 2O (l ) △H == -890kJ·mol -1 H H H H(2)取代反应:有机物分子里的某些 原子 或 原子团 被其他的 原子 或原子团所代替的反应。
【实验探究】在光照下CH 4与Cl 2反应:取两支硬质大试管,通过排饱和食盐水的方法先后各收集半试管甲烷和半试管氯气,分别用铁架台固定好。
其中1支试管A 用黑色纸套套上,另1支试管B 放在光亮处(不要放在日光直射的地方,以免引起爆炸)片刻后,去掉1支试管上的黑纸套,观察比较两支试管中的物质。
必修二 有机化合物复习导学案烷烃 甲烷学习目的1:1. 复习巩固有机物甲烷的性质;2. 复习巩固烷烃的特点、命名等知识;3. 复习巩固同系物、同分异构体等概念。
知识体系 1一. 甲烷(饱和烃)已知甲烷的气体密度在标准状况下为0.717 g/L ,其中含碳的质量分数为75%,含氢质量分数为25%,求甲烷的分子式。
⑴ 分子结构特点分子式:CH 4 电子式: 结构式:① 空间正四面体结构 ② C 与H 都是单键连接 ③ 非极性分子 ⑵ 俗名:沼气(存在于池沼中)坑气(瓦斯,煤矿的坑道中)天然气(地壳中) ⑶ 物理性质:无色无味的气体,密度小于空气,极难溶于水,但溶于CCl 4⑷ 化学性质:易取代、易分解、难氧化,与强酸、强碱或强氧化剂一般不反应 ① 与氧气反应 —— 氧化反应注意点:1、点燃前要验纯(瓦斯爆炸)2、写反应连接号时用“→” 3、 大多数的有机物燃烧后都生成CO 2和H 2O② 与氯气反应 —— 取代反应取代反应:有机物分子里的某些原子或原子团被其他原子或原子团所代替的反应叫取代反应。
③ 受热分解作用:工业上用这个反应来制炭黑,炭黑可以用来做橡胶填充剂,黑色颜料……⑸ 实验室制法: CH 3COONa + NaOH == Na 2CO 3 + CH 4↑ ⑹ 用途:清洁能源(新能源 --- 可燃冰)、化工原料 二. 烷烃⑴ 烃: ⑵ 定义:烃分子中的碳原子之间只以 结合成链状,碳原子剩余的价键全部跟 相结合,使每个碳原子的化合价都已充分利用,都达到“饱和”。
这样的烃叫做饱和烃,又叫烷烃。
⑶ 特点:① 碳碳单键(C —C) ② 链状 ③ “饱和” —— 每个碳原子都形成四个单键 烷烃的通式: ⑷ 物理性质递增:随着C 原子增加,结构相似,相对分子质量逐渐增大,分子间作用242H C CH +−−→−高温甲烷、乙烷、丙烷、丁烷和异丁烷的球棍模型⑸化学性质:①稳定性:②可燃性③取代反应(6)命名①碳原子数在10个以内,依次用“天干”(甲、乙、丙、丁、戊、已、庚、辛、壬、癸)代表碳原子数,其后加上“烷”字;碳原子数在10个以上,用汉字数字表示(如十二烷)。
第三章第一节甲烷的性质导学案学习目标:1.了解有机化合物的概念。
2.掌握甲烷的分子结构,了解甲烷的物理性质及存在、用途。
3.掌握甲烷的化学性质,认识取代反应的特点。
4.通过实验现象的观察,了解现象和本质的辩证关系。
知识导学:要点有机化合物的组成有机化合物都含有元素,但含有元素的物质不一定都是有机物,如2碳酸盐、碳酸氢盐都属于。
二、甲烷1.存在和用途。
(1)存在:甲烷是、、油田气和煤矿坑道气的主要成分。
(2)用途:天然气是一种、、的清洁能源,还是一种重要的。
2.组成与结构。
(1)表示方法。
(2)结构特点。
甲烷分子是以为中心,为顶点的结构,其中C—H键的和相同。
4.化学性质。
通常状况下,甲烷比较稳定,与等强氧化剂不反应,与、也不反应。
但在特定的条件下,甲烷也能发生某些反应。
(1)氧化反应。
纯净的甲烷在空气中安静的燃烧,火焰呈,放出大量的热,反应的化学方程式为。
(2)取代反应。
①定义:有机化合物分子里的某些被其他所代替的反应。
③ 取代产物。
水溶性:甲烷的四种氯代产物均。
状态:常温下除是气体,其余三种均为。
【应用思考】1.与甲烷的分子结构相同的物质是()A.CH3Cl B.CCl4C.CH2Cl2 D.CHCl32.甲烷分子是以碳原子为中心的四面体结构而不是正方形的平面结构,其理由是()A CHCl3只有一种结构B CH2Cl2只有一种结构C CH4分子受热分解D CH4的四个键的长度和强度都相等3点燃甲烷气体前为什么必须检验其纯度?如何检验?4.关于取代反应和置换反应的下列说法中,正确的是()A.取代反应和置换反应中一定都有单质生成B.取代反应和置换反应一定都属于氧化还原反应C.取代反应大多是可逆的,反应速率慢,而置换反应一般是单向进行的,反应速率快D.取代反应和置换反应的产物都是唯一的,不会有多种产物并存的现象5.下列反应中,属于取代反应的是( )A .CH 4――→高温C +2H 2B .H 2+Cl 2――→光2HClC .CH 4+2O 2――→点燃CO 2+2H 2OD .CH 4+Cl 2――→光CH 3Cl +HCl6.下列物质在一定条件下可跟CH 4发生化学反应的是( )A .酸性高锰酸钾溶液B .溴水C .氢氧化钠溶液D .溴蒸气7.将1 mol 甲烷和适量的Cl 2混合后光照,充分反应后生成的CH 3Cl 、CH 2Cl 2、CHCl 3、CCl 4四种有机产物的物质的量依次增大0.1 mol ,则参加反应的Cl 2的物质的量为( )A .1.5 molB .3 molC .4.5 molD .6 mol8.如图,某气体X 可能由H 2、CO 、CH 4中的一种或几种组成,将X 气体燃烧,把燃烧后生成的气体通过A 、B 两个洗气瓶。
第三章有机化合物第一节最简单的有机化合物——甲烷(第一课时)【学习目标】1、了解自然界中甲烷的存在及储量情况2、通过实践活动掌握甲烷的结构式和甲烷的正四面体结构3、通过实验探究理解并掌握甲烷的取代反应原理4、了解甲烷及其取代反应产物的主要用途5、培养学生实事求是、严肃认真的科学态度,培养学生的实验操作能力。
【重点】甲烷的结果特点和甲烷的取代反应【难点】甲烷的结果、立体结构模型的建立【教材伴读】什么是有机物?有机物种类繁多的主要原因是什么?什么样的有机物称为烃?一、甲烷的分子结构1、化学式2、电子式3、结构式讨论:甲烷分子结构特点:a、空间结构,碳原子位于的中心,键角为。
b、碳氢键。
二、甲烷的性质1、物理性质:色、味的体,溶于水,比空气,是天然气、沼气(坑气)和石油气的主要成分(天然气中按体积计,CH4占80%~97%)思考:①根据上述甲烷的物理性质,你知道如何收集甲烷吗?②天然气主要成分是CH4,CH4无色无味,但天然气有气味,为什么?2、化学性质:(1)可燃性(甲烷的氧化反应)实验1:甲烷的燃烧现象:甲烷燃烧的化学方程式:(方程式的中间用的是“”,而不是“”,这主要是因为有机物参加反应往往比较复杂,常有副反应发生。
)注意:点燃甲烷前,一定要,否则会。
思考:怎样鉴别CH4、H2、CO这三种气体?(尝试画出装置图)实验2:甲烷通入酸性高锰酸钾溶液中,观察实验现象现象:酸性高锰酸钾溶液证明甲烷(能/不能)使酸性高锰酸钾溶液褪色。
结论:一般情况下,甲烷性质稳定,与等不起反应(2)取代反应:实验3:甲烷与氯气在光照条件下反应现象:【讨论】①CH4与Cl2反应后,产物可能有几种?哪些是有机物?哪种产物最多?②瓶壁上油状液体是什么?油状液体是纯净物还是混合物? ( CH3Cl,CH2Cl2,CHCl3是难溶于水的液体)已知: CH3Cl CH2Cl2 CHCl3 CCl4沸点/℃ -24 40 62 77思考:如何分离这些混合物?③试管内的液面为什么会上升?④CH4与Cl2反应后量筒内的气体是什么?⑤CH4与Cl2反应后量筒内溶液酸碱性如何?⑥向CH4与Cl2反应后量筒内溶液中加入硝酸银溶液有什么现象?某同学认为可根据该现象判断该实验是否有HCl生成,你觉得合理吗?为什么?定义:甲烷与氯气在光照下反应的产物有书写CH4与Cl2发生取代反应的化学方程式3、用途:甲烷是一种很好的气体燃料,可用于生产种类繁多的化工产品。
第一章烃第一节甲烷烷烃新知探究一甲烷【学习目标】1.了解有机物的概况;了解自然界中甲烷的存在及储量情况,了解甲烷对人类生产和生活的意义。
2.会写甲烷的分子式、结构式、电子式,知道甲烷的结构特点;知道甲烷能发生氧化反应和取代反应,会写化学方程式;知道取代反应的概念和甲烷发生取代反应时的断键和成键情况。
3.通过对甲烷的学习,初步建立有机物“结构——性质——用途”的学习方法。
4.从生活实际入手,加深对有机物的整体认识,初步形成对于有机化学领域的学习兴趣。
【自主学习】阅读必修2第三章前言及第一节P60-62和选修5引言、第一章前言及第二节P7-8相关内容知识点一认识有机物[思考]请对下列物质进行分类: CO2、碳酸、CH3COOH、酒精、蔗糖、甲烷。
你对有机物和有机化学了解多少?知识梳理1、有机物:指大部分含的化合物(除CO、、碳酸、、氰化物、金属碳化物等外)。
除碳元素外还通常含有等几种元素。
2、有机物的主要特点:大多数有机物熔沸点,燃烧、导电、溶于水、溶于有机溶剂。
有机反应一般,一般需和使用,常伴有;所以有机反应中常用“→”不用“=”。
3、有机物种类繁多的原因:①碳原子有个价电子,可以和其他原子形成个共价键;②碳碳之间可以形成单键、也可以形成和;③碳碳之间结合的方式可以是链状,也可以是状。
4、仅由和两种元素组成的有机化合物总称为烃。
是最简单的烃。
5的科学叫做有机化学。
1.下列关于有机物的说法正确的是A.凡是含碳元素的化合物都属于有机物 B.有机物只含有碳、氢两元素C.有机物不但存在于动植物体内,而且可以通过人工的方法合成D.都属于非电解质,其水溶液都不导电2.下列物质中属于有机物的是①酒精;②一氧化碳;③KSCN;④甲烷;⑤红糖;⑥CCl4;⑦CO(NH2)2;⑧石灰石;⑨食用油;⑩醋酸A.①②④⑤⑨B.①④⑤⑥⑦⑨⑩C.①③④⑤⑦⑧⑨⑩D.①④⑤⑥⑩3.下列关于烃的说法正确的是A.含有碳、氢元素的有机物 B.含有碳元素的化合物C.仅由碳、氢两种元素组成的有机物 D.完全燃烧只生成二氧化碳和水的化合物4.下列物质属于烃类的是A.C6H6B.H2CO3C.C2H4O D.CHCl3知识点二甲烷的组成和结构[思考]沼气的成分是什么?写出其化学式、结构式及成键类型,其结构有何特点?知识梳理1.存在和用途(1)存在:甲烷是________、________、油田气和煤矿坑道气的主要成分。
(2)用途:天然气是一种______、______、________的清洁能源,还是一种重要的__________。
2.组成与结构(1)表示方法化学式电子式结构式分子结构示意图球棍模型比例模型(2)结构特点甲烷分子是以______为中心,________为顶点的__________结构,其中C—H键的______ 和______相同,属于分子。
迁移应用1.下列气体的主要成分不是甲烷的是:A. 沼气 B .天然气 C. 水煤气 D. 坑道所产生的气体2.下列关于甲烷结构的说法错误的是A.甲烷分子中的化学键都是共价键 B.甲烷分子为正四面体结构C.甲烷分子为正四边形结构 D.CCl4的结构和甲烷相同3.甲烷分子是以碳原子为中心的正四面体结构,而不是正方形的平面结构,理由是A.CH3Cl只存在一种结构B.CH2Cl2只存在一种结构C.CHCl3只存在一种结构 D.CCl4中四个价键的键角和键长都相等知识点三甲烷的性质[思考](1)煤矿中为何会发生瓦斯爆炸?发生什么反应?怎样防止气体爆炸?从中你能得到什么启示?(2)如何验证甲烷燃烧的产物?(3)如何区别H2、CO、CH4三种气体?(4)CH4与Cl2在什么条件下反应?现象是什么?产物有几种?哪种产物最多?属于哪种反应类型?知识梳理1.物理性质颜色状态气味密度(与空气相比) 水溶性2. 化学性质通常状况下,甲烷比较稳定,与______等强氧化剂不反应,与______、______也不反应。
但在特定的条件下,甲烷也能发生某些反应。
(1)氧化反应纯净的甲烷在空气中安静的燃烧,火焰呈________,放出大量的热,反应的化学方程式为________________________________________________________________________。
(2)取代反应实验操作a.气体颜色________,最后________ ;b.试管内壁有________出现;实验现象c.试管内液面逐渐________ ;d.试管中有少量白雾。
有关化学方程式②取代产物的性质水溶性:甲烷的四种氯代产物均________。
状态:常温下除__________是气体,其余三种均为__________。
③取代反应:有机化合物分子里的某些________________被其他________________所代替的化学反应。
④取代反应和置换反应的区别:(3)受热分解:在隔绝空气的情况下,加热至10000C,甲烷分解生成炭黑和氢气。
氢气是的原料;炭黑是的原料。
反应的化学方程式为3.甲烷的用途:。
迁移应用1.下列叙述中错误的是A.点燃甲烷不必事先进行验纯 B.甲烷燃烧放出大量的热,所以是一种很好的气体燃料C.煤矿的矿井要注意通风和严禁烟火,以防爆炸事故的发生 D.点燃甲烷不一定会爆炸2. 下列叙述错误的是A. 通常情况下,甲烷跟强酸、强碱、强氧化剂不反应B.甲烷化学性质比较稳定,不能被任何氧化剂氧化C. 甲烷跟氯气反应无论生成CH3Cl、CH2Cl2、CHCl3还是CCl4,都属于取代反应D.甲烷的四种有机氯代产物都难溶于水3.为验证甲烷分子中含有碳氢两种元素,可将其燃烧产物通过:a.浓硫酸 b.澄清石灰水 c.无水硫酸铜,正确的通过顺序是A.a b cB.b cC.b c aD.c b4.CH4和H2混合气体10 mL,完全燃烧后生成6 mL CO2气体(气体的体积在相同状况下测定),则混合气体中CH4和H2的体积之比为A.2∶3 B.3∶2 C.2∶1 D.1∶25.1 mol CH4与Cl2发生取代反应,待反应完全后,测得四种有机取代物的物质的量相等,则消耗的Cl2为A.0.5 mol B.2 mol C.2.5 mol D.4 mol6.在常温下,把一个盛有一定量甲烷和氯气的密闭玻璃容器放在光亮的地方,两种气体发生反应,下列叙述中不正确的是A.容器内原子总数不变 B.容器内分子总数不变C.容器内压强不变 D.发生的反应属于取代反应7. 下列反应中,光照对反应几乎没有影响的是A. 氯气与氢气的反应B. 氯气与甲烷的反应C.氧气与甲烷的反应D. 次氯酸的分解8. 下列反应中属于置换反应的是,属于取代反应的是。
①Zn+H2SO4===ZnSO4+H2↑② CH4+Cl2→CH3Cl+HCl ③CH4+2O2→CO2+2H2O④CH3CH2Br+H2O→CH3CH2OH+HBr ⑤ PCl5+4H2O===H3PO4+5HCl ⑥NaCl+AgNO3===NaNO3+AgCl↓新知探究二烷烃【学习目标】1.了解烷烃概念并会对烷烃和简单的环烷烃进行命名。
2.了解烷烃的物理性质及变化规律。
3.通过烷烃分子通式的总结推导,学会用“通式思想”认识有机物的同系物的组成特征。
4.掌握同系物、同分异构体、同分异构现象等概念;能判断和书写烷烃及环烷烃的同分异构体。
5.了解从一种代表物质入手研究同系物有机物性质的方法。
【自主预习】阅读必修2 P62-P64和选修5 P9,P13-14知识点一烷烃的概念及性质[思考](1)请根据乙烷、丙烷、丁烷分子模型,写出各物质的分子式、结构式及结构简式:乙烷丙烷丁烷分子式结构式结构简式(2)结合甲烷、乙烷、丙烷、丁烷的组成及结构特点,归纳它们的分子结构特点。
(3)既然甲烷的结构和其他的烷烃分子很相似,那么它们在性质上是否也很相似呢?分析课本P63表中数据,总结其物理性质的递变规律。
想一想它们的化学性质有何异同?知识梳理1.概念:分子中碳原子之间只以__________结合,剩余的价键全部跟__________结合,使每个碳原子的化合价都达到“饱和”,这样的烃叫__________,也叫______。
2.通式:__________________。
3.烷烃的结构特点①烷烃分子里的碳原子间都以______相连接,每个碳原子最多能以____个共价单键与其他碳(或氢)原子相连接。
每个碳原子的化合价都得到充分的利用。
②烷烃都是______结构,非平面或直线结构,碳原子_____一条直线上,而是呈______型或______状。
碳碳单键可以旋转,因此烷烃(主链的碳原子数≥4)的碳链形状可以改变。
4.物理性质机物的结构特点(官能团)球棍模型用小球表示原子,短棍表示价键,能表示其空间构型,但不能反映各种不同原子的大小比例用于表示有机物分子的空间构型(立体结构)比例模型用不同体积的小球表示不同的原子大小,能表示其空间构型,能反映各种不同原子的大小比例用于表示分子中各原子的相对大小和结合顺序迁移应用1.20XX年北京奥运会的“祥云”火炬所用燃料的主要成分是丙烷,下列有关丙烷的叙述正确的是A. 是天然气的主要成分 B. 光照下能够发生取代反应C. 能使酸性高锰酸钾溶液褪色D. 分子中碳原子在一条直线上2.下列有关烷烃的叙述中,不正确的是A. 在烷烃分子中,所有的化学键都为单键B. 所有的烷烃在光照条件下都能与Cl2发生取代反应C. 烷烃的分子通式为C n H2n+2,符合该通式的烃不一定是烷烃D. 随着碳原子数的增加,烷烃的熔沸点逐渐升高3.下列分子式所表示的烃中,属于烷烃的是A.C3H6 B.C4H6 C.C5H12 D.C6H64.下列性质中属于烷烃特征性质的是A.燃烧产物只有二氧化碳和水 B.分子通式为C n H2n+2,与氯气发生取代反应C.它们是非电解质 D.它们几乎不溶于水5.若1 mol某气态烃C x H y完全燃烧,需用3 mol O2,则A.x=2,y =2 B.x = 2,y =4 C.x = 3,y =6 D.x=3,y=86.由沸点数据:甲烷-146℃,乙烷-89℃,丁烷-0.5℃,戊烷+36℃,判断丙烷的沸点可能是A.高于-0.5℃B.约是+30℃C.约是-40℃D.低于-89℃7.某烃中碳、氢元素的质量比是24:5,该烃在标况下的密度是2.59g/L,则该烃的最简式是,摩尔质量是,分子式为。
8.写出下列各种烷烃的化学式及结构简式:⑴沸点最高的气态烷烃:_________ ⑵相对分子质量是86的烷烃:__________⑶对H2的相对密度为22的烷烃:___________⑷分子中有76个氢原子的烷烃:___________知识点二 烷烃的命名[思考]随碳原子数增加,我们依次称烷烃为甲烷、乙烷、丙烷、丁烷……,那再多的碳原子应该如何命名?知识梳理1. 习惯命名法:(1)n ≤10时,从一到十依次用________________________________________表示为“某 烷”,如C 6H 14命名为_____ _ ;C 8H 18命名为______ 。