胃间质瘤综述资料讲解
- 格式:doc
- 大小:24.50 KB
- 文档页数:8

临床特征:GIST是除了食管之外的胃肠道最常见的间叶性肿瘤,发病率约为0.68/10万,好发于50岁以上的中老年人,中位年龄63岁,40岁以前罕见,GIST的发病不存在性别差异。
最常发生于胃,其次为小肠、直肠及食管。
GIST还可发生于网膜肠系膜及腹膜后等位置。
GIST的临床表现与肿瘤大小、发生部位、肿块与肠壁的关系以及肿瘤的恶性程度有关。
肿瘤较小时多无症状,最常见的症状为腹部不适、隐痛或者可扪及的腹部肿块。
浸润到消化道的表现为溃疡或出血,其他的症状可有食欲不振、体重下降等,较少发生肠梗阻。
部分患者是在开腹手术、内镜检查或进行体检时无意中发现。
病理:胃肠间质瘤(GIST)属于胃肠道间叶源性肿瘤,通常是胃肠壁肌层内的肿块,可向腔内或浆膜面生长。
部分病例则完全表现为肠系膜或大网膜肿块。
肿块多呈圆形或椭圆形,有的包膜完整,有的无明显包膜。
切面部分灰白、实性、质韧;部分细腻,呈鱼肉状。
从组织形态学上分为3种类型:梭形细胞型、上皮细胞型和混合型。
光镜下,梭形细胞多呈编织状、栅栏状或旋涡状排列,上皮样细胞则多呈弥漫片状、巢索状排列。
肿瘤间质常出现黏液样基质及玻璃样变性,甚至可出现钙化,部分肿瘤组织可伴有或多或少的炎症细胞浸润。
在高度危险性GIST中出血及坏死常见,部分可囊变。
GIST起源于胃肠道的间质干细胞Cajar 细胞,属于髓细胞样干细胞并且含有c-kit 原癌基因(CD117 和CD34 呈阳性),CD117 阴性患者的药物治疗效果不佳。
部分GIST表达α-SMA和S- 100, GIST几乎不表达Desmin。
通过对CD117、CD34、SMA、Desmin及S-100等免疫组化分析,可以有助于GIST与平滑肌瘤、平滑肌肉瘤、神经纤维瘤或神经纤维肉瘤等鉴别。
神经方向分化的间质瘤S100阳性。
GIST的大小及核分裂相是目前比较公认的判断预后的指标影像学表现:GIST的CT 表现有一定特征性,最常发生于胃,其次为小肠、直肠及食管。




胃肠道间质瘤名词解释
《胃肠道间质瘤》名词解释
胃肠道间质瘤(Gastrointestinal Stromal Tumor,简称GIST)是一种起源于胃肠道间质细胞的
肿瘤。
它是目前广泛研究和讨论的一种罕见病。
胃肠道间质瘤可以发生在胃、小肠、结肠等消化道的任何部位,也有少数发生在食管和直肠等胃肠道之外的位置。
胃肠道间质瘤起源于胃肠道的间质细胞,这些细胞主要负责组织支持和调控肌肉运动。
间质细胞在正常情况下是稳定的,在肿瘤中发生了异常增生和变异。
胃肠道间质瘤的形成和发展与
KIT基因突变和PDGFRA基因突变有关,这些基因突变可以导致细胞增殖的过程中出现失控。
胃肠道间质瘤的症状和表现各有差异,取决于肿瘤的位置和大小。
一些患者可能出现腹部不适、消化道出血、腹部肿块等症状,而另一些患者可能没有明显的症状。
诊断胃肠道间质瘤通常通过临床检查、影像学检查、组织活检和分子遗传学检测来确定。
目前,胃肠道间质瘤的治疗方法主要包括手术切除和靶向治疗。
手术切除通常被认为是最有效的治疗方法,尤其适用于早期诊断的患者。
对于进展期或复发的患者,靶向治疗药物(如Imatinib)已经显示出显著的治疗效果。
此外,放射治疗和化疗也可以用于胃肠道间质瘤的治疗,但效果较为有限。
总的来说,胃肠道间质瘤是一种罕见的消化系统肿瘤,发生原因与基因突变有关。
对于患者来说,早期的诊断和治疗至关重要,因为它可以显著影响患者的预后和生存率。
同时,相关研究和临床试验的进行也有助于提高我们对这种罕见病的认识并探索更有效的治疗方法。


【优秀课件】胃肠道间质瘤(GIST)
胃肠道间质瘤( GIST)是胃肠道最常见的间叶组织来源肿瘤,起源于Cajal 间质细胞,占全部胃肠道恶性肿瘤的1%-3%。
GIST可发生在胃肠道的任何部位,包括网膜、肠系膜和腹膜,但主要发生于胃和小肠。
临床特点 GIST可发生于任何年龄,以50-60岁多见,男性发病率略高于女性,整体发病率约10-20/10万。
GIST的临床表现决定于肿瘤发生的部位及大小,最常见的症状是贫血、体重下降、消化道出血、腹痛和肿块相关症状,也可出现急腹症、梗阻、肠套叠、穿孔或破裂和腹膜炎等表现。
20%的GIST没有症状,在偶然情况下发现。
尽管临床上GIST的恶性比例只有 10%-30%,但所有GIST均有恶性潜能。
GIST的主要转移部位是肝脏和腹腔(包括网膜和肠系膜),淋巴结、骨、肺转移少见。
发生在胃部占62% ,肠道占32% ,食管占2% ,胃肠道外占 4% ,胃肠道是间质瘤的多发部位,其中发生于胃的比例最多,其次是小肠、结直肠和食管。
本文是刘春梅老师在漯河市基层骨干医师培训讲课中的课件,概述了胃肠道间质瘤的流行病学、内镜诊断、病理诊断、影像诊断,以及外科和内镜下治疗。
是不可多得的好文。

矿产资源开发利用方案编写内容要求及审查大纲
矿产资源开发利用方案编写内容要求及《矿产资源开发利用方案》审查大纲一、概述
㈠矿区位置、隶属关系和企业性质。
如为改扩建矿山, 应说明矿山现状、
特点及存在的主要问题。
㈡编制依据
(1简述项目前期工作进展情况及与有关方面对项目的意向性协议情况。
(2 列出开发利用方案编制所依据的主要基础性资料的名称。
如经储量管理部门认定的矿区地质勘探报告、选矿试验报告、加工利用试验报告、工程地质初评资料、矿区水文资料和供水资料等。
对改、扩建矿山应有生产实际资料, 如矿山总平面现状图、矿床开拓系统图、采场现状图和主要采选设备清单等。
二、矿产品需求现状和预测
㈠该矿产在国内需求情况和市场供应情况
1、矿产品现状及加工利用趋向。
2、国内近、远期的需求量及主要销向预测。
㈡产品价格分析
1、国内矿产品价格现状。
2、矿产品价格稳定性及变化趋势。
三、矿产资源概况
㈠矿区总体概况
1、矿区总体规划情况。
2、矿区矿产资源概况。
3、该设计与矿区总体开发的关系。
㈡该设计项目的资源概况
1、矿床地质及构造特征。
2、矿床开采技术条件及水文地质条件。


胃间质瘤治疗方案胃间质瘤概述胃间质瘤(Gastrointestinal stromal tumor,GIST)是一种起源于胃肠道间质细胞的恶性肿瘤。
它占据胃肠道恶性肿瘤的1%~2%。
胃间质瘤的治疗方案根据病情严重程度和患者的整体健康状况来定制。
胃间质瘤的常规治疗方法手术切除手术切除是治疗胃间质瘤的首选方法。
对于局部初发的胃间质瘤,完全切除是最主要的治疗手段。
手术通常采用胃镜或开腹手术进行。
胃镜手术具有微创、恢复快等优点,适用于小型胃间质瘤,且病变位于胃壁表浅部位的患者。
对于大型、位于胃壁深层或胃壁穿透的病变,开腹手术是更常见的选择。
术后一般还需要进行病理学检查以确定肿瘤的类型和分级。
靶向治疗由于胃间质瘤常常具有KIT基因突变,导致KIT蛋白激酶的活性增强,因此靶向治疗是胃间质瘤的重要治疗手段。
食管肿瘤的靶向治疗主要是通过选择性抑制KIT蛋白激酶的药物,如Imatinib,来抑制肿瘤细胞的生长和扩散。
患者通常需要长期口服这些药物来维持治疗效果。
化疗和放疗胃间质瘤通常不敏感于化疗和放疗,因此在常规治疗中很少使用。
但在手术切除之前,化疗和放疗可以用于缩小肿瘤的体积或减少肿瘤对周围组织的侵袭,以便更好地进行手术切除。
胃间质瘤的个体化治疗预测复发和转移风险预测胃间质瘤的复发和转移风险对制定个体化的治疗方案至关重要。
目前常用的预测指标包括肿瘤的大小、形态学特征、组织学类型、核分裂指数以及基因突变情况。
通过综合评估这些指标可以预测患者的预后并选择合适的治疗方法。
高危患者的治疗方案对于高危患者,常规手术切除通常不足以控制肿瘤的复发和转移。
这些患者通常需要接受术前和术后的辅助治疗,以提高治疗效果。
术前辅助治疗可以包括放疗和化疗,用于缩小肿瘤体积和减少肿瘤对周边组织的侵袭。
术后辅助治疗则主要包括靶向治疗,以预防肿瘤的复发和转移。
低危患者的治疗方案对于低危患者,常规手术切除通常已经足够。
这些患者的治疗重点主要在于规范的术后随访和监测,以及长期的靶向治疗。
胃间质瘤综述 精品文档 收集于网络,如有侵权请联系管理员删除 综述 胃肠道间质瘤研究进展 定远县总医院 刘 辉 胃肠道间质瘤(Gastrointestinal Stromal Tumors,GIST)是一组独立起源于胃肠道间质干细胞的肿瘤[1]。出现从Cajal间质细胞(ICC)或普通细胞的前体,两者的表达III型酪氨酸激酶受体。酪氨酸激酶受体c-kit(CD117)或相关的酪氨酸激酶受体的突变可能促进胃肠道间质瘤生长和最终肿瘤形成。胃肠道间质瘤属于频谱的非上皮、间质瘤,其范围从小型惰性肿瘤到恶性肉瘤,是腹部最常见的软组织肉瘤。
在伊马替尼出现之前,完整的手术切除是病人长期生存和疾病治愈的主要途径。然而,复发仍是不可避免的,患有不可切除或转移性胃肠道间质瘤患者的中位生存期为10~20数个月;使用酪氨酸激酶抑制剂(TKI)伊马替尼为治疗胃肠道间质瘤提供了新的方向。从此,以胃肠道间质瘤突变活化的酪氨酸激酶作为靶标的多种小分子酪氨酸激酶抑制剂不断的被合成,并进行药效检测。这些治疗方案正在持续改善患者的生活质量,延长患者的生存期。
本综述的目标是梳理胃肠道间质瘤最新诊断方法,以及针对不同患者的合理治疗方案。
1. 胃肠道间质瘤发病概述 自Mazur 等于1983 年首次提出了胃肠道间质肿瘤这个概念以来,多国对此病发病情况进行了统计。据统计,美国胃肠道间质瘤年发病率为3.2~7/100万[2]。欧洲、韩国和香港的发病率略高,为15~20/100万[3]。因为发病率数据来自于以人群体为基础的肿瘤登记,不能获得良性肿瘤发病率,因此,真正的胃肠道间质瘤的发生率可能更大高。
自1998年以来,胃肠道间质肿瘤发生率呈逐年指数增长趋势。这主要得益于c-kit和血小板衍生生长因子受体α(PDGFRA)的发现,它们均是胃肠道间精品文档 收集于网络,如有侵权请联系管理员删除 质肿瘤可靠的生物标志。胃肠道间质瘤最常见于胃部(50~60%),其次是小肠(30 ~35%)、结肠和直肠(5%)、食道(<1%),罕见于胃肠道以外组织(肠系膜、网膜、腹膜后,<5%)[2]。胃肠道间质肿瘤患者平均诊断年龄为63岁;小于1%的患者在20岁以下。一项连续21年的分析数据(使用SEER统计软件)显示,胃肠道间质瘤患者的12个月和5年生存率均得到改善(12个月:1990 - 1998 =81.5%,1999,2005 = 86.4%,2006,2011 = 89.7%;5年:1990 - 1998 = 48%,1999 - 2005 = 63.1%,2006 - 2011 = 69%),P<0.05。
2. 胃肠道间质瘤的诊断 胃肠道间质瘤直径大于5厘米便可激发患者产生临床症状,文献报道肿瘤直径介于10~13厘米。最新研究报道了直径小于1厘米的微小胃肠道间质瘤,同样表现为KIT和PDGFRA基因突变。此类微小胃肠道间质瘤向恶性胃肠道间质瘤转变的分子机制尚未明了。研究表明,在胃肠道间质瘤发病期间,50%的患者伴有转移性疾病,其中肝脏是最常见的转移靶器官。
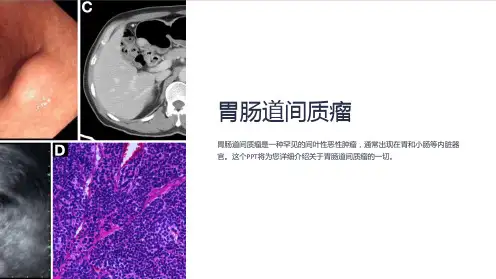
2.1 影像诊断 诊断胃肠道间质瘤最直接的方法是影像检查。此类检查方法种类很多,可用CT、胃肠道造影及B超进行检查。胃肠道间质瘤的CT表现具有以下较为典型的特征:(1)大多数病灶轮廓规整、边界清晰、易于坏死囊变,随着肿瘤的增大和恶性程度的增高,病变轮廓可以呈不规则形或分叶状,病变内容物坏死更明显,但其对周围结构的浸润依然相对轻微;(2)病变以外生型和跨壁生长型为主,即使肿块巨大,消化道梗阻的现象也极少发生;(3)肝、腹膜等处转移比较常见,但罕见淋巴结转移[4-6]。夏淦林等[6]报道认为胃肠道间质瘤的影像学表现具有一定的特征性:肿块虽形态不一,但多数肿瘤组织与周围组织界限清晰、光整;相比较而言,肿瘤对周围组织的浸润较为轻微,仅表现为肿块边缘与邻近结构的分界趋于模糊;肿块多血供丰富,内部出血、坏死、囊变比较明显。螺旋CT具有较高的应用价值,能够清晰显示病灶部位的具体位置、形态及大小,为临床胃肠道间质瘤的良性及恶性分级提供参考依据。动态增强扫描则可以反应病变的血液供应情况及强化特征,通过特征性的增强图像,可以清晰勾勒病变边界,并为病变的定性提供有价值的参考信息,因可以精品文档 收集于网络,如有侵权请联系管理员删除 清楚显示胃肠道管腔、管壁及周围组织的结构,此技术也被应用于检查胃肠道间质瘤[4]。侯毅斌等[5]报道指出,胃肠道间质瘤以腔外型生长为主,并且体积较大,瘤内常现出血、坏死等,无淋巴结转移,通常不引起肠梗阻和腹水。
2.2 胃肠道间质瘤镜下组织学特征 王钧[8]研究发现,在组织学上,胃肠道间质瘤主要由上皮样细胞和梭形细胞等组成,其中上皮样细胞约占65.63%,梭形细胞约占18.75%,两者混合型约占15. 63%。部分梭形肿瘤细胞与平滑肌瘤细胞的镜下形态相近,胞质较丰富,轻度或中度嗜伊红染色,细胞核呈胖梭形、短梭形或长杆状,核两端尖或平钝,可见空泡,胞质弱嗜酸性,核仁不明显。两种肿瘤细胞界限不清晰,细胞呈束状、栅栏状或旋涡状排列。细胞间质以浆细胞和淋巴细胞炎性浸润为主,伴有玻璃样变性或黏液样变性,部分可见囊性变、坏死及组织出血。上皮样瘤细胞界限清晰,细胞可呈印戒样细胞或脂肪母细胞表现,圆形、卵圆形、多角形,胞质丰富,轻度嗜伊红染色或透明淡染,细胞核可呈多样表现,核膜偏薄,染色质较细,均匀分布,多数细胞内可见1个紫红色染色核仁,居中或贴于核膜。细胞间质可见透明变性、玻璃样变性、黏液样变、钙化、出血及坏死。混合细胞形态包括有梭形区域和上皮样区域,其中,梭形区域细胞呈椭圆形,胞浆嗜酸性,而上皮样细胞区,染色质较细,胞浆较宽、透亮,可有大而偏心的核[7]。
2.3 免疫组化 免疫组化也是诊断胃肠道间质瘤的主要方法,研究表明,胃肠道间质瘤表达PDGFRA,CDKN2A,PI3K和DOG1。CD117、CD34、SMA和S-100在胃肠道间质瘤的诊断中可能具有一定的作用[9-10]。马庆锋等通过免疫组化研究表明胃肠道间质瘤表达CD117,并且多数也表达CD34,而CD34阴性的胃肠道间质瘤CD117几乎均阳性,提示CD117较CD34更敏感。不同的病例以及混合型病例不同形态区域均表达CD117,说明复杂多样的细胞形态、排列结构及生长方式实为同一种肿瘤,因此,GIST表达CD117,不仅扩展了CD117的表达谱,且为认识及研究胃肠道间质瘤提供了有效的指标[11]。
3. 胃肠道间质瘤的治疗 精品文档 收集于网络,如有侵权请联系管理员删除 3.1 手术 对原发胃肠道间质瘤而没有发生转移者,首选的治疗方法是手术切除[12],但是,对于大多数的原发性胃肠道间质瘤均不建议术前活检或术中冷冻活检[13]。同时,因为腹腔镜手术操作容易引起间质瘤破裂,导致腹腔种植,临床上不建议进行常规应用。对于肿瘤病变局限和最大径线≥2厘米者,建议完整切除肿瘤实体。孤立性复发或转移病变,预测手术可以完整切除并且对相关脏器功能不会产生严重影响者,推荐直接手术;难以完全切除的胃肠道间质瘤,可经药物靶向治疗,且待肿瘤缩小后切除。不同部位胃肠道间质瘤的手术原则也有不同。胃肠道间质瘤中大部分患者适用局部切除,切缘离病灶2厘米一般能够满足要求;应尽量避免全胃切除,单灶性病变估计需全胃切除者可以先进行新辅助治疗;多灶性巨大胃肠道间质瘤或同时性多原发肿瘤可进行全胃切除;近端胃切除适用于胃上部间质瘤切除缝合后可能引起胃入口狭窄的患者。十二指肠局部切除适用于外生型间质瘤,肠壁侵犯具有局限性,切除缝合后梗阻机会不大的患者。肠段切除适用于位于十二指肠水平段的间质瘤,其侵犯肠壁周径不超过0.5圈、肠管长轴侵犯长度<3厘米。胰头十二指肠切除则适用于上述情况以外的、肿瘤侵犯肠壁范围比较广的其他胃肠道间质瘤[13]。空肠及回肠间质瘤切缘应距肿瘤边缘10厘米以上,以保证切除完全,保留更多的正常组织,促进病灶愈合[14]。直肠间质瘤距肛门5厘米以上者可以切除,但需保证切缘1厘米;距肛门5厘米以下,并且肿瘤径线小于2 厘米可进行局部切除;径线大于2 厘米原则上应尽量进行保肛治疗,但病理冷冻切片常不能作为确切诊断的科学依据[15]。如前所述,较大的肿瘤除了进行临床研究入组的病例对照外,原则上不推荐进行腹腔镜手术,以免引发腹腔种植[13]。
3.2 药物治疗 甲磺酸伊马替尼是目前公认的治疗胃肠道间质瘤的最为有效的代表药物之一[16]。伊马替尼为分子靶向药物,特异性的与c-kit的胞浆内酪氨酸激酶功能域的ATP结合基序结合,阻断磷酸基团由ATP向蛋白质底物酪氨酸残基转移,即通过抑制酪氨酸磷酸化抑制酪氨酸活性,最终抑制细胞增殖,并诱导细胞发生凋亡。针对不能进行手术切除、手术难度比较大、恶性程度偏高的肿瘤,伊马替尼具有显著的治疗效果,临床上可以对此类病例进行药物治疗后再进行手术切除肿瘤。也就是说,对于部分最初不宜切除的肿瘤,为精品文档 收集于网络,如有侵权请联系管理员删除 可以顺利手术切除肿瘤,并降低手术风险,可以用伊马替尼先行治疗一段时间。中国胃肠间质瘤诊断治疗专家共识(2011年版)中推荐,对于中、高危复发风险的胃肠道间质瘤患者术后进行辅助治疗,中危患者术后给予伊马替尼辅助治疗时间应长于1年,而对于高危患者,药物辅助治疗时间至少达到3年,初始治疗推荐剂量均为400 mg/d[17]。对于c-kit外显子9突变的胃肠道间质瘤患者,应用伊马替尼治疗的初始治疗剂量为800 mg/d与400 mg/d比较,高剂量组(800 mg/d)患者获得了更长的无进展生存期。部分患者对伊马替尼耐药,原发性耐药可能与c-kit基因9号外显子突变、PDGFRα基因发生D842V突变或野生型基因表达有关,继发性耐药主要与c-kit或PDGFRα基因的二次突变有关[18]。对于耐药者可加大用药剂量至 600 mg/d,最大可加至800 mg/d,但应密切关注药物可能产生的不良反应[19]。对伊马替尼其中耐药GIST患者(600mg/d,连续8周治疗失败者)使用莫特塞尼治疗口服剂量胃125mg/d,连续48周或者出现严重不良反应及疾病恶化时停药。[20]
4. 结论和展望 随着分子生物学、免疫组织化学等基础学科的进展,GISTs的发生分子机制、病理学表现已得到了正确的认识,治疗方案也基本达成共识。但是更加精确的胃肠道间质瘤诊断方法以及危险度分级仍然是临床病理医师面临的重要课题,也是当今研究的重点。
参考文献: [1]朱玉萍,李德川,刘卓. 青少年胃肠道间质瘤研究进展. 国际肿瘤学杂志,2014,6,41(6):447
[2] Joensuu H, Hohenberger P, Corless C L. Gastrointestinal stromal tumour[J]. Lancet 2013;382:973-83.