方法开发报告: 2012-APP-RLC-018 2D-UHPLC 分析苦荞麦
- 格式:pdf
- 大小:907.99 KB
- 文档页数:10


荞麦和商品苦荞茶中总黄酮的含量测定一、背景介绍荞麦是一种传统的粮食作物,也是一种天然的保健食品。
荞麦中含有丰富的总黄酮,具有抗氧化、抗炎、降血糖、降血脂等多种保健功效。
商品苦荞茶是以苦荞为原料加工而成的茶类产品,同样富含总黄酮。
因此,测定荞麦和商品苦荞茶中总黄酮的含量对于了解其保健功效具有重要意义。
二、测定方法测定荞麦和商品苦荞茶中总黄酮的含量通常采用高效液相色谱法(HPLC)。
1. 样品制备将干燥的荞麦粉或商品苦荞茶粉称取5g左右,加入50ml乙腈-水(80:20)混合溶液中,在常温下超声提取30min,离心10min后收集上清液备用。
2. 色谱条件色谱柱:Kromasil C18(250mm×4.6mm)流动相:甲醇-乙腈-0.1%磷酸水溶液(15:30:55)流速:1.0ml/min检测波长:360nm3. 标准曲线绘制取总黄酮标准品,分别加入不同浓度的乙腈-水混合溶液中制成一系列浓度不同的标准溶液。
以每个浓度的标准溶液为样品进行HPLC测定,并绘制出标准曲线。
4. 样品检测将样品提取液过滤,取适量注入色谱柱中进行HPLC检测。
根据标准曲线计算出样品中总黄酮的含量。
三、结果分析经过HPLC检测,荞麦和商品苦荞茶中总黄酮的含量均较高。
其中,荞麦中总黄酮的含量一般在100-150mg/100g左右,而商品苦荞茶中总黄酮的含量则更高,一般在300-500mg/100g左右。
四、结论荞麦和商品苦荞茶均富含总黄酮,具有多种保健功效。
通过HPLC法可以快速、准确地测定其总黄酮含量,为进一步研究其保健功效提供了科学依据。

HPLC法测定苦荞茶中芦丁槲皮素的含量苦荞是我国独有的药食两用粮食作物,主要分布于我国内蒙古、陕西、甘肃、宁夏、四川、云南等高寒地区[1],近年来苦荞茶作为人们最热衷的保健饮品之一,在降低血压胆固醇,防治心脑血管疾病及高脂血症方面疗效显著[2]。
苦荞茶中富含黄酮类物质,其主要成分为芦丁、槲皮素等[3,4],能够降低毛细血管脆性,改善微循环功能,具有抑制肿瘤、防止衰老、降低血脂、增强免疫力、镇静止痛、保护心脏和肝脏等作用[5],在临床上主要用于糖尿病、高血压的辅助治疗[6,7]。
本实验通过优化提取工艺,进行了方法学考察,建立了苦荞茶的HPLC含量测定方法,并对不同苦荞茶中两种黄酮类组分进行了比较,为更好地控制苦荞茶的质量提供了一种简便、可行、重复性好的质量控制方法。
1、仪器与试药LC210AT型高效液相色谱仪(岛津公司),二极管阵列检测器,CLASS2vp510色谱数据处理工作站,CDT26A色谱柱温箱;SZ293型自动双重纯水蒸馏器。
芦丁、槲皮素对照品,由中国药品生物制品检定所提供。
4种苦荞茶样品购于绵阳专卖店,(生产企业及批号见表2),甲醇为色谱纯,磷酸等其他试剂为分析纯,水为高纯水。
2、方法与结果2.1 色谱条件色谱柱:SHIMDZU VP反相色谱柱;流动相:甲醇-0.08%磷酸溶液(6∶4);检测波长:360 nm;流速:0.95 mL?min-1;柱温:35℃。
进样量:5 µL。
在选定条件下,芦丁、槲皮素色谱峰与其他杂质峰达到基线分离,分离度(R)大于1.5,以芦丁、槲皮素计理论塔板数均不低于3500。
2.2 对照品溶液制备精密称量芦丁对照品8.0 mg、槲皮素对照品4.7 mg,分别置25 mL容量瓶,甲醇定容至刻度,分别精密吸取1 mL稀释10倍,制成每1 mL中含有32 µg芦丁18.8 µg槲皮素的混合对照品溶液。
2.3 供试品溶液制备取苦荞茶样品适量,研细,精密称定约0.5 g,置于25 mL锥形瓶中,加入甲醇15 mL,避光超声处理40 min,上清液转入25 mL容量瓶。



苦荞麦黄酮含量的测定概述苦荞麦是一种优质的谷物,其种子中含有丰富的黄酮类化合物。
黄酮类化合物具有多种生物活性,如抗氧化、抗炎、抗肿瘤等作用。
因此,测定苦荞麦黄酮含量对研究与应用苦荞麦具有重要意义。
本文将介绍苦荞麦黄酮含量的测定方法及其应用。
测定方法UV-Vis分光光度法1.准备样品:将苦荞麦样品研磨成粉末,称取适量样品备用。
2.提取黄酮:将样品加入乙醇中,超声处理30分钟,然后过滤得到提取液。
3.分光光度法测定:将提取液取一定体积,根据黄酮的最大吸收波长(通常为350nm),使用分光光度计测定吸光度。
4.绘制标准曲线:取不同浓度的黄酮标准溶液,进行相同测定步骤,得到吸光度与浓度的关系曲线。
5.计算黄酮含量:根据标准曲线,计算样品中黄酮的含量。
高效液相色谱法(HPLC)1.准备样品:将苦荞麦样品研磨成粉末,称取适量样品备用。
2.提取黄酮:将样品加入乙醇中,超声处理30分钟,然后过滤得到提取液。
3.色谱条件设置:选择适当的色谱柱和移动相,设置流速和梯度条件。
4.进样和检测:将提取液注入色谱仪中,通过检测器检测黄酮成分。
5.计算黄酮含量:根据标准品的峰面积和样品的峰面积,计算黄酮的含量。
比色法1.准备样品:将苦荞麦样品研磨成粉末,称取适量样品备用。
2.提取黄酮:将样品加入乙醇中,超声处理30分钟,然后过滤得到提取液。
3.获取吸收光谱:将提取液置于分光光度计中,获取100-500nm范围内的吸收谱。
4.分析计算:根据吸收峰的位置和强度,计算黄酮的含量。
应用苦荞麦黄酮具有多种生物活性,因此其含量的测定在食品、保健品、药品等领域具有广泛的应用。
保健品开发苦荞麦黄酮作为保健品的主要活性成分,测定其含量可以指导保健品的开发和生产,保证产品质量。
食品添加剂苦荞麦黄酮可以增强食品的营养价值和功能,测定其含量可以指导食品添加剂的添加量和使用效果。
药物研究苦荞麦黄酮具有抗氧化、抗炎、抗肿瘤等多种作用,测定其含量可以为药物研究提供依据,寻找新的药物开发方向。

苦荞中总黄酮的含量测定苦荞又称鞑靼荞麦(Tartary buckwheat),为双子叶蓼科荞麦属植物,在我国西南、北方种植广泛,资源丰富。
苦荞含有黄酮类化合物、多种氨基酸、多糖、不饱和脂肪酸等许多化学成分。
药理和化学成分的研究表明,苦荞具有较明显的降血糖、降血脂、增强免疫功能等作用,其有效成分主要是芦丁、槲皮素等黄酮类化合物。
民间亦以食用苦荞防治糖尿病、高血压、高血脂等病。
目前,荞麦黄酮的测定方法有分光光度法、高效液相色谱法、毛细管电泳法。
本实验采用芦丁法直接测定黄酮含量,并与另外两种显色后的分光光度法进行比较,期望为苦荞中总黄酮含量的测定提供参考。
1、材料、试剂与仪器1.1 材料与试剂材料:苦荞样品分别取自会泽火红、云南大山包、罗平牛街。
芦丁对照品(批号:09072231,上海同田生物技术XX 公司),试剂均为分析纯。
1.2仪器紫外可见分光光度计(北京普析,TU1810),超声提取器(上海仪器制造厂,SK3200H),电子天平(德国赛多利斯CP-224S)。
2、方法与结果2.1 对照品和样品溶液制备2.1.1对照品溶液的配制精密称取芦丁对照品9.5mg置于25mL容量瓶中,用甲醇溶解并定容至刻度,摇匀,即得芦丁对照品溶液浓度为0.38mg/mL。
2.1.2 供试品溶液的配制分别取苦荞粉末(过60 目筛)约100mg 精密称定,置于25mL容量瓶中,加入60%乙醇2mL在常温下超声(59KHz)提取20min,用乙醇稀释至刻度,摇匀,即得供试品溶液。
2.2 总黄酮含量测定2.2.1 标准曲线的制定2.2.1 芦丁法精密移取2.1.1 项下的对照品溶液0.5 、0.8 、1.0、1.2、1.5ml于25mL容量瓶中,用60%乙醇溶液稀释并定容至刻度后,在360mn波长处进行测定,绘制标准曲线,得到回归方程为:Y= 0.028X + 0.0172(r = 0.9998)。
2.2.1.2 氯化铝法精密移取2.1.1 项下的对照品溶液0.6 、0.7、0.8、0.9、1.0mL于25mL容量瓶中,加入60%乙醇溶液5mL 5%氯化铝溶液3mL, 100mg/mL乙酸钠溶液5mL,再用60% 乙醇溶液定容至刻度后,放置40min,在420mn波长处进行比色测定,绘制标准曲线,得到回归方程为:Y= 0.0365X + 0.0278(r=0.9994)。

金荞和苦荞黄酮含量变异及其特色保健茶的开发研
究的开题报告
一、研究背景与意义
金荞和苦荞是常见的食用粮食和保健品材料。
其中,金荞含有丰富
的黄酮类化合物和多种营养成分,具有降血脂、抑制肝癌、增强免疫力
等功效。
而苦荞中的苦味物质具有药用价值,可用于降血压、治疗糖尿病、解毒等。
因此,金荞和苦荞被广泛用于开发保健食品和药物。
但是,在金荞和苦荞的生长环境、处理方法、品种不同的情况下,
其成分含量存在较大的变异性,导致产品功效和质量的不稳定性。
因此,对金荞和苦荞的主要活性成分——黄酮类化合物的变异规律和影响因素
进行深入研究,对于保障金荞和苦荞产品质量、提高功能效果具有非常
重要的意义。
二、研究目标和方法
本研究的目标是:1)分析金荞和苦荞黄酮类化合物的含量变异规律,探究影响其含量变异的因素;2)开发基于金荞和苦荞的特色保健茶,并评估其保健作用和适口性。
本研究的方法包括:1)分析金荞和苦荞样品的黄酮类化合物含量,采用高效液相色谱(HPLC)进行分析;2)对采集样品的土壤、气象等环境参数进行监测和分析;3)采用 L9(3^4)正交设计方法考察金荞和苦荞加工处理方法及时间对其功能成分的影响;4)针对金荞和苦荞的特性进行茶叶制作工艺的优化,并开发具有良好口感和功能的保健茶产品。
三、研究预期结果
本研究预计能够:1)通过对金荞和苦荞的样品进行多维度分析,探究黄酮类化合物含量的变异规律和相关因素;2)开发出基于金荞和苦荞的特色保健茶,具有良好的风味和保健作用;3)提供金荞和苦荞生产过
程中优化功能成分含量的参考依据;4)为金荞和苦荞产品的科学开发提供参考。

2008,No.2 25 收稿日期;修回日期作者简介田 龙(),男,博士研究生,讲师,研究方向为仪器分析和食品分析。
苦荞中抗氧化物质分子结构的波谱学分析田 龙(南阳师范学院生命科学与技术学院,河南南阳 473061)摘 要:选择超声强化提取法提取苦荞黄酮,采用聚酰胺柱层析和制备薄层层析对苦荞黄酮提取液进行分离纯化,通过抗氧化活性比较,筛选出抗氧化活性最好的样品F3,运用高效液相色谱法、紫外光谱法、红外光谱法、液质联用法、核磁共振法,对样品F3进行结构分析,确定苦荞黄酮的主要成分为木犀草素。
关键词:苦荞;黄酮;抗氧化;分离纯化;光谱中图分类号:T Q91 文献标识码:A 文章编号:1003-6202(2008)02-0025-03Spectr um Ana lysi s on M olecul a r S tr uc ture of An tioxidan ts i n Fa gopyrum Ta ta r i cum Ga er tnABSTRAC T:The flavonoids of fag opyru m tataricu m gae rtn wa s extracted forcedly by ultrasonic,then separated and purified with poly 2am ide colu m n chro m atography and PT LC.Sample F3was selected by screen the anti oxida tive activit y and its struc ture wa s e l ucidated by UV,I R ,LC -M S,1H -NMR,13C -N MR ,and wa s identifi ed as Luteolin .KEY W O RD S:fagopyru m tataricu m gaertn;flav onoids ;anti 2oxida ti on;s epa ra ting and puri fying;s pectru m 荞麦富含高生物价的蛋白质、维生素、矿物质元素等,且含有丰富的生物活性成分———黄酮类化合物,尤其是苦荞,其黄酮含量较高,比甜荞高10~100倍,这是其它谷类粮食所不具有的,也是黄酮的重要膳食来源。

荞麦成分检测及其化学指纹图谱研究的开题报告一、研究背景荞麦是一种经济作物和重要的食品作物,在我国北方地区广泛种植。
其中,荞麦富含优质蛋白、植物脂肪、有机酸、微量元素、生物碱等多种营养物质,具有降血脂、降血压、降血糖、增强免疫力等良好的保健功效。
随着荞麦产品的日益普及,人们对荞麦品质与安全问题的关注日益提高。
目前,关于荞麦中主要成分的研究已经有所突破。
但是,对于不同品种及其生产地的荞麦,其成分组成和含量的差异性较大,目前常规的检测方法仍不能有效地解决这一难题。
因此,需要开展荞麦成分检测及其化学指纹图谱研究,为荞麦的品质评价、生产管理、食品安全监管等提供科学依据。
二、研究内容和方法(一)研究内容本研究拟开展荞麦成分检测及其化学指纹图谱研究,具体包括以下几个方面:1、不同生产地、不同品种的荞麦成分分析研究:通过对荞麦中主要成分的定量分析,比较各品种及其生产地在蛋白质、脂肪、糖类等方面的差异性。
2、荞麦化学指纹图谱研究:采用高效液相色谱-质谱联用技术(HPLC-MS)等现代化学分析方法,构建不同品种及其生产地的荞麦化学指纹图谱,为荞麦品种鉴定、地理区划及其品质评价提供科学依据。
3、荞麦品质评价研究:基于荞麦成分和化学指纹图谱的分析结果,系统评价不同品种及其生产地的荞麦品质。
(二)研究方法1、荞麦成分分析方法:包括蛋白质分析、脂肪分析、糖类分析等常规方法,采用光谱法、化学法等精确分析方法,定量分析荞麦中主要成分含量。
2、荞麦化学指纹图谱建立方法:采用高效液相色谱-质谱联用技术(HPLC-MS)等现代化学分析方法,对荞麦中的化学成分进行分析,建立不同品种及其生产地的荞麦化学指纹图谱。
3、荞麦品质评价方法:利用荞麦成分和化学指纹图谱的分析结果,综合评价不同品种及其生产地的荞麦品质,建立品质评价指标体系。
三、研究意义本研究的开展,将为荞麦品质评价、生产管理、食品安全监管等提供科学依据,具体体现在以下几个方面:1、为荞麦品种鉴定提供科学依据:荞麦化学指纹图谱的建立,可以实现对不同品种的荞麦进行快速鉴定。
·68·药品评价 Drug Evaluation 2021,18(02)苦荬菜Ixeris chinensis (Thunb.)Nakai为菊科植物山苦荬、抱茎小苦荬的新鲜或干燥全草,主要分布在浙江、江苏、广西、贵州、福建、湖南、江西、安徽等地,具有清热解毒,消肿排脓,凉血止血,生津止渴等功效。
在《湖南省中药材标准(2009版)》《藏药标准》均有收载苦荬菜,但缺少含量测定项,不足以控制其药材质量。
据文献报道[1-3],苦荬菜主要含有黄酮类、木质素类、萜类,此外还有有机酸类、甾醇类、苯丙素类等。
相关药理实验表明,苦荬菜具有抗菌、抗炎保肝、抗肿瘤、降脂、降糖的功效[4-10]。
苦荬菜分布广泛,营养成分丰富,化学成分较复杂,生理活性和药理活性较高,具有广阔的开发利用前景[11-14]。
但目前缺乏有效的质量控制,对苦荬菜的应用开发具有的一定的限制,因此,本研究在参考相关文献[15-16]基础上,首次建立了高效液相色谱测量苦荬菜中木犀草苷和菊苣酸含量的方法,该方法简单准确,可以为苦荬菜的质量标准研究提供参考。
1 材料与仪器岛津LC-20AT型高效液相色谱仪,AUW220D 型电子天平(十万分之一,日本岛津公司);BS224S 型电子天平(万分之一,Sartorius);KQ250DB型数控超声波清洗器(巩义市予华仪器有限责任公司);KQ5200型水浴锅(昆山市超声仪器有限公司)。
木犀草苷对照品(批号:111720-201810,中国食品药品检定研究院),菊苣酸对照品(批号:111752-201703,中国食品药品检定研究院),甲醇、高效液相色谱法测定苦荬菜中木犀草苷和菊苣酸的含量曾文辉1,龚千锋2,廖宝源31.江西省药品检查员中心赣南药品检查所,江西 赣州 341000;2.江西中医药大学,江西 南昌 330000;3.赣州市食品药品检验检测中心,江西 赣州 341000[摘要]目的:建立高效液相色谱法测定不同产地苦荬菜中木犀草苷和菊苣酸的含量。
HPLC检测苦荞制品中黄曲霉毒素B1的可行性探讨
林巧;巩发永;肖诗明
【期刊名称】《食品研究与开发》
【年(卷),期】2016(037)023
【摘要】本试验对HPLC测定苦荞制品中AFB1的可行性进行研究,研究HPLC 法测定黄曲霉毒素B1的标准曲线、准确度、精密度、系统误差、灵敏度,结果表明HPLC分析方法的检测范围0.20μg/L~200.00μg/L,判定系数R2=0.9968,各个数据的相对误差分别是7.09%、5.28%、4.55%、0.23%,苦荞芯粉平均加标回收率为84.58%,检测出苦荞面、苦荞羹、苦荞茶中黄曲霉毒素Bl的变异系数分别是9.36%、5.25%、8.22%。
检测灵敏度最低检测限0.20μg/L。
【总页数】4页(P146-149)
【作者】林巧;巩发永;肖诗明
【作者单位】西昌学院苦荞麦重点实验室,四川西昌 615000;西昌学院苦荞麦重点实验室,四川西昌 615000;西昌学院苦荞麦重点实验室,四川西昌 615000【正文语种】中文
【相关文献】
1.薄层层析法测定苦荞中黄曲霉毒素B1影响因素的研究 [J], 王雄;林巧;林璐;巩发永;肖诗明
2.羊乳以及羊奶粉中黄曲霉毒素M1和黄曲霉毒素B1的HPLC柱后碘衍生化法检测 [J], 陈娴;肖丽恒
3.贵州苦荞饭中黄曲霉毒素B1物理降解技术对比 [J], 刘辉; 卢扬; 唐建波; 刘嘉;
胡永平; 赵英彩; 刘军林; 李俊
4.酶联免疫法测定苦荞制品中的黄曲霉毒素B1 [J], 兰珊珊;陈锦玉;邵金良;杨芳;刘宏程
5.苦荞籽中黄曲霉毒素B1质量分数检测方法的研究 [J], 刘恒;王安虎;刘晓燕
因版权原因,仅展示原文概要,查看原文内容请购买。
离子色谱法测定苦荞系列产品中4种无机元素乌兰其其格;宝力道;赵玉英【摘要】采用离子色谱法同时测定苦荞粉、苦荞壳、苦荞叶、苦荞杆中Na、K、Ca、Mg等4种元素含量,并对元素进行了对比研究,同时对各元素进行了加标回收实验,苦养粉、苦养壳、苦养叶、苦荞杆中各元素的平均回收率在94.00%~102.7%,相对标准偏差(RSD)在0.88%~2.8%,测定范围为0.89~999.10 μg/L.实验建立了简便、快速、准确和稳定的测定苦养粉、苦荞壳、苦荞叶、苦荞杆中无机元素的方法.结果显示苦荞叶中Ca和Mg的含量均很高,分别为17208.8 mg/kg 和3954.5 mg/kg,苦荞壳中钾和钠含量很高,分别为4849.1 mg/kg和1269.2 mg/kg;在苦养叶中Ca、Mg等营养元素的含量较苦荞粉中的高,所以苦荞叶有开发应用价值.【期刊名称】《中国无机分析化学》【年(卷),期】2016(006)002【总页数】3页(P51-53)【关键词】离子色谱法;苦养粉;苦荞叶;同时测定【作者】乌兰其其格;宝力道;赵玉英【作者单位】赤峰学院化学化工学院,内蒙古赤峰024000;赤峰学院化学化工学院,内蒙古赤峰024000;内蒙古民族大学分析测试中心天然产物开发与废弃物利用研究所,内蒙古通辽028000【正文语种】中文【中图分类】O657.7+5;TH833荞麦属于蓼科属作物,有甜荞、苦荞、翅荞和米荞四种,其中甜荞和苦荞是主要的种植作物。
苦荞不但在高寒山区生长,在我国大多数地区都能生长。
苦荞富含蛋白质、黄酮类化合物、脂肪、维生素等有机物成分,还含有人体必需的多种常量及微量元素。
在粮食作物中唯有荞麦是食药兼用作物,具有良好抗氧化、抗衰老、降血糖、降血脂、调节内分泌系统和提高人体免疫力的作用,对糖尿病、冠心病等许多病症有良好的辅助疗效[1],目前被誉为理想的功能性食物源之一。
对苦荞中微量元素、氨基酸以及其它化学成分测定的报道较多[2-4],但对苦荞系列产品中的钠、钾等无机元素未见报道。
HPLC-DAD法同时测定苦荞麦保健品中芦丁槲皮素山奈酚含量任强;吴昊;聂其婷;刘伟【摘要】Objective To establish a high performance liquid chromatography with a diode array detector (HPLC-DAD)method for simultaneous determination of rutin,quercetin,and kaempferol in tartary buck-wheat functional food.Methods The chromatographic separation was performed on a TOSOH TSK gel ODS-1 00V (4.6 ×1 50mm,3.0μm)column.The mobile phase was composed of water containing 0.2% acetic acid (A)and acetonitrile (B)using gradient elution.The column temperature wasma intained at 35℃;the flow rate was set at 1 .0 ml/min;and UV absorbance was detected at a wavelength of 254 nm.Results The HPLC-DAD method was established and validated to determine the rutin,quercetin,and kaempferol in tartary buck-wheat functional food.The calibration curves of rutin,quercetin,and kaempferol were in the range of 1 0 ~500μg/ml,with good linearity (r2 >0.9997),repeatability (RSD<2.3%),precision(RSD<1 .5%),recovery (97.2%~1 02.8%),limit of detection (1μg/ml),and limit of quantification (5μg/ml).Conclusion The method is asimple,feasible,and accurate approach for the determination major flavonoids in tartary buck-wheat functional food.%目的:建立HPLC-DAD方法,同时测定苦荞麦保健品中芦丁、槲皮素及山奈酚的含量。
高效液相色谱法测定苦荞中的β-谷甾醇彭镰心;王姝;胡一冰;邹亮;邓丽君;饶轩臣;何鑫怡;赵钢【摘要】目的:建立HPLC法测定苦荞不同品种和不同部位β-谷甾醇含量.方法:色谱柱:Kromasil-ODS C18柱(250mm×4.6 mm,5μm),流动相:100%甲醇,检测波长:205 nm,流速:1 ml/min,柱温:30℃,进样量:20 μl.结果:β-谷甾醇在103~1854 μg(r=0.9999)线性良好,平均回收率为100.59%,RSD=2.05%(n=6),检测34个苦荞品种中β-谷甾醇含量范围为4.1 ~ 65.3 mg/100g,不同部位中苦荞麸皮β-谷甾醇含量最高,为116mg/100 g,最低的为心粉.结论:该方法准确可靠、简便快速,可用于苦荞的质量评价.【期刊名称】《西南民族大学学报(自然科学版)》【年(卷),期】2012(038)002【总页数】5页(P247-251)【关键词】高效液相色谱;苦荞;β-谷甾醇【作者】彭镰心;王姝;胡一冰;邹亮;邓丽君;饶轩臣;何鑫怡;赵钢【作者单位】成都大学生物产业学院,四川成都610106;四川农业大学生命科学与理学院,四川雅安625014;成都大学生物产业学院,四川成都610106;成都大学生物产业学院,四川成都610106;成都大学生物产业学院,四川成都610106;成都大学生物产业学院,四川成都610106;成都大学生物产业学院,四川成都610106;成都大学生物产业学院,四川成都610106【正文语种】中文【中图分类】R284β-谷甾醇是一种类固醇成分,广泛存在于自然界多种植物油和坚果中,具有抗炎、抗癌、抗氧化、抗艾滋病,预防和治疗高血压、冠心病和其他生理功能[1-3],β-谷甾醇的化学式为C29H50O,结构类似于血清胆固醇(图1).近年来,一些实验表明,荞麦种子的提取物能清除自由基和保护动物体内抗氧化酶的活性[4],能有效的降低动物的血脂[5-7],预防和辅助治疗糖尿病、心血管疾病、高血压[8-9],帮助消化[10].荞麦品种多[11],不同品种和不同部位的功能性成分含量不尽相同[12].目前,一般检测β-谷甾醇的方法有:HPLC-UV[13]、HPLC-ELSD[14]、GC[15]和TLCS[16].苦荞中的β-谷甾醇含量的测定未见文献报道,因此本文建立了苦荞中β-谷甾醇的检测方法,目的是通过比较苦荞及其不同部位中β-谷甾醇含量,评价苦荞的质量.1.1 仪器岛津LC-20A高效液相色谱; ESJ120-4型电子分析天平.1.2 试剂β-谷甾醇标准品(西南民族大学,HPLC-ELSD检测纯度为95.3%),甲醇为色谱纯,水为重蒸水,其他试剂均为分析纯.1.3 材料米荞1号,由成都大学赵钢教授通过对苦荞种子的物理和化学诱变筛选获得,并于2009年通过四川省农作物品种审定委员会审定.其他品种见表1.材料经过干燥、粉碎,通过60目筛,心粉通过200目筛.2.1 色谱条件色谱柱:Kromasil-ODS C18柱(250 mm ×4.6 mm,5 μm),流动相:100%甲醇,检测波长:205nm,流速:1 ml/min,柱温:30 ℃,进样量:20 μl.2.2 溶液制备2.2.1 对照品溶液的制备精密称取β-谷甾醇适量,置10 ml容量瓶中,加甲醇溶解并定容至刻度,摇匀,配制成1.03 mg/mlβ-谷甾醇对照品溶液.2.2.2 供试品溶液的制备精密称取干燥粉末(过60目筛)3 g于100 ml具塞锥形瓶,加入50 ml甲醇和10 ml 10% HCl,称重.85 ℃水浴回流1.5h,放至室温,加甲醇补足损失的重量,摇匀,过滤,取25 ml续滤液挥干,加甲醇溶解,定容至10 ml,用0.45 μm微孔滤膜过滤,即得.2.3 方法学考察2.3.1 线性关系考察取β-谷甾醇对照品溶液(1.03 mg/ml),分别进样1 μl,2 μl,6 μl,10 μl,14 μl,18 μl.以峰面积积分值为纵坐标,进样量(μg)为横坐标绘制标准曲线,得回归方程为Y=362310X-6324.9,r=0.9999.线性范围为:103~1854 μg.2.3.2 精密度试验取β-谷甾醇对照品溶液,按上述色谱条件,连续进样测定5次,每次进样20 μl,记录峰面积,RSD=1.42%(n=5).表明仪器误差小,精密度高.2.3.3 重复性试验取米荞1号粉末6份,每份3g,精密称定,按“样品溶液的制备”项下的方法制备供试品,按上述色谱条件进行测定,计算各样品中β-谷甾醇含量分别为0.284 mg/g、0.281 mg/g、0.279 mg/g、0.288 mg/g、0.280 mg/g、0.276mg/g,RSD=1.35%(n=5).RSD<5%,重复性良好.2.3.4 稳定性试验取米荞1号供试品溶液,分别于0、2、4、6、8和24 h按上述色谱条件进行测定,结果各次进样测得的峰面积值分别为128279、128707、128109、127980、127991、128598,RSD=0.22%,表明样品在24 h内稳定.2.3.5 回收率试验分别精密称取已知含量的米荞1号粉末1.5 g,共6份,各加入β-谷甾醇对照品甲醇溶液(0.1 mg/ml)4 ml,按“样品溶液的制备”项下的方法制备供试品,按上述色谱条件进行测定,结果β-谷甾醇含量平均回收率100.59%,RSD=2.05%.2.4 样品溶液的测定2.4.1 苦荞不同品种β-谷甾醇含量的测定取不同品种苦荞粉末各3 g,精密称定,按“样品溶液的制备”项下的方法制备供试品,按上述色谱条件进行测定,计算各样品中β-谷甾醇含量,结果见表2,色谱图见图2.2.4.2 苦荞不同部位β-谷甾醇含量的测定对苦荞5个不同部位:茎、根、麸皮、全粉、心粉中β-谷甾醇进行检测,结果见表3.由表2可见,34个苦荞品种β-谷甾醇含量范围为4.1~65.3mg/100g,不同品种β-谷甾醇含量有较大差异.其中甘肃珀姓β-谷甾醇含量最高(0.653mg/g),额拉β-谷甾醇含量最低(0.041 mg/g),前者是后者的16倍.由表3可见,苦荞麸皮β-谷甾醇含量最高,为116 mg/100 g,最低的为心粉,因此苦荞麸皮有很好的利用前景.本文对β-谷甾醇的提取溶媒、提取时间、提取方式及盐酸浓度进行了比较,结果表明以甲醇:10% HCl(50:10)回流提取1.5 h效果最好.本文建立的方法准确可靠,可用于苦荞的质量评价.【相关文献】[1] 肖松明.β-谷甾醇及其葡萄糖苷抗大鼠实验性胃溃疡的研究[J].华西医科大学学报,1992,23(1):98-101.[2] 吴时敏.功能性油脂[M].北京:中国轻工业出版社,2001.[3] 王建新.天然活性化妆品[M].北京:中国轻工业出版社,1997.[4] WOJCICK J.Effect of extraction of buckwheat on the production of free radical in rabbits of high fat diet[J].Foreign Medical Sciences,1996,18:44-45.[5] 杨林,成国才,陈立国.荞麦对大鼠血清脂质过氧化作用影响的实验研究[J].中国公共卫生学报,1992,11:288-230.[6] 李茂言,何利城,吴志成,等.荞秸果胶对高脂血症大鼠调脂作用的实验研究[J].中成药,1999,21:135-137.[7] 张政,王转花,刘凤艳,等.苦荞蛋白复合物的营养成分及其抗衰老作用的研究[J].营养学报,1999,21:159-161.[8] 张宏伟,张永红,卢明俊.荞麦与血糖有关的流行病学研究[J].中国公共卫生,1999,5:392-393.[9] 武素平,鲁纯静.荞麦面对血脂及脂肪肝影响的动物实验[J].食品科学,1988,2:10-11.[10] KAYASHITA J,SHIMAOKA I,NAKAJOH M,ed al.Feeding of buckwheat protein extract reduces hepatic triglyceride concentration,adipose tissue weight,and hepatic lipogenesis in rats[J].J Nutr biochem,1996,555-559.[11] 林汝法,柴岩,廖琴,等.中国小杂粮[M].北京:中国农业科学技术出版社,2002:27-28,51-53.[12] 彭镰心,勾秋分,邹亮,等.HPLC法测定不同品种苦荞麦中的手性肌醇[J].中草药,2009(40)S:279-281.[13] CARERI M,ELVIRI L,MANGIA A.Liquid chromatography-UV determination and liquid chrom-atography-atomosperic pre-ssure chemical ionization mass spectrometric characterization of sitosterol and stigmasterol in soybean oil[J].J Chro-matogrA,2001,935(2):249-257.[14] 刘凤萍,戴华,李拥军,等.高效液相色谱-蒸发光散射检测器测定五种甾醇含量[J].分析科学学报,2002,18 (3):230-233.[15] 戴玲妹,祝心茹,赵天贵.维生素E中游离甾醇的气相色谱分析[J].中国油脂,2000,25(3):41.[16] ABIDI S L.Chromatographic analysis of plant sterols in food and vegetable oils[J].J Chrom-atogr A,2001,935 (2):173-201.。
HPLC法测定贵州苦荞麦种皮中槲皮素含量
方玲芬
【期刊名称】《贵阳中医学院学报》
【年(卷),期】2009(031)004
【摘要】目的:建立贵州苦荞麦种皮中槲皮素含量测定方法.方法:采用反相高效液相色谱法,固定相为十八烷基硅烷键舍硅胶,流动相为甲醇-0.4%磷酸(50:50),检测波长为360nm.结果:用本方法测定槲皮索线性范围为8.816μg-79.344μgmL-1,相关系数r为0.99199,平均加样回收率为99.01%,隅D为0.82%(n=9).结论:该方法简单、可靠,能有效提取样品中槲皮素的含量.
【总页数】3页(P71-73)
【作者】方玲芬
【作者单位】贵州省药品检验所,贵州贵阳,550004
【正文语种】中文
【中图分类】R927.2
【相关文献】
1.HPLC法测定蒙药材胡枝子不同部位中槲皮素的含量 [J], 郑敏;陈广荣;张栓珍;刘静
2.HPLC法测定杠板归中槲皮素-3-O-β-D-葡萄糖醛酸及槲皮素的含量 [J], 范东生;赵超;陈华国;周欣;龚小见;赵杨;杨世林
3.HPLC-DAD法同时测定苦荞麦保健品中芦丁槲皮素山奈酚含量 [J], 任强;吴昊;聂其婷;刘伟
4.HPLC法测定滇柴胡中槲皮素和异鼠李素的含量 [J], MA Yuexin;LIU Qian;WU Yongkang
5.HPLC法测定排石颗粒中槲皮素和山奈素含量 [J], 刘彬果;叶盛英
因版权原因,仅展示原文概要,查看原文内容请购买。
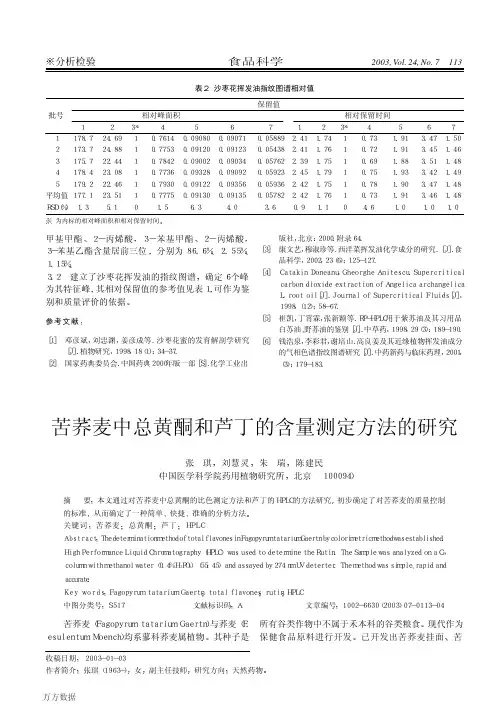
方法开发报告:2012-APP-RLC-0182D-UHPLC分析苦荞麦中12个主要化学成分(LC-UV)(1为Quercetin-3-O-β-D-galactoside,2为Quercetin-3-O-β-D-glucoside, 3为Kaempferol-3-O-β-D-galactoside,4为N-trans-feruloyltyramine, 5为Kaempferol-3-O-β-D-glucoside, 6为Quercetin-3-O-α-L-rhamnoside, 7为Quercetin-3-O-[β-D-xyloxyl-(1→2)-α-L-rhamnoside],8为1, 3, 6-tri-p-coumaroyl-6′-feruloyl sucrose, 9为3,6-di-p-coumaroyl-1, 6-di-feruloyl sucrose, 10为1, 6,6′-tri-feruloyl-3-p-coumaroyl sucrose,11为1, 3, 6,126′-tetra-feruloyl sucrose,12为rutin)苦荞麦又名乌麦、花麦、三角麦,是蓼科取苦荞麦药材粉末0.1000 g, 精密称定,置具塞圆底玻璃试管中,精密加入70% 乙醇2 mL ,密塞,称定重量。
室温浸泡30 min 后,超声处理(功率100W ,频率40 kHZ )30min ,放冷,再称定重量,用70%乙醇补足减失的重量,摇匀,4500 rpm 离心10 min 。
用0.22μm 微孔滤膜过滤,作为供试品溶液。
3. 标准曲线和线性范围取系列浓度的标准曲线样品,从低浓度到高浓度连续进样,以被测物浓度(X )为横坐标,被测物的峰面积之比(Y )为纵坐标,按最小二乘法进行标准曲线的I C -10 0m m拟合,获得标准曲线线性回归方程和线性相关系数r2值。
结果见表1。
结果表明,12个化学成分在各自考察的浓度范围内,线性关系良好,线性相关系数r2均大于0.999。
表1 Calibration curves, LOD and LOQ data of investigated compounds by 2D-UHPLCAnalytes Calibration curves a r2Linearrange(μg/m l)LOD(μg/ml)LOQ(μg/ml)1. Quercetin-3-O-rutinoside y =0.1258x -0.1089 0.99971.02 -162.800.20 0.302. Quercetin-3-O-β-D-galactoside y =0.1582x -0.0800 0.99960.50 -80.800.15 0.203. Quercetin-3-O-β-D-glucoside y =0.1319x -0.1375 0.99951.03 -165.200.21 0.414. Kaempferol-3-O-β-D-galactoside y =0.1956x -0.0660 0.99980.52 -82.400.10 0.215. N-trans-feruloyltyramine y =0.5018x -0.2307 0.99960.52 -83.600.05 0.166. Kaempferol-3-O-β-D-glucoside y =0.1932x -0.1552 0.99961.01 -162.00.10 0.307. Quercetin-3-O-α-L-rhamnoside y =0.1700x -0.1644 0.99961.0 -160.00.20 0.408. Quercetin-3-O-[β-D-xyloxyl-(1→2)-α-L- rhamnoside]y =0.1288x -0.14290.99941.01 -161.200.20 0.409. 1, 3, 6-tri-p-coumaroyl-6′-feruloyl sucrosey =0.5425x -0.15720.99950.26 -42.200.05 0.1010. 3, 6-di-p-coumaroyl-1, 6-di-feruloyl sucrosey =0.5627x -0.16270.99950.25 -40.00.05 0.1011. 1, 6, 6′-tri-feruloyl-3-p-coumaroyl sucrosey =0.5642x -0.33070.99950.49 -78.800.05 0.1512. 1, 3, 6, 6′-tetra-feruloyl sucrose y =0.4061x -0.1296 0.99960.24 -39.200.07 0.12a y is the logarithmic value of peak area and x is the logarithmic value of the reference compound’s concentration (μg/ml).4.精密度和质控样品溶液稳定性通过测定日内及日间质控样品浓度变化来验证方法的精密度,测定低、中、高三种不同浓度的质控样品,将峰面积带入相应的标准曲线计算浓度,日内精密度实验中质控样品连续测定6次,日间精密度实验中质控样品每天测定1次,连续测定6天,测定浓度的RSD作为衡量精密度的指标。
结果表明(Table 2)所建立的分析方法日内精密度RSD小于3.3%,日间精密度RSD小于3.9%。
82.60 2.3 2.0 2.4 2.01.032.83.14.1 3.14. Kaempferol-3-O-β-D-galactoside5.15 3.3 3.0 2.9 3.041.20 2.5 3.8 2.8 3.81.04 0.3 0.9 0.6 0.95. N-trans-feruloyltyramine 5.22 2.8 3.7 2.8 3.741.80 2.6 3.9 2.8 3.92.02 1.9 1.3 1.3 1.36. Kaempferol-3-O-β-D-glucoside10.12 2.6 3.1 2.9 3.181.0 2.5 3.6 2.7 3.62.0 1.4 1.9 1.8 1.97. Quercetin-3-O-α-L-rhamnoside10.0 2.3 2.0 2.1 2.080.0 2.8 2.8 2.9 2.82.02 0.9 2.1 2.1 2.1 8. Quercetin-3-O-[β-D-xyloxyl-(1→10.083.0 0.9 2.5 0.9 2)-α-L- rhamnoside] 80.60 2.6 2.3 2.6 2.30.53 2.0 2.1 1.7 2.1 9. 1, 3, 6-tri-p-coumaroyl-6′-feruloyl 2.64 2.4 3.3 2.3 3.3 sucrose 21.10 2.5 3.0 2.6 3.00.50 2.3 2.9 2.3 2.9 10. 3, 6-di-p-coumaroyl-1, 6-di- 2.50 2.4 3.3 2.4 3.3 feruloyl sucrose 20.0 2.6 2.5 2.5 2.50.98 1.1 1.4 1.0 1.4 11. 1, 6, 6′-tri-feruloyl-3-p- 4.92 2.5 3.0 2.6 3.0Stability StabilityRSD (%) (n=6) RSD (%)(n=6)RSD (%) (n=6)1. Quercetin-3-O-β-D-galactoside 1.0 1.12.32. Quercetin-3-O-β-D-glucoside 1.8 2.3 1.03. Kaempferol-3-O-β-D-galactoside 2.5 2.7 3.24. N-trans-feruloyltyramine 1.2 1.9 0.95. Kaempferol-3-O-β-D-glucoside 1.8 2.7 0.86. Quercetin-3-O-α-L-rhamnoside 3.2 4.4 3.37.Quercetin-3-O-[β-D-xyloxyl-(1→2)-α-L-rhamnoside]1.1 3.02.0 8. 1, 3, 6-tri-p-coumaroyl-6′-feruloyl sucrose 1.3 2.0 1.49. 3, 6-di-p-coumaroyl-1, 6-di-feruloyl sucrose 1.1 1.8 0.810. 1, 6, 6′-tri-feruloyl-3-p-coumaroyl sucrose 1.4 1.7 0.911. 1, 3, 6, 6′-tetra-feruloyl sucrose 1.8 2.0 1.16.回收率称取苦荞麦茎粉末9份,称取量为样品测定时称样品量的二分之一,按各测定化合物含量的1:0.5(低)、1:1(中)、1:1.5(高)的比例加入各对照品贮备液,每个浓度制备3份,按样品前处理方法处理后,进行2D-UHPLC分析,带入标准曲线,计算回收率。
结果见表4,12个待测成分的回收率均在91.21%~107.76%37.39 18.22 54.92 96.21±0.03 3.5 6. Kaempferol-3-O-β-D-glucoside 37.39 36.45 71.46 93.47±0.03 3.237.39 54.68 93.01 101.72±0.01 0.634.47 18.0 52.17 100.51±0.05 4.9 7. Quercetin-3-O-α-L-rhamnoside 34.47 36.0 71.36 102.47±0.02 1.934.47 54.0 88.32 99.72±0.02 2.439.29 18.14 56.52 95.00±0.04 4.1 8. Quercetin-3-O-[β-D-xyloxyl-(1→39.29 36.27 76.35 102.18±0.02 2.02)-α- L-rhamnoside] 39.29 54.4 93.08 98.88±0.03 2.95.48 4.75 10.72 107.73±0.04 3.6 9. 1, 3, 6-tri-p-coumaroyl-6′-feruloyl 5.48 9.50 14.88 98.92±0.03 3.4sucrose 5.48 14.24 20.17 103.17±0.02 1.710.43 4.5 15.33 107.76±0.02 1.8 10. 3, 6-di-p-coumaroyl-1,6-di- 10.43 9.0 19.23 97.80±0.02 2.4feruloyl sucrose 10.43 13.5 23.82 99.17±0.03 3.218.96 8.86 27.81 101.22±0.03 3.3 11. 1, 6, 6′-tri-feruloyl-3-p- 18.96 17.73 37.12 102.41±0.02 1.6coumaroyl sucrose 18.96 26.6 44.79 97.12±0.01 1.011.23 4.41 15.87 105.11±0.04 3.612. 1, 3, 6, 6′-tetra-feruloyl sucrose 11.23 8.82 19.66 97.41±0.04 4.411.23 13.23 24.01 96.58±0.03 2.7 Recovery (%) = 100×(amount found – original amount)/ amount spiked.a The values were means ± S.D. of three experiments.7.8.苦荞麦茎2D-UHPLC色谱图图2 12个对照品色谱图LQ-root 0.08 - - - 0.09 - 0.12 - 0.56 0.56 0.44 0.32 LQ-stem 0.86 - 0.04 0.04 0.02 - 0.07 - 0.16 0.13 0.18 0.08 LQ-leaf 33.41 - 0.33 0.65 0.02 - 0.06 - 0.01 0.01 0.02 0.01 SZ-herb 3.10 0.30 0.51 - 0.03 0.02 0.05 - 0.02 0.15 0.05 0.04 SZ-root 0.23 0.56 0.35 - - - 0.29 - 0.09 1.19 0.22 0.12 SZ-stem 1.15 0.49 0.41 - 0.06 - 0.09 - 0.02 0.19 0.07 0.06 SZ-leaf 36.95 - 0.63 - - 0.16 0.09 - - 0.04 - - 09-herb 1.62 0.17 0.32 - 0.09 - - - 0.04 0.06 0.07 0.03 09-root 0.08 0.08 0.10 - 0.03 - - - 0.35 0.52 0.52 0.20 09-stem 0.57 0.29 0.46 - 0.12 - - - 0.06 0.09 0.10 0.04 09-leaf 8.07 - 0.25 - 0.07 - - - - - - - 08-herb 1.60 0.11 0.50 - - - - - - 0.02 0.03 0.0208-root 0.25 0.12 0.28 - - - - - 0.06 0.16 0.18 0.12 08-stem 1.49 0.18 0.44 - - - - - 0.01 0.04 0.04 0.04 08-leaf 2.98 0.07 0.17 - - - - - 0.01 0.03 0.03 0.03 1. Quercetin-3-O-rutinoside, 2.Quercetin-3-O-β-D-galactoside, 3.Quercetin-3-O-β-D- glucoside, 4.Kaempferol-3-O-β-D-galactoside,5.N-trans-feruloyltyramine, 6. Kaempferol-3-O-β-D-glucoside, 7. Quercetin-3-O-α-L-rhamnoside, 8. Quercetin-3-O-[β-D-xyloxyl-(1→2)-α-L-rhamnoside]9. 1, 3, 6-tri-p-coumaroyl-6′-feruloyl sucrose, 10. 3, 6-di-p-coumaroyl-1, 6-di-feruloyl sucrose, 11. 1, 6, 6′-tri-feruloyl-3-p-coumaroyl sucrose, 12. 1, 3, 6, 6′-tetra-feruloyl sucrose10.可行性建议本方法使用Acclaim HILIC-10 把苦荞麦全草部分分成两部分分别使用Acclaim PAII和Acclaim Phenyl-1分析柱进行二维分析,对于我们的目标化合物得到了理想的分离状态,对于其他干扰物也能达到很好的分离,对于苦荞麦全草的分析提供了有力的条件。