结晶水含量测定的原理
- 格式:pptx
- 大小:542.32 KB
- 文档页数:13

实验一硫酸铜晶体中结晶水含量的测定(1)测定原理:CuSO4·5H2O中,Cu(H2O)42+与SO42-·H2O,其中前者是蓝色的,后者是_______色的。
5个水分子与CuSO4结合力是__________,在383 K时,Cu(H2O)42+失去4个水分子,在531 K时,才能使_________中的水失去。
(2)测定标准记量:如果用w为托盘天平称量坩埚的质量,w2为坩埚与晶体的总质量,w3是无水CuS04与坩埚再加热,放在干燥器中冷却后的质量。
设x为结晶水的物质的量,则计算x的数学表达式为值只有在4.9-5.1之间,才表明实验是成功的。
(3)测定误差分析:你认为在_________条件下会导致实验失败。
你认为产生误差的可能情况有哪些? (至少写五种)问题:脱水后的白色CuSO4粉未为什么要放在干燥器中冷却?重点点拨做此实验如果没有瓷坩埚、坩埚钳、铁架台等仪器,可用试管和试管夹代替来做,步骤如下:①用天平准确称量出干燥试管的质量,然后称取已研碎的CuSO4·5H2O并放入干燥的试管。
CuSO4·5H2O应铺在试管底部。
②把装有CuS04·5H20的试管用试管夹夹住,使管口向下倾斜,用酒精灯慢慢加热。
应先从试管底部加热,然后将加热部位逐步前移,至CuS04·5H2O完全变白:当不再有水蒸气逸出时,仍继续前移加热,使冷凝管在试管壁上的水全部变成气体逸出。
③待试管冷却后,在天平上迅速称出试管和CuSO4的质量。
④加热,再称量,至两次称量误差不超过0.1为止。
问题:该实验为什么以两次称量误差不超过0.1 g(即(0.1 g)作为标准?答:用加热的方法除去CuSO4·5H2O中的结晶水,为了避免加热时间过长或温度过高造成的CuS04分解,就不可避免的没有使CuSO4·5H2O中结晶水全部失去,这势必会造成新的误差。
为此,本实验采取了多次加热的方法,以尽可能的使晶体中的结晶水全部失去。

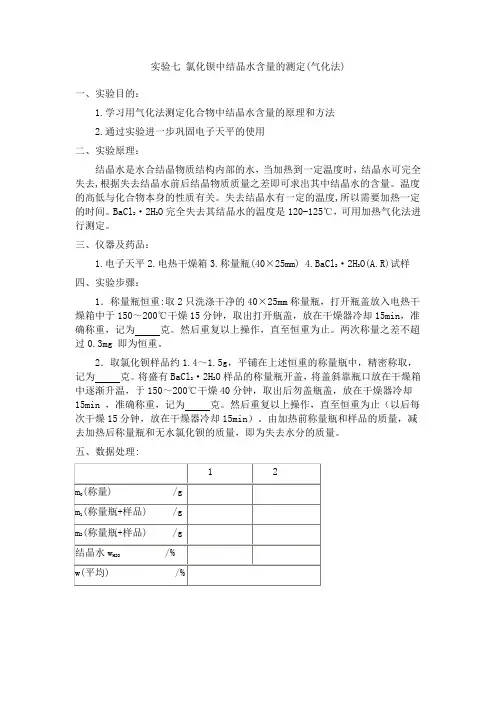
实验七氯化钡中结晶水含量的测定(气化法)一、实验目的:1.学习用气化法测定化合物中结晶水含量的原理和方法2.通过实验进一步巩固电子天平的使用二、实验原理:结晶水是水合结晶物质结构内部的水,当加热到一定温度时,结晶水可完全失去,根据失去结晶水前后结晶物质质量之差即可求出其中结晶水的含量。
温度的高低与化合物本身的性质有关。
失去结晶水有一定的温度,所以需要加热一定的时间。
BaCl2·2H2O完全失去其结晶水的温度是120-125℃,可用加热气化法进行测定。
三、仪器及药品:1.电子天平2.电热干燥箱3.称量瓶(40×25mm)4.BaCl2·2H2O(A.R)试样四、实验步骤:1.称量瓶恒重:取2只洗涤干净的40×25mm称量瓶,打开瓶盖放入电热干燥箱中于150~200℃干燥15分钟,取出打开瓶盖,放在干燥器冷却15min,准确称重,记为克。
然后重复以上操作,直至恒重为止。
两次称量之差不超过0.3mg 即为恒重。
2.取氯化钡样品约1.4~1.5g,平铺在上述恒重的称量瓶中,精密称取,记为克。
将盛有BaCl2·2H2O样品的称量瓶开盖,将盖斜靠瓶口放在干燥箱中逐渐升温,于150~200℃干燥40分钟,取出后勿盖瓶盖,放在干燥器冷却15min ,准确称重,记为克。
然后重复以上操作,直至恒重为止(以后每次干燥15分钟,放在干燥器冷却15min)。
由加热前称量瓶和样品的质量,减去加热后称量瓶和无水氯化钡的质量,即为失去水分的质量。
五、数据处理:六、注意事项:(1)称取的BaCl2·2H2O样品在放入烘箱前应水平方向轻摇称量瓶,使堆积的样品平铺于瓶底而利于干燥, 烘干时应将瓶盖斜放于瓶口(2)从烘箱中取物时小心烫伤,烘干物品不可直接用手接触(3)烘干物品在干燥器中放置至室温时方可称量, 且每次放置时间应一致(4)称量烘干物品应称一个就从干燥器中取一个, 而且称量速度要快,不可一次全部取出(称量后是否放回干燥器中应视实验具体情况而定)(5)可溶性钡盐有毒(6)称量应准确至0.0001mg(小数点后第4位)(7)在加热的情况下,称量瓶盖子不要盖严,以免冷却后盖子不易打开。

胆矾结晶水的测定实验报告实验目的,通过实验测定胆矾结晶中的水含量,掌握水含量的测定方法及实验操作技能。
实验原理,胆矾是一种含水量较高的固体,通过加热胆矾,可以使其中的水分蒸发出来,从而测定胆矾中水的含量。
利用胆矾的质量损失来计算水的含量。
实验仪器和试剂,胆矾样品、烧杯、天平、酒精灯、玻璃棒。
实验步骤:1. 取一定质量的胆矾样品,记录下其质量为m1。
2. 将胆矾样品放入烧杯中,并记录下烧杯的质量为m2。
3. 将烧杯放在酒精灯上加热,加热至胆矾完全失去水分,直至不再有水蒸气冒出。
4. 关闭酒精灯,待烧杯冷却后,记录下烧杯和干燥胆矾样品的总质量为m3。
5. 用玻璃棒搅拌胆矾,使其均匀受热。
6. 重复以上步骤,直至连续两次称量的质量差异小于0.005g。
实验数据处理:1. 胆矾样品的质量损失量Δm=m2-m3。
2. 胆矾样品中水的质量为m=Δm。
3. 胆矾样品中水的质量分数w(%)=m/m1×100%。
实验结果,通过实验测定,得到胆矾样品中水的质量分数为w(%)=m/m1×100%。
实验结论,通过本次实验,我们成功测定了胆矾结晶中水的含量,并掌握了水含量的测定方法及实验操作技能。
这对我们理解固体中水含量的测定方法具有重要意义。
实验注意事项:1. 实验中要注意安全,避免烧伤和其他意外。
2. 实验操作要仔细,确保实验数据的准确性。
3. 实验结束后,要及时清理实验仪器和试剂,保持实验环境整洁。
实验改进方向:1. 可以尝试使用其他方法测定胆矾结晶中水的含量,比较不同方法的优缺点。
2. 可以尝试改变实验条件,探索对实验结果的影响。
通过本次实验,我们对胆矾结晶水的测定方法有了更深入的了解,同时也提高了我们的实验操作技能,为今后的实验研究奠定了基础。


实验七氯化钡中结晶水含量的测定(气化法)一、实验目的:1.学习用气化法测定化合物中结晶水含量的原理和方法2.通过实验进一步巩固电子天平的使用二、实验原理:结晶水是水合结晶物质结构内部的水,当加热到一定温度时,结晶水可完全失去,根据失去结晶水前后结晶物质质量之差即可求出其中结晶水的含量。
温度的高低与化合物本身的性质有关。
失去结晶水有一定的温度,所以需要加热一定的时间。
BaCl2·2H2O完全失去其结晶水的温度是120-125℃,可用加热气化法进行测定。
三、仪器及药品:1.电子天平2.电热干燥箱3.称量瓶(40×25mm)4.BaCl2·2H2O(A.R)试样四、实验步骤:1.称量瓶恒重:取2只洗涤干净的40×25mm称量瓶,打开瓶盖放入电热干燥箱中于150~200℃干燥15分钟,取出打开瓶盖,放在干燥器冷却15min,准确称重,记为克。
然后重复以上操作,直至恒重为止。
两次称量之差不超过0.3mg 即为恒重。
2.取氯化钡样品约1.4~1.5g,平铺在上述恒重的称量瓶中,精密称取,记为克。
将盛有BaCl2·2H2O样品的称量瓶开盖,将盖斜靠瓶口放在干燥箱中逐渐升温,于150~200℃干燥40分钟,取出后勿盖瓶盖,放在干燥器冷却15min ,准确称重,记为克。
然后重复以上操作,直至恒重为止(以后每次干燥15分钟,放在干燥器冷却15min)。
由加热前称量瓶和样品的质量,减去加热后称量瓶和无水氯化钡的质量,即为失去水分的质量。
五、数据处理:六、注意事项:(1)称取的BaCl2·2H2O样品在放入烘箱前应水平方向轻摇称量瓶,使堆积的样品平铺于瓶底而利于干燥, 烘干时应将瓶盖斜放于瓶口(2)从烘箱中取物时小心烫伤,烘干物品不可直接用手接触(3)烘干物品在干燥器中放置至室温时方可称量, 且每次放置时间应一致(4)称量烘干物品应称一个就从干燥器中取一个, 而且称量速度要快,不可一次全部取出(称量后是否放回干燥器中应视实验具体情况而定)(5)可溶性钡盐有毒(6)称量应准确至0.0001mg(小数点后第4位)(7)在加热的情况下,称量瓶盖子不要盖严,以免冷却后盖子不易打开。



五水硫酸铜结晶水含量的测定一、实验目的要求:1.了解制备五水硫酸铜晶体的方法。
2.测定硫酸铜的结晶水含量。
二、实验内容:1.五水硫酸铜的提纯。
2.五水硫酸铜晶体自由水的脱去。
3.测定硫酸铜晶体里的结晶水含量。
三、主要仪器设备及药品:仪器设备:电子天平,称量瓶,不锈钢锅(薄壁,内装食盐用于盐浴),温度计(量程在350℃,测量盐浴温度),烘箱(烘干自由水),电炉,滤纸,皮筋。
药品:五水硫酸铜,3公斤食盐左右(用于盐浴加热),无水乙醇。
四、实验原理五水硫酸铜结构:图1 CuSO4·5H2O的晶体结构一般性质硫酸铜CuSO4(硫酸铜晶体:CuSO4·5H2O)分子量249.68。
深蓝色大颗粒状结晶体或蓝色颗粒状结晶粉末,略透明。
有毒,无臭,带有金属涩味。
密度2.2844g/cm-3。
干燥空气中会缓慢风化。
易溶于水,水溶液呈弱酸性。
不溶于乙醇,缓缓溶于甘油。
150℃以上将失去全部水结晶成为白色粉末状无水硫酸铜。
五水硫酸铜有极强的吸水性,把它投入95%乙醇成含水有机物(即吸收水分)而恢复为蓝色结晶体。
失水过程五水硫酸铜晶体失水分三步。
上图中两个仅以配位键与铜离子结合的水分子最先失去,大致温度为102摄氏度。
两个与铜离子以配位键结合,并且与外部的一个水分子以氢键结合的水分子随温度升高而失去,大致温度为113摄氏度。
最外层水分子最难失去,因为它的氢原子与周围的硫酸根离子中的氧原子之间形成氢键,它的氧原子又和与铜离子配位的水分子的氢原子之间形成氢键,总体上构成一种稳定的环状结构,因此破坏这个结构需要较高能量。
失去最外层水分子所需温度大致为258摄氏度。
五、实验步骤:1、在常温下将适量的CuSO4溶解于少量的水中,配置成过饱和溶液,倒掉上层溶液,取未溶解的五水硫酸铜加少量水洗涤三次,再用无水乙醇洗涤三次,将所得试剂尽量滴干(为节约实验时间,可用滤纸将大部分自由水吸干)。
2、将1所得试剂加入称量瓶(不带瓶盖)中,再覆盖上滤纸和皮筋,称重(事先称量无盖称量瓶、滤纸和皮筋的总质量为m0)。

一、实验原理结晶水合物受热能够失去结晶水,硫酸铜晶体(蓝色)在110℃开始失去部分结晶水,150℃时失去全部结晶水,生成白色的无水硫酸铜。
650℃硫酸铜分解成黑色的氧化铜。
CuSO 4·xH 2O −→−∆CuSO 4 + xH 2OCuSO 4 −−→−℃650 CuO + SO 3x O H m CuSO m :118)(160)(24=:24160m(H O)x 18m(CuSO )=22118)(160m m m x -=式中:m 1=m(CuSO 4·xH 2O),m 2=m(CuSO 4)二、实验仪器和装置1.瓷坩埚、坩埚钳、泥三角瓷坩埚用于加热或灼烧固体物质,加热、灼烧时应放在泥三角上进行。
热的瓷坩埚及坩埚盖取放时要用坩埚钳。
2.干燥器干燥器用于保存干燥的物质。
由普通厚玻璃制成,内有带孔瓷板,玻璃盖与容器应与磨砂面保持吻合。
容器内下部装有干燥剂(如无水氯化钙、碱石灰、浓硫酸等)。
脱水后的白色CuSO 4粉末和坩埚要放在干燥器里进行冷却,因为CuSO 4具有很强的吸湿性,在空气中会重新吸水形成水合物。
结晶水含量的测定知识梳理()1220160(m m )18m m --【知识拓展】化学干燥剂脱水原理分为两种:℃与水可逆地结合生成水合物,如氯化钙、硫酸镁等; ℃干燥剂与水发生不可逆的化学反应,生成新的化合物。
注意:选用干燥剂时,必须注意不与被干燥的物质发生化学反应,不溶于被干燥的物质中。
三、实验1.实验操作(1)研磨:在研钵中用研棒将硫酸铜晶体研碎。
(2)称量:准确称量干燥的瓷坩埚的重量,并记下瓷坩埚的质量m 0,并用此坩埚准确称取一定质量已研碎的硫酸铜晶体,并记下坩埚钳和硫酸铜晶体的质量m 1。
(3)加热:加热晶体,使其失去全部结晶水(由蓝色完全变为白色)。
(4)称量:在干燥器内冷却后称量,并记下瓷坩埚和无水硫酸铜的质量m 2。
(5)再加热、再称量至恒重:把盛有无水硫酸铜的瓷坩埚再加热,再放入干燥器里冷却后再称量,并记下瓷坩埚和无水硫酸铜的质量,到两次称量的质量相差不超过0.001g 为止。
110.2 硫酸铜结晶水含量的测定高二化学胆矾(硫酸铜晶体)CuSO4·5H2O明矾(硫酸铝钾晶体)KAl(SO4)2· 12H2O结晶水合物问题•加热5克硫酸铜晶体(CuSO4·x H2O)至完全失去结晶水,称得剩余固体质量为3.2克,求硫酸铜晶体的化学式。
一、实验目的:·x H2O中x的值)测定硫酸铜晶体中结晶水的含量(CuSO4OxH CuSO O xH CuSO 2424·+−→−△ 1 mol x mol二、实验原理硫酸铜晶体(CuSO 4·x H 2O )化学反应加热晶体至晶体完全失去结晶水,固体前后质量差就是结晶水的质量。
计算公式:4242421816016018mCuSO O mH mCuSO OmH nCuSO O nH x ===需要测定:无水硫酸铜的质量和结晶水的质量实验仪器研钵、电子天平、坩埚、坩埚钳、药匙、泥三角、酒精灯、玻璃棒、干燥器、铁架台(铁圈)药品硫酸铜晶体(CuSO 4·x H 2O )三、实验仪器及药品三、实验仪器及药品仪器分析❑质量测定确保结晶水完全失去❑加热装置防止飞溅或带出❑干燥装置防止重新吸水四、实验步骤(1)研磨:在研钵中将硫酸铜晶体研碎)(2)称量:准确称量一干燥洁净的瓷坩锅质量(m)(3)再称:称量瓷坩埚+硫酸铜晶体的质量(m1(4)加热灼烧:加热瓷坩埚(边加热边搅拌)至蓝色晶体全部变为白色粉末(5)干燥冷却:并放入干燥器中冷却(6)称量并进行恒重操作:再加热,再冷却,再称重,直到两次称量误差不得超)过0.001g(结晶水已经完全分解),称量瓷坩埚+硫酸铜粉末的质量(m2(7)计算:根据实验测得的结果计算硫酸铜晶体中结晶水X。
四、实验步骤问题讨论❑加热晶体前为什么要研细晶体?便于加热,受热均匀,不易飞溅❑固体加热可以使用哪些仪器和相关设施?试管(较少量),坩埚(较多量,且需要搅拌)四、实验步骤❑如何取用坩埚?使用坩埚钳,注意在使用过程中防止坩埚盖跌落❑加热坩埚需要垫石棉网吗?不需要,坩埚可直接加热,但要放在泥三角上加热❑加热时为什么要不断搅拌?防止局部过热造成晶体飞溅,实验结果偏大.搅拌时需用坩埚钳夹住坩埚,防止跌落四、实验步骤❑加热到何时可以停止加热?蓝色晶体基本变为白色粉末,停止加热,并继续用玻棒搅拌,利用余热将可能还有的结晶水除去,也可以防止因过热引起受热分解❑加热结束后为什么要冷却后称量?为什么要放在干燥器中冷却?温度较高时称量会损坏天平;在空气中冷却会又吸收空气中的水蒸气,影响测定结果四、实验步骤实验过程中至少需要称量几次?为什么?为什么要恒重操作?如何进行恒重操作?至少要称量4次: 称量坩埚,加入晶体后称量,加热失去结晶水并冷却后称量,再加热并冷却后称量。
五水硫酸铜结晶水含量的测定一、实验目的要求:1.了解制备五水硫酸铜晶体的方法。
2.测定硫酸铜的结晶水含量。
二、实验内容:1.五水硫酸铜的提纯。
2.五水硫酸铜晶体自由水的脱去。
3.测定硫酸铜晶体里的结晶水含量。
三、主要仪器设备及药品:仪器设备:电子天平,称量瓶,不锈钢锅(薄壁,内装食盐用于盐浴),温度计(量程在350℃,测量盐浴温度),烘箱(烘干自由水),电炉,滤纸,皮筋。
药品:五水硫酸铜,3公斤食盐左右(用于盐浴加热),无水乙醇。
四、实验原理五水硫酸铜结构:图1 CuSO4·5H2O的晶体结构一般性质硫酸铜CuSO4(硫酸铜晶体:CuSO4·5H2O)分子量249.68。
深蓝色大颗粒状结晶体或蓝色颗粒状结晶粉末,略透明。
有毒,无臭,带有金属涩味。
密度2.2844g/cm-3。
干燥空气中会缓慢风化。
易溶于水,水溶液呈弱酸性。
不溶于乙醇,缓缓溶于甘油。
150℃以上将失去全部水结晶成为白色粉末状无水硫酸铜。
五水硫酸铜有极强的吸水性,把它投入95%乙醇成含水有机物(即吸收水分)而恢复为蓝色结晶体。
失水过程五水硫酸铜晶体失水分三步。
上图中两个仅以配位键与铜离子结合的水分子最先失去,大致温度为102摄氏度。
两个与铜离子以配位键结合,并且与外部的一个水分子以氢键结合的水分子随温度升高而失去,大致温度为113摄氏度。
最外层水分子最难失去,因为它的氢原子与周围的硫酸根离子中的氧原子之间形成氢键,它的氧原子又和与铜离子配位的水分子的氢原子之间形成氢键,总体上构成一种稳定的环状结构,因此破坏这个结构需要较高能量。
失去最外层水分子所需温度大致为258摄氏度。
五、实验步骤:1、在常温下将适量的CuSO4溶解于少量的水中,配置成过饱和溶液,倒掉上层溶液,取未溶解的五水硫酸铜加少量水洗涤三次,再用无水乙醇洗涤三次,将所得试剂尽量滴干(为节约实验时间,可用滤纸将大部分自由水吸干)。
2、将1所得试剂加入称量瓶(不带瓶盖)中,再覆盖上滤纸和皮筋,称重(事先称量无盖称量瓶、滤纸和皮筋的总质量为m0)。
硫酸铜晶体中结晶水含量的测定实验报告单实验目的:本实验旨在通过测定硫酸铜晶体中结晶水含量,掌握含水晶体的水合物的制备和鉴定方法。
实验原理:硫酸铜为含2个结晶水的盐,其化学式为CuSO4·2H2O。
结晶水晶体中的水分子与盐分子通过氢键相连,结构稳定。
根据质量守恒定律,在失去结晶水的情况下,硫酸铜质量减少的部分即为结晶水的质量。
实验中可以通过加热硫酸铜样品,使其脱水,再称重,计算质量差来确定结晶水含量。
实验仪器和药品:仪器:电子天平、烧杯、玻璃棒、火炬药品:硫酸铜晶体样品实验步骤:1.将硫酸铜晶体样品称取0.5g放入干燥烧杯中。
2.使用电子天平准确称重,并记录初始质量。
3.在通风良好的条件下,使用火炬加热烧杯,加热硫酸铜样品。
注意要均匀加热,并用玻璃棒搅拌样品,以促进脱水反应。
直到热效应消失,即加热后的质量基本不再变化为止。
4.关闭火炬,待样品冷却至室温。
5.使用电子天平称重加热后的硫酸铜样品,并记录最终质量。
实验结果:初始质量:0.5g最终质量:0.35g质量差:初始质量-最终质量=0.5g-0.35g=0.15g结晶水的质量:0.15g讨论与分析:根据实验结果,硫酸铜样品中结晶水的质量为0.15g。
根据化学计量学原理,硫酸铜中结晶水的摩尔比为1∶2,因此可计算出结晶水的摩尔质量。
硫酸铜的摩尔质量为:63.5g/mol结晶水的摩尔质量为:18g/mol根据化学计量学计算公式,可得到结晶水的摩尔质量:0.15g × (1 mol/63.5g) × (18g/1 mol) ≈ 0.425mol可以计算得知,硫酸铜晶体中的结晶水的比例约为0.425mol/1mol,即约为42.5%。
结论:在本实验中,通过加热硫酸铜晶体样品,我们测定了硫酸铜晶体中结晶水的含量。
实验结果显示,硫酸铜晶体中的结晶水含量约为42.5%。
通过本实验,我们掌握了含水晶体的水合物制备和鉴定的方法。