结晶水合物中结晶水含量测定
- 格式:ppt
- 大小:173.50 KB
- 文档页数:11



《10.2结晶⽔合物中结晶⽔含量的测定(第⼀课时)》教案《10.2结晶⽔合物中结晶⽔含量的测定(第⼀课时)》教案松江四中李婉⼀、设计思路1.教材分析本节课是沪科版《化学》⾼⼆年级第⼀学期第⼗章“学习⼏种定量测定⽅法”第⼆节“结晶⽔合物中结晶⽔含量的测定”第⼀课时内容。
第⼗章共有三个定量实验:“测定1mol⽓体的体积”“结晶⽔合物中结晶⽔含量的测定”“酸碱滴定”,其中“测定1mol⽓体的体积”是拓展型课程内容,因此“结晶⽔合物中结晶⽔含量的测定”就成为本章的第⼀个定量实验,是学⽣学习定量测定⽅法的第⼀课,也是学⽣学习的第⼀种定量测定⽅法——重量法。
因此,本节课设计思路:既然是第⼀课,那么本节课的任务是带领学⽣进⼊定量测定实验的殿堂,在完成本节课后对定量实验的核⼼——“精准性”留下深刻的印象。
教学设计让学⽣在测定物质组成的过程中,始终围绕着“精准性”徐徐展开内容,感受“精准性”在定量测定中的意义和价值,为后⾯学习“中和滴定”和拓展型课程中的“⽓体摩尔体积的测定”、“⼩苏打中碳酸氢钠的含量测定”打好基础。
2.教学基本要求分析《上海市⾼中化学学科教学基本要求》中指出:⾼中阶段共学习5个定量实验,按基础性课程和拓展型课程的顺序,分别是“配制⼀定物质的量浓度的溶液”、“结晶⽔合物中结晶⽔含量的测定”、“中和滴定”、“⽓体摩尔体积的测定?”、“⼩苏打中碳酸氢钠的含量测定?”。
其中对“结晶⽔合物中结晶⽔含量的测定”的学习⽔平要求:知识⽔平C级,技能⽔平C级;即知识达到运⽤层⾯,能将所学内容应⽤到新的情境中,并⽤于解决简单的问题;技能达到设计层⾯,能根据具体情境的需要,选择、组合相关实验操作,解决问题。
虽然,在⾼⼀年级学习“配制⼀定物质的量浓度的溶液”时初次接触了定量实验,但对定量实验的“精准性”核⼼只有⼀个模糊的印象,技能⽔平也只要求达到B级:能规范、熟练地完成某种操作的⽔平。
⽽本节课要在其基础上,技能⽔平有所提⾼,要求达到C级设计⽔平;但是在具体要求⼀栏的描述中,并没有出现设计⽅案四个字,⽽是解释实验原理、复述恒重操作要点的概念和操作要点、描述实验步骤、归纳仪器使⽤要点。
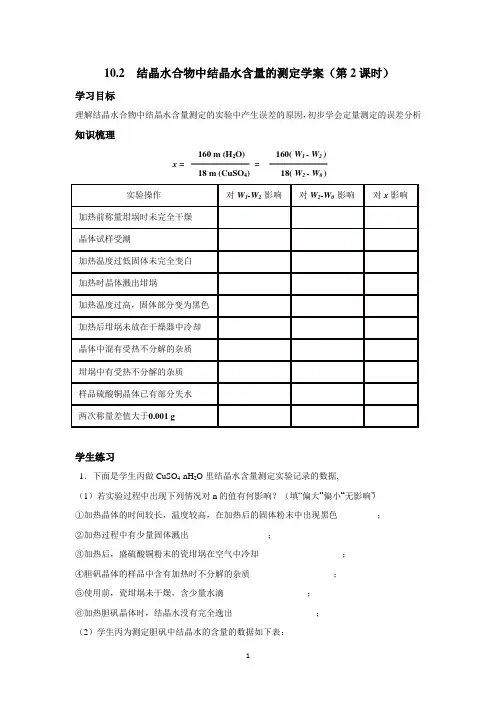
10.2 结晶水合物中结晶水含量的测定学案(第2课时)学习目标理解结晶水合物中结晶水含量测定的实验中产生误差的原因,初步学会定量测定的误差分析知识梳理160 m (H2O) 160( W1 - W2 )x = =18 m (CuSO4) 18( W2 - W0 )学生练习1.下面是学生丙做CuSO4·nH2O里结晶水含量测定实验记录的数据,(1)若实验过程中出现下列情况对n的值有何影响?(填“偏大”“偏小”“无影响”)①加热晶体的时间较长,温度较高,在加热后的固体粉末中出现黑色_________;②加热过程中有少量固体溅出__________________;③加热后,盛硫酸铜粉末的瓷坩埚在空气中冷却___________________;④胆矾晶体的样品中含有加热时不分解的杂质___________________;⑤使用前,瓷坩埚未干燥,含少量水滴___________________;⑥加热胆矾晶体时,结晶水没有完全逸出___________________;(2)学生丙为测定胆矾中结晶水的含量的数据如下表:(1)计算:第一次测定n= ,第二次测定n= ,平均值为,误差为。
(2)以上实验产生误差的原因可能是。
(至少写出3种)2.以下是某同学测定硫酸钠晶体中结晶水含量的实验方案。
实验用品:硫酸钠试样、研钵、干燥器、坩埚、三脚架、泥三角、玻璃棒、药匙、电子天平实验步骤:①准确称量一个干净、干燥的坩埚;②在坩埚中加入一定量的硫酸钠晶体试样,称重,将称量过的试样放入研钵中研细,再放回到坩埚中;③将盛有试样的坩埚加热,待晶体变成白色粉末时,停止加热;④将步骤③中的坩埚放入干燥器,冷却至室温后,称重;⑤将步骤④中的坩埚再加热一定时间,放入干燥器中冷却至室温后称量。
重复本操作,直至两次称量结果不变;⑥根据实验数据计算硫酸钠晶体试样中结晶水的质量分数。
分析该方案并回答下面问题:(1)完成本实验还需要的实验用品是;(2)指出实验步骤中存在的错误并改正:;(3)硫酸钠不能放置在空气中冷却的原因是;(4)步骤⑤的目的是;(5)下面的情况有可能造成测试结果偏高的是(填序号)。


《10.2结晶水合物中结晶水含量的测定(第一课时)》教案松江四中李婉一、设计思路1.教材分析本节课是沪科版《化学》高二年级第一学期第十章“学习几种定量测定方法”第二节“结晶水合物中结晶水含量的测定”第一课时内容。
第十章共有三个定量实验:“测定1mol气体的体积”“结晶水合物中结晶水含量的测定”“酸碱滴定”,其中“测定1mol气体的体积”是拓展型课程内容,因此“结晶水合物中结晶水含量的测定”就成为本章的第一个定量实验,是学生学习定量测定方法的第一课,也是学生学习的第一种定量测定方法——重量法。
因此,本节课设计思路:既然是第一课,那么本节课的任务是带领学生进入定量测定实验的殿堂,在完成本节课后对定量实验的核心——“精准性”留下深刻的印象。
教学设计让学生在测定物质组成的过程中,始终围绕着“精准性”徐徐展开内容,感受“精准性”在定量测定中的意义和价值,为后面学习“中和滴定”和拓展型课程中的“气体摩尔体积的测定”、“小苏打中碳酸氢钠的含量测定”打好基础。
2.教学基本要求分析《上海市高中化学学科教学基本要求》中指出:高中阶段共学习5个定量实验,按基础性课程和拓展型课程的顺序,分别是“配制一定物质的量浓度的溶液”、“结晶水合物中结晶水含量的测定”、“中和滴定”、“气体摩尔体积的测定❃”、“小苏打中碳酸氢钠的含量测定❃”。
其中对“结晶水合物中结晶水含量的测定”的学习水平要求:知识水平C级,技能水平C级;即知识达到运用层面,能将所学内容应用到新的情境中,并用于解决简单的问题;技能达到设计层面,能根据具体情境的需要,选择、组合相关实验操作,解决问题。
虽然,在高一年级学习“配制一定物质的量浓度的溶液”时初次接触了定量实验,但对定量实验的“精准性”核心只有一个模糊的印象,技能水平也只要求达到B级:能规范、熟练地完成某种操作的水平。
而本节课要在其基础上,技能水平有所提高,要求达到C级设计水平;但是在具体要求一栏的描述中,并没有出现设计方案四个字,而是解释实验原理、复述恒重操作要点的概念和操作要点、描述实验步骤、归纳仪器使用要点。


10.2 结晶水合物中结晶水含量的测定学案(第1课时)学习目标解释结晶水合物中结晶水含量的测定的实验原理描述结晶水合物中结晶水含量的测定的实验步骤归纳结晶水合物中结晶水含量的测定的实验要点知识梳理1.实验原理:CuSO4 ·x H2O CuSO4 + x H2O↑160 g 18 x gA gB g (A-B) gx =2. 操作步骤:(1)研磨:在中将硫酸铜晶体研碎。
(2)称量:准确称量一干燥洁净的瓷坩锅质量(W0 g)。
(3)再称:称量瓷坩埚+硫酸铜晶体的质量(W1g)。
(4)加热:加热至色晶体全部变为色粉末,并放入中冷却。
(5):在干燥器内冷却后,称量瓷坩埚+硫酸铜粉末的质量(W2g)。
(6):把盛有硫酸铜的瓷坩埚再加热,再冷却。
(7):将冷却后的盛有硫酸铜的瓷坩埚再次称量(两次称量误差不得超过g)。
(8)计算:根据实验测得的结果计算硫酸铜晶体中结晶水的质量分数。
简称:“”、“”、“”、“”。
(9)依据理论值计算误差。
绝对误差 = ______________ ;相对误差 = ___________________。
3.注意事项①晶体加热后先放在石棉网上稍冷却,之后一定要放在干燥器内冷却,以保证无水硫酸铜不会从空气中吸收水分而引起测得值偏。
②晶体要在坩埚底上摊开加热,有利于失去全部结晶水,以免引起测得值偏。
③加热时间不充分、加热温度过低(未全变白),都会使测得值偏。
④加热过程中,应慢慢加热(可改垫石棉网),以防因局部过热而造成晶体溅失,引起测量值偏。
⑤加热温度过高或时间过长,会导致硫酸铜少量分解,使测得值偏。
学生练习1.下面是学生甲做硫酸铜晶体里结晶水含量测定实验记录的数据。
坩埚质量:m1 g,坩埚+硫酸铜晶体质量:m2g 坩埚+无水CuSO4质量为:m3 g则硫酸铜晶体C uSO4·nH2O中的n的计算公式为:2.根据实验室中测定硫酸铜晶体结晶水含量的实验。



一、实验原理结晶水合物受热能够失去结晶水,硫酸铜晶体(蓝色)在110℃开始失去部分结晶水,150℃时失去全部结晶水,生成白色的无水硫酸铜。
650℃硫酸铜分解成黑色的氧化铜。
CuSO 4·xH 2O −→−∆CuSO 4 + xH 2OCuSO 4 −−→−℃650 CuO + SO 3x O H m CuSO m :118)(160)(24=:24160m(H O)x 18m(CuSO )=22118)(160m m m x -=式中:m 1=m(CuSO 4·xH 2O),m 2=m(CuSO 4)二、实验仪器和装置1.瓷坩埚、坩埚钳、泥三角瓷坩埚用于加热或灼烧固体物质,加热、灼烧时应放在泥三角上进行。
热的瓷坩埚及坩埚盖取放时要用坩埚钳。
2.干燥器干燥器用于保存干燥的物质。
由普通厚玻璃制成,内有带孔瓷板,玻璃盖与容器应与磨砂面保持吻合。
容器内下部装有干燥剂(如无水氯化钙、碱石灰、浓硫酸等)。
脱水后的白色CuSO 4粉末和坩埚要放在干燥器里进行冷却,因为CuSO 4具有很强的吸湿性,在空气中会重新吸水形成水合物。
结晶水含量的测定知识梳理()1220160(m m )18m m --【知识拓展】化学干燥剂脱水原理分为两种:℃与水可逆地结合生成水合物,如氯化钙、硫酸镁等; ℃干燥剂与水发生不可逆的化学反应,生成新的化合物。
注意:选用干燥剂时,必须注意不与被干燥的物质发生化学反应,不溶于被干燥的物质中。
三、实验1.实验操作(1)研磨:在研钵中用研棒将硫酸铜晶体研碎。
(2)称量:准确称量干燥的瓷坩埚的重量,并记下瓷坩埚的质量m 0,并用此坩埚准确称取一定质量已研碎的硫酸铜晶体,并记下坩埚钳和硫酸铜晶体的质量m 1。
(3)加热:加热晶体,使其失去全部结晶水(由蓝色完全变为白色)。
(4)称量:在干燥器内冷却后称量,并记下瓷坩埚和无水硫酸铜的质量m 2。
(5)再加热、再称量至恒重:把盛有无水硫酸铜的瓷坩埚再加热,再放入干燥器里冷却后再称量,并记下瓷坩埚和无水硫酸铜的质量,到两次称量的质量相差不超过0.001g 为止。