配合物结构
- 格式:ppt
- 大小:431.00 KB
- 文档页数:28


无机化学《配合物》教案配合物是指由配位原子(或离子)与另一部分(配位体)通过化学键连接而成的化合物。
配合物具有许多独特的化学和物理性质,并广泛应用于催化剂、药物、颜料和材料等领域。
本教案旨在介绍配合物的定义、结构以及配位键的形成机制和性质。
一、配合物的定义1.配合物是指由配位原子(或离子)与另一部分(配位体)通过化学键连接而成的化合物。
2.配位原子(或离子)是通常为过渡金属离子,但也可以是其他元素或离子。
3.配位体是指可以通过配位键与配位原子(或离子)形成配合物的分子或离子。
二、配合物的结构1.配位原子(或离子)和配位体通过配位键相连。
2.配位键的形成使得配位体围绕着配位原子(或离子)形成一个立体结构,称为配位球。
3.配合物的结构可以是一维、二维或三维的,具有不同的形态和几何构型。
4.配位原子(或离子)的电子层配置决定了配合物的稳定性和反应性。
三、配位键的形成机制和性质1.配位键的形成是通过配位体的配位原子与配位原子(或离子)的空位或配对电子形成配位键。
2.配位键可以是共价键、离子键或金属键。
3.配位键的形成能力受到配位原子(或离子)的电子能级和配位体的配位能力的影响。
4.配位键的性质包括键长、键能、键角和配位度等。
这些性质决定了配合物的化学和物理性质。
四、配合物的化学性质1.配合物可以发生配位键的断裂和配位体的替换反应,产生新的配合物。
2.配合物的稳定性受到配位原子(或离子)的电荷、原子半径和配位体的配位能力的影响。
3.配合物的溶解度和酸碱性常常与配位体的配位能力和配位度有关。
4.配合物的光谱性质(如吸收光谱、荧光光谱等)可以用来确定配位原子(或离子)和配位体的结构和环境。
五、配合物的应用1.配合物常用作催化剂,参与有机合成和化学反应。
2.配合物可用于制备药物,具有生物活性和药效。
3.配合物可以用作颜料和染料的原料,提供不同颜色和稳定性。
4.配合物可用于制备材料,具有特殊的磁性、光学和电学性质。

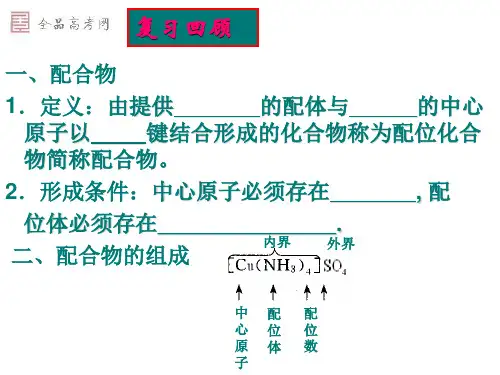
第4章:配合物一.配合物的组成(1)配位体:是含有孤电子对的分子或离子,如NH3、Cl-、CN-等。
配位体中直接同中心原子配合的原子,叫做配位原子。
如上例[Cu(NH3)4]2+配离子中,NH3是配位体,其中N原于是配位原子。
配位原子经常是含有孤对电子的原子。
(2)中心离子(或原子):一般是金属离子,特别是过渡金属离子,但也有电中性的原子为配合物的中心原子,如Ni(CO)4、Fe(CO)5中的Ni和Fe都是电中性的原子。
此外,少数高氧化态的非金属元素也能作为中心原子存在,如SiF62-中的Si(Ⅳ)及PF6-中的P(V)等。
(3)配位数:直接同中心离子(或原子)配合的配位原子的数目,叫做该中心离子(或原子)的配位数,一般中心离子的配位数为2、4、6、8(较少见),如在[Pt(NH3)6]C14中,配位数为6,配位原子为NH3分子中的6个氮原子。
(4)配离子的电荷:配离子的电荷数等于中心离子和配位体电荷的代数和。
如[Cu(NH3)4]2+的电荷是+2+(0)×4=+2。
二.配合物的分类配位化合物的范围极广,主要可以分为以下几类:(1)单核配合物这类配合物是指一个中心离子或原子的周围排列着一定数量的配位体。
中心离子或原子与配位体之间通过配位键而形成带有电荷的配离子或中性配合分子。
如[Cu(NH3)4]SO4、K4[Fe(CN)6]等皆属于此类配合物。
(2)螯合物这类配合物是由多齿配位体以两个或两个以上的配位原子同时和一个中心离子配合并形成具有环状结构的配合物。
例如乙二胺H2N-CH2-CH2-NH2和Cu2+形成的如下螯合物:三.配合物的命名配合物的命名与一般无机化合物的命名原则相同。
若配合物的外界是一简单离子的酸根,便叫某化某;若外界酸根是一个复杂阴离子,便叫某酸某(反之,若外界为简单阳离子,内界为配阴离子的配合物也类似这样叫法)。
若配离子的内界有多种配体,须按下列顺序依次命名:简单离子—复杂离子—有机酸根离子;而中性分子配位体的命名次序为:H2O—NH3—有机分子。


第三章配合物结构主要内容:1.配合物价键理论的基本要点、配合物的几何构型与中心离子杂化轨道的关系。
2.内轨型、外轨型配合物的概念;中心离子价电子排布与配离子稳定性、磁性的关系。
3.配合物晶体场理论的基本要点;高自旋、低自旋配合物等;推测配合物的稳定性、磁性。
4.配合物的颜色与 d-d 跃迁的关系。
配合物的组成配合物:是由中心离子(或原子)与一定数目的阴离子或中性分子形成具有一定的空间构型和稳定性的复杂化合物。
例如: [Ag(NH3)2]OH, [Cu(NH3)4]SO4,Ni(CO)41.中心离子(或原子)中心离子(或原子)也称为形成体,具有空的价电子轨道,通常是金属离子和原子,也有少数是非金属元素。
例如:Cu2+,Ag+,Fe3+,Fe,Ni,BⅢ,PⅤ……配位体简称配体,通常是非金属的阴离子或分子,例如:F-,Cl-,Br-,I-,OH-,CN-,H2O,NH3,CO……2.配位体和配位原子单齿配体:配体中只有一个配位原子。
多齿配体:具有两个或多个配位原子的配体。
例如:乙二胺(en ) 2 2 2 2H N CH CH N H ∙∙∙∙乙二酸根(草酸根) -242O C 乙二胺四乙酸根 EDTA (Y 4-)配位原子:与形成体成键的原子。
配位数:配位原子数单齿配体:形成体的配位数等于配体的数目;多齿配体:形成体的配位数等于配体的数目与基数的乘积。
3. 中心离子(或原子)的配位数[] Cu(en)22+Cu 2+的配位数等于4。
例如:CH N H NH C H CuCH N H NH C H 2222222 22+Ca2+的配位数为6,配位原子分别是4个O,2个N。
从溶液中析出配合物时,配离子常与带有相反电荷的其他离子结合成盐,这类盐称为配盐。
配盐的组成可以划分为内层和外层。
配离子属于内层,配离子以外的其他离子属于外层。
外层离子所带电荷总数等于配离子的电荷数。
配合物的化学式和命名配酸:×××酸配碱:氢氧化×××配盐:先阴离子后阳离子,简单酸根加“化”字,复杂酸根加“酸”字。
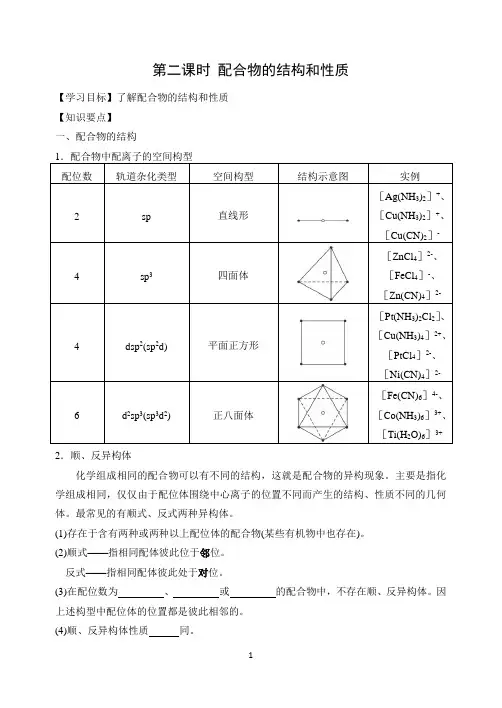
第二课时配合物的结构和性质【学习目标】了解配合物的结构和性质【知识要点】一、配合物的结构2.顺、反异构体化学组成相同的配合物可以有不同的结构,这就是配合物的异构现象。
主要是指化学组成相同,仅仅由于配位体围绕中心离子的位置不同而产生的结构、性质不同的几何体。
最常见的有顺式、反式两种异构体。
(1)存在于含有两种或两种以上配位体的配合物(某些有机物中也存在)。
(2)顺式——指相同配体彼此位于邻位。
反式——指相同配体彼此处于对位。
(3)在配位数为、或的配合物中,不存在顺、反异构体。
因上述构型中配位体的位置都是彼此相邻的。
(4)顺、反异构体性质同。
【基础训练】已知Pt(NH3)2Cl2有顺、反两种异构体A、B,A为棕黄色,有抗癌活性,在水中溶解度为0.2577g,B为淡黄色,无抗癌活性,在水中溶解度为0.0366g。
请指出______是顺式异构体,______是反式异构体,写出表示A、B的空间结构的结构式:A___________________________ B___________________________3.配合物的类型(了解)配合物的范围极广,主要可以分为以下几类:(1)简单配位化合物:指由单基配位体与中心离子配位而形成的配合物。
这类配合物通常配体较多,在溶液中可以逐级解离成一系列配位数不同的配离子。
(2)螯合物:具有环状结构的配合物叫螯合物。
二、配合物的性质:配合物具有一定的稳定性,配合物中的配位键越强,配合物越稳定。
当作为中心原子的金属离子相同时,配合物的稳定性与有关。
如CO与血红素中的Fe2+形成的配位键比O2与Fe2+形成的强。
(1)配位原子的电负性__________________________________________________(2)配位体的碱性____________________________________________________三、配合物的应用1.银镜反应2.Fe3+的检验3.用于离子的检验用可分离CuSO4溶液和Fe2(SO4)3溶液。




第十一章配合物结构一、教学基本要求1、熟悉配合物价键理论的基本要点,掌握用价键理论说明配合物的空间构型。
2、了解配合物的磁性、空间构型、内轨型、外轨型配合物等基本概念。
二、主要内容(一)配合物的空间构型1、配合物的空间构型是指配位体在中心离子(或原子周围)排布的几何构型。
2、测定方法:实验测定、普遍采用X射线衍射。
3、配合物空间构型不仅取决于配位数,还与中心离子和配位体的种类有关。
配合物空间构型与配位数的关系见表11- 1。
(二)配合物的磁性1、配合物的磁性是配合物的重要性质之一,它对配合物结构的研究提供了重要的实验依据。
2、含有未成对电子的的配合物具有顺磁性。
不含有未成对电子的的配合物具有反磁性。
3.通常用物质的磁矩(μ)来表示顺磁性配合物在磁场中产生的磁效应。
μ=√n(n+2) B.M n—未成对电子数磁矩可借助磁天平测得,通过其可以确定未成对电子数。
(三)配合物的价键理论1、配合物的价键理论的要点:a.在配合物中,中心离子(或原子)与配位体以配位键结合,即配位体的孤对电子进入形成体的空的价电子轨道。
b.形成体以杂化轨道接受配位体提供的孤对电子。
c.不同类型的杂化轨道具有不同的空间构型。
见表11-1表11-1 配合物的空间构型与杂化轨道类型2、按照价键理论讨论配合物结构的基本思路:a.由实验测得的磁矩算出未成对电子数。
b.推测中心离子的价电子的分布情况和采取的杂化方式。
c.确定配合物是内轨型还是外轨型。
d.解释配合物的相对稳定性。
+例:对配合物[CoF6]3-和[Co(CN)6]3-的讨论配合物以知磁矩μ/B.M.未成电子数nCo3+的价电子排布中心离子的杂化分式配合物的类型相对稳定性[CoF6]3- 5.26 4 ↑↓↑↑↑↑—————sp3d2外轨型较高[Co(CN)6]3-0 0 ↑↓↑↓↑↓d2sp3内轨型较低。
高中化学配合物配合物是指由中心金属离子和周围的配体离子共同形成的一个整体结构。
配合物广泛存在于日常生活和化学实验中,具有重要的应用价值。
在高中化学课程中,我们经常会接触到配合物的概念,了解其结构、性质和应用。
一、配合物的结构1. 配合物的组成:配合物通常由一个中心金属离子和若干个配体离子组成。
中心金属离子通常是过渡金属元素,具有较多的空位和不完满的d轨道。
配体离子则是能够给出一个或多个孤对电子的分子或离子,与中心金属离子形成配位键。
2. 配位键的形成:配位键是指中心金属离子与配体离子之间的化学键。
常见的配位键包括配位共价键、配位离子键和配位金属键。
配位键的形成使得配合物呈现特定的几何构型,如八面体、四方形、三角形等。
二、配合物的性质1. 颜色:配合物的颜色常常取决于其中的中心金属离子和配体离子的种类和结构。
不同的配合物由于电子跃迁的不同而呈现出不同的颜色。
这也是我们常常用来区分不同配合物的一种方法。
2. 稳定性:配合物的稳定性取决于配体的性质、中心金属离子的能力和配位数等因素。
稳定的配合物通常具有较低的配位能和较大的配位数,能够稳定保持其结构不发生变化。
3. 溶解性:部分配合物具有较好的溶解性,可以在水或有机溶剂中形成溶液。
溶解性的大小与配合物的结构和性质有关,不同的配合物在不同溶剂中呈现出不同的溶解性。
三、配合物的应用1. 工业应用:配合物在工业中具有广泛的应用,如催化剂、染料、氧化还原剂等。
通过合理设计配合物的结构和性质,可以实现对目标反应的催化和调控,提高反应的效率和产率。
2. 医药应用:部分配合物具有生物活性,可以作为药物的主体或辅助成分。
配合物药物可以改善药物的稳定性、生物利用度和靶向性,提高药物治疗的效果和减少副作用。
3. 环境应用:某些配合物可以被应用于环境保护领域,如重金属离子的吸附和去除。
通过设计合适的配合物结构,可以实现对有害物质的高效捕获和转化,减少环境污染和资源浪费。
综上所述,配合物作为化学领域中的重要概念,具有广泛的应用前景和研究价值。