配合物结构的空间构型汇总.
- 格式:ppt
- 大小:190.00 KB
- 文档页数:15

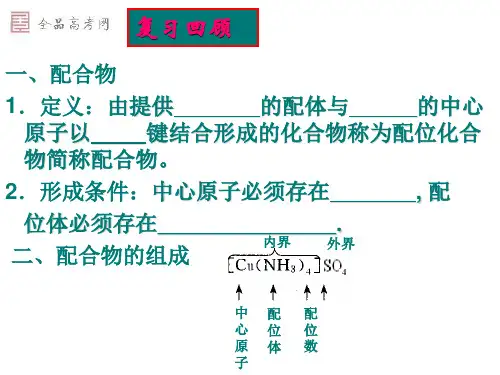
存在形式:气相(离子对)Ti(I), In(I), Ga(I), Cu(I), Ag(I) 配体:体积庞大Ga[C(SiMe 3)3], 2,4,6-三苯基苯基合铜(I)(2,4,6-triphenylphenylcopper 三苯基苯基合银(I)(2,4,6-triphenylphenylsilver )[(2,6-trip 2C 6HCu(I), Ag(I), Au(I), Hg(II), Mo(IV), U(IV), AgCN, AgSCN, AuI, [UO 2] 2+, [PuO 2]2+, Mn[N(SiMePh2.1 配合物的空间结构3. 配位数3构型:平面三角形金属:d 10组态离子,Cu(I), Au(I), Hg(II), Pt(0)示例:K[Cu(CN)2], [Cu 2Cl 2(Ph 3P)2], [Cu(tu)]Cl, [Cu(SPPh 3)3]ClO 4, [Cu(Me 3PS)Cl]3, [Au(PPh 3)3]+, [AuCl(PPh 3)2], [HgI 3]-, [Pt(PPh 3)3] 注意:MX 3型化合物不一定都是三配位,如:CuCl 3,链状结构-Cl-CuCl 2-Cl-CuCl 2-;AuCl 3,实为Au 2Cl 6,Au Cl AuCl Cl Cl Cl Cl2.1 配合物的空间结构4. 配位数4构型:四面体、平面正方形、畸变四面体四面体:第一过渡系金属[尤其是Fe 3+、Co 2+以及具有球对称d 0、d 5(高自旋)或d 10电子构型的金属离子];碱性较弱或体积较大的配体——价层电子对互斥理论。
如:[Be(OH 2)4]-、[SnCl 4]、[Zn(NH 3)4]2+、Ni(CO)4、[FeCl 4]-等平面正方形:d 8电子组态的Ni 2+(强场)、第二、三过渡系的Rh +、Ir +、Pd 2+、Pt 2+、Au 3+等——晶体场理论。
如:[Ni(CN)4]2-、[AuCl 4]-、[Pt(NH 3)4]2+、[PdCl 4]2-、[Rh(PPh 3)3Cl]等畸变四面体:[CuCl 4]2-、Co(CO)4四面体平面正方形R=异丙基,磁矩=1.8∼2.3B.M.,四面体30 ∼50%R=叔丁基,磁矩=3.2B.M.,四面体95%电子排布:e 4t 24d yz 2d xz 2d z22d xy 2未成对电子数:2 0磁矩(B.M.):3.3 0:ThI2二硫醇根)合铼]dbm=二苯甲酰甲烷单帽八面体2.1 配合物的空间结构7. 配位数7构型:五角双锥(D 5h )、单帽三棱柱(C 2v )、单帽八面体(C 3v );结构互变五角双锥:Na 3[ZrF 7]、[Fe II (H 2O)(H 2edta)]⋅2H 2O 、K 5[Mo(CN)7]⋅H 2O 单帽三棱柱:(NH 4)3[ZrF 7]、Li[Mn(H 2O)(edta)]⋅4H 2O 、[MoI(CNR)6]I 单帽八面体:[MoCl 2(CO)3(PEt 3)2]、(NEt 4)[WBr 3(CO)4]金属:大多数过渡金属,d 0∼d 4畸变五角双锥2(Ac)3]4)4[VO 2(C 2O 4)3]2.1 配合物的空间结构三角十二面体四方反棱柱体dbm=二苯甲酰甲烷[Sm III (H 2O)(dmb )3],七配位[Sm II I 2(dme )3],八配位离子半径:Sm II (1.27Å) > Sm (0.958Å)配体体积:dmb > dmedme = 二甲氧基乙烷dbm=二苯甲酰甲烷单帽八面体畸变六角双锥畸变三角十二面体中心金属半径&配体体积对配位数的影响比较:2.1 配合物的空间结构10. 配位数10构型:双帽四方反棱柱(D 4d )、双帽十二面体(D 2)、十四面体(C 2v )配位数2-12的最重要配位多面体的构型配位数2-12的最重要配位多面体的构型2.2 配合物的异构现象2.2.1 化学结构异构1. 配位异构2. 键合异构——两可配体CoCl BAA CoClCl BBACoClBBA A能垒低可互变[Cr(en)3][Ni(CN)5]⋅1.5H 2O :三角双锥& 四方锥[NiBr 2(EtPPh 2)2]:四面体(顺磁性)& 平面型(抗磁性)H 2H 2H 配体异构)配体的构象异构)配合物的多元异构)手性配合物绝对构型的命名(IUPAC)ΔΛΛΔ选取八面体一对相互平行的合适的三角形平面,以M为中心画投影图,按配合物的确定构型联结双齿配体的螯合物位置。








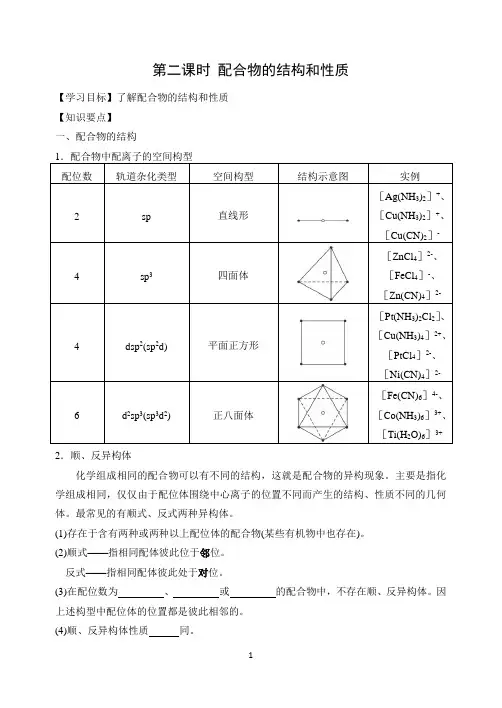
第二课时配合物的结构和性质【学习目标】了解配合物的结构和性质【知识要点】一、配合物的结构2.顺、反异构体化学组成相同的配合物可以有不同的结构,这就是配合物的异构现象。
主要是指化学组成相同,仅仅由于配位体围绕中心离子的位置不同而产生的结构、性质不同的几何体。
最常见的有顺式、反式两种异构体。
(1)存在于含有两种或两种以上配位体的配合物(某些有机物中也存在)。
(2)顺式——指相同配体彼此位于邻位。
反式——指相同配体彼此处于对位。
(3)在配位数为、或的配合物中,不存在顺、反异构体。
因上述构型中配位体的位置都是彼此相邻的。
(4)顺、反异构体性质同。
【基础训练】已知Pt(NH3)2Cl2有顺、反两种异构体A、B,A为棕黄色,有抗癌活性,在水中溶解度为0.2577g,B为淡黄色,无抗癌活性,在水中溶解度为0.0366g。
请指出______是顺式异构体,______是反式异构体,写出表示A、B的空间结构的结构式:A___________________________ B___________________________3.配合物的类型(了解)配合物的范围极广,主要可以分为以下几类:(1)简单配位化合物:指由单基配位体与中心离子配位而形成的配合物。
这类配合物通常配体较多,在溶液中可以逐级解离成一系列配位数不同的配离子。
(2)螯合物:具有环状结构的配合物叫螯合物。
二、配合物的性质:配合物具有一定的稳定性,配合物中的配位键越强,配合物越稳定。
当作为中心原子的金属离子相同时,配合物的稳定性与有关。
如CO与血红素中的Fe2+形成的配位键比O2与Fe2+形成的强。
(1)配位原子的电负性__________________________________________________(2)配位体的碱性____________________________________________________三、配合物的应用1.银镜反应2.Fe3+的检验3.用于离子的检验用可分离CuSO4溶液和Fe2(SO4)3溶液。
第二节配合物的几何结构与异构现象一.知识储备1.配离子或配分子的空间结构根据配合物的配位数,可以判断配离子或配分子的空间结构。
不同配位数的配离子或配分子的空间结构2.配合物的异构现象化学式相同而结构不同的化合物其性质必然不同,此现象称为异构现象,这类化合物彼此称为异构体。
异构分为结构异构和立体异构。
结构异构——电离异构、水合异构、键合异构、配位异构。
立体异构——几何异构、旋光异构。
1.结构异构:组成相同但因原子之间连接方式不同所引起的异构现象。
(1)电离异构:具有相同化学组成的配合物,在溶液中电离时若能生成不同的离子,则这些配合物互为电离异构。
例如:[PtCl2(NH3)4]Br2与[PtBr2(NH3)4]Cl2。
(2)水合异构:当电离异构配合物分子中有一个配体换成水分子时就成为水合异构。
例如:[Cr(H 2O)6]Cl 3(紫色)、[CrCl(H 2O)5]Cl 2.H 2O(亮绿色)与[CrCl 2(H 2O)4]Cl.2H 2O(暗绿色)。
(3)键合异构:有一些配体能够以二种或多种不同方式与中心离子键合。
例如:[Co(NO 2)(NH 3)5]Cl 2(黄褐色)与[Co(ONO)(NH 3)5]Cl 2(红褐色);[Cr(SCN)(H 2O)5]2+与[Co(NCS)(H 2O)5]2+。
(4)配位异构:在由配阳离子和配阴离子组成的盐里,因配体在配阳离子和配阴离子中分配不同而引起的异构现象。
例如:[Co(NH 3)6][Cr(CN)6]与[Cr(NH 3)6] [Co(CN)6];[Cr(NH 3)6]2.立体异构:配体在中心原子周围因排列方式不同而产生的异构现象,称为立体异构。
立体异构分为几何异构和旋光异构。
(1)几何异构(顺—反异构)四配位数的平面四边形配合物可能形成几何异构,而四面体构型的配合物不存在几何异构现象。
几何异构体之间不仅物理性质不同,而且某些化学性质也差别很大。
①平面四边形配合物MA 2B 2型平面四边形配合物有顺式和反式两种异构体。
中心原子杂化轨道类型和配合物的空间构型中心原子杂化轨道类型和配合物的空间构型是化学中两个重要的概念,它们对于理解和预测分子的几何形状和化学性质至关重要。
以下是关于这两个概念的详细解释:1. 中心原子杂化轨道类型:在化学中,杂化轨道理论是用来解释分子几何形状和键合性质的重要理论之一。
根据该理论,中心原子的原子轨道在与其他原子形成化学键时会发生杂化,形成新的杂化轨道。
杂化轨道的类型取决于中心原子的价电子数和与之成键的配体数。
常见的杂化轨道类型包括sp、sp²、sp³、sp³d和sp³d²等。
每种杂化轨道类型都对应着特定的分子几何形状和键角。
例如,sp杂化轨道形成直线型分子(如CO₂),sp²杂化轨道形成平面三角形分子(如BF₃),而sp³杂化轨道则形成四面体形状的分子(如CH₄)。
2. 配合物的空间构型:配合物是由中心原子或离子与一组配体通过配位键结合而成的化合物。
配合物的空间构型取决于中心原子的杂化轨道类型和配体的排列方式。
根据价层电子对互斥理论(VSEPR理论),中心原子的价层电子对会相互排斥,使得分子采取最低能量的几何形状。
在配合物中,中心原子的价层电子对包括与配体形成的配位键电子对和孤对电子。
这些电子对的排斥作用决定了配合物的空间构型。
例如,如果中心原子采用sp³杂化轨道,并且没有孤对电子,那么配合物将呈现四面体构型。
然而,如果存在孤对电子,它们将占据更多的空间,导致分子的几何形状发生扭曲。
综上所述,中心原子的杂化轨道类型和配合物的空间构型是相互关联的。
通过了解中心原子的杂化轨道类型和配体的排列方式,我们可以预测和解释配合物的几何形状和化学性质。