溶解性和溶解度的区别
- 格式:doc
- 大小:23.50 KB
- 文档页数:1



第5节物质的溶解知识点1 物质的溶解性1.溶解性的概念溶解性是指一种物质(溶质)溶解在另一种物质(溶剂)中的能力。
一般情况下,在一定温度下,在一定量的溶剂里溶质溶解的能力是__有限的__。
大多数固体物质,随着温度的升高,溶解能力逐渐增强;常见的固体物质中,氢氧化钙随着温度的升高,溶解能力__减弱。
2.影响固体物质溶解性的因素影响固体物质溶解性的因素有:__溶质__的性质、__溶剂__的性质和温度等。
(1)不同的物质在同一溶剂中的溶解性不同(物质的溶解性与溶质本身的性质有关)。
(2)同一种物质在不同的溶剂中的溶解性不同(物质的溶解性与溶剂的性质有关)。
(3)同一种物质在同一溶剂中的溶解性与__温度__有关。
3.物质溶解时的吸热放热现象有的物质溶解时,会放出热量,使溶液温度升高,如氢氧化钠、浓硫酸等;有的物质溶解时,会吸收热量,使溶液温度降低,如硝酸铵等;也有许多物质溶解时,溶液的温度没有明显变化,如氯化钠等。
知识点2 饱和溶液和不饱和溶液1.概念在一定温度下,在一定量的__溶剂__里,不能继续溶解某种溶质的溶液,称为这种溶质的__饱和__溶液。
还能继续溶解某种溶质的溶液,称为这种溶质的__不饱和__溶液。
说明①必须要指明“一定温度”“一定量的溶剂”,因为溶液是否饱和不仅与温度有关,也与溶剂的量有关。
②必须指明是何种溶质的饱和溶液或不饱和溶液。
例如在一定条件下,某溶液不能再继续溶解硝酸钾但可继续溶解氯化钠,此时的溶液对硝酸钾来说是饱和溶液,但对氯化钠来说就是不饱和溶液。
2.饱和溶液和不饱和溶液的判断在不改变温度等其他条件的情况下,往溶液中继续加入该溶质,看能否继续溶解。
如果能,则原溶液是该溶质的不饱和溶液;如果不能继续溶解,则原溶液是该溶质的饱和溶液。
说明一定温度下,大多数物质在一定量的溶剂中都能形成其饱和溶液,而酒精能与水以任意比例混溶,所以不存在酒精饱和溶液。
3.饱和溶液和不饱和溶液的相互转化(1)一般情况下,对于大多数固体物质来说有以下转化关系:饱和溶液升高温度或增加溶剂增加溶质、蒸发溶剂或降低温度不饱和溶液(2)特殊情况,对于少部分物质(如氢氧化钙)来说,有以下转化关系:饱和溶液增加溶剂或降低温度增加溶质、升高温度或蒸发溶剂不饱和溶液4.浓溶液和稀溶液(1)为了粗略地表示溶液中溶质含量的多少,常把溶液分为浓溶液和稀溶液。




溶解性与溶解度解析
既然在一定温度下,溶质在一定量的溶剂里的溶解量是有限度的,科学上是如何表述和量度这种溶解限度呢?好,那么我们就先来看一下溶解性的概念。
溶解性
通过实验的验证,在相同条件下(温度相同),同一种物质在不同的溶剂里,溶解的能力是各不相同的。
我们通常把一种物质溶解在另一种物质里的能力叫做溶解性。
溶解性的大小跟溶剂和溶质的本性有关。
所以在描述一种物质的溶解性时,必须指明溶剂。
物质的溶解性的大小可以用四个等级来表示:易溶、可溶、微溶、难溶(不溶),很显然,这是一种比较粗略的对物质溶解能力的定性表述。
溶解度
1.固体的溶解度
从溶解性的概念,我们知道了它只是一种比较粗略的对物质溶解能力的定性表述。
也许会有同学问:能不能准确的把物质的溶解能力定量地表示出来呢?答案是肯定的。
这就是我们本节课所要学的溶解度的概念。
溶解度:在一定温度下,某固态物质在100g溶剂中达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂中的溶解度。
在这里要注意:如果没有指明溶剂,通常所说的溶解度就是物质在水里的溶解度。

课题2溶解度一、教学目的要求1.了解饱和溶液的涵义。
2.了解溶解度的涵义,初步学习绘制和查阅溶解度曲线。
二、本课题分析学生虽然对于一般物质溶解后形成溶液的现象比较熟悉,但是对从定量的角度去理解物质的溶解性以及溶液的种种状态却很少思考。
在上一课题中,已从定性的角度研究了溶质放到溶剂中时的一些情况。
但是不是所有物质都能溶解于水呢?在一定量水中是不是能大量溶解某一物质呢?本课题就要研究物质在一定量水中溶解的限度的问题。
本课题分为饱和溶液和溶解度两部分。
以学生亲自参与的两个“活动与探究”和两个“讨论”为线索组织教学过程。
第一个活动后通过讨论引入溶解度概念,再以一个活动巩固和应用溶解度概念。
最后通过讨论又引出气体溶解度的概念。
本课题的重点是建立饱和溶液和溶解度的概念。
教学建议如下:1.学生通过对氯化钠溶于水和硝酸钾溶于水的活动与探究,应该了解:(1)要判断物质的溶解是否有限度,必须确定“一定量溶剂”和“一定温度”这两个条件;(2)当这两个条件不变时,多数物质的溶解有一定的限度。
学生有了这两点理解之后,就比较容易理解:当溶质溶解达到它的限度时,如果条件不变,溶液就处于一种特殊的状态即饱和状态,这时的溶液就是饱和溶液。
如果条件发生变化,如溶剂量或温度发生变化,饱和溶液就有可能变成不饱和溶液。
2.要引导学生结合海水制盐,利用下式理解饱和溶液和不饱和溶液的关系:3.在建立溶解度的概念时,学生对于温度对物质溶解度的影响有一定的生活经验,对于规定“一定的温度”比较容易理解。
但是对于为什么要规定“在100 g溶剂里”,常常缺乏感性的思考依据,对此教师能够用形象的比喻来协助学生思考。
例如,用一杯水和一盆水分别溶解糖和食盐,你能判断糖和食盐的溶解度哪个大吗?如果都用一杯水,你能判断吗?当学生理解应对溶剂量作规定后,教师就能够明确指出,固体物质的溶解度通常用100 g 溶剂为依据,这是人为规定的。
用学生所能接受的事实来比较,能够协助学生对一些科学规定的意义加深理解。


气体的溶解度气体的溶解度大小,首先决定于气体的性质,同时也随着气体的压强和溶剂的温度的不同而变化。
例如,在20℃时,气体的压强为101 kPa,1 L水可以溶解气体的体积是:氨气为702 L,氢气为0.018 19 L,氧气为0.031 02 L。
氨气易溶于水,是因为氨气是极性分子,水也是极性分子,而且氨气分子跟水分子还能形成氢键,发生显著的水合作用,所以,它的溶解度很大;而氢气、氧气是非极性分子,所以在水里的溶解度很小。
当压强一定时,气体的溶解度随着温度的升高而减小。
这一点对气体来说没有例外,因为当温度升高时,气体分子运动速率加大,容易自水面逸出。
当温度一定时,气体的溶解度随着气体的压强的增大而增大。
这是因为当压强增大时,液面上的气体的浓度增大,因此,进入液面的气体分子比从液面逸出的分子多,从而使气体的溶解度变大。
而且,气体的溶解度和该气体的压强(分压)在一定范围内成正比(在气体不跟水发生化学变化的情况下)。
例如,在20℃时,氢气的压强是101 kPa,氢气在1 L水里的溶解度是0.018 19 L;同样在20℃,在2×101 kPa时,氢气在1 L水里的溶解度是0.018 19 L×2=0.036 38 L。
气体的溶解度有两种表示方法,一种是在一定温度下,气体的压强(或称该气体的分压,不包括水蒸气的压强)是101 kPa时,溶解于1体积水里,达到饱和的气体的体积(并需换算成在0 ℃时的体积),即这种气体在水里的溶解度。
另一种气体的溶解度的表示方法是,在一定温度下,该气体在100 g水里,气体的总压强为101 kPa(气体的分压加上当时水蒸气的压强)所溶解的质量,用这种方法表示气体的溶解度就可和教材中固体溶解度的定义统一起来。
气体物质的溶解性和溶解度的关系固体物质的溶解度1.概念在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。
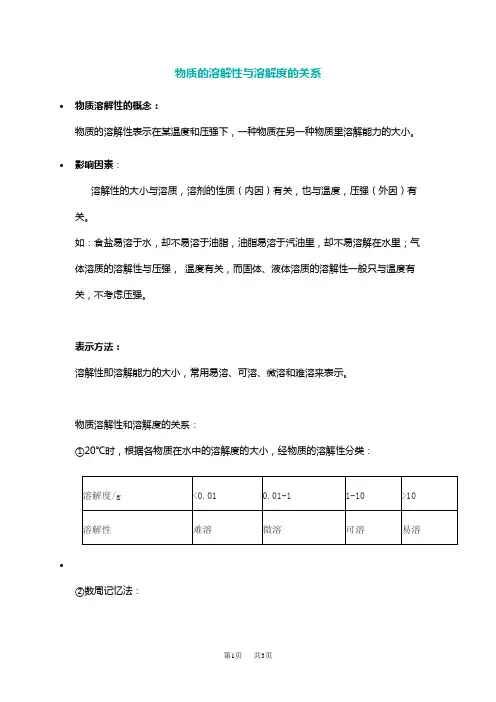
物质的溶解性与溶解度的关系•物质溶解性的概念:物质的溶解性表示在某温度和压强下,一种物质在另一种物质里溶解能力的大小。
•影响因素:溶解性的大小与溶质,溶剂的性质(内因)有关,也与温度,压强(外因)有关。
如:食盐易溶于水,却不易溶于油脂,油脂易溶于汽油里,却不易溶解在水里;气体溶质的溶解性与压强,温度有关,而固体、液体溶质的溶解性一般只与温度有关,不考虑压强。
表示方法:溶解性即溶解能力的大小,常用易溶、可溶、微溶和难溶来表示。
物质溶解性和溶解度的关系:①20℃时,根据各物质在水中的溶解度的大小,经物质的溶解性分类:•②数周记忆法:③绝对不溶于水的物质是不存在的。
习惯上把难溶物质叫做“不溶”物质。
•溶解性和溶解度的理解:溶解性和溶解度都是物质的一种物理性质,不因溶质和溶剂的多少而改变,但与溶剂和溶质的性质有关,并受温度的影响。
溶解性只是一般地说明某种物质在水里溶解能力的大小。
通常用难溶(或不溶)、微溶、可溶、易溶等较粗略的概念表示;溶解度是衡量物质在某种溶剂里溶解性大小的尺度,是溶解性定量的表示方法。
溶解过程中的放热和吸热物质溶解放热和吸热在溶解过程中发生了两种变化,一种是溶质的分子(或离子)在水分子的作用下向水中扩散,这一过程吸收热量;另一种是扩散的溶质的分子(或离子)和水分子作用,生成水和分子(或水和离子),这一过程放出热量。
有的溶质溶解时,扩散过程吸收的热量小于水合过程放出的热量,表现为溶液的温度升高如:NaOH、浓H2SO4;有的溶质溶解时,扩散过程吸收的热量大于水合过程放出的热量,表现为溶液的温度降低。
物质溶解放热、吸热的原因物质溶解时,为什么会有吸热或放热的现象呢?这是因为:物质溶解,一方面是溶质的微粒──分子或离子要克服它们本身的相互之间的吸引力离开溶质,另一方面是溶解了的溶质要扩散到整个溶剂中去,这些过程都需要消耗能量,所以物质溶解时,要吸收热量。
溶解过程中,温度下降原因就在于此。
如果溶解过程只是单纯的扩散,就应该全是吸热的,为什么还有的放热呢?原来,在溶解过程中,溶质的微粒──分子或离子不仅要互相分离而分散到溶剂中去,同时,溶解于溶剂中的溶质微粒也可以和溶剂分子生成溶剂化物(如果溶剂是水,就生成水合物)。
初中化学溶解度知识要点归纳初中化学溶解度知识要点归纳化学是自然科学的一种。
化学是主要在分子、原子层面,研究物质的组成、性质、结构与变化规律的科学。
以下是店铺为大家整理的初中化学溶解度知识要点归纳,希望对大家有所帮助。
初中化学溶解度知识溶解度1、固体的溶解度溶解度定义:在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量四要素:①条件:一定温度②标准:100g溶剂③状态:达到饱和④质量:单位:克溶解度的含义:20℃时NaCl的溶液度为36g含义:在20℃时,在100克水中最多能溶解36克NaCl或在20℃时,NaCl在100克水中达到饱和状态时所溶解的质量为36克2、影响固体溶解度的因素①溶质、溶剂的性质(种类)②温度大多数固体物的溶解度随温度升高而升高;如KNO3少数固体物质的溶解度受温度的影响很小;如NaCl极少数物质溶解度随温度升高而降低。
如Ca(OH)23、溶解度曲线t3℃时A的溶解度为80gP点的的含义在该温度时,A和C的溶解度相同N点为t3℃时A的不饱和溶液,可通过加入A物质,降温,蒸发溶剂的方法使它变为饱和t1℃时A、B、C、溶解度由大到小的顺序C>B>A从A溶液中获取A晶体可用降温结晶的方法获取晶体。
从A溶解度是80g。
t2℃时A、B、C的饱和溶液各W克,降温到t1℃会析出晶体的有A和B无晶体析出的有C,所得溶液中溶质的质量分数由小到大依次为A除去A中的泥沙用过滤法;分离A与B(含量少)的混合物,用结晶法4、气体的溶解度气体溶解度的定义:在压强为101kPa和一定温度时,气体溶解在1体积水里达到饱和状态时的气体体积。
影响因素:①气体的性质②温度(温度越高,气体溶解度越小)③压强(压强越大,气体溶解度越大)5、混合物的分离过滤法:分离可溶物+难溶物结晶法:分离几种可溶性物质结晶的两种方法:①蒸发溶剂,如NaCl(海水晒盐)②降低温度(冷却热的饱和溶液,如KNO3)初三化学基础知识氧气一、氧气的性质【物理性质】密度略大于空气的密度。
难溶电解质的溶解平衡一、难溶电解质的溶解平衡1.固体物质的溶解度(S)与溶解性的关系溶解性难溶微溶可溶易溶S的范围S<0.01 g 0.01 g<S<1 g 1 g <S<10 g S>10 g 2. 溶解平衡状态:在一定温度下,固体溶质在水中形成饱和溶液时,溶液中溶质质量保持不变的状态,该状态下,固体溶质溶解的速率和溶液中溶质分子结晶的速率达到相等,但溶解和结晶仍在进行。
3.沉淀溶解平衡(1)概念在一定温度下,当沉淀溶解和生成的速率相等时,即建立了动态平衡,叫做难溶电解质的溶解平衡。
如AgCl溶于水的溶解平衡表示为:(2)特征逆:沉淀的溶解是一个过程动:动态平衡等:溶解速率和沉淀速率相等定:平衡状态时,溶液中离子的浓度保持不变变:当外界条件改变时,溶解平衡发生移动练习:1.已知溶解平衡Mg(OH)2 Mg2+(aq)+2OH-(aq),请分析当下列条件改变时,对该溶解平衡的影响,填写下表,并归纳其影响因素。
条件改变移动方向c(Mg2+) c(OH-)加水向右减小减小升温向右增大增大加MgCl2(s) 向左增大减小2.从物质类别、变化过程角度分析沉淀溶解平衡与弱电解质的电离平衡有何区别?答案(1)从物质类别看,难溶电解质可以是强电解质,也可以是弱电解质[如BaSO4是强电解质,而Al(OH)3是弱电解质],而难电离物质只能是弱电解质。
(2)从变化的过程来看,沉淀溶解平衡是指已溶解的溶质与未溶解的溶质之间形成沉淀与溶解的平衡状态;而电离平衡则是指已经溶解在溶液中的弱电解质分子与离子之间的转化达到平衡状态。
二、影响沉淀溶解平衡的因素:(1)内因:溶质本身的性质。
绝对不溶的物质是没有的;同是微溶物质,溶解度差别也很大;易溶溶质只要是饱和溶液也存在溶解平衡。
(2)外因:①浓度:加水,平衡向溶解方向移动。
②温度:升温,多数平衡向溶解方向移动;少数平衡向生成沉淀的方向移动,如Ca(OH)2的溶解平衡。
③同离子效应:向平衡体系中加入相同的离子,使平衡向生成沉淀的方向移动。
溶解度的概念是什么意思溶解度的概念是什么意思溶解度,符号S,在一定温度下,某固态物质在100g溶剂中达到饱和状态时所溶解的溶质的质量,叫做这种物质在这种溶剂中的溶解度。
下面是店铺给大家整理的溶解度的概念简介,希望能帮到大家!溶解度的概念1、固体物质的溶解度是指在一定的温度下,某物质在100克溶剂里达到饱和状态时所溶解的克数。
在未注明的情况下,通常溶解度指的是物质在水里的溶解度。
2、气体的溶解度通常指的是该气体(其压强为1标准大气压)在一定温度时溶解在1体积水里的体积数。
通常把在室温(20度)下:溶解度在10g/100g水以上的物质叫易溶物质;溶解度在1~10g/100g水叫可溶物质;溶解度在0.01g~1g/100g水的物质叫微溶物质;溶解度小于0.01g/100g水的物质叫难溶物质.可见溶解是绝对的,不溶解是相对的。
不同状态溶解度的基本情况固体溶解度固体物质的能容溶解度是指在一定的温度下,某物质在100克溶剂里达到饱和状态时所溶解的质量,用字母s表示,其单位是“g/100g 水”。
在未注明的情况下,通常溶解度指的是物质在水里的溶解度。
例如:在20℃时,100g水里最多能溶36g氯化钠(这时溶液达到饱和状态),在20℃时,氯化钠在水里的溶解度是36g。
气体溶解度在一定温度和压强下,气体在一定量溶剂中溶解的最高量称为气体的溶解度。
常用定温下1体积溶剂中所溶解的最多体积数来表示。
如20℃时100mL水中能溶解1.82mL氢气,则表示为1.82mL/100mL 水等。
气体的溶解度除与气体本性、溶剂性质有关外,还与温度、压强有关,其溶解度一般随着温度升高而减少,由于气体溶解时体积变化很大,故其溶解度随压强增大而显著增大。
关于气体溶解于液体的溶解度,在1803年英国化学家W.亨利,根据对稀溶液的研究总结出一条定律,称为亨利定律。
【提示】如果不指明溶剂,通常所说的溶解度是指物质在水里的溶解度。
另外,溶解度不同于溶解速度。
溶解、熔解和融解的区别溶解、熔解和融解的区别融解简介融解,指溶解,融化。
通常由于热的作用而从固态变为液态。
基本解释1. [thaw]∶使[冻结物]变为液体。
要使冰融解就必须升温。
2. [melt]∶通常由于热的作用而从固态变为液态。
冰在阳光下融解。
3. [know]∶通晓了解。
引证解释1. 溶解,融化。
夏衍《复活》第一幕:“春雪已经开始融解,天气还是很冷。
” 吴运铎《把一切献给党劳动的开端》:“冰雪在阳光下融解,变得又松又软。
”2. 消失;消散。
谢觉哉《知识青年参加体力劳动问题》:“少数人在参加体力劳动中冷的情绪,将很快就会在热的气氛中融解掉。
”3. 通晓了解。
黄远庸《外交总长宅中之茶会》:“其谈吐超俗,似於吾国之社会人事不甚融解。
”辨析融解-溶解二者都有化解的意思。
但不同的是“融解”指融化,如:“山顶上的积雪融解了”;“溶解”指固体、液体或气体物质的分子均匀地分布在一种液体中,如“食盐很快就被溶解了”。
化学含义物质由固相转变为液相的过程,叫做“溶解”。
它是凝固的相反过程。
晶体物质在一定压强和一定的温度下,就开始熔解。
在熔解过程中,要吸收热量,这部分热量是熔解热。
尽管晶体物质吸收熔解热而熔解,但其温度不变,直至全部晶体都变成液体时为止。
晶体熔解时对应的温度,称为熔点。
融解的过程:在熔解过程中,吸收热量的多少,只能影响熔解的快慢,而不能影响熔解温度的高低。
这说明晶体在熔解和凝固的过程中具有共同的特征:温度保持不变。
晶体的液态和固态之间有着明显的界限。
这是由于晶体的分子是按一定的规则排列成为空间点阵的。
分子只能在平衡位置附近不停地振动,因此,它具有动能;同时,在空间点阵中,由于分子之间相互作用,它又同时具有势能。
晶体在开始熔解之前,从热源获得的能量,主要是转变为分子的动能,因而使物质的温度升高。
但在熔解开始时,热源传递给它的能量,是使分子的有规则的排列发生变化,分子之间的距离增大以及分子离开原来的平衡位置移动。
溶解性和溶解度的区别
溶解性只是一般地说明某种物质在某种溶剂里溶解能力的大小,是物质的一种物理性质。
通常用易溶、可溶、微溶、难溶或不溶等粗略的概念表示。
溶解度是衡量物质在某种溶剂里溶解性大小的尺度,是溶解性的定量的表示方法,是在一定的温度、压强下,在一定量的溶剂里制成饱和溶液时,所溶解的溶质的量。
溶解性虽然是用易溶、可溶、微溶和难溶等较粗略的概念表示,但它也有在一定范围内定量的意义。
在学习物理性质或某些化学反应时是经常应用的,因此,对这个概念不可忽视。