气体摩尔体积和物质的量浓度(第二课时)解读
- 格式:doc
- 大小:1.09 MB
- 文档页数:8

物质的量(气体摩尔体积、浓度)一 气体摩尔体积1.定义: ,叫做气体摩尔体积。
2.表示符号:3.单位:4.标准状况下,气体摩尔体积约为5.数学表达式:气体的摩尔体积=, 即 【例】判断下列说法是否正确?并说明理由1.常温常压下,11.2L 氧气所含的原子数为N A2.在25℃,压强为1.01×105 Pa 时,11.2L 氮气所含的原子数目为N A3.标准状况下的22.4L 辛烷完全燃烧,生成CO 2分子数为8N A4.标准状况下,11.2L 四氯化碳所含分子数为0.5N A5.标准状况下,1L 水所含分子数为(1/22.4)N A6.标准状况下,11.2L SO 3中含1.5N A 个氧原子二 阿伏加德罗定律及其推论1.阿伏加德罗定律:在同温同压下,同体积的气体含有相同的分子数。
即:T 1=T 2;P 1=P 2 ;V 1=V 2 n 1 = n 22.阿伏加德罗定律的推论:(1)三正比:同温同压下,气体的体积比等于它们的物质的量之比.V 1/V 2=n 1/n 2同温同体积下,气体的压强比等于它们的物质的量之比.p 1/p 2=n 1/n 2同温同压下,气体的密度比等于它们的相对分子质量之比.M 1/M 2=ρ1/ρ2(2)二反比:同温同压下,相同质量的任何气体的体积与它们的相对分子质量成反比.V 1/V 2=M 2/M 1同温同体积时,相同质量的任何气体的压强与它们的摩尔质量的反比.p 1/p 2=M 2/M 1。
(3)一连比:同温同压下,同体积的任何气体的质量比等于它们的相对分子质量之比,也等于它们的密度之比。
m 1/m 2=M 1/M 2=ρ1/ρ2(注:以上用到的符号:ρ为密度,p 为压强,n 为物质的量,M 为摩尔质量,m 为质量,V 为体积,T 为温度;上述定律及其推论仅适用于气体,不适用于固体或液体。
)【例1】(2010上海卷,7)N A 表示阿伏加德罗常数,下列叙述正确的是A .等物质的量的N 2和CO 所含分子数均为N AB .1.7g H 2O 2中含有的电子数为0.9 N AC .1mol Na 2O 2 固体中含离子总数为4 N AD .标准状况下,2.24L 戊烷所含分子数为0.1 N A易错警示:进行阿伏伽德罗常数的正误判断的主要考查点有:①判断一定量的物质所含的某种粒子数目的多少;②物质的组成;③通过阿伏加德罗常数进行一些量之间的换算等,在解题时要抓住其中的易错点,准确解答。



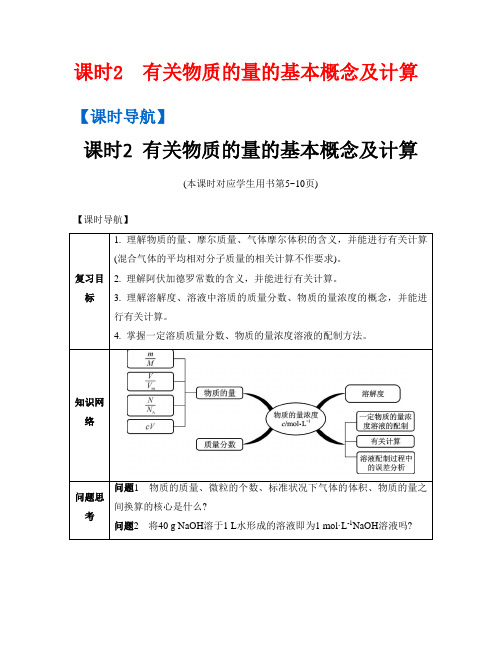
课时2 有关物质的量的基本概念及计算【课时导航】课时2 有关物质的量的基本概念及计算(本课时对应学生用书第5~10页)【课时导航】【自主学习】考点1物质的量【基础梳理】1. 物质的量:是国际单位制中的七个基本物理量之一,符号为。
物质的量用来表示一定数目微粒的集合体,单位是(mol)。
适用于微观粒子或微观粒子的特定组合。
2. 物质的量与微粒数之间的关系:;如果不同物质的物质的量相等,则它们所含有的粒子数目,即12nn=12NN。
3. 摩尔质量:单位物质的量的物质所具有的质量称为该物质的摩尔质量。
符号为M,单位为,计算公式为。
当质量以g为单位时,摩尔质量在数值上等于该物质的。
【举题说法】例题1(2015·南通期中)有下列物质:①8.5 g NH3、②标准状况下22.4 L H2、③4 ℃时10 mL H2O、④0.2 mol H3PO4,按所含分子数由多到少的顺序排列正确的是()A. ①④③②B. ④③②①C. ②③①④D. ①②③④【答案】 C【解析】物质的量与分子数成正比,物质的量分别为①0.5 mol、②1 mol、③0.56 mol、④0.2 mol,所以分子数由多到少的顺序正确的是C。
变式1(2015·海南高考)下列指定微粒的数目相等的是()A. 等物质的量的水与重水含有的中子数B. 等质量的乙烯和丙烯中含有的共有电子对数C. 同温、同压、同体积的CO 和NO 含有的质子数D. 等物质的量的铁和铝分别与足量氯气完全反应时转移的电子数 【答案】 BD【解析】 H 2O 中的中子数为8,D 2O 中的中子数为10,则等物质的量的水与重水含有的中子数不同,A 错;乙烯和丙烯的最简式均为CH 2,由n =mM 可知,等质量时含CH 2的个数相同,1个C 2H 4分子共用6对电子,1个C 3H 6分子共用9对电子,因此可以发现规律:1个CH 2平均共用3对电子,含CH 2的个数相同则共有电子对数相同,B 正确;同温、同压、同体积,由n =m VV 可知,气体的物质的量相同,C 、N 的质子数不同,则CO 和NO 含有的质子数不同,C 错;铁和铝分别与足量氯气完全反应,Fe 、Al 元素的化合价均由0升高为+3价,则等物质的量的铁和铝分别与足量氯气完全反应时转移的电子数相等,D 正确。

第二章海水中的重要元素——钠和氯第三节物质的量第2课时气体摩尔体积一、单选题1.设N A为阿伏加德罗常数的值,下述正确的是()A.64g二氧化硫含有原子数为3N AB.O2气体的摩尔质量为36gC.标准状况下,11.2L水含分子数为0.5 N AD.摩尔是国际单位制中七个基本物理量之一【正确答案】A【详细解析】A.64g SO2的物质的量为1mol,则含有原子3mol,则原子个数为3N A,A正确;B.O2气体的摩尔质量为36g/mol,B错误;C.标准状况下,水为液体,不能计算其物质的量,C错误;D.摩尔是物质的量的单位,而物质的量才是国际单位制中七个基本物理量之一,D错误;2.下列叙述正确的是()A.1molH2O的质量为18g/molB.CH4的相对分子质量为16C.3.01×1023个SO2分子的体积为11.2LD.标准状况下,1mol任何物质体积均为22.4L【正确答案】B【详细解析】A.质量的单位为g,1molH2O的质量为18g,故A错误;B.CH4的相对分子质量为16,故B正确;C. 3.01×1023个SO2分子即0.5mol SO2,但没有指明标况下,无法计算体积,故C错误;D. 标准状况下,1mol气体的体积均为22.4L,故D错误;3.(2020·北京高一期末)关于1molH2O的下列说法中,不正确...的是()A.质量为18g B.含氧原子数约为6.02×1023C.含电子数约为10×6.02×1023D.标准状况下的体积约为22.4L【正确答案】D 【详细解析】A. 1molH 2O 的质量为:m=n ∙M=1mol×18g/mol=18g,A 正确;B. 1molH 2O 中含氧原子数目为:23123A ·1mol 6.0210mol 6.0210N n N -==⨯⨯=⨯,B 正确;C. 1molH 2O 中含电子数目为:23123A ·10mol 6.0210mol 10 6.0210N n N -==⨯⨯=⨯⨯,C 正确;D. 标准状况下,H 2O 是液体,不能用m ·V nV=计算,D 错误; 4.( 2020·河北深州市中学高一期末)设N A 表示阿伏伽德罗常数的值,下列说法正确..的是( ) A .常温常压下,14g 有N 2与CO 组成的混合气体含有的原子数目为N A 个 B .0.5molO 3与11.2LO 2所含的分子数一定相等 C .标准状况下,22.4 L 四氯化碳的分子数为N AD .用16.25gFeCl 3制备Fe(OH)3胶体,Fe(OH)3胶体粒子数为0.1N A 个 【正确答案】A 【详细解析】A. 常温常压下,N 2与CO 的摩尔质量均为28g/mol,且为双原子分子,则14g 有N 2与CO 组成的混合气体的物质的量为0.5mol,含有的原子数目为N A 个,符合题意,A 正确;B. 0.5molO 3与标况下的11.2LO 2所含的分子数一定相等,与题意不符,B 错误;C. 标准状况下,四氯化碳为液态,22.4 L 的四氯化碳含有的分子数大于N A ,与题意不符,C 错误;D. 用16.25gFeCl 3制备Fe(OH)3胶体,Fe(OH)3胶体粒子不一定为一个Fe(OH)3,则胶粒数无法确定,与题意不符,D 错误; 正确答案为A 。
第2课时 物质的量在化学方程式计算中的应用(1)已知物质的质量m (B),n (B)=m (B )M。
(2)已知标准状况时的气体体积V [B(g)],n (B)=V [B (g )]V m。
(3)已知物质的粒子数N (B),n (B)=N (B )N A。
(4)已知溶液中溶质的物质的量浓度c (B),n (B)=c (B)·V 。
2.物质的量在化学方程式计算中的应用比。
(2)在同温同压下,气态物质的分子数之比=物质的量之比=体积之比。
(3)化学方程式除可以表示反应物、生成物的粒子数目关系和质量关系外,还可以表示它们的物质的量关系,如H 2+Cl 2=====点燃2HCl 可表示1__mol__H 2与1__mol__Cl 2在点燃的条件下完全反应生成2__mol__HCl 。
物质的量应用于化学方程式计算的步骤和类型1.基本步骤 2.计算类型 (1)基本计算已知一种反应物(或生成物)的量求解其他物质的有关量,此时,只要按照化学方程式中量的关系,列出已知物质和待求物质的比例式计算便可。
(2)混合物反应的计算设混合物中各物质的物质的量为x 、y ,按照化学方程式中量的关系,并用x 、y 表示,列出方程组解答。
(3)过量计算给出了两种反应物的量,求解某产物的量。
方法:按照化学方程式中量的关系进行判断,哪一种物质过量,然后根据不足的物质的量进行求解。
(1)计算时,各物质不一定都用物质的量表示,也可以用物质的质量、气体的体积,但要注意各物质的物质的量与各物理量的换算关系。
(2)在化学方程式中列出的各量,同种物质的单位必须相同,不同物质的单位可以相同,也可以不同,但单位必须“上下统一”。
(3)列式求解时要注意所有的数值要带单位,同时注意有效数字的处理。
【素养升华】 证据推理:以实例明确根据化学方程式计算的基本步骤 实例:计算0.1 mol 金属钠与水反应,在标准状况下生成氢气多少升? ①根据题意写出配平的化学方程式。
第1讲物质的量气体摩尔体积[考纲要求]1.了解物质的量(n)及其单位摩尔(mol)、摩尔质量(M)、气体摩尔体积(V m)、阿伏加德罗常数(N A)的含义。
2.能根据微粒(原子、分子、离子等)物质的量数目、气体体积(标准状况下)之间的相互关系进行有关计算。
考点一物质的量摩尔质量知识梳理1.物质的量、摩尔、阿伏加德罗常数(1)基本概念间的关系(2)物质的量的规范表示方法:如:1 mol Fe、1 mol O2、1 mol Na+或钠离子。
(3)物质的量与微粒个数、阿伏加德罗常数之间的关系为:n=__________。
2.摩尔质量[判断](正确的打“√”,错误的打“×”)(1)1 mol任何物质都含有6.02×1023个分子()(2)1 mol水中含有2 mol氢和1 mol氧()(3)NaOH的摩尔质量为40 g()(4)1 mol O2的质量与它的相对分子质量相等()(5)1 mol OH-的质量为17 g·mol-1()(6)氖气的摩尔质量(单位g·mol-1)在数值上等于它的相对原子质量()(7)2 mol H2O的摩尔质量是1 mol H2O的摩尔质量的2倍()(8)106 g碳酸钠中离子总数为3N A()[提醒]1.阿伏加德罗常数有单位,应写为6.02×1023 mol-1,不能仅写数值6.02×1023。
2.摩尔质量的单位是g·mol-1或kg·mol-1,相对原子(或分子)质量的单位为1,不是同一个物理量。
摩尔质量只有当以g·mol-1作单位时,在数值上才等于其相对原子(或分子)质量。
对点速练练点一“n、mol、N A、M”的判断计算1.下列说法中正确的是()A.摩尔是可以把物质的质量与微观粒子数联系起来的一个基本物理量B.0.012 kg12C中所含的碳原子数为N AC.物质的摩尔质量等于其相对分子(原子)质量D.1 mol任何物质都含有约6.02×1023个原子2.(1)含6.02×1023个中子的Li37的质量是________g。