物质的量气体摩尔体积
- 格式:docx
- 大小:543.45 KB
- 文档页数:21

高考化学一轮复习—物质的量气体摩尔体积【课标要求】 1.了解物质的量(n)及其单位摩尔(mol)、摩尔质量、气体摩尔体积、阿伏加德罗常数(N A)的含义。
2.能根据微粒(原子、分子、离子等)物质的量、数目、气体体积(标准状况下)之间的相互关系进行有关计算。
一、物质的量、阿伏加德罗常数1.基本概念2.物质的量的规范表示方法。
3.物质的量与粒子数、阿伏加德罗常数之间的关系n=NN A或N=n·N A【诊断1】判断下列叙述的正误(正确的划“√”,错误的划“×”)。
(1)1mol H含有2×6.02×1023个电子(×)(2)等物质的量的O2与O3,所含氧原子数相同(×)(3)1mol H2O中含有2mol氢和1mol氧(×)(4)1mol SiO 2和1mol CO 2含有相同的分子数(×)二、摩尔质量1.概念:单位物质的量的物质所具有的质量。
符号:M ,单位:g·mol -1。
2.数值:当粒子的摩尔质量以g·mol -1为单位时,在数值上等于该粒子的相对分子(或原子)质量。
3.关系:物质的量(n )、质量(m )与摩尔质量(M )之间的关系为n =m M或m =n ·M 。
4.计算气体摩尔质量的五种方法(1)根据物质的质量(m )和物质的量(n ):M =m n 。
(2)根据一定质量(m )的物质中微粒数目(N )和阿伏加德罗常数(N A ):M =N A ·m N。
(3)根据标准状况下气体的密度ρ:M =ρ(g·L -1)×22.4(L·mol -1)。
仅适用于标况下的气体(4)根据同温同压下气体的相对密度(D =ρ1ρ2):M 1M 2=D 。
(5)对于混合气体,求其平均摩尔质量,上述计算式仍然成立,还可以用下式计算:M =M 1×a %+M 2×b %+M 3×c %……,a %、b %、c %指混合物中各成分的物质的量分数(或体积分数)。

高考化学复习物质的量和气体摩尔体积知识点单位物质的量的理想气体所占的体积叫做气体摩尔体积。
以下是物质的量和气体摩尔体积知识点,请考生认真复习。
一、相关概念1.关于物质的量及其单位的明白得物质的量是国际单位制的7种差不多量之一,是表示物质所含微粒多少的物理量。
摩尔是物质的量的单位,每摩尔物质含有阿佛加德罗常数个微粒,即0.012kg12C所含的碳原子数,约为6.021023,单位:mol-1。
2.关于摩尔质量的明白得人们将单位物质的量的物质所具有的质量叫做摩尔质量,它的常用单位为g/mol;当以克为单位时在数值上等于1mol物质所具有的质量,也等于该微粒的相对质量。
物质的量(n)、物质的质量(m)和物质的摩尔质量(M)之间存在着以下关系:n=m/M3.关于气体摩尔体积的明白得(1)含义:在相同的温度和压强下,1摩尔任何气体所占有的体积在数值上近似相等。
人们将一定的温度和压强下,单位物质的量的气体所占的体积叫做气体摩尔体积,它的常用单位是:L/mol。
(2)气体摩尔体积是一个与温度、压强相关的物理量;一定温度、压强下气体摩尔体积是一个定值。
(3)22.4L/mol是气体在特定条件下(即标况下)的气体摩尔体积,不能笼统地认为气体摩尔体积确实是22.4L/mol。
二、本部分内容经常以选择题形式出现,即以NA为背景的选择题一直是全国各地高考命题的热点,现将这部分知识常考查的知识点归纳如下:1.在标况下(0oC,1.01105Pa),1mol任何气体所占的体积均约为22.4L,围绕这句话是高考命题的最热点;关于这句话要同时具备三个要点:①在标准状况下②1摩尔任何气体(包括混合气体)③体积约是22.4L。
在解相关问题时,只要有一个要点被忽略,会专门大可能导致选出错误选项,一定要当心!如论述对象不是气体、所述体积不是标况下的体积等等。
为此,要专门注意以下物质在标况下的状态:H2O(固、液混合)、SO3(固)、Br2(液)、CH3OH(液)、碳原子数5的烃为液态或固态、CHCl3(液);HCHO(气)、CH3Cl(气)例1.NA代表阿佛加德罗常数,下列说法正确的是( )A。


第1讲物质的量和气体摩尔体积一、物质的量:1.阿佛加德罗常数2.摩尔:3.物质的量:用来衡量物质含有阿伏加得罗常数个微粒的物理量说明:①物质的量是国际单位制中的7个基本物理量之一②4.摩尔质量:二、关于物质的量的应用1.微粒数、质量、物质的量之间的关系2.在化学方程式中的应用1.填空(1)1molH2O含有_________水分子;0.5molH2O含有________个水分子,1molH2O含有___mol质子_______mol电子______mol原子。
(2)1molH2SO4分子含有_______个H2SO4分子;______mol氢原子;_______个硫原子______mol氧原子;和_____molCO2分子所含有的氧原子数相等。
(3)0.5molSO2含有________个硫原子________个氧原子和______molSO3所含有的硫原子个数相同(4)3.01×1023个OH—中质子的物质的量为_______mol,电子的物质的量为______mol,它与______molNH3具有相同的电子数气体是多少克?4.相等物质的量的CO和CO2相比较,下列有关叙述中正确的是①它们所含的分子数目之比为1∶1②它们所含的O原子数目之比为1∶2③它们所含的C原子数目之比为1∶1④它们所含的原子总数目之比为2∶3⑤它们所含的电子数目之比为7∶115.下列哪种物质所含原子数与0.2mol H3PO4所含原子数相等A.0.4mol H2O2B.1.204 × 1023 H2SO4C.0.4mol HCl D.1.806×1023HNO36.下列数量的各物质中,含原子个数最多的是A.1mol HCl B.3.01 × 1023个水分子C.12g 12C D.0.5mol CH4 7.a molH2SO4中含有b个氧原子,则阿伏加德罗常数可以表示为)A.a/4b mol-1 B.b/4a mol-1 C.a/b mol-1 D.b/a mol-1 8.由Na2O和Na2O2组成的混合物质量为35.8 g,此混合物中氧元素的质量为12.8g。


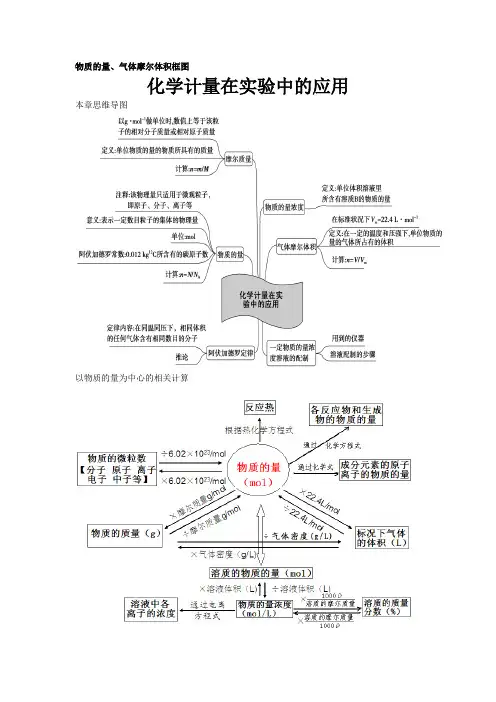
物质的量、气体摩尔体积框图化学计量在实验中的应用本章思维导图以物质的量为中心的相关计算①、定义:表示含有一定数目粒子的集体。
②、符号:n物质的量 ③、单位:摩尔、摩、符号mol ④、1mol 任何粒子(分、原、离、电、质、中子)数与0.012kg 12C 中所含碳原子数相同。
⑤、、架起微观粒子与宏观物质之间联系的桥梁。
①、定义:1mol 任何粒子的粒子数叫阿伏加德罗常数。
阿伏加德罗常数: ②、符号N A③、近似值:6.02×1023①、定义:单位物质的量气体所占的体积叫~基本概念 气体摩尔体积: ②、符号:Vm③、单位:L·mol -1①、定义:单位物质的量物质所具有的质量叫~摩尔质量: ②、符号:M ③、单位:g·mol -1或kg·mol -1④、若以g·mol -1为单位,数值上与该物质相对原子质量或相对分子质量相等。
B 的物质的量来表示溶液组成的物理量叫溶质B 的物质的量浓度。
物质的量浓度:②、符号:c(B)mol·L -1①、定律:在相同温度和压强下,相同体积的作何气体都含有相同数目的分子。
同温同压下:212121N N =n n =V V ②、推论: 同温同压下:212121Mr Mr =M M =ρρ 同温同体积下:212121N N =n n =P P Ⅰ、气体休的密度和相对密度:标况下:1-L •g 4.22Mr =mol•.4L 22M =)(ρ气体 A 气体对B 气体的相对密度:)B (M )A (M =)B (ρ)A (ρ=)B (D Ⅱ、摩尔质量M (或平均摩尔质量M —)M=22.4L ·mol -1×ρ,•••+)B (n +)A (n •••+)B (M •)B (n +)A (M •)A (n =M — M —=M(A)ф(A)+M(B)ф(B)+··· ф为体积分数。

第一节 物质的量 气体摩尔体积1.物质的量、阿伏加德罗常数注意:(1)使用摩尔作单位时,必须指定化学式或指明微粒的种类,如1 mol H 不能描述为1 mol 氢等。
(2)阿伏加德罗常数有单位,单位为mol -1,不能仅写数值6.02×1023。
2.摩尔质量(1)概念:单位物质的量的物质所具有的质量,符号为M ,单位为g/mol 或g·mol -1。
(2)数值:当微粒的摩尔质量以g·mol -1为单位时,在数值上等于该微粒的相对分子(原子)质量。
(3)关系:物质的量、物质的质量与摩尔质量关系为n =m M或M =m n或m =n ·M 。
注意:(1)摩尔质量、相对分子质量、质量是三个不同的物理量,具有不同的单位。
如H 2O 的摩尔质量为18 g·mol -1,H 2O 的相对分子质量为18,1 mol H 2O 的质量为18 g 。
(2)摩尔质量与温度、压强、物质的量多少无关。
[应用体验]1.正误判断(正确的打“√”,错误的打“×”)(1)1 mol OH -的质量是17 g·mol -1。
( )(2)N A 代表阿伏加德罗常数,22 g CO 2中含有的氧原子数为N A 。
( )(3)n mol O 2中分子数为N ,则阿伏加德罗常数为N n。
( ) 答案:(1)× (2)√ (3)×2.(1)硫酸钠(Na 2SO 4)的摩尔质量为________;71 g Na 2SO 4中含钠离子的物质的量为________,氧原子的物质的量为________。
(2)49 g H 3PO 4的物质的量为________,用N A 表示阿伏加德罗常数的值,其中含有________个H ,含________个O 。
答案:(1)142 g·mol -1 1 mol 2 mol (2)0.5 mol 1.5N A 或1.5×6.02×1023 2N A 或2×6.02×1023⊙考法1 物质的量、摩尔质量的有关概念1.下列说法不正确的是( )A .物质的量是描述微观粒子集合体的物理量B .阿伏加德罗常数就是6.02×1023C .1 mol CO 2与1 mol CO 含有的分子数目相等D .SO 2-4的摩尔质量为96 g·mol -1B [阿伏加德罗常数为物理量,单位为mol -1。


气体摩尔体积换算公式在咱们学习化学的这个奇妙旅程中,有一个特别重要的概念,那就是气体摩尔体积换算公式。
这玩意儿可有意思啦,它就像是一把神奇的钥匙,能帮咱们打开理解气体世界的大门。
先来说说啥是气体摩尔体积。
简单点儿讲,气体摩尔体积就是指单位物质的量的气体所占的体积。
在标准状况下,也就是 0℃和 101kPa 时,1 摩尔任何理想气体所占的体积都约为 22.4 升。
这就好比,一堆相同的“气体小分子”整齐地排好队,它们所占的空间大小就有个固定的数。
那气体摩尔体积换算公式是啥呢?就是 V = n × Vm 。
这里的 V 代表气体体积,n 是气体的物质的量,Vm 就是气体摩尔体积。
我记得有一次给学生们讲这个知识点的时候,有个小同学一脸懵地问我:“老师,这咋这么难理解啊?”我笑着跟他说:“别着急,咱们来做个小实验。
”于是我拿出了两个气球,一个充了很少的气,一个充得鼓鼓的。
我问同学们:“这两个气球里的气体,哪个物质的量多呀?”同学们七嘴八舌地讨论起来。
然后我再解释:“就像这气球,充的气多,就相当于物质的量多,体积也就大,这和气体摩尔体积的关系是一样的。
”在实际生活中,这个公式也特别有用。
比如说,咱们要知道一个充满氧气的钢瓶能提供多少氧气,那就可以用这个公式来算一算。
假设钢瓶里氧气的物质的量是 5 摩尔,那根据气体摩尔体积换算公式,体积 V 就等于 5×22.4 升 = 112 升。
是不是一下子就清楚啦?再比如说,工厂里要控制气体的用量,也得靠这个公式来帮忙。
知道了需要多少体积的某种气体,就能算出需要准备多少物质的量的这种气体原料。
学习气体摩尔体积换算公式,不能光死记硬背,得理解着来。
多做几道练习题,多想想生活中的例子,慢慢地就能熟练掌握啦。
总之,气体摩尔体积换算公式虽然看起来有点复杂,但只要咱们用心去学,多思考多练习,它就能成为咱们手中的利器,让咱们在化学的世界里畅游无阻。
希望同学们都能把这个知识点牢牢掌握,为今后的学习打下坚实的基础!。

物质的量气体摩尔体积安徽省郎溪中学化学备课组一、考点分析二、教材回顾三、温馨提示四、练习斩获五、教学反思1.了解物质的量的单位——摩尔(mol)、摩尔质量、气体摩尔体积、阿伏伽德罗常数的含义。
2.根据物质的量与粒子(原子、分子、离子等)数目、气体体积(标准状况下)之间的相互关系进行有关计算。
3.以物质的量为核心的各物理量之间的相互换算。
4.结合基本概念、基本理论、元素化合物知识考查阿伏伽德罗常数的具体应用。
5.气体摩尔体积的概念辨析及在化学计算中的应用。
1.物质的量物质的量表示含有一定数目粒子的微粒集体。
物质的量的符号为n,其单位是摩尔,简称摩,符号为mol。
1 mol任何粒子的粒子数与0.012kg12C中所含的碳原子数相同.这里的粒子指分子、原子、离子、电子、质子、中子或它们的特定组合等。
与可称量的物质联系起来。
2. 阿伏加德罗常数(1)规定:0.012 kg12C所含的原子数为阿伏加德罗常数个,约为6.02×1023个。
把含有6.02×1023个粒子的任何粒子集体的物质的量计量为1 mol,6.02×1023mol-1叫做阿伏加德罗常数。
(2)符号:N。
A)与微粒数(N)间关(3)物质的量(n)、阿伏加德罗常数(NA。
系为:n=N/NA3.摩尔质量(1)概念:单位物质的量的物质所具有的质量。
(2)符号:M 。
(3)单位:g/mol。
(4)当摩尔质量以g·mol-1为单位时,在数值上与该物质的相对原子质量或相对分子质量相等。
(5)物质的量、物质的质量和摩尔质量间的关系为:n=m/M。
想一想1 mol氢这种说法正确吗?如何表示1 mol氢原子、1 mol氢分子、1 mol氢离子?提示:不正确。
1 mol氢,没有指明是氢分子、氢原子还是氢离子。
1 mol氢原子、1 mol氢分子、1 mol氢离子应分别表示为1 mol H、1 mol H2、1 mol H+。
物质的量气体摩尔体积公式1. 物质的量到底是个啥?说到“物质的量”,你可能会想,“这是什么高深的玩意儿啊?”其实,它就是我们用来描述物质数量的一个好帮手。
想象一下你在市场上买苹果,买的多了、少了,当然得有个标准对吧?物质的量就是这样的标准,用“摩尔”这个单位来表示。
一个摩尔的物质,差不多是6.02乘以10的23次方个粒子,听起来是不是有点夸张?但就是这么神奇!不管是原子、分子,还是离子,统统都可以用摩尔来计算。
就像我们说一斤苹果和一斤香蕉,没什么区别,只是名称不一样而已。
1.1 摩尔的由来说到“摩尔”,这个名字其实是个“翻译官”。
最开始是德国化学家阿伏伽德罗,提出了粒子的概念,后来大家就用摩尔来表示。
这下可好,科学家们有了共同的语言,再也不怕沟通不畅了!在化学反应中,如果你听说某个反应需要2摩尔的氢气,那就意味着需要一大堆氢分子来参与战斗。
哦,对了,大家可千万别觉得摩尔是个死数字,它可是活的,能和你一起做化学反应,带来各种惊喜!1.2 气体的摩尔体积说完物质的量,咱们再来聊聊“气体的摩尔体积”。
在标准状态下(温度0℃,压力1个大气压),任何气体的一个摩尔体积差不多是22.4升。
这就像是一条宽敞的大路,无论是小汽车还是大卡车,都是可以通行的!而且,这个22.4升的体积,简直就像是气体的身份证,不管是什么气体,只要到了这个标准状态,就都能用它来算大小。
想想看,真是个不错的“公路”!无论你是在实验室里做实验,还是在厨房里做饭,气体摩尔体积都能帮你轻松搞定。
2. 生活中的应用生活中,气体摩尔体积的概念也随处可见。
比如,你在家里做饭,想用氧气来帮助食物更好地燃烧,或者你在外面烧烤,想要知道需要多少气体来让火更旺。
其实,都是在和摩尔体积打交道呀!你想啊,如果你知道每摩尔气体占多少空间,就能准确计算出你需要的气体量,避免浪费。
这就像买菜一样,精打细算,让每一分钱都花在刀刃上。
2.1 实验室的好帮手在实验室里,气体摩尔体积更是化学反应的“导航员”。
物质的量与气体摩尔体积的关系嘿,大家好!今天咱们来聊聊“物质的量”跟“气体摩尔体积”之间的关系,这听起来像是科学课上的话题,不过别担心,我会尽量把它变得轻松有趣。
物质的量,这玩意儿就像是我们买菜时,称重的那一刻,想象一下,挑了个大西瓜,称重时心里那份期待,哇,真是有点小兴奋呢!物质的量,简而言之,就是说你有多少的某种东西,通常用摩尔这个单位来表示。
嘿,摩尔可不是个啥难懂的东西,1摩尔大概就是6.02×10²³个粒子,也就是咱们说的阿伏伽德罗常数,想想看,这个数字有多庞大,几乎就是个宇宙级的数字了。
气体摩尔体积就更好理解了,这个东西就像是你买了一大桶汽水,气体摩尔体积就是指在一定的温度和压力下,1摩尔气体占据的空间。
一般情况下,在标准状态下(0°C,1个大气压),气体摩尔体积差不多是22.4升。
要是你心里开始想,哇,这么大的空间,难怪我喝完饮料后,感觉肚子鼓鼓的,哈哈!这22.4升的气体,想象一下,有多么的“宽敞”,就像是咱们和朋友一起在外面聚餐时,肆意挥洒的快乐一样,空气中的每一口都是自由的象征。
这物质的量和气体摩尔体积之间到底有啥关系呢?简单说,就是它们就像一对好朋友,互相依存又密不可分。
举个简单的例子,你今天想炸一份薯条,首先得有土豆吧。
假设你有2摩尔的土豆,这就意味着你有2×6.02×10²³个土豆,哇,这得炸多少个薯条啊!现在你把这些土豆放进热油里,结果油烟四起,香气扑鼻,简直让人受不了,光是想想就流口水。
不过,这些土豆可不是我们今天的主角,主角是气体!想想那些炸薯条时冒出的热气,正是气体摩尔体积在发挥作用。
只要你有足够的土豆,就会产生足够的气体,这些气体也需要空间啊,这就涉及到摩尔体积的大小了。
再想象一下,如果你用的是不同种类的气体,比如二氧化碳,那它的摩尔体积和你用空气时会有所不同。
嘿,有趣的是,二氧化碳可比空气重,所以同样的物质的量,体积可能会变得更小一些。
物质的量气体摩尔体积 公司标准化编码 [QQX96QT-XQQB89Q8-NQQJ6Q8-MQM9N] 第3讲 物质的量 气体摩尔体积 考纲要求 1.了解物质的量(n)及其单位摩尔(mol)、摩尔质量(M)、气体摩尔体积(Vm)、物质的量浓度(c)、阿伏加德罗常数(NA)的含义。2.能根据微粒(原子、分子、离子等)数目、物质的量、气体体积(标准状况下)之间的相互关系进行有关计算。
考点一 物质的量、气体摩尔体积
1.物质的量 (1)物质的量(n) 物质的量是表示含有一定数目粒子的集合体的物理量,单位为摩尔(mol)。 (2)物质的量的规范表示方法:
(3)阿伏加德罗常数(NA) 0.012 kg 12C中所含的碳原子数为阿伏加德罗常数,其数值约为×1023,单位为mol-1。公
式:NA=Nn。 2.摩尔质量 (1)摩尔质量是单位物质的量的物质所具有的质量。常用的单位是 g·mol-1。公式:M=mn。 (2)数值:以 g·mol-1为单位时,任何粒子的摩尔质量在数值上都等于该粒子的相对分子(原子)质量。 3.气体摩尔体积 (1)影响物质体积大小的因素 ①微粒的大小(物质的本性);②微粒间距的大小(由温度与压强共同决定);③微粒的数目(物质的量的大小)。 (2)含义:单位物质的量的气体所占的体积,符号为Vm,标准状况下,Vm约为 ·mol-1。
(3)基本关系式:n=VVm=mM=NNA (4)影响因素:气体摩尔体积的数值不是固定不变的,它决定于气体所处的温度和压强。 4.阿伏加德罗定律及其推论 (1)阿伏加德罗定律:同温同压下,相同体积的任何气体,含有相同数目的分子(或气体的物 质的量相同)。 (2)阿伏加德罗定律的推论 相同 条件 结论公式 语言叙述
T、p 相同 n1n2=V
1
V2
同温、同压下,气体的体积与其物质的量成正比
T、V 相同 p1p2=n
1
n2
温度、体积相同的气体,其压强与其物质的量成正比
T、p 相同 ρ1ρ2=M
1
M2
同温、同压下,气体的密度与其摩尔质量(或相对分子质量)成正比
提醒 对于同一种气体,当压强相同时,密度与温度成反比例关系。 物质的量、摩尔质量、气体摩尔体积概念的理解 (1)2 g氦气所含的原子数目约为××1023( ) (2)1 mol任何物质都含有×1023个分子( ) (3)在标准状况下,1 mol O2 与1 mol SO3的体积相同( ) (4)在标准状况下,1 mol气体的体积约是 L,在非标准状况下,1 mol气体的体积则一定不是 L( ) (5)标准状况下,O2和O3中氧原子的摩尔质量均为16 g·mol-1( ) (6)常温常压下,14 g N2与7 g乙烯(C2H4)所含原子数相同( ) (7)22 g CO2与标准状况下 L HCl所含的分子数相同( ) 答案 (1)√ (2)× (3)× (4)× (5)√ (6)× (7)√
题组一 有关n=mM=NNA=VVm的计算 1.(1)含×1023个中子的73Li的质量是________g。 (2)4 g D2和20 g 18O2的单质化合时最多能生成________________gD218O。 (3)若 g Na2X中含有 mol钠离子,Na2X的摩尔质量是________,X的相对原子质量是________。
答案 (1)74 (2)22 (3)62 g·mol-1 16
解析 (1)根据n=NNA计算中子物质的量,73Li的中子数为7-3=4,进而计算Li的物质的 量,再根据m=nM计算。 (2)根据不足量的物质计算生成D182O的质量;18O2过量。 (3)1 mol Na2X中含有2 mol钠离子, mol Na2X中含有 mol钠离子,则Na2X的摩尔质量为M(Na2X)=错误!=62 g·mol-1;X的相对原子质量=62-46=16。
2.CO和CO2的混合气体18 g,完全燃烧后测得CO2体积为 L(标准状况), (1)混合气体中CO的质量是________g。 (2)混合气体中CO2在标准状况下的体积是________L。 (3)混合气体在标准状况下的密度是________g·L-1。 (4)混合气体的平均摩尔质量是________g·mol-1。 答案 (1)7 (2) (3) (4)36 解析 CO燃烧发生反应:2CO+O2=====点燃2CO2,CO的体积与生成CO2的体积相等,燃烧后CO2
的总体积为 L,故18 g CO和CO2的混合气体的总体积为 L,在标准状况下,18 g CO和CO2
的混合气体的物质的量为 mol,设CO的物质的量为x mol,CO2的物质的量为y mol,
则错误!,解得x=,y=。 (1)混合气体中CO的质量=28 g·mol-1× mol=7 g。 (2)原混合气体中,CO2的体积为 mol× L·mol-1= L。
(3)原混合气体的密度=18 g L≈ g·L-1。 (4)解法一:M=ρ· L·mol-1= g·L-1× L·mol-1≈36 g·mol-1; 解法二:M=错误!=36 g·mol-1; 解法三:M=28 g·mol-1×50%+44 g·mol-1×50%=36 g·mol-1; 故平均摩尔质量为36 g·mol-1。 3.(2017·长沙市第一中学高三检测)1个某种氯原子的质量是a g,1个12C原子的质量是b g,用NA表示阿伏加德罗常数的值,下列说法中正确的是( ) ①该氯原子的相对原子质量为12a/b ②m g该氯原子的物质的量为m/(aNA) mol ③该氯原子的摩尔质量是aNA g ④a g该氯原子所含的电子数为17 mol A.①③ B.②④ C.①② D.②③ 答案 C
解析 ①该原子的相对原子质量为一个氯原子的质量与一个12C质量的112的比值,即ab12=
12ab,正确;②阿伏加德罗常数个氯原子的质量,即为1 mol该氯原子的质量,因而该氯原 子摩尔质量为aNA g·mol-1,n(Cl)=maNA mol,正确,③错误;④电子数应为17,错误。 4.设NA为阿伏加德罗常数,如果 a g 某气态双原子分子的分子数为p,则b g该气体在标准状况下的体积V(L)是( )
答案 D 解析 解法一 公式法:
a g双原子分子的物质的量=pNA mol,
双原子分子的摩尔质量=a gpNA mol=aNAp g·mol-1,
所以b g气体在标准状况下的体积为 b g
aNA
p g·mol-1
× L·mol-1=错误! L。
解法二 比例法: 同种气体其分子数与质量成正比,设b g气体的分子数为N a g ~ p b g ~ N
则:N=bpa,双原子分子的物质的量为pbaNA,所以b g该气体在标准状况下的体积为错误! L。 题组二 阿伏加德罗定律及应用 5.(2018·合肥模拟)在两个密闭容器中,分别充有质量相等的甲、乙两种气体,它们的温度和密度均相同。根据甲、乙的摩尔质量(M)的关系判断,下列说法中正确的是( ) A.若M(甲)<M(乙),则分子数:甲<乙 B.若M(甲)>M(乙),则气体摩尔体积:甲<乙 C.若M(甲)<M(乙),则气体的压强:甲>乙 D.若M(甲)>M(乙),则气体的体积:甲<乙 答案 C 解析 等质量的气体,其摩尔质量与物质的量(或分子数)成反比,若M(甲)<M(乙),则分子数:甲>乙,A项错误;若M(甲)>M(乙),则物质的量:甲<乙,又气体体积相等,故气体摩尔体积:甲>乙,B项错误;同温同体积同质量的气体或混合气体,压强与摩尔质量成反比,C项正确;由质量和密度相等可知气体体积相等,D项错误。 6.等温等压下,有质子数相等的CO、N2、C2H2三种气体,下列叙述中正确的是( ) A.体积之比为13∶13∶14 B.密度之比为14∶14∶13 C.质量之比为1∶1∶1 D.原子数之比为1∶1∶1 答案 B 解析 A项,三种气体分子的质子数均为14,质子数相等的CO、N2、C2H2三种气体,物质的量相等,等温等压下,气体的体积与其物质的量成正比,所以三者体积之比为1∶1∶1,错误;B项,CO、N2、C2H2摩尔质量分别为28 g·mol-1、28 g·mol-1、26 g·mol-1,等温等
压下,气体摩尔体积相同,根据ρ=nMnVm=MVm知,密度与摩尔质量成正比,则密度之比为28∶28∶26=14∶14∶13,正确;C项,三种气体分子的物质的量相等,CO、N2、C2H2摩尔质量分别为28 g·mol-1、28 g·mol-1、26 g·mol-1,根据m=nM知:质量之比与摩尔质量成正比为28∶28∶26=14∶14∶13,错误;D项,1分子CO、N2、C2H2分别含原子数为2、2、4,所以三种气体原子数之比为1∶1∶2,错误。 7.在某温度时,一定量的元素A的氢化物AH3在一定体积密闭容器中可完全分解成两种气态单质,此时密闭容器中气体分子总的物质的量增加了75%。则A单质的一个分子中有________个A原子,AH3分解反应的化学方程式为____________________。 答案 4 4AH3=====一定温度A4+6H2
求气体的摩尔质量M的常用方法 (1)根据物质的质量(m)和物质的量(n):M=m/n。 (2)根据一定质量(m)的物质中微粒数目(N)和阿伏加德罗常数(NA):M=NA·m/N。 (3)根据标准状况下气体的密度ρ:M=ρ×(g·mol-1)。 (4)根据气体的相对密度(D=ρ1/ρ2):M1/M2=D。 (5)对于混合气体,求其平均摩尔质量,上述计算式仍然成立;还可以用下式计算:M=M1×a%+M2×b%+M3×c%……,a%、b%、c%指混合物中各成分的物质的量分数(或体积分
数)。
微专题 气体体积的测定 气体体积的测定既可通过测量气体排出的液体体积来确定(二者体积值相等),也可直接测量收集的气体体积。 测量气体体积的常用方法: (1)直接测量法。如图A、B、C、D、E均是直接测量气体体积的装置。 测量前,A装置可先通过调整左右两管的高度使左管(有刻度)充满液体,且两管液面相平。