氢氧化钠变质的知识归纳
- 格式:doc
- 大小:44.00 KB
- 文档页数:2


氢氧化钠变质的三种情况检验方法1. 引言嘿,朋友们!今天咱们聊聊一个平常但又重要的小角色——氢氧化钠,或者说烧碱。
这货在化学界可是个大明星,清洁剂、去污剂,各种工业应用少不了它。
不过,时间长了,这家伙也可能会变质,变质后可就不好使了。
所以,我们得学会怎么检验它的质量,避免在关键时刻掉链子。
下面,我就给大家介绍三种简单易行的方法,保证你一看就懂,轻松上手。
2. 氢氧化钠变质的情况2.1 吸湿首先,氢氧化钠最常见的变质情况就是吸湿。
大家知道的,氢氧化钠是一种非常吸水的物质,就像干海绵见到水那样。
它一旦吸湿,可能就变成了湿哒哒的块状物,这样不仅影响它的效果,使用时也会麻烦不断。
你想想,买了一包崭新的氢氧化钠,打开一看,哎呀,湿漉漉的,简直让人心里一紧。
2.2 变质反应其次,氢氧化钠在某些环境下,还可能发生变质反应。
比如,放在阳光下暴晒,或者和其他化学物质接触,这可就麻烦了。
有些情况下,它甚至可能和空气中的二氧化碳发生反应,生成碳酸钠,这样一来,它的化学性质就大打折扣,根本无法达到我们想要的效果。
2.3 分解最后,氢氧化钠还可能经历分解的过程。
虽然这个情况比较少见,但一旦发生,后果可就不堪设想了。
特别是在高温环境下,如果不小心让它受热,可能就会分解,变成一些不再是氢氧化钠的东西。
想象一下,原本想用来清洁的东西,最后却变成了“无用之物”,这真是令人哭笑不得。
3. 检验方法3.1 外观检查说了变质的几种情况,咱们接下来聊聊怎么检验。
首先,最简单的方式就是外观检查。
大家可以用肉眼观察一下,看看氢氧化钠的状态。
若发现结块、潮湿或者颜色变了,基本上可以判定它变质了。
这就像咱们吃东西,先看看颜色和形状,没问题再吃,安全第一嘛。
3.2 溶解性测试接下来,溶解性测试也很重要。
把一小撮氢氧化钠放进水里,看看它溶得快不快。
如果溶解得很慢,或者根本不溶,那就得小心了,这可能意味着它已经变质。
这就像喝酒,酒好不好的,先喝一口,嘴里没感觉,那就得怀疑是不是兑水了。

氢氧化钠变质的原理、影响和检测氢氧化钠是一种强碱,具有强烈的腐蚀性和吸湿性。
氢氧化钠在空气中容易变质,主要是与空气中的二氧化碳发生反应,生成碳酸钠和水。
这种变质会降低氢氧化钠的纯度和碱度,影响其使用效果。
本文介绍了氢氧化钠变质的原因、过程、影响和检验方法,并给出了相应的化学方程式。
氢氧化钠变质的原因氢氧化钠是一种白色或无色的固体,溶于水时放出大量的热能,形成强碱性的溶液。
氢氧化钠具有强烈的腐蚀性,能与许多物质发生反应,如金属、酸、盐、有机物等。
因此,氢氧化钠必须密封保存,避免与空气或其他物质接触。
然而,即使密封保存,氢氧化钠也会慢慢地变质。
这是因为氢氧化钠具有很强的吸湿性,能吸收空气中的水分和二氧化碳。
当空气中的水分和二氧化碳进入到密封容器中时,就会与固体或液体的氢氧化钠发生反应,生成碳酸钠和水。
这种反应可以用下面的化学方程式表示:2NaOH+CO2→Na2CO3+H2O这个方程式表明,每消耗两个摩尔的氢氧化钠,就会生成一个摩尔的碳酸钠和一个摩尔的水。
这样,随着时间的推移,原来纯净的氢氧化钠就会逐渐变成含有碳酸钠杂质的混合物。
氢氧化钠变质的过程根据上面的方程式,我们可以知道,当空气中的二氧化碳与固体或液体的氢氧化钠接触时,就会发生变质反应。
但是,这个反应并不是一次完成的,而是分为两个步骤进行的。
第一步是二氧化碳与水反应生成碳酸:CO2+H2O→H2CO3这个反应是可逆的,也就是说,在一定条件下,碳酸也可以分解为二氧化碳和水。
但是,在常温常压下,这个反应是向右进行的,也就是说,二氧化碳更容易与水结合成碳酸。
第二步是碳酸与氢氧化钠反应生成碳酸钠和水:H2CO3+2NaOH→Na2CO3+2H2O这个反应是不可逆的,也就是说,在任何条件下,碳酸钠都不会分解为碳酸和氢氧化钠。
这是因为碳酸是一种弱酸,而氢氧化钠是一种强碱,在水溶液中会完全离解为离子。
因此,在这个反应中,弱酸被强碱中和了。
综合上面两个步骤,我们可以得到氢氧化钠变质的总方程式:2NaOH+CO2→Na2CO3+H2O这个方程式说明,氢氧化钠变质的过程实际上是一个中和反应的过程,也就是说,强碱被弱酸中和了。

氢氧化钠变质的过程-概述说明以及解释1.引言1.1 概述氢氧化钠变质是指在一定条件下,氢氧化钠(NaOH)的物理性质和化学性质发生变化的过程。
氢氧化钠作为一种常见的化学物质,在日常生活和工业生产中有着广泛的应用。
在变质过程中,氢氧化钠的结构和性质会发生改变,导致其在实际应用中可能出现一些问题。
氢氧化钠变质的过程是一个复杂而多样的现象。
变质通常由许多因素的综合作用引起,包括温度、湿度、空气中的杂质、光照强度等等。
温度是其中最主要的因素,因为随着温度的升高,分子运动加剧,导致氢氧化钠分子的结构更加不稳定,从而引发变质反应。
氢氧化钠的变质可以表现为物理性质和化学性质的改变。
在物理性质方面,氢氧化钠可能发生颜色变化、晶体形态变化、溶解度的改变等现象。
这些变化可能导致氢氧化钠的外观、透明度等方面与原来不同。
在化学性质方面,氢氧化钠可能发生水解、氧化还原反应等,导致其原有的化学反应性质发生变化。
氢氧化钠变质的过程对于其在各个领域的应用产生了一定的影响。
例如,在化妆品和洗涤剂等领域中,氢氧化钠的变质可能会影响产品的稳定性和效果。
在实验室研究中,如果氢氧化钠发生了变质,可能会导致实验结果的不准确甚至失败。
因此,了解氢氧化钠变质的过程以及其影响因素,对于合理使用和储存氢氧化钠至关重要。
综上所述,本文将深入探讨氢氧化钠变质的过程,介绍其背景知识、性质以及影响因素,并探讨可能的应用。
通过对氢氧化钠变质的研究,可以为其在各个领域的应用提供参考和指导,促进相关领域的发展。
1.2 文章结构本文旨在探讨氢氧化钠变质的过程。
为了使读者更好地理解这个过程,本文将按照以下结构进行探讨。
第一部分为引言,将提供对氢氧化钠变质的概述。
我们将介绍氢氧化钠的普遍应用,并概述其在化学反应中的重要性。
此外,我们还将简要分析本文的结构和目的,以便读者能够更好地理解要探索的内容。
第二部分为正文,包括背景知识、氢氧化钠的性质和氢氧化钠变质的过程。
我们将首先介绍相关的背景知识,如氢氧化钠的化学成分和常见的应用领域。


判断氢氧化钠是否变质的方法氢氧化钠是一种很重要的化学物质呢。
那怎么判断它是不是变质了呢?咱先来说一种方法。
可以取少量的氢氧化钠样品,把它溶解在水中,然后往里面滴加稀盐酸。
要是有气泡产生呀,那就说明氢氧化钠变质了。
这就好比一个原本很安静的房间,突然有气泡冒出来,就像平静的湖面突然冒起了泡泡一样奇怪。
这里的注意事项呢,滴加稀盐酸的时候要慢慢滴,可别一下子倒进去好多。
从安全性方面来说,稀盐酸有一定的腐蚀性,要是不小心溅到皮肤上,那可就糟糕了,就像小蚂蚁咬一口,虽然不至于很严重但也会疼得你“嘶嘶”直叫呢。
在稳定性上,只要按照正确的操作来,这个反应还是比较稳定的。
这种方法的应用场景很多呀,比如说在实验室里,要是发现氢氧化钠的保存有点问题,就可以用这个方法快速检测。
它的优势就是操作简单呀,就像搭积木一样简单。
再看另一种方法,取氢氧化钠样品溶解后,滴加氯化钙溶液。
如果出现白色沉淀,那很可能氢氧化钠已经变质了。
这白色沉淀就像天上突然掉下来的白色小雪花一样。
这里的注意事项是,氯化钙溶液的浓度要合适。
从安全性上讲,氯化钙溶液相对比较安全,不会像一些危险化学品那样让人胆战心惊。
在稳定性方面,只要实验环境正常,这个反应是很稳定可靠的。
这种方法在工业生产中也很有用呢。
比如说在生产中用到氢氧化钠的环节,如果怀疑氢氧化钠有问题,就可以用这个方法检测。
它的优势就是成本比较低,就像买东西买到了性价比超高的东西一样让人开心。
我曾经遇到过一个实际案例呢。
在一个学校的化学实验室,有一批氢氧化钠存放了一段时间。
老师就怀疑它变质了,于是就用滴加稀盐酸的方法检测。
结果一有气泡,老师就知道它变质了。
这就像侦探找到了关键线索一样兴奋。
我觉得这些判断氢氧化钠是否变质的方法都很实用,它们就像我们的小助手一样,在很多时候能帮助我们快速了解氢氧化钠的状态,避免因为使用变质的氢氧化钠而带来不必要的麻烦,真的很棒呢。
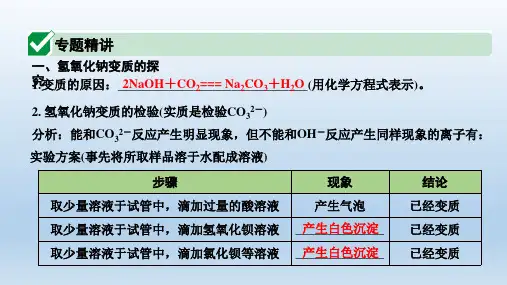

氢氧化钠变质的知识归纳碱的性质是九年级化学的重要学习内容,其中氢氧化钠、氢氧化钙是最重要的碱,关于氢氧化钠变质的相关问题有些学生容易混淆。
我们把这几个点归纳在一起,对比记忆,就比较容易解题了。
1、氢氧化钠变质的原因:敞口放置,与空气中的二氧化碳反应,生成了碳酸钠。
2NaOH + CO2 = Na2CO3+ H2O2、检验氢氧化钠是否变质的方法:(分别滴加酸、碱、盐溶液,各为一种方法)①取少量样品于试管中,滴加稀盐酸(或者稀硫酸),如果产生气泡,说明已变质。
原理:碳酸钠会与酸反应生成二氧化碳气体;而氢氧化钠与酸反应无明显现象。
Na2CO3+ 2HCl = 2NaCl + CO2↑+ H2O ; NaOH + HCl = NaCl + H2O②取少量样品于试管中,滴加氢氧化钙溶液(或者氢氧化钡溶液),如果产生白色沉淀,说明已变质。
原理:碳酸钠会与氢氧化钙反应生成碳酸钙白色沉淀,而氢氧化钠与氢氧化钙不反应,无明显现象。
Na2CO3+ Ca(OH)2= CaCO3↓ + 2NaOH ; NaOH + Ca(OH)2≠③取少量样品于试管中,滴加氯化钙溶液(或者氯化钡溶液)原理:碳酸钠会与氯化钙反应生成碳酸钙白色沉淀,而氢氧化钠与氯化钙不反应,无明显现象。
Na2CO3+ Ca Cl2= CaCO3↓ + 2NaCl ;NaOH + CaCl2≠3、检验氢氧化钠是完全变质还是部分变质的方法:取少量样品于试管中,滴加足量的Ca Cl2溶液,再滴加少量酚酞溶液,如果溶液变红色,说明溶液部分变质;如果溶液呈无色,说明氢氧化钠完全变质。
原理:氢氧化钠和变质后生成的碳酸钠溶液都呈碱性,滴加足量的氯化钙溶液是为了除尽生成的碳酸钠,这时会产生白色沉淀,然后滴加酚酞溶液,如果溶液呈红色,说明溶液呈碱性,有未变质的氢氧化钠,部分变质。
如果溶液不变红,说明没有氢氧化钠了,完全变质了。
Na2CO3+ BaCl2= BaCO3↓ + 2NaCl(注意:除去碳酸钠时,不能用氢氧化钙,因为氢氧化钙与碳酸钠反应会生成新的氢氧化钠,会干扰对氢氧化钠的检验。

氢氧化钠在空气中变质的现象
氢氧化钠在空气中暴露一段时间后会出现变质的现象。
这是因为氢氧化钠与空气中的二氧化碳反应,生成碳酸钠和水。
这种反应会导致氢氧化钠的化学性质发生变化,从而降低其纯度和效果。
氢氧化钠在空气中变质的迹象包括其外观变得混浊、颜色变暗、味道变酸、并且可能会有气泡产生。
这些变化可能会影响氢氧化钠的使用,尤其是在科学实验、工业生产和医疗用途中。
为了避免氢氧化钠在空气中变质,应该注意存储方法。
最好将氢氧化钠保存在密闭容器中,存放在阴凉、干燥和通风的地方。
此外,在使用氢氧化钠前应该检查其外观和效果,以确保它在使用过程中能够发挥最佳效果。
- 1 -。


氢氧化钠变质生成物
氢氧化钠(NaOH)变质时,会产生一些非常危险的化学物质,
包括:
1. 氧气(O2):氢氧化钠在变质过程中,会释放氧气。
氧气是一种强氧化剂,可引发燃烧或加剧火灾。
2. 氢气(H2):变质的氢氧化钠会产生氢气。
氢气是一种易燃气体,与空气混合后会形成可燃气体,容易引发爆炸。
3. 二氧化碳(CO2):氢氧化钠变质时,会与空气中的二氧化碳
反应生成碳酸钠。
碳酸钠是一种对皮肤和眼睛有腐蚀性的物质。
4. 氟化氢(HF):如果氢氧化钠受到氟化物的污染,会产生有毒的氟化氢气体。
氟化氢是一种强酸,对皮肤、眼睛和呼吸系统有极强的腐蚀性。
因此,当氢氧化钠变质时,应当立即进行处理或处置,以避免产生以上危险物质的释放和潜在危险。
氢氧化钠在空气中变质的方程式
氢氧化钠(NaOH)在空气中变质的方程式可以表示为:
2NaOH + CO2 → Na2CO3 + H2O
这个方程式描述了氢氧化钠与空气中的二氧化碳反应产生碳酸钠和水的过程。
当氢氧化钠暴露在空气中时,由于空气中存在二氧化碳,氢氧化钠会与二氧化碳发生反应。
这个反应是一种酸碱反应,其中氢氧化钠是碱,二氧化碳是酸。
在反应过程中,二氧化碳和氢氧化钠发生中和反应,生成碳酸钠和水。
碳酸钠是一种盐,可以溶解在水中形成碳酸钠溶液。
这个反应是一个重要的化学反应,有很多应用。
碳酸钠广泛用于制造玻璃、肥皂、洗涤剂等化工产品。
此外,碳酸钠还可以用作调节剂、脱硫剂和中和剂。
这个反应方程式给出了反应物和生成物的化学式,以及反应的摩尔比例。
两个氢氧化钠分子与一个二氧化碳分子反应生成一个碳酸钠分子和一个水分子。
在这个方程式中,氢氧化钠和二氧化碳是反应物,碳酸钠和水是生成物。
反应物和生成物之间的化学键断裂和形成,导致原子重新组合形成不同的分子。
这个方程式中的系数表示了反应物和生成物之间的摩尔比例。
在这种情况下,两个氢氧化钠分子与一个二氧化碳分子反应生成一个碳酸钠分子和一个水分子。
这个方程式符合标题中心扩展下描述的要求,详细解释了氢氧化钠在空气中变质的方程式。
通过这个方程式,我们可以理解和预测氢氧化钠与二氧化碳反应的化学过程。
这对于理解和应用氢氧化钠的化学性质具有重要意义。
检验氢氧化钠是否变质的原理
氢氧化钠(NaOH)是一种常见的化学物质,也被广泛应用于工业和实验室中。
然而,由于其易吸湿、易溶于水的性质,氢氧化钠很容易受到空气中的湿度和其他环境因素的影响,从而导致其变质。
要检验氢氧化钠是否变质,我们可以通过以下原理进行判断:
我们可以观察氢氧化钠的外观。
新鲜的氢氧化钠是无色或白色固体,呈颗粒状或块状。
如果氢氧化钠变质,其外观可能会发生变化,出现颜色变深、变黄或变成块状粉末等异常情况。
我们可以尝试溶解氢氧化钠。
正常的氢氧化钠在溶解时会产生热量,这是一个放热反应。
我们可以将一小部分氢氧化钠加入一定量的水中,观察是否有明显的温度变化。
如果溶解过程中没有明显的放热现象,那么可能是氢氧化钠已经变质。
我们还可以使用酸碱指示剂来检验氢氧化钠的酸碱性。
正常的氢氧化钠是一种碱性物质,溶解时会使溶液呈碱性。
我们可以将一小部分氢氧化钠溶解在水中,然后加入几滴酸碱指示剂。
如果溶液变红或变黄,说明氢氧化钠已经变质或受到了污染。
我们可以进行氢氧化钠的化学反应测试。
正常的氢氧化钠可以与酸类物质反应,产生盐和水。
我们可以将一小部分氢氧化钠溶解在水中,然后加入少量的醋酸或其他酸类物质。
如果没有明显的反应发生,那么可能是氢氧化钠已经变质。
通过观察氢氧化钠的外观、溶解特性、酸碱性以及化学反应等方面,我们可以初步判断氢氧化钠是否变质。
当然,为了更准确地判断氢氧化钠是否变质,我们还可以使用更精确的实验方法和仪器进行进一步的分析和检测。
鉴别氢氧化钠是否变质的方法
氢氧化钠(NaOH)是一种常用的化学试剂,在工业、农业、医疗和科学研究等领域都有广泛的应用。
然而,随着时间的推移,氢氧化钠可能会发生变质,使其失去原来的化学性质。
因此,我们需要知道如何鉴别氢氧化钠是否变质。
以下是一些常见的方法:
1. 观察外观:氢氧化钠变质后可能会产生深色、潮湿、易潮解的物质,其外观可能会发生变化。
如果氢氧化钠外观变得潮湿、深色或有奇怪的气味,则它可能已经变质。
2. 检测pH值:变质的氢氧化钠其pH值可能会降低,使其不再具有碱性。
可以将氢氧化钠溶液与标准氢氧化钠溶液进行比较,并确定其pH值。
如果氢氧化钠溶液的pH值低于7,则它可能已经变质。
3. 检测溶解度:变质的氢氧化钠其溶解度可能会降低。
如果氢氧化钠变质后,其在水中溶解度降低,则可以用更少的水来制备溶液,从而更容易检测出其是否已经变质。
4. 使用化学方程式:变质的氢氧化钠可能会与某些物质发生反应,使其失去碱性或产生其他化合物。
可以使用氢氧化钠和标准氢氧酸的混合酸反应来检测氢氧化钠是否变质,或者使用氢氧化钠和氧化铜的反应来检测氢氧化钠是否有其他化合物产生。
5. 使用光谱分析:可以使用光谱分析技术来检测氢氧化钠是否变质。
例如,可以使用红外光谱分析来检测氢氧化钠是否产生了其他化合物,或者可以使用紫外-可见光谱分析来检测氢氧化钠是否发生了变化。
需要注意的是,这些方法并不能完全保证氢氧化钠是否已经变质。
因此,在实
际应用中,还需要进行其他测试来确定氢氧化钠是否变质。
一、氢氧化钠变质问题:1、氢氧化钠变质的原因:①易吸收空气中的水分而潮解;②与空气中的CO2反应而变质。
化学方程式为:CO2+2NaOH=Na2CO3+H2O2、检验氢氧化钠是否变质(检验是否存在Na2CO3 )的方法:①取少量样品于试管中,滴加稀盐酸(或者稀硫酸),如果产生气泡,说明已变质,反之,没变质。
原理:碳酸钠会与酸反应生成二氧化碳气体;而氢氧化钠与酸反应无明显现象。
Na2CO3 +2HCl=2NaCl+CO2↑NaOH+HCl = NaCl + H2O②取少量样品于试管中,向其中加入足量的蒸馏水,振荡使其完全溶解,再滴加氢氧化钙溶液(或者氢氧化钡溶液),如果产生白色沉淀,说明已变质,反之,没变质。
原理:碳酸钠会与氢氧化钙反应生成碳酸钙白色沉淀,而氢氧化钠与氢氧化钙不反应,无明显现象。
Na2CO3+ Ca(OH)2= CaCO3↓+2NaOH ; NaOH + Ca(OH)2≠③取少量样品于试管中向其中加入足量的蒸馏水,振荡使其完全溶解,再滴加氯化钡溶液(或者硝酸钙等其它可溶性钙盐、钡盐溶液)如果产生白色沉淀,说明已变质,反之,没变质。
原理:碳酸钠会与氯化钡反应生成碳酸钡白色沉淀,而氢氧化钠与氯化钡不反应,无明显现象。
Na2CO3+ BaCl2= BaCO3↓+ 2NaCl ;NaOH + BaCl2≠2、检验氢氧化钠是完全变质还是部分变质的方法:取少量样品于试管中,向其中加入足量的蒸馏水,振荡使其完全溶解,再滴加足量的BaCl2溶液[或Ba(NO3)2或CaCl2或Ca(NO3)2]并振荡,有白色沉淀产生,证明有Na2CO3;过滤后取上层清夜,再滴加少量酚酞溶液,如果溶液变红色,说明溶液部分变质;如果溶液呈无色,说明氢氧化钠完全变质。
原理:氢氧化钠溶液和变质后生成的碳酸钠溶液都呈碱性,滴加足量的氯化钡溶液是为了除尽生成的碳酸钠,这时会产生白色沉淀,然后过滤取上层清夜,滴加酚酞溶液,如果溶液呈红色,说明溶液呈碱性,有未变质的氢氧化钠,部分变质。
氢氧化钠的变质问题浅析氢氧化钠没密封保存会因吸收空气中的二氧化碳,生成碳酸钠而变质。
2NaOH+CO2= ==Na2CO3+H2O.检验是否变质,就相当于检测是否有Na2CO3了。
氢氧化钠的变质存在这样三中情况:(1)没有变质;(成分NaOH)(2)部分变质;(成分NaOH 和Na2CO3)(3)完全变质。
(成分Na2CO3)一、证明变质:取少许固体物质溶于水,配成溶液与试管中;可分别向其中滴加酸、碱、盐溶液中的一种。
(1)取少许固体物质溶于水,配成溶液与试管中,向其中滴加稀盐酸或稀硫酸,如果产生气泡,说明已经变质。
原理:碳酸钠会与酸反应生成二氧化碳气体,而氢氧化钠与酸反应没有明显现象。
Na2 CO3+2HCl=== 2NaCl+H2O+ CO2↑;NaOH+HCl== NaCl+H2O(2)取少许固体物质溶于水,配成溶液与试管中,向其中滴加氢氧化钡溶液或氢氧化钙溶液,如果产生白色沉淀,说明已经变质。
原理:碳酸钠会与氢氧化钡或氢氧化钙反应生成白色沉淀,而氢氧化钠与氢氧化钡或氢氧化钙不反应,没有明显现象。
Na2CO3+Ba(OH)2== BaCO3↓+ 2NaOH;NaOH+ Ba(OH)2≠(3)取少许固体物质溶于水,配成溶液与试管中,向其中滴加氯化钡溶液或氯化钙溶液(或硝酸钡等其他可溶性钙盐、钡盐溶液),如果产生白色沉淀,说明已经变质。
原理:碳酸钠会与氯化钡或氯化钙反应生成白色沉淀,而氢氧化钠与氯化钡或氯化钙不反应,没有明显现象。
Na2CO3+BaCl2== BaCO3↓+ 2NaCl;NaOH+ Ba Cl2≠二、确定成分1. 没有变质(成分NaOH)的探究方法:取少许固体物质溶于水,配成溶液置与试管中,向其中滴加氯化钡或氯化钙看到溶液无变化,滴无色酚酞试液显红色,说明没变质;Na2 CO3+BaCl2== BaCO3↓+ 2NaCl ;NaOH+ Ba Cl2≠2. 部分变质(成分NaOH 和Na2CO3)的探究方法:取少许固体物质溶于水,配成溶液与试管中,向其中滴加足量的氯化钡或氯化钙溶液,溶液变浑浊,向反应后的溶液滴加无色酚酞试液,溶液显红色,说明是部分变质;Na2CO3+BaCl2== BaCO3↓+ 2NaCl3. 完全变质(成分Na2CO3)的探究方法:取少许固体物质溶于水,配成溶液与试管中,向其中滴加足量氯化钡或氯化钙溶液,溶液变浑浊,向反应后的溶液滴加无色酚酞试液,溶液不变色,说明完全变质。
氢氧化钠放在空气中变质的化学方程式
氢氧化钠放在空气中会与空气中的水汽反应,形成碱性的氢氧化钠溶液。
变质指的是氢氧化钠溶液中的氢氧化钠逐渐分解、失去碱性的过程。
其化学方程式如下:
2NaOH + CO2 → Na2CO3 + H2O
其中,CO2指的是空气中的二氧化碳,Na2CO3是碳酸钠,H2O是水。
这个反应是一个酸碱中和反应,氢氧化钠中的碱性氢氧根离子与二氧化碳中的酸性氢离子反应,生成了碳酸钠和水。
由于生成的碳酸钠是一种中性物质,因此氢氧化钠溶液的碱性会逐渐降低,从而变质。
- 1 -。
氢氧化钠变质的知识归纳
碱的性质是九年级化学的重要学习内容,其中氢氧化钠、氢氧化钙是最重要的碱,关于氢氧化钠变质的相关问题有些学生容易混淆。
我们把这几个点归纳在一起,对比记忆,就比较容易解题了。
1、氢氧化钠变质的原因:敞口放置,与空气中的二氧化碳反应,生成了碳酸钠。
2NaOH + CO
2 = Na
2
CO
3
+ H
2
O
2、检验氢氧化钠是否变质的方法:(分别滴加酸、碱、盐溶液,各为一种方法)
①取少量样品于试管中,滴加稀盐酸(或者稀硫酸),如果产生气泡,说明已变质。
原理:碳酸钠会与酸反应生成二氧化碳气体;而氢氧化钠与酸反应无明显现象。
Na
2CO
3
+ 2HCl = 2NaCl + CO
2
↑+ H
2
O ; NaOH + HCl = NaCl + H
2
O
②取少量样品于试管中,滴加氢氧化钙溶液(或者氢氧化钡溶液),如果产生白色沉淀,说明已变质。
原理:碳酸钠会与氢氧化钙反应生成碳酸钙白色沉淀,而氢氧化钠与氢氧化钙不反应,无明显现象。
Na
2CO
3
+ Ca(OH)
2
= CaCO
3
↓ + 2NaOH ; NaOH + Ca(OH)
2
≠
③取少量样品于试管中,滴加氯化钙溶液(或者氯化钡溶液)
原理:碳酸钠会与氯化钙反应生成碳酸钙白色沉淀,而氢氧化钠与氯化钙
不反应,无明显现象。
Na
2CO
3
+ Ca Cl
2
= CaCO
3
↓ + 2NaCl ;NaOH + CaCl
2
≠
3、检验氢氧化钠是完全变质还是部分变质的方法:取少量样品于试管中,滴加足量的Ca Cl
2
溶液,再滴加少量酚酞溶液,如果溶液变红色,说明溶液部分变质;如果溶液呈无色,说明氢氧化钠完全变质。
原理:氢氧化钠和变质后生成的碳酸钠溶液都呈碱性,滴加足量的氯化钙溶液是为了除尽生成的碳酸钠,这时会产生白色沉淀,然后滴加酚酞溶液,如果溶液呈红色,说明溶液呈碱性,有未变质的氢氧化钠,部分变质。
如果溶液不变红,说明没有氢氧化钠了,完全变质了。
Na
2CO
3
+ BaCl
2
= BaCO
3
↓ + 2NaCl
(注意:除去碳酸钠时,不能用氢氧化钙,因为氢氧化钙与碳酸钠反应会生成新的氢氧化钠,会干扰对氢氧化钠的检验。
Na
2CO
3
+ Ca(OH)
2
= CaCO
3
↓ + 2NaOH )
弄懂了吗?让我们把这些知识点记熟,来攻克以下题目吧
1、一天,实验助手小娟走进实验室,和老师一起检查每个
实验桌上的药品、仪器是否齐备,走到某组的时候,看到了一个
不和谐的“音符”,如图:
(1)此情此景你首先想到的是它可能变质了,该变质反应
的化学方程式为_______________________________。
(2)围绕此瓶NaOH溶液是否变质的问题,小娟利用实验室的三种试剂(氯化钙溶液、稀盐酸、酚酞试液)展开了探究活动。
①验证该溶液已经变质。
你认为小娟所加的试剂是。
②欲证明变质的溶液中尚存NaOH,请你帮助小娟完成以下探究方案:
探究目的探究步骤预计现象
除尽溶液中的
①取少量溶液于试管中,滴
加足量的_________试剂
有白色沉淀产生
证明溶液中尚存NaOH ②向实验①所得溶液中滴
加酚酞试液
_____________________
(3)通过上述探究,说明氢氧化钠溶液暴露在空气中容易变质,故应_________保存。
2、某同学做中和反应实验时,将稀盐酸滴入氢氧化钠溶液中,意外看到有气泡产生,在确认药品没错,只是在瓶口发现有白色粉末状物质后,该同学认为是氢氧化钠溶液变质了。
⑴氢氧化钠溶液变质的原因是
⑵利用与上述实验不同的原理,该同学又设计了一个实验,再次确认该氢氧化钠溶液已变质。
实验步骤实验现象实验结论
取少量氢氧化钠溶液于试管中,滴加____该氢氧化钠溶液已变质
⑶该氢氧化钠溶液是部分变质还是全部变质?
实验步骤实验现象实验结论
该氢氧化钠溶
液_______变质写出⑶中所涉及到的一个反应的化学方程式
⑷如何用该变质的溶液来制取氢氧化钠溶液?简述实验步骤。