麦克斯韦速率分布律
- 格式:ppt
- 大小:463.00 KB
- 文档页数:8



麦克斯韦速率分布律的物理意义
麦克斯韦速率分布律是概率论中的一个重要定律,它描述了随机变量的分布。
对于任意一个随机变量 X,它的分布律可以用麦克斯韦速率分布律来描述。
麦克斯韦速率分布律的物理意义可以从以下几个方面来理解:
1. 描述随机变量的分布:麦克斯韦速率分布律描述了随机变量 X 的取值在一个区间内出现的概率密度。
例如,如果随机变量 X 的取值为 [a, b],那么它在 [a, b] 区间内出现的概率密度就是 f(x) = dx/(b-a),其中 dx 是 X 取值[a, b] 区间内的微小区间。
2. 解释随机现象:麦克斯韦速率分布律可以用来解释随机现象。
例如,如果我们掷一枚硬币,硬币正面朝上的概率是 0.5,那么硬币正面朝上的概率密度就是 f(x) = 0.5 * dx/(1-0.5)。
我们可以用 f(x) 来描述硬币正面朝上的取值范围,从而解释掷硬币正面朝上的概率分布。
3. 计算随机变量的概率:麦克斯韦速率分布律可以用来计算随机变量的概率。
例如,如果我们想要计算随机变量 X 的取值 [a, b] 区间内的概率,我们可以用 f(x) = dx/(b-a) 来计算 X 在 [a, b] 区间内出现的概率。
麦克斯韦速率分布律是概率论中的一个重要定律,它可以用来描述随机变量的分布,解释随机现象,计算随机变量的概率。
它对于理解随机过程、随机变量的分布等方面都有重要的作用。
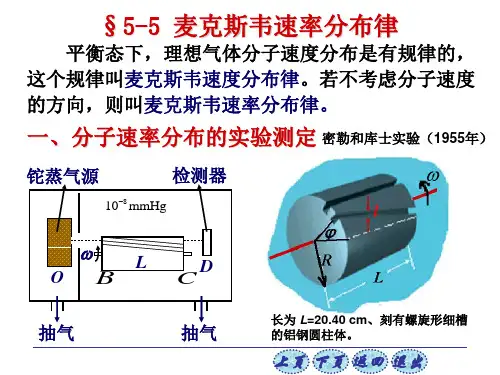

推导麦克斯韦速度分布律、速率分布律的简单方法麦克斯韦速度分布律是量子力学中重要的一部分。
1860年,麦克斯韦发现在粒子系统中,粒子运动的速度都遵循一定的分布关系,即概率密度函数与速度成反比,这就是麦克斯韦速度分布律。
那么,如何推导出麦克斯韦速度分布律和速率分布律?
首先,考虑一个温度为T的系统,采用能量有限的情况下可以把粒子的运动视为马尔可夫链的形式。
由于能量有限,可以认为处在同一状态的粒子的总体数量就构成了该状态的热平衡状态。
由此可推出粒子的速度分布概率:
P(v) = e^(-mv^2/2kT)
其中,m为粒子的质量,T为温度,k为Boltzmann常数。
将此式作为粒子的速度分布函数,即可推出其速率分布函数。
即:
f(v) = e^(-mv^2/2kT) * Usqrt(m/2πkT)
此式也叫麦克斯韦分布,概率密度与粒子速率成反比,即概率密度随着粒子速率的增加而减少。
通过此式,可以推导出麦克斯韦速度分布律和速率分布律。
以上便是推导麦克斯韦速度分布律以及速率分布律的简单方法。
虽然在实际应用中,还有许多根据环境情况改变相关参数的变体,但基础思想是一致的:概率密度随着粒子运动速度的增加而减少。






麦克斯韦速率分布律介绍麦克斯韦速率分布律是描述理想气体粒子速度分布的统计物理学定律。
它是由19世纪物理学家詹姆斯·麦克斯韦提出的,通过分析气体分子的碰撞和运动,揭示了粒子速度的分布规律。
麦克斯韦速率分布律在理解和研究气体的性质和行为方面起着重要作用。
物理背景在理想气体状态下,气体分子间无相互作用力,分子之间碰撞时可以视为弹性碰撞,满足动量守恒和能量守恒。
根据统计物理学的理论,在给定温度下,气体粒子的速度具有一定范围的分布。
麦克斯韦速率分布函数麦克斯韦速率分布函数是描述理想气体速度分布的函数,可以用来计算在给定温度下不同速度范围内气体分子的数量。
麦克斯韦速率分布函数的形式为:[f(v)=4()^{3/2} v^2 e^{-}]其中,[f(v)]为速度为[v]的气体分子的数量,[m]为分子的质量,[k]为玻尔兹曼常数,[T]为气体的温度。
速度分布特点根据麦克斯韦速率分布律,气体分子的速度分布具有以下特点:1. 最概然速度最概然速度是指在给定温度下,气体粒子速度分布函数的峰值对应的速度值[v_p]。
最概然速度与温度无关,只取决于粒子的质量。
最概然速度可以通过对速度分布函数求导并令导数等于零来求得。
2. 平均速度平均速度是指在给定温度下,所有速度可能取值的加权平均值。
根据麦克斯韦速率分布律,平均速度与温度成正比,与粒子质量无关。
3. 方均根速度方均根速度是指在给定温度下,速度平方的平均值的开平方。
方均根速度与温度成正比,与粒子质量无关。
麦克斯韦速率分布律的应用麦克斯韦速率分布律在研究气体性质和行为时具有广泛的应用。
以下是一些麦克斯韦速率分布律的应用:1. 气体的热容根据麦克斯韦速率分布律可以计算出给定温度下气体分子的平均动能和热容。
热容是指单位物质在温度变化下吸收或释放的热量。
通过麦克斯韦速率分布律,我们可以计算气体的平均动能,并根据统计物理学的理论将其与热容联系起来。
2. 气体的扩散速率扩散是指气体中各个分子在温度梯度下的运动。